酸性氧化物和碱性氧化物的定义和性质
衔接点01 酸性氧化物和碱性氧化物-2022年高一化学预科班《衔接教材》

衔接点 01 酸性氧化物和碱性氧化物
一、酸性氧化物 1.定义: 能与水作用生成相应价态的酸,或与碱作用只生成一种相应价态盐和水的氧化物。 2.概述: 非金属氧化物多数是酸性氧化物,某些过渡元素的高价氧化物(如 CrO3、Mn2O7 等)也是酸性氧化物。
酸性氧化物属于酸酐,例如 SO2 叫亚硫酐,SO3 叫硫酐,CO2 叫碳酐,醋酸酐是酸酐但不是酸性氧化物。 注意: ①硝酸的酸酐是 N2O5,磷酸的酸酐是 P2O5. ②非金属氧化物不一定是酸性氧化物;如:NO、CO(不成盐氧化物),NO2、N2O4、H2O 。 酸性氧化物对应的水化物是含氧酸,如 SO3 对应的水化物是 H2SO4,CO2 对应的水化物是 H2CO3,SiO2
C.有机物
D.单质
3.物质的分类法是化学研究的重要方法之一。化学工作者经常根据物质的组成对物质进行分类研究。近年
来发现在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
()
A.H2、O3
B.H2SO4、H2CO3 C.SO2、NO
D.Na2SO3、KClO3
4.小美在奥运五连环中填入了 5 种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反
敏捷性训练
1.【答案】B 【解析】HNO3 应属于酸、含氧酸、一元酸、化合物,所以 B 选项正确 2.【答案】B 【解析】①中此盐既属于钠盐又属于硫酸盐。则可排除 A、C 两选项,④中此盐既属于铵盐又属于盐酸盐, 则 B 项中的 NH4Cl 正确,排除了 D 项。 3.【答案】B 【解析】非金属氧化物不都是酸性氧化物,如水、一氧化碳、一氧化氮等氧化物就属于不成盐氧化物,所 以 A 不正确。SiO2 是酸性氧化物但不与水反应;所以 C 不正确。酸性氧化物一般不能和酸反应,但二氧化 硅能与氢氟酸反应,生成四氟化硅气体和水:SiO2+4HF=SiF4↑+2H2O。D 选项也不正确。只有碱性氧化物都 是金属氧化物的说法是正确的。 4.【答案】C 【解析】根据初中化学中对化学反应的分类方法,物质得到氧的反应称为氧化反应;由两种或两种以上的 物质生成一种物质的反应叫化合反应。在题目所给出的四个反应中,既属于化合反应又属于氧化反应的应 当是 C。 5.【答案】D 【解析】四个选项中属于无机物的是碳酸钠和氢氧化铜;其中碳酸钠是盐,氢氧化铜是碱。
酸性氧化物与碱性氧化物的特点与应用

酸性氧化物与碱性氧化物的特点与应用酸性氧化物与碱性氧化物是化学中常见的两类氧化物。
它们在化学反应和日常生活中具有重要的特点和应用。
本文将分别探讨酸性氧化物和碱性氧化物的特点以及它们在实际应用中的用途。
一、酸性氧化物的特点与应用酸性氧化物是指能够与水反应生成酸的氧化物。
它们具有以下几个特点:1. 酸性性质:酸性氧化物在水中能够释放出氧化物中的氧元素或氧化性的根离子,形成酸。
例如,二氧化硫(SO2)在水中反应生成亚硫酸:SO2 + H2O → H2SO32. 酸性氧化物发生还原反应:酸性氧化物纷纷参与许多还原反应,将其他物质氧化为较低的氧化态。
例如,二氧化锰(MnO2)能将硫酸氢钠还原为二氧化硫:2MnO2 + 3NaHSO3 → 2MnSO4 + Na2SO4 + H2O3. 腐蚀性:酸性氧化物具有较强的腐蚀性,能够与许多金属反应,产生气体并腐蚀金属表面。
酸性氧化物在实际应用中有着广泛的用途:1. 工业应用:二氧化硫广泛应用于稀硫酸的制造、制造硫酸盐等。
2. 环境保护:酸性氧化物是大气酸雨的主要成分之一,对环境有着负面影响。
因此,研究和监测酸性氧化物的排放和控制成为环境保护的重要课题。
3. 医药领域:某些酸性氧化物可用于医药制剂的合成和病原体的消毒防治。
二、碱性氧化物的特点与应用碱性氧化物是指能够与水反应生成碱的氧化物。
它们具有以下几个特点:1. 碱性性质:碱性氧化物在水中能够释放出氧化物中的氧元素或碱性的阳离子,形成碱。
例如,氢氧化钠(NaOH)在水中反应生成氢氧化钠溶液:NaOH + H2O → Na+ + OH-2. 碱性氧化物发生氧化反应:碱性氧化物能够将其他物质氧化为较高的氧化态。
例如,氧化铜(CuO)能将亚硫酸氢钠氧化为硫酸:CuO + 2NaHSO3 → CuSO4 + Na2SO4 + H2O3. 与酸性氧化物中和:碱性氧化物能与酸性氧化物进行中和反应,生成相对中性的物质。
碱性氧化物在实际应用中也有着广泛的用途:1. 工业应用:氢氧化钠和氢氧化钾等碱性氧化物广泛应用于肥皂、玻璃、制革、纸张等行业。
谈谈高中化学中的氧化物

谈谈高中化学中的氧化物氧化物含义:氧化物是指氧与另一种元素形成的化合物。
二、氧化物的分类:1、氧化物依组成元素,可以分成两类,金属氧化物和非金属氧化物。
2、氧化物依性质可分为四类:(1)酸性氧化物(又称为酸酐)(如二氧化硫、三氧化硫、二氧化碳、二氧化硅、七氧化二锰、三氧化铬、五氧化二氮、三氧化二氮、五氧化二磷等)。
(2)碱性氧化物(氧化钠、氧化镁、氧化钙、氧化铁、氧化铜等)。
(3)两性氧化物(氧化铝即三氧化二铝)。
(4)其他:不成盐氧化物(一氧化碳、一氧化氮、二氧化氮)。
磁性氧化物(四氧化三铁)。
3、氧化物依氧元素的化合价又可分为普通氧化物和特殊氧化物(过氧化物、超氧化物、臭氧化物等)。
三、酸性氧化物:1、定义:指能与碱反应生成盐(只一种盐)和水的氧化物;2、判断方法:依定义来判断。
记住常见的与特殊的。
与含氧酸中中心原子化合价相同的氧化物。
3、酸性氧化物不一定是非金属氧化物(七氧化二锰),非金属氧化物也不一定是酸性氧化物(CO)。
4、酸性氧化物又叫酸酐。
酸分解就来酐了,酐加水就酸了,这是从组成上看,酸不一定能分解,酐也不一定能与水反应。
如硅酸能分解成二氧化硅,但二氧化硅不能与水反应。
另有机酸的酸酐是羧酸分子间脱水形成的物质不是氧化物,所以酸酐不一定是氧化物。
5、酸性氧化物的性质(4条):(1)都能与碱反应生成对应的盐和水。
(2)有的能与水反应生成对应的酸。
(3)有的能与碱性氧化物反应生成盐。
(4)有的能与某些盐反应生成盐和新的酸性氧化物。
四、碱性氧化物1、定义:指能与酸反应生成盐和水的氧化物。
2、判断方法:依定义判断。
记住常见的。
与碱中金属元素化合价相同的氧化物。
3、碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物。
(如氧化铝、七氧化二锰、三氧化铬)。
4、碱性氧化物的性质(3条):(1)都能与酸反应生成对应的盐和水。
(2)有的能与水反应生成对应的碱。
(3)有的能与酸性氧化物反应生成盐。
酸性氧化物和碱性氧化物的定义和性质

酸性氧化物和碱性氧化物的定义和性质酸性氧化物和碱性氧化物是实验室中经常用到的物质,它们也是一类重要的无机化合物。
在日常生活中,它们几乎无处不在;在生产工业过程中,使用它们也成为常态;在矿产勘查工作中,其潜在地质意义还值得我们细细挖掘。
酸性氧化物和碱性氧化物分别是什么?它们各自都有哪些特性?本文将介绍这两种物质的定义,特殊性质和采样实践。
一、酸性氧化物酸性氧化物是指可溶于水的酸性卤化物,包括氧化铝、尖晶石、氯化铝和磷酸。
它们可以与其他溶液形成可溶性酸盐,可溶于水的浓度可以调节它们的物理性质,因此它们是实验室中广泛使用的水溶液。
酸性氧化物有一系列特殊的属性,其中包括:第一,酸性氧化物通常呈粉末状,只有溶解在它们的溶质中才可以有效利用;第二,它们是无机氧化物,具有一定的抗氧化能力;第三,它们在均相中具有较大的物理稳定性,可以抵抗水的洗礼;第四,它们的溶解度通常较低,需要一定的温度和处理技术才能使它们易溶化;第五,它们可以与有机物等其它物质形成固体混合物,因此在隔离过程中需要特殊的溶剂处理;最后,它们在均相中产生强烈的分解和氧化作用,因此会溶解性固体物质易混合,需要特殊的技术处理以避免反应活性过大。
二、碱性氧化物碱性氧化物是指可溶于水的碱性氧化物,包括氧化钠、氯化钠、氢氧化物和硫酸盐。
它们能够与有机物形成弱可溶性有机盐,可以溶解在水中,表现出良好的溶性性能。
碱性氧化物也有一系列特殊的属性,其中包括:第一,它们具有较强的抗氧化性;第二,它们可以与氧化物形成强催化剂,能够大量生成强氧化或氧化功能;第三,它们在实验室中有广泛的应用,不仅是溶剂,还可以用于检测有机物、无机物和水中的其他物质;第四,它们由于存在引起不稳定,因此容易发生反应或氧化变质;第五,它们可以与硅酸盐形成碳酸盐,造成环境污染,由此带来了二次污染。
三、采样实践要采样酸性氧化物和碱性氧化物,应该从理论和实践的角度理解其性质。
在实验室应用中,我们应该以科学的方法采集其样品:1.使用仪器或手工法进行分析采样。
人教版2019新教材高中化学必修一第一章第一节物质的分类及转化知识点梳理
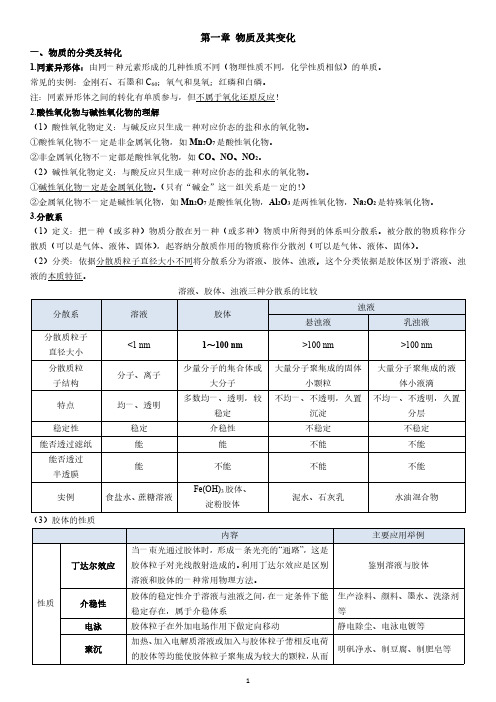
第一章物质及其变化一、物质的分类及转化1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!2.酸性氧化物与碱性氧化物的理解(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
(只有“碱金”这一组关系是一定的!)②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
3.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较(3)胶体的性质形成沉淀从分散剂中析出提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜,用此法将胶体提纯用于分离溶液和胶体(4)胶体部分易错归纳①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
④电泳现象是由于胶体粒子吸附溶液中的离子而带电,通电后胶体粒子定向移动,所以并非所有胶体都有电泳现象(如淀粉胶体)。
(5)Fe(OH)3胶体的制备在小烧杯中,加入40mL蒸馏水,加热至沸腾,向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,立即停止加热,即可得到Fe(OH)3胶体,整个过程不能搅拌。
酸碱氧化物定义

酸碱氧化物定义酸碱氧化物是化学中常见的一类物质,它们具有特定的化学性质和反应特点。
本文将从酸碱氧化物的定义、性质、应用等方面进行阐述,以帮助读者更好地理解和掌握这一概念。
一、酸碱氧化物的定义酸碱氧化物是指在化学反应中能够起到酸碱性质或氧化还原性质的物质。
酸碱氧化物可以分为酸性氧化物、碱性氧化物和中性氧化物三类。
酸性氧化物是指在水中能够生成酸的氧化物,如二氧化硫、二氧化氮等;碱性氧化物是指在水中能够生成碱的氧化物,如氢氧化钠、氢氧化钾等;中性氧化物则是指既不具有酸性也不具有碱性的氧化物,如氧化锌、氧化铝等。
二、酸碱氧化物的性质1. 酸性氧化物具有酸性质,可与碱反应生成盐和水。
例如,二氧化硫与氢氧化钠反应生成亚硫酸钠和水的反应方程式为SO2 + 2NaOH → Na2SO3 + H2O。
2. 碱性氧化物具有碱性质,可与酸反应生成盐和水。
例如,氢氧化钠与盐酸反应生成氯化钠和水的反应方程式为NaOH + HCl → NaCl + H2O。
3. 中性氧化物既不具有酸性也不具有碱性,不与酸碱反应,一般不溶于水。
例如,氧化锌与酸反应生成盐和水的反应方程式为ZnO + 2HCl → ZnCl2 + H2O。
三、酸碱氧化物的应用1. 酸碱氧化物在化学实验中常用于调节溶液的酸碱度。
例如,氢氧化钠可用于调节溶液的酸度,硫酸可用于调节溶液的碱度。
2. 酸碱氧化物在工业生产中有广泛应用。
例如,氢氧化钠可用于制备肥皂和纸浆,硫酸可用于制造肥料和清洁剂。
3. 酸碱氧化物在生活中也有一定的应用。
例如,柠檬汁中含有柠檬酸,可用于去除金属上的氧化物;小苏打可以中和胃酸,缓解消化不良等症状。
四、酸碱氧化物的反应特点1. 酸碱氧化物与水反应时,酸性氧化物会生成酸,碱性氧化物会生成碱,中性氧化物则不发生反应。
2. 酸碱氧化物与金属反应时,酸性氧化物会生成盐和水,碱性氧化物会生成盐和氢氧化物,中性氧化物则不发生反应。
3. 酸碱氧化物与非金属氧化物反应时,酸性氧化物会生成盐和二氧化物,碱性氧化物会生成盐和水,中性氧化物则不发生反应。
碱性氧化物与酸性氧化物的区分

碱性氧化物与酸性氧化物的区分氧化物是指化合物中含有氧元素的化学物质。
根据其溶解时所产生的氢离子(H+)或氢氧根离子(OH-)的数量不同,氧化物可以被分为两类:碱性氧化物和酸性氧化物。
一、碱性氧化物碱性氧化物是指在溶液中会释放出氢氧根离子(OH-)的氧化物。
这类氧化物通常是金属氧化物或金属氢氧化物。
例如,钠氧化物(Na2O)和钠氢氧化物(NaOH)都属于碱性氧化物。
碱性氧化物溶解在水中时会与水发生反应,产生氢氧根离子(OH-)。
这种反应是放热反应,使得溶液的温度升高,并且导致溶液呈碱性。
碱性溶液具有苦味、滑润的性质,并能使红色的酚酞指示剂变为蓝色。
碱性氧化物常用于中和酸性物质、调节pH值的过程中。
二、酸性氧化物酸性氧化物是指在溶液中会释放出氢离子(H+)的氧化物。
这类氧化物通常是非金属氧化物,例如二氧化硫(SO2)和二氧化碳(CO2)。
酸性氧化物溶解在水中时会与水发生反应,产生氢离子(H+)。
这种反应是放热反应,使得溶液的温度升高,并且导致溶液呈酸性。
酸性溶液具有酸味、酸腐蚀性的性质,并能使蓝色的溴酚蓝指示剂变为红色。
酸性氧化物常用于酸洗、脱垢、清洁等过程中,也可以用于产生酸性溶液。
三、碱性氧化物与酸性氧化物的区别1. 溶解特性:碱性氧化物溶解在水中会释放出氢氧根离子(OH-),而酸性氧化物溶解在水中会释放出氢离子(H+)。
2. 溶液性质:碱性氧化物溶液呈碱性,酸性氧化物溶液呈酸性。
3. 反应性质:碱性氧化物与酸性物质反应时会中和,酸性氧化物与碱性物质反应时也会中和。
综上所述,碱性氧化物和酸性氧化物之间的区别主要在于其溶解特性和溶液性质。
碱性氧化物溶解时释放的是氢氧根离子(OH-),而酸性氧化物溶解时释放的是氢离子(H+)。
根据这一区别,我们可以通过溶液的性质、指示剂的变化等来区分它们。
需要注意的是,生活中往往有一些氧化物既能产生氢氧根离子又能产生氢离子,这种情况下我们需要根据具体的化学反应来判断其性质。
碱性氧化物 酸性氧化物 两性氧化物

碱性氧化物酸性氧化物两性氧化物碱性氧化物酸性氧化物两性氧化物说明:能跟酸起反应,生成盐和水的氧化物叫碱性氧化物(且生成物只能有盐和水,不可以有任何其它物质生成,且能与水反应生成碱)。
碱性氧化物一般不与正盐、碱式盐(如mg(oh)cl)反应,但可与酸式盐(如nahso4)反应。
碱性氧化物包括活泼金属氧化物和其他金属的低价氧化物,如na2o、cao、bao和cro、mno。
碱性氧化物的对应水化物是碱。
例如,cao对应的水化物是ca(oh)2,fe2o3对应的水化物是fe(oh)3(胶体)。
碱金属(钠、钾)和钙、钡的氧化物能跟水反应,生成相应的氢氧化物。
它们都是强碱:na2o+h2o==2naohcao+h2o==ca(oh)2高温下,碱性氧化物和酸性氧化物促进作用分解成盐:cao+sio2==casio3碱性氧化物与酸性氧化物反应:na2o+co2==na2co3碱性氧化物受热时比较稳定,一般不会分解。
碱性氧化物不一定就是金属氧化物,例如三氧化二砷,而金属氧化物不一定就是碱性氧化物,如mn2o7就是酸性氧化物,al2o3、beo、cr2o3、zno,mno2为两性氧化物。
碱性氧化物还可以和对应的酸式盐反应——na20+2nahso4===2na2so4+h2o当然,碱性氧化物只是从理论上可以视作对应碱水解后的产物,并不是所有碱性氧化物都可以与水反应分解成对应的碱。
注意:★能与酸反应的氧化物不一定就是碱性氧化物,如sio2可以与hf反应,但sio2却是酸性氧化物(应要注意,sio2可以与hf反应是sio2的特性,与它是碱性氧化物或酸性氧化物无关!)。
★碱金属的氧化物不一定就是碱性氧化物,如na2o2可以和水反应分解成碱,但它就是过氧化物而不是碱性氧化物。
说明:酸性氧化物是一类能与水作用生成酸或与碱作用生成盐和水的氧化物,但一般不与正盐或酸式盐反应。
一般是非金属元素的氧化物和某些过渡金属元素的高价氧化物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.
酸性氧化物是一类能与水作用生成酸或与碱作用生成盐和水的氧化物。
一般是非金属元素的氧化物和某些过渡金属元素的高价氧化物.例如三氧化硫SO3、五氧化二磷P2O5、七氧化二锰Mn2O7、三氧化铬CrO3等。
.
.
酸性氧化物对应水化物是酸,比如CO2对应水化物是H2CO3,N2O5对应水化物是HNO3。
.
.
注:非金属氧化物大多数是酸性氧化物,我们熟悉的非金属氧化物中,一氧化碳和一氧化氮不是酸性氧化物,通常将其归入不成酸氧化物。
.
.
跟酸起反应,生成盐和水,这种氧化物叫碱性氧化物(且生成物只能有盐和水,不可以有任何其它物质生成).碱性氧化物包括活泼金属氧化物和其他金属的低价氧化物,如Na2O、CaO、BaO和CrO、MnO。
.
.
碱性氧化物的对应水化物是碱。
例如,CaO对应的水化物是Ca(OH)2,Fe2O3对应的水化物是Fe(OH)3.
.
.
碱性氧化物受热时比较稳定,一般不会分解。
.
.
注:碱性氧化物全部是金属氧化物,而金属氧化物不一定是碱性氧化物,如
Mn2O7就是酸性氧化物,Al2O3为两性氧化物。
.。
