高考化学题型复习提纲
高三化学知识点大纲

高三化学知识点大纲一、化学的基本概念1.化学的定义和研究对象2.物质的组成和性质3.化学方程式二、化学元素和元素周期表1.元素的概念和性质2.元素周期表的组成和分类3.主要元素的特征和应用三、化学键和分子结构1.原子价层电子结构2.离子键、共价键和金属键3.分子和离子的结构四、化学反应1.化学反应的判定2.化学反应方程式和化学计量3.化学平衡和化学平衡常数五、酸碱与盐1.酸碱的概念和性质2.盐的概念和性质3.酸碱中和反应和盐的生成六、氧化还原与电化学1.氧化还原反应的概念和性质2.电池和电解池的原理3.电化学方程式和电解定律七、化学能和化学动力学1.能量的传递和转化2.化学反应速率和活化能3.化学平衡和热力学控制条件八、有机化学1.有机化合物的命名和分类2.有机反应的机理和特性3.常见有机物的应用九、高分子化合物与材料科学1.高分子化合物的特征和合成2.聚合反应和高分子材料的性质3.高分子材料在实际应用中的意义十、化学计量与质量关系1.摩尔和质量关系的计算2.溶液浓度和溶液配制的计算3.化学反应的产率和理论计算十一、化学实验和实验技巧1.化学实验室的安全和危险知识2.常用化学实验仪器和操作技巧3.实验数据的处理和结果分析总结:本文简要介绍了高三化学的知识点大纲,包括化学的基本概念、化学元素和元素周期表、化学键和分子结构、化学反应、酸碱与盐、氧化还原与电化学、化学能和化学动力学、有机化学、高分子化合物与材料科学、化学计量与质量关系以及化学实验和实验技巧等内容。
这些知识点是高三学习化学的基础,掌握好这些知识对于理解和应用化学原理具有重要意义。
同时,通过实验和练习,提高化学实验和实验技巧也是必不可少的。
相信通过系统的学习和合理的复习安排,学生们能够顺利掌握这些化学知识,为高考取得更好的成绩打下坚实基础。
化学复习题纲

化学复习题纲化学复习题纲化学是一门研究物质组成、性质和变化的科学。
它不仅是一门基础学科,也是应用广泛的学科。
在学习化学的过程中,复习是不可或缺的一环。
下面,我将为大家提供一份化学复习题纲,希望能够帮助大家更好地复习化学知识。
一、基础概念复习1. 原子结构:原子的组成、质子、中子、电子的性质和相互关系。
2. 元素周期表:元素周期表的组成、特点、周期性规律和应用。
3. 化学键:离子键、共价键、金属键的形成和特点。
4. 物质的状态变化:固态、液态、气态之间的相互转化和影响因素。
5. 化学反应:化学方程式、化学反应类型、化学反应速率和平衡。
二、无机化学复习1. 酸碱中和反应:酸碱的定义、酸碱中和反应的原理和应用。
2. 氧化还原反应:氧化还原反应的定义、氧化剂和还原剂的判定、氧化还原反应的应用。
3. 盐的性质:盐的组成、性质、制备和应用。
4. 金属与非金属:金属的性质、金属与非金属的反应和应用。
三、有机化学复习1. 烃的分类:烃的分类、结构和性质。
2. 单质与化合物:碳的单质和化合物的特点和应用。
3. 功能团:醇、醛、酮、酸等有机化合物的功能团特点和命名规则。
4. 聚合物:聚合物的分类、合成和应用。
四、化学实验复习1. 常见实验仪器:试管、烧杯、容量瓶等常见实验仪器的用途和使用方法。
2. 化学实验操作:称量、溶解、过滤、蒸发等常见化学实验操作的步骤和注意事项。
3. 化学实验现象:酸碱反应、氧化还原反应、沉淀反应等常见化学实验现象的观察和解释。
五、应用化学复习1. 燃烧与能量:燃烧的定义、燃烧过程中的能量变化和应用。
2. 酸雨与环境保护:酸雨的成因、危害和防治措施。
3. 化学肥料与农业:化学肥料的种类、成分和作用。
4. 化学药品与健康:常见化学药品的种类、成分和应用。
六、化学知识的应用1. 化学在生活中的应用:化妆品、日用品、食品等生活中常见化学产品的成分和应用。
2. 化学在工业中的应用:石油化工、冶金、电子等工业领域中常见化学过程和产品的应用。
2024年高考化学复习大纲

2024年高考化学复习大纲一、基础知识复习1. 元素周期表- 了解主要元素的基本信息,包括原子序数、原子量等。
- 熟悉元素周期表的布局和组成,掌握周期和族的概念。
- 掌握元素的周期性规律,如原子半径、电子亲和能、电离能等。
2. 化学键- 熟悉离子键、共价键和金属键的形成条件和特点。
- 掌握离子键的特性,如电导性、溶解度等。
- 理解共价键的键长、键能和极性的概念。
3. 化学反应- 理解化学反应的基本概念,如反应物、生成物和化学方程式。
- 熟悉氧化还原反应和酸碱中和反应的特点和应用。
- 掌握化学反应的平衡条件及影响平衡的因素。
二、无机化学复习1. 酸碱盐- 熟悉酸碱盐的定义和性质,了解酸碱中和反应的规律。
- 掌握常见酸碱盐的名称、化学式和性质。
2. 有机化合物- 理解有机化合物的基本概念和特点。
- 熟悉不饱和烃、醇、醛、酮、羧酸等有机化合物的结构和性质。
- 掌握有机化合物的命名规则和化学反应。
三、物质与能量转化复习1. 燃烧与能量- 理解燃烧的过程和能量转化。
- 熟悉燃烧反应的特点和燃烧热的计算方法。
2. 化学能与化学反应- 了解化学能的定义和计量单位。
- 掌握化学反应中的能量变化和化学反应的焓变计算。
四、化学元素周期律与资源利用1. 元素的周期性- 熟悉元素周期表的布局和规律。
- 掌握周期表上元素性质的周期性变化规律。
2. 化学元素与人类生活- 了解常见化学元素在人类生活中的应用和重要性。
- 掌握化学元素的提取、分离和利用的方法与原理。
五、化学实验操作与技巧1. 基本实验操作- 熟悉实验室常用的基本仪器、玻璃器皿和实验操作规范。
- 掌握实验中的物质称量、溶解、过滤、加热等基本操作技巧。
2. 实验数据处理与分析- 掌握实验数据的记录、整理和处理方法。
- 熟悉常用的化学计算方法,如浓度计算、反应产率计算等。
六、化学领域的新进展1. 纳米材料与纳米技术- 了解纳米材料的基本概念和特点。
- 掌握纳米材料在生物医学、环境保护等领域的应用。
高考化学必考知识点大纲

高考化学必考知识点大纲随着高考的临近,对于即将参加高考的学生们来说,复习各科的知识变得越来越重要。
而化学作为一门必考科目,需要学生们熟练掌握一些必考的知识点。
本文将为大家总结高考化学必考知识点的大纲,帮助大家高效备考。
一、无机化学1. 元素的基本性质:学生需要了解元素的物理性质、化学性质、周期规律等基本知识。
例如,金属的特性,非金属的特性,周期表的结构。
2. 化学键和分子:学生需要了解化学键的种类,如离子键、共价键等,及其特点和形成规律。
同时,还需熟悉分子的概念、结构和性质。
3. 化学方程式:学生需要通过实例了解化学方程式的表示方法,掌握平衡化学方程的原则和方法,理解反应的条件和速率。
4. 酸碱盐以及酸碱中和反应:学生需要了解酸和碱的定义和性质,了解常见酸碱盐的命名规则。
此外,还需要掌握酸碱滴定中的计算方法和示意图。
5. 氧化还原反应:学生需要了解氧化还原反应的定义和性质,了解常见的氧化还原反应,并掌握氧化还原反应的平衡方法。
二、有机化学1. 碳的特性和有机化合物的分类:学生需要了解碳的特性和有机化合物的命名方法,了解常见的有机化合物,如烷烃、烯烃、炔烃等。
2. 有机反应的类型和机理:学生需要了解有机反应的类型,如加成反应、消除反应、取代反应等,并了解各种反应的机理和条件。
3. 功能团的性质和反应:学生需要了解常见的有机化合物中的功能团,如醇、醛、酮、酸等,并了解它们的性质和反应。
4. 聚合物的合成和性质:学生需要了解聚合物的合成方法,如自由基聚合、阴离子聚合等,并了解聚合物的性质和应用。
三、物理化学1. 气体的性质和理论:学生需要了解气体的状态方程、性质和理论,了解气体的压力、体积和温度之间的关系,以及气体的动力学理论。
2. 溶液的性质和溶解度:学生需要了解溶液的定义和性质,掌握溶液中溶质和溶剂的概念,了解溶液的溶解度和溶解度曲线。
3. 化学平衡和化学动力学:学生需要了解化学平衡的条件和原理,了解平衡常数和平衡常量的计算方法。
高中化学复习提纲(全套)

高中化学复习提纲(全套)
第一章:化学基础知识复
1.1 基本概念
- 原子结构
- 元素周期表
- 分子结构
1.2 化学方程式
- 离子方程式
- 平衡方程式
- 氧化还原方程式
1.3 化学反应
- 酸碱反应
- 氧化还原反应
- 气体的化学反应
第二章:常见化学物质复
2.1 酸碱盐
- 酸的性质和分类
- 碱的性质和分类
- 盐的性质和分类
2.2 金属与非金属
- 金属元素和化合物的性质
- 非金属元素和化合物的性质
2.3 有机化合物
- 烃类
- 醇类
- 羧酸类
第三章:化学实验与实践3.1 基本实验操作
- 配制溶液
- 提取纯净物质
- 分离混合物
3.2 化学实验常用仪器
- 显色反应管
- 酸碱滴定仪
- 蒸馏器
3.3 常见化学实验
- 酸碱滴定实验
- 气体检验实验
- 溶液浓度实验
第四章:化学应用与相关知识4.1 化学工业
- 常见化学工业原料与产品
- 化学工业生产过程
4.2 环境与化学
- 大气污染与控制
- 水污染与控制
- 土壤污染与控制
4.3 化学与生活
- 食品添加剂
- 药物与药理学
- 日常用品的化学原理
以上是高中化学复习的全套提纲,涵盖了基础知识、常见化学物质、化学实验与实践以及化学应用与相关知识。
希望对你的复习有所帮助!。
高三化学复习总纲全部

高三复习总纲.一、复习关键----掌握25条必要知识点121.阿伏加德罗常数(物质的量、气体摩尔体积、阿伏加法罗定律及推论)2.氧化还原反应概念及应用3.离子反应、离子方程式4.电解质溶液(溶液浓度、、中和滴定及PH计算、胶体的知识)5.“位—构—性”(金属性、非金属性强弱判断原理及应用、同周期、同主族元素性质的递变)6.化学键与晶体及其特点7.化学反应速率与化学平衡8.等效平衡思想的应用9.弱电解质电离平衡(溶液中微粒间的关系(物料平衡和电荷守恒)盐类的水解、弱电解离子浓度与大小比较)10.11.离子的鉴定、共存与转化12.、热化学方程式及反应热计算13.原电池与电解池原理及应用14.典型元素常见单质及其化合物的重要性质及相互转化关系15.官能团、官能团的确定、同分异构和同系物16.有机反应类型17.有机合成推断18.有机新信息题有机聚合体19.阴阳离子的鉴别与鉴定20.物质的除杂、净化、分离和鉴定21.实验仪器使用与连接和基本操作22.实验设计与评价23.混合物的计算24.化学史、环境保护、能源25.信息和新情景题的模仿思想3、复习备考的小专题40个1.化学实验仪器及其使用2.化学实验装置与基本操作3.常见物质的分离、提纯和鉴别4.常见气体的制备方法5.常用的加热方法与操作6.实验设计和实验评价7.有机物燃烧的规律8.有机反应与判断9.有机代表物的相互衍变10.有机物的鉴别11.既能与强酸反应又能与强碱反应的物质的小结12.分解产物为两种或三种的物质13.碳酸与碳酸的盐的相互转化14.铝三角15.铁三角16.中学里可以和水反应的物质17.中学中的图像小结18.离子反应与离子方程式19.氧化还原反应20.无机反应小结21.阿伏加德罗常数22.阿伏加德罗定律23.原子结构24.元素周期律和元素周期表25.化学键、分子结构和晶体结构26.化学反应速率27.化学平衡的应用(化学平衡、溶解平衡、电离平衡)28.盐类的水解29.原电池30.电解池31.几个定量实验32.离子共存、离子浓度大小的比较 33.溶液的酸碱性与pH 计算 34.多步反应变一步计算35.溶解度、溶液的浓度及相关计算 36.混合物的计算37.化学计算中的巧妙方法小结 38.无机化工 39.有机合成 40.能源与环保二、第一轮基础理论实质:有电子转移(得失与偏移) 特征:反应前后元素的化合价有变化还原性 化合价升高 弱氧化性 ↑ ↑还原剂 氧化反应氧化产物氧化剂 还原反应 还原产物↓ 氧化性 化合价降低 弱还原性氧化还原反应有元素化合价升降的化学反应是氧化还原反应。
高考化学考试重点大纲解析

高考化学考试重点大纲解析一、化学基本概念1、物质的组成、性质和分类元素、原子、分子、离子等基本概念物质的分类方法,如纯净物、混合物、单质、化合物等物理性质和化学性质的区别2、化学用语常见元素的名称、符号、原子结构示意图化学式、电子式、结构式、结构简式等的书写化学方程式、离子方程式的书写及配平3、溶液溶液的组成表示,如溶质的质量分数、物质的量浓度溶解度的概念及计算溶液的配制和稀释4、化学反应与能量化学反应的分类,如氧化还原反应、离子反应等化学反应中的能量变化,吸热反应和放热反应热化学方程式的书写及相关计算二、化学基本理论1、物质结构原子结构,包括原子核外电子排布规律元素周期律和元素周期表化学键的类型,如离子键、共价键等分子的极性和空间构型2、化学反应速率和化学平衡化学反应速率的概念及计算影响化学反应速率的因素,如浓度、温度、压强、催化剂等化学平衡的建立、特征和影响因素化学平衡常数的计算和应用3、电解质溶液电解质和非电解质的概念强弱电解质的区别和电离方程式的书写水的电离和溶液的酸碱性盐类的水解及其应用离子共存问题三、无机化学1、常见金属元素钠、铝、铁等金属元素的性质金属化合物的性质,如氧化物、氢氧化物、盐等金属的冶炼方法2、常见非金属元素氯、氮、硫等非金属元素的性质非金属化合物的性质,如氧化物、氢化物、酸等非金属元素的重要用途3、无机推断根据物质的性质和反应进行推断常见无机物之间的转化关系四、有机化学1、有机物的结构和性质有机物的分类和命名常见官能团的性质和反应同分异构体的书写和判断2、烃甲烷、乙烯、苯等烃的性质烃的燃烧规律3、烃的衍生物乙醇、乙酸、酯等烃的衍生物的性质有机合成的基本思路和方法4、有机推断和有机合成根据有机物的性质和反应进行推断设计合理的有机合成路线五、化学实验1、实验基本操作仪器的使用和洗涤药品的取用和存放实验安全知识2、物质的制备和检验常见气体的制备方法和收集物质的检验和鉴别方法3、实验方案的设计和评价设计实验方案来探究化学问题对实验方案进行评价和改进六、化学计算1、根据化学方程式的计算有关反应物和生成物的量的计算过量计算和多步反应的计算2、物质的量的计算物质的量、摩尔质量、气体摩尔体积、物质的量浓度等的计算有关溶液的计算3、混合物的计算混合物中各组分含量的计算有关平均相对分子质量的计算七、综合应用1、化学与生活化学在环境保护、材料科学、能源开发等方面的应用常见化学物质在生活中的用途和危害2、化学与工业生产化工生产中的基本原理和工艺流程绿色化学的理念和应用以上内容为高考化学考试的重点大纲解析,考生应根据自身情况有针对性地进行复习,注重理解和应用,提高解题能力和思维水平。
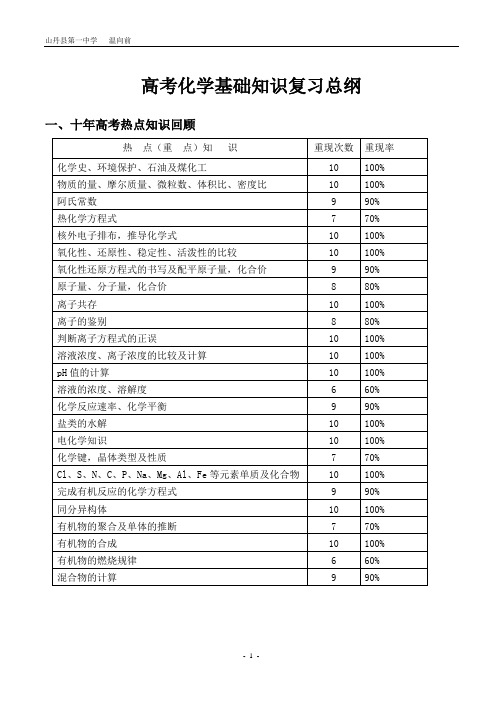
高考化学基础知识复习总纲
4、P30—31理解酸、碱、盐、氧化物的概念,从氯化钠在水中的溶解和电离示意图和实验2—1中离子反应的含义,理解中和反应的本质等。
5、P36氯化钠形成的示意图理解氧化还原反应的含义
【必修1:第三章】:
1、P46元素在地壳中的含量顺序;
2、P61-62甲烷与氯气的反应及实验现象
3、P64同系物和同分异构体的概念
4、P66-68乙烯的来源,乙烯的用途。乙烯的重要地位,乙烯性质的探究
5、P69-71苯的结构、性质实验探究,资料卡片
6、P73-74乙醇、水分别与钠反应的现象区别,结论。P67资料卡片,乙醇的所有性质反应。
7、P75如何设计乙酸与碳酸酸性比较的实验
9、P61了解难溶电解质的溶解平衡,理解沉淀反应的应用,熟悉P68的实验目的、结论等
【选修4:第四章】
1、P71原电池的工作原理,盐桥的作用
2、P75熟悉不同电池的工作原理,电极反应方程式。
3、P79理解电解原理和应用,尤其是电镀,再次完成P88的思考与交流
4、P84金属腐蚀的原理,电化学腐蚀为主,识记吸氧腐蚀和析氢腐蚀的电极方程式和总方程式。
8、P75酯化反应的实验操作和注意事项
【必修2:第四章】
1、P78基本营养物质要熟悉
2、P88金属的冶炼原理,熟记方程式,铝热反应实验
3、P90海水资源的开发利用:了解、熟记所有内容
4、P95-102了解、识记所有内容。
【选修4:绪言】
绪言中熟悉有效碰撞、活化分子和活化能
【选修4:第一章】
1、P2断键吸收能量,成键释放能量
5、P79-80硅和二氧化硅都是良好的半导体材料,硅是信息技术、光电池的材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学题型复习提纲 The Standardization Office was revised on the afternoon of December 13, 2020
一、高考化学题型归纳
1、 单项选择题1-6
2、 主观题(7-10)
元素无机综合、化学平衡综合、实验综合、有机综合 二、选择题考点归纳
基本化学用语化学基本概念化学反应与能量
氧化还原反应的概念及计算三、元素无机综合题考点归纳
1、 常出现的元素:H 、C 、N 、O 、F 、Na 、Mg 、Al 、Si 、S 、Cl 、Fe 、Cu
2、 常出现的气体:H 2、O 2、N 2、Cl 2、CO 2、NH
3、HCl 、SO 2、CH
4、NO 2、CO 、NO
3、 常出现的信息:物质状态、颜色、用途、来源、工业生产、物质类型、原子结构
4、 常出现的条件:点燃、加热、高温、电解、催化剂
5、常出现的反应:
2Na + 2H
2O = 2NaOH + H
2
↑
2Na
2O
2
+ 2H
2
O = 4NaOH + O
2
↑
2Na
2O
2
+ 2CO
2
= 2Na
2
CO
3
+ O
2
↑
2NaCl + 2H
2O 2NaOH + H
2
↑+ Cl
2
↑
2NaOH + Cl
2= NaCl +NaClO + H
2
O
2NaOH + Ca(HCO
3)
2
= Na
2
CO
3
+ CaCO
3
↓+ 2H
2
O
NaOH + Ca(HCO
3)
2
= NaHCO
3
+ CaCO
3
↓+ H
2
O
2NaHCO
3+ Ca(OH)
2
= Na
2
CO
3
+ CaCO
3
↓+ 2H
2
O
NaHCO
3+ Ca(OH)
2
=NaOH + CaCO
3
↓+ H
2
O
2Mg + CO
2
2MgO + C
3Mg + N
2 Mg
3
N
2
2Al + 2NaOH + 2H
2O = 2NaAlO
2
+ H
2
↑
Al
2O
3
+ 2NaOH = 2NaAlO
2
+ H
2
O
Al(OH)
3+ NaOH = NaAlO
2
+ 2H
2
O
2Al + Fe
2O
3
Al
2
O
3
+ 2Fe
3Fe + 4H
2O Fe
3
O
4
+ 4H
2
C + H
2O CO + H
2
2C + SiO
2
2CO + Si
Si + 2NaOH + H
2O = Na
2
SiO
3
+ 2H
2
↑
SiO
2+ 2NaOH = Na
2
SiO
3
+ H
2
O
SiO
2+ Na
2
CO
3
Na
2
SiO
3
+ CO
2
↑
SO 2 + Cl 2 + 2H 2O = 2HCl + H 2SO 4 C + 2H 2SO 4(浓) CO 2↑+ 2SO 2↑+ 2H 2O Cu + 2H 2SO 4(浓)
CuSO 4 + SO 2 +2H 2O C + 4HNO 3(浓)
CO 2↑+ 4NO 2↑+ 2H 2O 3Cu + 8HNO 3(稀) 3Cu(NO 3)2 + 2NO ↑+ 4H 2O Cu + 4HNO 3(浓)
Cu(NO 3)2 + 2NO2↑ + 2H 2O
4NO + 3O 2 + 2H 2O = 4HNO 3 4NO 2 + O 2 + 2H 2O = 4HNO 3
6、 常出现的工业制备:
Na 的制备:2NaCl
2Na + Cl 2↑ Mg 的制备:MgCl 2 Mg + Cl 2↑ Al 的制备:2Al 2O 3
4Al + 3O 2↑
氯碱工业:2NaCl + 2H 2O
2NaOH + H 2↑ + Cl 2↑
漂白粉制备:2Cl 2 + 2Ca(OH)2 = CaCl 2 + Ca(ClO)2 + 2H 2O 石灰工业:CaCO 3
CaO + CO 2↑
硅的制备:2C + SiO 2 2CO + Si Si +2Cl 2=SiCl 4 SiCl 4
+ 2H 2 = Si + 4HCl
硫酸工业: 4FeS 2 + 11O 2
2Fe 2O 3 + 8SO 2(沸腾炉) + O 2 2SO 3 (接触室) 2SO 2 + H 2O = H 2SO 4 (吸收塔) SO 3 合成氨工业: N 2
+3H 2 2NH 3 (合成塔) 硝酸工业:4NH 3 +
5O 2 4NO + 6H 2O
2NO + O
2= 2NO
2
3NO
2+ H
2
O = 2HNO
3
+ NO
高炉炼铁: C + O2CO2 CO2 + C 2CO (产生高温环境,并制备还原剂CO)
3CO + Fe
2O
3
2Fe + 3CO
2
CaCO
3 CaO + CO
2
↑ CaO + SiO
2
CaSi
3
除脉石(造渣)
7、常出现的问题:
元素符号或名称、元素在周期表的位置、物质的名称或分子式
物质的电子式或结构式、晶体类型判断、熔沸点比较
半径大小比较、化学方程式书写及计算、热化学方程式书写
离子方程式书写、原电池电极方程式书写、电解池电极方程式书写
四、化学平衡综合题考点归纳
1、常出现的类型:
气体转化的平衡、弱电解质的电离平衡、盐类水解平衡、沉淀溶解平衡
2、常出现的问题:
化学反应速率计算及影响因素分析、化学平衡的判断标志
化学平衡常数的计算及影响因素分析、平衡转化率的计算及影响因素分析
ΔH和ΔS以及反应自发性的判断、化学平衡的移动判断及等效平衡
溶液酸碱性变化、离子浓度大小变化及比较、
离子是否沉淀的计算判断、沉淀后溶液中离子浓度的计算
热化学方程式的书写、化学平衡图像的分析与绘制
五、实验综合题考点归纳
1、常出现的类型:
物质的检验、物质性质验证、物质含量测定、物质的制备、物质性质探究
2、常出现的问题:
仪器的选择及使用方法、装置的连接及气密性检测、装置各部分的作用及现象、
添加药品顺序及作用、化学方程式书写和计算以及误差分析、其他注意事项
六、有机综合题考点归纳
1、常出现的物质:烯烃、苯的同系物、卤代烃、醇、醛、羧酸、酯、高聚物、环酯
2、常出现的反应:
烯烃加成、卤代烃水解、卤代烃消去、醇催化氧化、醛的氧化、醛的还原
酯化反应、环酯化反应、酯的水解、加聚反应、缩聚反应
3、常出现的信息:
H
2/Ni,Δ、 X
2
/CCl
4
、 NaOH醇溶液/Δ、 NaOH溶液/Δ、催化剂
/O
2
浓硫酸/Δ、稀硫酸/Δ、 Cu/Ag,Δ、银氨溶液、新制氢氧化铜悬浊液
4、常出现的合成线路:
5、常出现的问题:
物质的名称或分子式、物质的结构简式、所含官能团名称或结构简式
物质能发生的反应判断、方程式书写及反应类型判断、同分异构体。
