醛酮α-H反应
有机化学第十一章 醛酮

NaCl + SO2↑ + H2O
Na2CO3 NaHCO3 + Na2SO3
(C)转化成α-羟基腈 α-羟基磺酸钠与NaCN作用,其磺酸基则被氰基取代生成α-
羟基腈。如:
CHO NaHSO3
OH C
Na C N
SO3Na
OH C
CN
HCl H2O
OH C
COOH
优点:可以避免使用易挥发、有毒的HCN,且产率较高。
O
O
CH3-C-CH2-C-CH3
2,4 戊二酮
H3C O
3 甲基环戊酮
练习
命名下列化合物。
O CH3 CH3CCH2C=CH2
4-甲基-4-戊烯-2-酮
CH3CHCH2CHO OH
3-羟基丁醛
O CH3CHCH2CCH3
Cl
4-氯-2-戊酮
O CCH3
CHO
CHO
苯乙酮
CH2CHO
苯甲醛
CH3
3-甲基苯甲醛
= = R
++ δ
δ
R δ+ δ
CO >
CO
H
R
羰基碳原子连有基团的体积↑,空间位阻↑,不利于亲核试剂
进攻,达到过渡状态所需活化能↑,故反应活性相对↓。
综上所述,下列醛、酮进行亲核加成的相对活性为:
Cl3C C=O
H
> C=O
> CH3 C=O
R
> C=O
Ar
> C=O
>
H
H
H
H
H
= CH3 C O >
α -二醛或酮:两个羰基直接相连。 β -二醛或酮:两个羰基间隔一个碳原子。
经典的合成反应
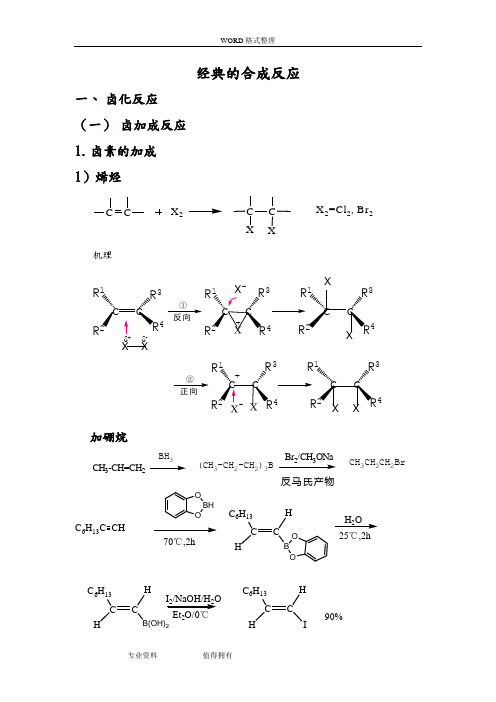
经典的合成反应一、 卤化反应 (一) 卤加成反应 1. 卤素的加成 1)烯烃X 2CC XX 2=Cl 2, Br 2机理c c c c c c x xR 1R R 34R 1R 4R 334R R ①x-R 1R 4R 3R 34R R 1②+c c c c δ-加硼烷CH 3-CH=CH 2BH 3(CH 3-CH 2-CH 2)3B23CH 3CH 2CH 2Br反马氏产物C 6H 13C CHBH O 70℃,2hC CC 6H 13HHO B 25℃,2hC CC 6H 13HH2C CC 6H 13HHI90%I 2/NaOH/H 2O 2H 2O3)不饱和羧酸 2. 卤化氢的加成加卤化氢H X C C H X =H C l, H B r, HI机理C R1R3+C R2C R2HH反向同向CH 3CH=CH 2CH 3CHBrCH 3CH 3CH 2CH 2BrMarkovnikov 加成反Markovnikov 加成Ph-CH=CH 2HBrHBr H 2O 2或光照Ph--C-CH 3Ph-CH 2CH 2Br Br反马氏规则3. 次卤酸(酯)、N-卤代酰胺加成C CX 2CCX+H 2OHXX 2=Cl 2, Br 2+(二) 卤代反应 1.烃类 1)脂肪烃芳烃卤代反应 机理+E+Eπ-络合物HEE +H +σ-络合物HX X-H ++-σ-络合物举例:Cl CH 3+CH 3CH 3CH 3CH 3CH 3BrClBr ++22OHOHBr°0 COH BrBr BrH 2O 2H 2O 2Br 22Br 2/Bu-NH 2-70 COHBrBr OHBrBr °OHOHOH2.羰基化合物羰基化合物的卤代反应机理OR R'δδCC OHB C COBHCOC COC C C等于C OHCOO HC OCHCOCH1)醛、酮酮α-H 卤代反应R- C - CH 3OR- C - CH 2BrO2亲电取代反应C CHCCC COC CH OHOH酸催化机理C C H OH慢C C C C X碱催化机理举例:O 2NC-CH 3O O 2N C-CH 2BrOHBrBr 2+氯霉素的制备溴对酮的加成CH 2CH 2CHH 2C OHC CHCH 2CH 33COHCH 2CH 23BrH 2C OCH 2CH 2CH 3H Br HBr-Br 2C CH 2CH 2CH 32C OCHCH 2CH 3H 3C OBr+(1.5%)(58%)酮自由基反应(饱和烃、苄位和烯丙位的卤取代反应、某些不饱和烃的卤加成反应以及羧基、重碳基的卤置换反应)α-羰基自由基取代OCC O R'H R''R'''+Br2+CC OR'Br R''R'''Br 22Br光O +HBrOHBrO O O OBrBr CHOCHO Br2)羧酸衍生物 3.醇、酚、醚 1)醇 2)酚 3)醚4.羧酸1)羧羟基2)羧酸脱羧5.其他官能团的卤代反应1)卤化物2)磺酸酯3)芳香重氮盐化合物二、烃化反应(一)碳原子的烃化反应1.芳烃的烃化Friedel-Crafts 烷基化反应芳烃与卤代烃、醇类或烯类化合物在Lewis催化剂(如AlCl3,FeCl3, H2SO4, H3PO4, BF3, HF等)存在下,发生芳环的烷基化反应。
12 醛和酮化学性质

中间体 烷氧基负离子
2017/1/10 21
羟醛缩合反应机理(四步) 亲核加成-消除反应
A: 生成亲核试剂(烯醇负离子) B: 亲核加成 C: 生成β-羟醛
H3 C OC H
H2O
OH H3 C C H
CH2 CHO
CH2 CHO
D: 脱水形成不饱和醛
OH H3 C C H
,— H2O
H3C
CH
2017/1/10 30
A: 托伦斯试剂
R(Ar) CHO
+
2 Ag(NH3)2OH
RCOONH4
Байду номын сангаас
+
2 Ag
+
3 NH3
+
H2O
银镜反应 B: 费林试剂
RCHO
+
2 Cu
2+
+
OH
-
+
H2O
RCOO -
+
Cu2O
+
4H
+
2017/1/10
31
托伦斯、菲林试剂的特点
① 此两种试剂都是弱氧化剂,只氧化醛基,对原结 构中的双键没有影响;
2017/1/10 28
卤仿反应的应用:
定性鉴别
合成其它方法难以得到的、减少了一个碳的羧酸。
如:制备2,2-二甲基丙酸
嚬 呐 酮
CH3 O H3 C C CH3 C CH3
① Br2 / NaOH ② H+
H3 C
CH3 O C CH3 C OH
思考:能否用卤烃氰解的方法?
CH3 H3 C
CH2CH2
E
醛、酮的其它反应

(b)用还原剂(金属氢化物)还原 LiAlH4还原:
CH3CH=CHCH2CHO ① LiAlH 4 干乙醚 ② H2O CH3CH=CHCH2CH2OH ( 只还原 C=O )
LiAlH4是强还原剂,但①选择性差,除不还原C=C、C≡C外,其它不 饱和键都可被其还原;②不稳定,遇水剧烈反应,通常只能在无水醚或THF 中使用 。
a) 羰基加成
O N OH
N OH
H2N OH
+ NH2 OH
O
羟氨
O
对苯醌单肟
N OH
对苯醌双肟
b) 双键加成
O O O
+ Cl 2
O O
Cl H Cl H
Cl2
Cl H Cl H
O
Cl H Cl H
二氯苯醌
四氯苯醌
O + HCl O
O
[
OH
Cl H
OH
]
重排
Cl OH
②
还原反应 O
[H]
[O]
C6H5CHO + CH 3CHO
C6H5CHO + CH 3CH 2CHO
OH
OH
C6H5CH=CHCHO
C6H5CH=CCHO CH 3 68%
含有α -H的酮在碱催化下,也可发生类似反应,称为羟 酮缩合,但反应比醛难以进行。
十、 醌的性质
醌是一类特殊环状不饱和二元酮,醌分子中两个碳-碳 双键与两个羰基共轭,形成交错共轭体系,而不是闭合共 轭体系,故醌不具芳香性。 ① 加成反应:(具有典型烯、羰基化合物性质)
第八章 醛、酮、醌
8.3醛、酮的其它反应
八、氧化和还原反应
1.氧化反应 醛易被氧化,弱的氧化剂即可将醛氧化为羧酸。 酮难被氧化,使用强氧化剂(如重铬酸钾和浓硫酸) 氧化酮,则发生碳链的断裂而生成复杂的氧化产物。 (1)与多伦(B.Tollen)试剂反应
实验 醛酮的化学性质

【实验指导及操作步骤】
5.希夫反应
希夫试剂 希夫试剂 10滴 苯甲醛 乙醛 丙酮 在冷溶液和酸性条 件下进行反应
甲醛
【实验指导及操作步骤】
6.与亚硝酸酰铁氰化钠反应
乙醛10滴 丙酮10滴
Na2[Fe(CN)5NO] 10滴 、盐氢氧化钠5滴
观察溶液颜色变化
【讨论】
【实验仪器和试剂】
仪器:试管、 250 ml烧杯、100℃ 温度计、石棉网、 酒精灯。
药品:甲醛水溶液 (福尔马林)、乙醛、苯甲醛、丙 酮 、 乙 醇 、 2,4- 二 硝 基 苯 肼 试 剂 、 碘 试 剂 、 1.25mol/L 氢氧化钠、 0.05mol/L 硝酸银、 0.5mol/L 氨水、斐林试剂A液(0.2mol/L硫酸铜)、 斐林试 剂 B 液( 0.8mol/L 酒石酸钾钠的氢氧化钠溶液)、 希夫试剂
2 , 4 二 硝 基 苯 腙
【实验指导及操作步骤】
2.碘仿反应
甲醛
基苯 肼反应生成不溶于水的 2,4 -二硝基苯腙
若无沉淀,可在温水浴温热数 分钟,冷却后再观察
【实验指导及操作步骤】
3.银镜反应
托伦试剂的制备:硝酸银溶液、氢 氧化钠1滴、加氨水直至生成的沉淀 恰好溶解为止
1.哪些试剂可以用于醛、酮的鉴别? 2.现有5瓶失去标签的有机化合物,它们可能 是乙醇、甲醛、乙醛、苯甲醛、苯甲醇、丙酮, 请设计一个方案,将它们的标签一一贴上。
斐林试剂含有Cu2+的配离子,它具有弱氧化性,可将脂 肪醛氧化成相应的羧酸,而Cu2+被还原为砖红色Cu2O沉 淀。甲醛因还原性强,可进一步把氧化亚铜还原为铜, 在洁净的试管上形成铜镜。只有脂肪醛能被斐林试剂氧 化,芳香醛则不能
有机化学第11章 醛和酮

O H3C C CH3
NaCN H2S O4
CH3 CH2=C-COOCH3
(CH3)2CCN OH
H2O
CH3 CH2=C-CN
CH3OH
CH3
H
CH2=C-COOCH3
α-甲基丙烯酸甲酯
2、与格氏试剂的加成反应
δ C
δ O
+ δR δMgX
无水乙醚
OMgX H2O C
R C OH + HOMgX
R
C H (R )
O
+ CH3-CH-CH3 ( i - Pr -O-)3Al
R CH OH
OH
H (R )
+ CH3-C-CH3 O
可逆反应,正反应称为麦尔外因-庞多夫-维尔莱还原反应, 其逆反应称为奥本奥尔氧化反应。 反应的专一性高,只使羰基与醇羟基互变而不影响其它基团, 故为一级醇、二级醇与醛酮对应转变的重要方法。
4-甲基-3-乙基己醛
2-甲基-3-戊酮
2-苯丙醛
例如:
CH3-C=CHCH 2CH2-CH-CH 2CHO
CH3
CH3
3,7 二甲基 6 辛烯醛
H3C O
3 甲基环戊酮
O
O
O
C-CH 2CH3
C-CH 3
2 环己烯酮
1 环己基 1 丙酮
1 苯基 1 乙酮
多元醛酮:称某二醛或酮
当酮羰基和醛羰基共存时,酮羰基称羰基、酰基或氧代;
醛的异构现象是碳链异构。 酮的异构现象是碳链异构和羰基的位置异构。
三、醛酮的命名
1、IUPAC命名法
选择含羰基的最长链为主链;从近羰基的一端开始编号, 醛基总在链端;取代基位次和名称写于母体名称之前。
醛酮的加成反应

O O 1. CH3CHO CH3CCH2CH2MgBr + 2. H2O , H
CH3COCH 2CH2CHCH 3 OH
CH2OH 例3:从甘油合成 CHOH CH2OCR O
CH3 CH2OH CH COCH CH2O RCOCl 3 3 C CHO CH3 解: CHOH 碱 H CH2OH CH2OH
1720~1740cm-1
1695~1715cm-1
1680~1705cm-1
醛羰基约在1750~1700cm-1,醛基C-H伸缩在2820
~2720cm-1,低于脂肪烃的C-H伸缩频率。
O R C R O Ar C R O Ar C Ar O RCH CH C R
1700~1725cm-1 1680~1700cm-1
(Z)-丁酮肟
(E)-丁酮肟
(4) 与氢氰酸的加成反应
OH C=O
+ H
CN
C
CN
α -羟基腈
O OH
N aCN , H 2 SO 4
例: CH 3CCH 3
CH 3CCH 3 CN
实验:丙酮与氢氰酸作用,在3-4 h内只有一半原料起反
应,若加一滴氢氧化钾溶液,则反应可以在两分 钟内完成。加酸则使反应速度减慢。在大量的酸 存在下,放几星期也不起反应。
产率(1h,%)
89
56
36
CH 3 C= O CH 3CH 2CH 2
CH 3 C= O (CH 3)2CH
CH 3 C= O (CH 3)3C
23
12
6
加成产物在酸、碱作用下,可分解为原来的醛和酮:
R H OH C SO 3Na HCl R H C= O + NaCl + SO 2 + H 2O
有机化学第09章 醛酮(2)

2)用化学还原剂还原 ——还原产物均为醇 常用的化学还原剂:
NaBH4 , Al[OCH(CH3)2]3/(CH3)2CHOH,
LiAlH4
特点 ①NaBH4在水/醇中是一种非常缓和的还原剂,
O
选择性高,一般只还原醛酮的 C ,不还原
C C , C C , NO2
CN
COOH, COOR
可用此还原剂合成不饱和醇。
+ CH3(CH2)2COCl
CO(CH2)2CH3
Zn-Hg ,HCl
( CH2)3 CH3
②沃尔夫—凯息纳(L.Wolff-N·M·Kishner)—黄鸣龙法
C O NH2 NH2 , KOH 三 甘醇
CH2
CH2-CH2 CH2-CH2 CH2-CH2 OH OH OH OH OH OH
原来Wolff-Kishner的方法是将醛或酮与肼和金属钠或钾 在高温(约200 °C)下加热反应,需要在封管或高压釜中 进行,操作不方便。 黄鸣龙改进不用封管而在高沸点溶剂如一缩二乙二醇 (二甘醇,b.p.245 °C)中,用氢氧化钠或氢氧化钾代替 金属钠反应
H2O2 OH-
3 RCH=CHOH
重 排 RCH2CHO
2、从芳烃制备 1)F – C 酰基化反应
+
COCl
2)伽特曼 – 科赫反应
苯环上有强吸电子取代基不反应
O
AlCl3
82
C
CH3+ CO + HCl AlCl3-CuCl2
反应条件:
H3C
CHO
只有苯、烷基苯、烷氧基苯可反应,产物多为对位,
O
OH
RCH=CHCCH3 NaBH4 RCH=CHCHCH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
合成中的重 要中间物。
O –C–CH2CH2COOH
H+/H2O
齐鲁工业大学《有机化学》教学课件—第6讲 (2014.3.24-1/2)
预习主要知识点
1、醛的氧化反应(与酮比较) P345 2、还原成醇和还原成烃 P346 4、歧化反应(坎尼扎罗反应) P350 3
H+
H+
-H+
-
-
轭
H–CH2–CH=O乙醛 CH2=CH–O–H 乙烯醇 (烯醇式) (酮式)
1、酮式—烯醇式的互变异构 P338
一般结构烯醇式不稳定,特殊结构烯醇式可稳定存在。 OH CH2=C–CH3 烯醇式 1.5×10-4% H : O O O O –H O CO C O 动态平衡 O C C CH CH –CCH –CH CH –C–CH CH33–C– CH 3–C=CH 3 CH CH CH 3 3 22 3 3 酮式 24% 烯醇式 76% 即可与羰基试剂反应 如:NaHSO3、H2N–OH O H–CH2–C–CH3 酮式 ≈100%
互 变 异 构
也可与烯醇式试剂反应 如:Na、Br2、FeCl3
2、卤代反应和碘仿反应 P340 O H O X 卤代 X2 R–C—C– R–C—C– 反应 O H O X X2 R–C—C–H R–C—C–X H X
O R–C–O- + CHX3 CHCl3 CHBr3 CHI3
卤仿 反应
注意——酸碱催化条件下,反应位置、反应程度 均有差异。
(1) 醛、酮的自身缩合(以醛为例) CH3CH=O + H–CH2CH=O
HO-
△ 反应机理: 羰基组分 亚甲基组份 HO CH3CH=O + H2–CHCH=O △ CH3CH=CH–CH=O CH2CH=O + H2 O ① HO + H–CH2CH=O ,-丁烯醛 (1) 醛、酮的自身缩合 O OH (巴豆醛) HO CH RCH +H –CHCH=O ② CH CH=O + CH RCH –CH–CH=O 3CHCH 2CH=O 2CH=O 3 2CH=O (2) 二元醛、酮的缩合 2CH R R O OH △ -羟基醛 (3)苯甲醛的交叉缩合 羰基组分 亚甲基组份 - CH CHCH CH=O + HO ③ CH CHCH CH=O +H O HO 3 2 3 2 2 RCH2CH=O + H2–CCH=O RCH CH=C –CH=O 2 △ R ,-不饱和醛 R
(1) 反应位置
R OH H O R O R O ①酸 R–C=C– H–C—C— H–C—C— R–C—C— O H H H ②碱 R–C—C— R -离子连接R越多越不稳定 C HO -H的酸性越强越好 O CH3–C–CH–CH3 CH3 H+ 羰基O的负电越多越好 (2) 反应程度 O负电降低, 不利
HO△
O
,-不饱和酮
(3)苯甲醛的交叉缩合——克莱森-施密特反应 –CHO
直接 脱水
+ CH3–CH=O
HO-
不含-H 含有 O-H –CHO 亚甲基组分 HO羰基组分 + CH3–C–CH3
O –CHO HO + CH3–C–CH2CH3
–CH=CH–CH=O 3-苯丙烯醛 (肉桂醛 O) –CH=CH–C–CH3 4-苯-3-丁烯-2-酮 O –CH=C–C–CH3 CH3
OH H CH3CH– –CH=O –CH CH2– -羟基丁醛
(2) 二元醛、酮的缩合
发生分子内羟醛缩合,生成5、6元环状,-不饱和酮。 O O HO O CH3–C–CH2–CH2–C–CH3 △ 2,5-己二酮 3-甲基-2-环戊烯酮 O O O HOO CH3–C–CH 2–CH2–CH O2–C–CH3 △ O 2,6-庚二酮 CH3–C=O + H2–CH–C–CH3 甲基-2-环己烯酮 CH33 O O
pKa= 35
离域式 互变式: CH2–CH=CH2 CH2=CH-CH 2共 p- 碳负离子 碳负离子 更活泼
-H+ CH CH –CH=CH — CH—CH 2 2 22
-
-
-
H–CH2–CH=O
更稳定 CH2 –CH=O CH — CH—O 2 pKa= 17 离域式 CH2=CH–O 互变式:CH2–CH=O 碳负离子 烯醇负离子
酸催化——取代较少的-H C=C连接R越多越稳定 碱催化——取代较多的-H
< >
< >
+与O再结合。 于 H H O ①酸 (一步) H O - + H–C—C— X—C—C— 剩余-H酸性更强 ②碱 (多步) H H 更易于HO-进攻。
练习1:写出下列反应的主要产物 O CH3 H+ Br O Br2 CH3 O CH3 HO- Br Br2 Br
齐鲁工业大学《有机化学》教学课件—第5讲 (2014.3.20-7/8)
主要知识点
1、酮式和烯醇式的互变异构
) 4、曼尼希(Mannich)反应
(二 一) 羰基的亲核加成反应 -H的反应 P338
以乙醛和丙烯为例,比较说明: H–CH2–CH=CH2
氧化性 碘仿反应
O CH3–C– ——甲基酮和乙醛 OH CH3–CH– ——甲基醇和乙醇
三取代 O CH3–C–CH–CH3 CH3 一取代
NaOI HO- CHI ↓(黄) + 3 I2
H+ Cl2
O Cl CH3–C–C–CH3 CH3
O -O–C–CH–CH 3 CH3
3、羟醛缩合反应P342 ——加成 + 缩水
–CHO +
3-甲基-4-苯-3-丁烯-2-酮 O OO –C–CH3 HO–CH=CH – 2CH3 –CH=CH –C–C CH 1苯-1戊烯-3-酮 1,3二苯丙烯酮
4、曼尼希(Mannich)反应 P344 O –C–CH3 + HCHO+ (CH3)2NH· HCl O -酮胺盐酸盐 –C–CH2CH2N(CH3)2 · HCl 含活泼α-H的醛酮 - OH O △ –C–CH2CH2N(CH3)2 O –C–CH=CH2 KCN/△ O –C–CH2CH2CN
