分子量分解问题的参考解答
高中化学分子量的计算技巧详解

高中化学分子量的计算技巧详解化学是一门重要的自然科学,其中分子量的计算是化学学习中的基础知识之一。
掌握分子量的计算技巧对于高中化学学习至关重要。
本文将详细介绍高中化学分子量的计算技巧,并通过具体的题目举例,分析考点和解题思路,帮助高中学生及其父母更好地理解和掌握这一知识点。
一、分子量的概念和计算方法分子量是指化学物质中分子所含有的所有原子的质量之和。
通常用原子量单位来表示,即原子质量单位为g/mol。
要计算分子量,首先需要知道化学式中各个元素的原子量,然后根据化学式中各个元素的个数,将其与对应的原子量相乘,最后将所有元素的质量之和即为分子量。
例如,计算H2O的分子量。
根据元素周期表,H的原子量为1.008 g/mol,O的原子量为16.00 g/mol。
化学式H2O中,H的个数为2,O的个数为1。
因此,H2O的分子量为2×1.008 + 1×16.00 = 18.02 g/mol。
二、分子量计算中的常见考点和解题技巧1. 化学式中含有括号的情况有些化学式中含有括号,这时需要将括号内的化学式中的元素个数乘以括号后面的数字。
例如,计算Ca(OH)2的分子量。
根据元素周期表,Ca的原子量为40.08 g/mol,O的原子量为16.00 g/mol,H的原子量为1.008 g/mol。
化学式Ca(OH)2中,Ca的个数为1,O的个数为2,H的个数为2。
因此,Ca(OH)2的分子量为1×40.08 + 2×16.00 + 2×1.008 = 74.10 g/mol。
2. 化学式中含有水合物的情况有些化学式中含有水合物,即结合了水分子的化合物。
计算分子量时,需要将水合物中的水分子的质量也计算在内。
例如,计算CuSO4·5H2O的分子量。
根据元素周期表,Cu的原子量为63.55 g/mol,S的原子量为32.07 g/mol,O的原子量为16.00 g/mol,H的原子量为1.008 g/mol。
聚合物的分子量和分子量分布习题及解答
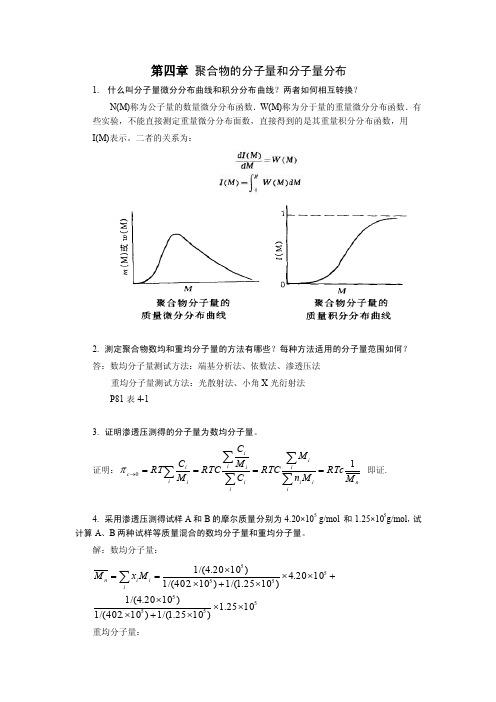
第四章 聚合物的分子量和分子量分布1. 什么叫分子量微分分布曲线和积分分布曲线?两者如何相互转换?N(M)称为公子量的数量微分分布函数.W(M)称为分于量的重量微分分布函数.有些实验,不能直接测定重量微分分布面数,直接得到的是其重量积分分布函数,用 I(M)表示。
二者的关系为:2. 测定聚合物数均和重均分子量的方法有哪些?每种方法适用的分子量范围如何? 答:数均分子量测试方法:端基分析法、依数法、渗透压法重均分子量测试方法:光散射法、小角X 光衍射法P81表4-13. 证明渗透压测得的分子量为数均分子量。
证明:n ii i i i i i i i i i ii c M RTc M n M RTC C M C RTC M C RT 10====∑∑∑∑∑→π 即证.4. 采用渗透压测得试样A 和B 的摩尔质量分别为4.20×105 g/mol 和1.25×105g/mol ,试计算A 、B 两种试样等质量混合的数均分子量和重均分子量。
解:数均分子量:555555551025.1)1025.1/(1)10.402/(1)1020.4/(11020.4)1025.1/(1)10.402/(1)1020.4/(1⨯⨯⨯+⨯⨯+⨯⨯⨯+⨯⨯==∑ii i n M x M重均分子量:55510725.21025.15.01020.45.0⨯=⨯⨯+⨯⨯==∑i ii M M ωω5.35℃时,,环已烷为聚苯乙烯(无规立构)的θ溶剂。
现将300mg 聚苯已烯(ρ=1.05 g/cm 3,n M =1.5×105)于 35℃溶于环己烷中,试计算:(1)第二维利系数A z ;(2)溶液的渗透压。
6.某聚苯乙烯试样经分级后得到5个级分。
用光散射法测定了各级分的重均分子量,用粘度法(22℃、二氯乙烷溶剂)测定了各级分的特性粘度,结果如下所示: 试计算Mark -Houwink 方程[η]=KM α中的两个参数K 和α。
高中化学气体的分子质量计算题解题技巧

高中化学气体的分子质量计算题解题技巧在高中化学学习中,气体的分子质量计算是一个重要的知识点。
掌握了这个技巧,不仅可以帮助我们解决各种与气体有关的计算题,还能帮助我们更好地理解气体分子的构成和性质。
本文将介绍一些解决气体分子质量计算题的技巧和方法。
首先,我们需要了解气体的分子质量是怎么计算的。
气体的分子质量是指一个气体分子中所有原子的质量之和。
例如,对于二氧化碳(CO2)这个分子来说,它由一个碳原子和两个氧原子组成。
碳的原子质量为12.01,氧的原子质量为16.00。
因此,CO2的分子质量可以通过计算12.01+16.00+16.00=44.01得到。
当我们遇到一个气体分子质量计算题时,首先要确定该气体的分子式。
分子式告诉我们一个气体分子中有多少个原子以及它们的种类。
例如,对于二氧化碳(CO2)这个分子来说,分子式告诉我们它由一个碳原子和两个氧原子组成。
接下来,我们需要查找每个原子的原子质量。
原子质量可以在元素周期表中找到。
例如,碳的原子质量为12.01,氧的原子质量为16.00。
然后,我们将每个原子的原子质量相加,得到气体分子的分子质量。
例如,对于二氧化碳(CO2)这个分子来说,我们将碳的原子质量12.01和氧的原子质量16.00相加,得到44.01。
在解决气体分子质量计算题时,有一些常见的考点需要我们特别注意。
首先是多原子分子的计算。
对于多原子分子来说,我们需要计算每个原子的原子质量,并将它们相加得到分子质量。
例如,硫酸(H2SO4)这个分子由两个氢原子、一个硫原子和四个氧原子组成。
我们需要计算氢、硫和氧的原子质量,并将它们相加得到硫酸的分子质量。
另一个考点是带有系数的分子式。
有时候,题目中给出的分子式前面会有一个系数。
这个系数表示该分子在化学反应中的个数。
我们在计算分子质量时,需要将该系数乘以每个原子的原子质量,并将它们相加得到分子质量。
例如,二氧化碳(CO2)这个分子的分子式中,氧的系数为2。
pm分子量问题回答

pm分子量
PM分子量是指聚合物中单个分子的平均质量。
它是衡量聚合物分子大小的重要指标,也是聚合物物理性质和化学性质的重要参数之一。
PM分子量的计算方法有多种,其中最常用的是凝胶渗透色谱法(GPC)。
该方法通过将聚合物样品溶解在适当的溶剂中,然后将其注入到一根特殊的柱子中,柱子内填充有一种特殊的凝胶。
当样品通过柱子时,由于分子大小的不同,聚合物分子会在凝胶中产生不同程度的阻力,从而分离出不同大小的分子。
通过检测分离出的分子的数量和大小,可以计算出聚合物的PM分子量。
PM分子量的大小对聚合物的性质有着重要的影响。
一般来说,PM分子量越大,聚合物的物理性质和化学性质就越好。
例如,高分子量的聚合物通常具有更高的强度、更好的耐热性和耐化学性,同时也更难降解。
因此,在聚合物材料的选择和设计中,PM分子量是一个非常重要的参数。
除了影响聚合物性质外,PM分子量还可以用于确定聚合物的合成方法和反应条件。
例如,在聚合物合成过程中,控制反应时间、温度和催化剂浓度等因素可以影响聚合物的PM分子量。
因此,通过对PM分子量的测定和分析,可以优化聚合物的合成过程,从而获得更好的聚
合物性质。
总之,PM分子量是衡量聚合物分子大小的重要指标,它对聚合物的物理性质、化学性质和合成方法都有着重要的影响。
因此,在聚合物材料的选择和设计中,PM分子量是一个不可忽视的参数。
《分子量分解问题》

分子量分解问题组号:第12小组程引 02 算法设计论文撰写刘静伟 04 C程序编程论文撰写李海欣 09 matlaB程序实现1问题提出生命蛋白质是由若干种氨基酸经不同的方式组合而成。
在实验中,为了分析某个生命蛋白质的分子组成,通常用质谱实验测定其分子量x (正整数),然后将分子量x分解为n个已知分子量a[i](i=1,2……n)氨基酸的和的形式。
某实验室所研究的问题中:n=18, x 1000a[i](i=1,2……18)分别为57, 71, 87, 97, 99, 101, 103, 113, 114, 115, 128, 129, 131, 137, 147, 156, 163, 186要求针对该实验室拥有或不拥有计算机的情况作出解答。
2问题分析#问题本身有一些不符合实际的情况如下:1)氨基酸组成蛋白质的时候会失去一分子的水,而且氨基酸组合方式不同形成不同形状的蛋白质如链形、环形等会失去不同个数的水分子;2)蛋白质水解的程度不同所得到的氨基酸分子的质量也不同;3)蛋白质中有些氨基酸是相互依存的,即,一种氨基酸的存在是以其他某一种或某几种氨基酸的存在为前提的;4)当给定的蛋白质重量增加时,所得到的解的个数可能成指数倍数上升,计算量庞大3模型假设针对2中对问题的分析,我们做一下假设:1)不考虑蛋白质水解时水分子的量,即,给定的蛋白质分子量就是几个已知分子量的和。
2)不考虑蛋白质水解程度的不同;3)被测定的蛋白质仅由给定分子量的氨基酸组成,而不含有其他物质或元素4)氨基酸组合成蛋白质的过程是任意排列组合的,一种氨基酸的存在不是以其他某一种或某几种氨基酸的存在为前提的;|4模型分析与建立给定蛋白质的分子量X 和各种氨基酸的分子量a(i),测定蛋白质的组成,即求解n 元线性方程X x a ni i =∑=1i 的所有整数解的问题。
当n=18时即为本题所要求解的问题 X x a i i =∑=181i ①i x 是非负整数(i=1,2,3……18) 再拥有和不拥有计算机的情况下可以使用不同的算法,,这里分别为“优化穷举法”和“矩阵”解法在拥有计算机的情况下求解——“优化穷举法”利用传统穷举法,我们可以先计算给定的蛋白质分子量X 包含ia 的最多的个数[X\i a ],即i x ∈{0,1,2…[X\i a ]},所以当全部结果都列举出来时,利用排列组合可以算出,要穷举的次数为]\[181i ∏=i a X ,当X=1000时将达到*10^17次,显然在实际计算中是不可行的。
分子量计算方法详解

分子量计算方法详解在化学中,分子量是指一个分子所含原子的总质量。
分子量的精确计算对于化学研究、实验以及工业应用都非常重要。
本文将详解分子量的计算方法。
1. 原子量首先要了解的是原子量。
原子量是元素中一个原子的相对质量。
相对质量是相对于碳-12原子的质量。
例如,氢的相对原子量为1.008,氧的相对原子量为15.999。
2. 分子式分子式是化学式的一种形式,用化学符号表示分子中化学元素的类型和个数。
例如,水的分子式为H2O,二氧化碳的分子式为CO2。
3. 分子量计算分子量是分子中所有原子对应原子量的总和。
可以使用以下公式来计算分子量:分子量= ∑(原子量 ×原子数量)以乙醇(C2H5OH)为例,可以计算出其分子量:C的原子量为12.01,出现2次H的原子量为1.008,出现6次O的原子量为15.999,出现1次因此,乙醇的分子量为:分子量 = (12.01 × 2) + (1.008 × 6) + (15.999 × 1) = 46.07这表明,乙醇的分子质量为46.07。
4. 相对分子质量相对分子质量是化合物分子质量相对于1/12碳-12原子质量的比值。
相对分子质量也可以表示为摩尔质量。
例如,乙醇的相对分子质量为46.07。
5. 摩尔质量分子量或相对分子质量可以转化为摩尔质量。
摩尔质量是指1摩尔物质的质量,其中1摩尔=6.02×1023个粒子(原子、分子或离子)。
可以使用以下公式将分子量转换为摩尔质量:摩尔质量 = 分子量 × 1g/mol以乙醇为例,它的分子量为46.07,因此其摩尔质量为:摩尔质量 = 46.07 × 1g/mol = 46.07g/mol6. 摩尔质量的应用摩尔质量在化学实验和化学工业中得到广泛应用。
它通常用于计算反应物和生成物的摩尔数,以便确定化学方程式中的量比。
例如,如果要制备1摩尔乙醇,将需要46.07克的乙醇。
高中化学分子质量计算题解题步骤

高中化学分子质量计算题解题步骤在高中化学学习中,分子质量计算是一个重要的知识点。
通过计算分子质量,我们可以了解化学物质的组成和性质。
本文将介绍解决分子质量计算题的步骤和技巧。
一、了解分子质量的概念分子质量是指一个分子中所有原子的质量之和。
在计算分子质量时,需要根据元素的相对原子质量(也称为相对分子质量或摩尔质量)来计算。
例如,对于化学式为H2O的水分子,H的相对原子质量为1,O的相对原子质量为16。
因此,水分子的分子质量为1×2+16=18。
二、分子质量计算题的解题步骤1. 确定化学式中各元素的相对原子质量。
首先,需要查找元素的相对原子质量。
这些数据通常可以在化学教科书或在线化学数据库中找到。
有时候,教师也会提供这些数据。
2. 计算各元素在化学式中的个数。
根据化学式中各元素的下标数字,计算各元素在化学式中的个数。
例如,对于化学式H2O,H的个数为2,O的个数为1。
3. 计算分子质量。
将各元素的相对原子质量与其在化学式中的个数相乘,然后求和,即可得到分子质量。
例如,对于化学式H2O,H的相对原子质量为1,个数为2;O的相对原子质量为16,个数为1。
因此,分子质量为1×2+16=18。
三、解题技巧和注意事项1. 注意化学式的写法化学式的写法应准确无误,特别是元素的下标数字。
一个错误的下标数字可能导致计算错误的分子质量。
2. 注意元素的相对原子质量在查找元素的相对原子质量时,应注意使用正确的数值。
不同的元素可能具有不同的相对原子质量。
3. 注意单位的转换在计算过程中,应注意单位的转换。
通常,相对原子质量的单位是g/mol,而分子质量的单位是g。
4. 多练习,熟悉常见化学式通过多做练习题,可以熟悉常见的化学式和它们的分子质量。
这样,在解决分子质量计算题时,就能更加快速和准确地计算。
举例说明:题目:计算化学式CaCO3的分子质量。
解题步骤:1. 查找元素的相对原子质量。
Ca的相对原子质量为40,C的相对原子质量为12,O的相对原子质量为16。
有关分子量的有机推断汇总

【例】(北京市模拟)已知: C 2H 5OH +HO —NO 2(硝酸)C 2H 5O —NO 2(硝酸乙酯)+H 2ORCH(OH)2 RCHO +H 2O现有只含C 、H 、O 的化合物A 、B、D、E ,其中A 为饱和多元醇,其它有关信息已注明在下图的方框内。
回答问题:(1) A 的分子式为 。
(2) 写出下列物质的结构简式D E 。
【随堂训练】已知: ①累积二烯烃(如:CH 2=C=CH 2)较不稳定,性质比较活泼。
化合物A 为烃,B~D 为烃的含氧衍生物,有关信息如下:则化合物A 的结构简式可能为例2.以某链烃A 为起始原料合成化合物G 的路径如下(图中Mr 表示相对分子质量): 又知:A 是不饱和链烃,没有甲基;NaOH 醇溶液可以和卤代烃发生消去反应产生不饱和碳不稳定,自动失水 浓硫酸原子;G 是有香味的物质,且可以使溴水褪色。
回答下列问题:(1)指出反应类型:B→C : ,E→F : 。
(2)写出下列物质的结构简式:A : ,F : 。
(3)写出下列反应的化学方程式:B → C : ;F → G : 。
3.[ 化学——选修有机化学基础](15分)(08年宁夏理综〃36)已知化合物A 中各元素的质量分数分别为C 37.5%,H 4.2%和O 58.3%。
请填空(1)0.01 molA 在空气中充分燃烧需消耗氧气 1.01 L (标准状况),则A 的分子式是 ;(2)实验表明:A 不能发生银镜反应。
1molA 与中量的碳酸氢钠溶液反应可以放出3 mol 二氧化碳。
在浓硫酸催化下,A 与乙酸可发生酯化反应。
核磁共振氢谱表明A 分子中有4个氢处于完全相同的化学环境。
则A 的结构简式是 ;(3)在浓硫酸催化和适宜的的反应条件下,A 与足量的乙醇反应生成B (C 12H 20O 7),B 只有两种官能团,其数目比为3∶1。
由A 生成B 的反应类型是 ,该反应的化学方程式是 ; (4)A 失去1分子水后形成化合物C ,写出C 的两种可能的结构简式及其官能团的名称① ,② 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、分子量分解问题
1. 问题的提出
生命蛋白质是由若干种氨基酸经不同的方式组合而成。
在实验中,为了分析某个生命蛋白质的分子组成,通常用质谱实验测定其分子量x(正整数),然后将分子量x分解为n个已知分子量a[i](i=1,.......,n)氨基酸的和的形式。
某实验室所研究的问题中:
n=18, x≤1000
a[i](i=1,.......,18)分别为57, 71, 87, 97, 99, 101, 103, 113, 114, 115, 128, 129, 131, 137, 147, 156, 163, 186
要求针对该实验室拥有或不拥有计算机的情况作出解答。
2.问题的分析
上述问题就是要将任意给定的正整数表示为若干已知正整数的倍数
之和,亦即求解下列不定方程
∑==
n
i
x
i x
i
a
1
][
][
(1)
其中x是已知蛋白质的分子量,a[i]代表第i种氨基酸的分子量,x[i]代表该种蛋白质中所含第i种氨基酸的个数。
根据题意,我们作以下几点分析:
(A1)对一些给定的值x,不定方程(1)可能无解;但对实际问题,应有解,若出现无解,说明数值x有偏差,应重新测定。
(A2)以m表示(1)右端x的上界。
此时m=1000, n=18, 考虑用穷举法求出全部解,这时,每个m[i]的取值范围为0≤x[i]≤ [m/a[i]],所以穷举的次数要达到O(m n),实际为
故穷举法在实际上是不可行的。
(A3) 考虑分解x的一个反问题,将若干个分子量a[i](i=1,2,….,n)经组合,构成更大分子量的蛋白质,从中寻找具有分子量x的各种构成。
(A4) 若实验室没有计算机,我们事前仍可利用计算机求得一些便于查阅的工具或表格供实验室工作人员使用。
3 .模型的建立
(I)深度、广度搜索
先从穷举法着手,对给定的m,将其分解为a[i]的组合形式,具体过程可以分为深度搜索和广度搜索两种方式。
但这两种方式,一方面计算量随着m的增大而指数增加,另一方面,面对几万、几十万种组合,无法方便筛选。
(II)启发式搜索
考虑(A3)中的思想,对a[i](i=1,2,…..,n)不断求和。
看是否能达到x?由于在求和中只考虑和数小于m的范围,因此对每个a[i]的求和过程的计算工作量为O(m),整个求和过的计算工作量为O(mn),这比穷举法的计算量O(m n)要少得多。
为了实现上述方法,先引入下列定义:
Y={x|x≤m,x使(1)有解,x为正整数}
L(a[i])={0,a[i],2a[i],……..,[m/a[i]].a[i]}定义一种运算
其中U可为{1,2,…,m}的任何子集。
开始令Y=φ,然后对i=1,2,…,n用下列运算不断扩大集合Y:
Y:=Y])
a
⊕
L
(i
[
定义数组b[i](i=1,2,…,m),开始时一切b[x]=0,若在求和过程中得到一个x,则令b[x]=1,表示该x的不定方程(1)有解:定义另一种数组s[i](i=1,2,…,m),开始时一切s[x]=0, 以后在求和过程中每次得到一个x, 就令s[x]:= s[x]+1, 这样最终得到的s[x]相等于该x的不定方程(1)的解的个数.
然而, 我们不仅要得到解的个数, 还要求得所有的解, 因此在求和过程中还应记录更多的信息。
为此对不定方程(1)的解的构造作进一步的分析与提炼。
设(x[1],x[2],…x[n])为相应于x的(1)非负整数解,又设x[q]为
x[1],x[2],…,x[n]中最后一个非零项,即q∈[1,n]使x[q+1]=x[q+2]= …
=x[n]=0,q称为末项指标, 于是(1)可改写为
从而还可得到
q
x
a
q
+
+
x
=
-q
x
q
a
x
a
x
a
+
a
q
]1
-
[
[
[
](
)1
]
[
...
]1
[-
+
]2[
]
-
]1[
]2[
]1[
(2)
若记第q个分量为1的n维单位向量为e[q]. 如果(x[1],x[2],…,x[n])为相应于x的(1)的解,其末项指标为q,则(x[1],x[2],…,x[n])-e[q]为相应于x-a[q]的(1)的解,其末项指标为p≤q,考虑到多解的情况,q可能有多种选择,因此在求和过程Y:=Y⊕L(a[i])中还应记录末项可能的种数,记为v[x](v[x]≤n)及相应的末项指标q[x,1], q[x,2], …, q[x,v[x]].
有了一切v[x]及q[x,v[x]]后,我们可以利用(2)不断减少x来跟踪x 的所有解的情况。
为此将上述v[.]及q[.,.]记录为解的跟踪信息表。
下面给出了x≤186时的跟踪信息表,以示求解的过程。
表1 跟踪信息表的一部分
的两个解为
x=a[2]+a[5], x=a[1]+a[3]
又以表中未列出的x=284为例,有关的跟踪信息为
x=284, s[x]=6, v[x]=4, q[x,1]=9, q[x,2]=11, q[x3,]=15, q[x,4]=16 这些信息表明:解的总数s=6,末项指标有4种选择,分别为9、11、15、16,利用末项指标的信息,我们利用(2)得到
x-a[9]=170, x-a[11]=156, x-a[15]=137, x-a[16]=128
再对上述所得的4个数继续往前利用表1关于它们的跟踪信息,使末项指标不断下降,可得如下6个解:
x=a[2]+a[5]+a[9]; x=a[1]+a[8]+a[9]; x=a[1]+a[5]+a[11];
x=a[14]+a[15]; x=a[1]+a[2]+a[16]; x=a[11]+a[16] 上述跟踪方式的求解步骤,可描述为一棵树,可以据此编制出一个完整的程序。
对x≤1000, 解的个数最多可达几百个。
但对于没有计算机的实验室,我们可以给出x≤m(如x≤1000)的跟踪信息表用手算来实现跟踪也是可行的。
4 .进一步讨论
因算法的计算量为O(mn),故计算时间上是可行的。
由于存储解的跟踪信息表需一个m⨯n的矩阵q,所以空间需求为O(mn),当m与n 很大时,可以用压缩存放来发掘潜力。
其次,实验得到的蛋白质分子量x有偏差时的情况是有实际意义的。
如果偏差不超过3,则可对x、x±1、x±2、x±3分别求解,其结果供决策人员参考,因此,计算工作量还需随偏差量线性增加。
此外,当m与n相当大,且蛋白质分子量x相应的解数很多时,则为了减少计算以及缩小解的总数,还应增加其他求解条件,如通过实验验证某分子量为a[i]的氨基酸是否存在,某种氨基酸存在数量的上下限等,这样可使计算量大大减少。
