钠及其化合物(知识网络)复习进程
金属钠及其化合物知识归纳及巩固

金属钠及其化合物知识归纳及巩固一、钠:I 、钠原子结构钠元素位于元素周期表第三周期第IA 。
从钠的原子核外电子排布看,其最外电子层上只有一个电子,因此,极易将这一电子失去,而达到稳定结构,形成+1价的钠阳离子(Na +)。
即金属钠的原子结构决定了其性质的活泼。
因其易失电子被氧化,故金属钠是还原剂。
II 、钠的物理性质钠是银白色金属,质软(可用刀切割),密度小(0.97g/cm 3),熔点低,是电和热的良导体。
III 、钠的化学性质由于钠原子最外层只有一个电子,在化学反应中容易失去最外层的一个电子变为钠离子:Na -e -→Na+所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。
1. 与非金属反应 (1)与氧气的反应常温下能与空气中的氧气化合,表面变暗。
4Na+O 2=2Na 2O 在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。
2Na+O 2Na 2O 2(2)与硫反应 2Na+S=Na 2S (研磨易爆炸) (3)与氯气反应 2Na+Cl 2 2NaCl (发出黄色火焰,产生白烟)2. 与水反应钠与水反应的化学方程式为:2Na+2H 2O=2NaOH+H 2↑该反应的实质是钠原子与水电离出的H +发生氧化还原反应,其离子方程式为:2Na+2H 2O=2Na ++2OH -+H 2↑注:钠与水反应的现象可概括为“浮、熔、游、响、红”,并结合钠的性质进行记忆。
3. 与酸反应 钠与酸反应比与水反应更加激烈,极易爆炸。
钠与盐酸反应 2Na+2HCl=2NaCl+H 2↑钠与稀硫酸反应 2Na+H 2SO 4 =Na 2SO 4 +H 2↑钠与酸溶液反应的实质是:钠与酸电离出来的H +直接反应,而不是钠先与水反应,生成的氢氧化钠再和酸溶液反应。
因为钠与水反应时,得电子的是水电离的H +,而酸中H +浓度大于水中H +的浓度。
4. 与盐的反应 与熔融盐的反应 4Na+TiCl 4(熔融) =Ti+4NaCl 与盐溶液反应 将钠加到盐溶液中,首先是钠与水反应,若生成的氢氧化钠与盐能发生复分解反应,生成难溶物或弱电解质等,则氢氧化钠和盐再反应;否点燃点燃则钠只与水反应。
钠及其化合物知识网络图
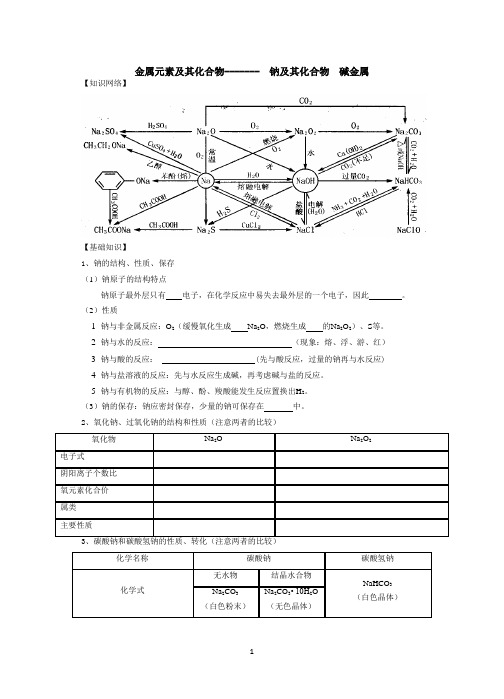
金属元素及其化合物-------钠及其化合物碱金属
【知识网络】
【基础知识】
1、钠的结构、性质、保存
(1)钠原子的结构特点
钠原子最外层只有电子,在化学反应中易失去最外层的一个电子,因此。
(2)性质
1钠与非金属反应:O2(缓慢氧化生成Na2O,燃烧生成的Na2O2)、S等。
2钠与水的反应:(现象:熔、浮、游、红)3钠与酸的反应: (先与酸反应,过量的钠再与水反应) 4钠与盐溶液的反应:先与水反应生成碱,再考虑碱与盐的反应。
5钠与有机物的反应:与醇、酚、羧酸能发生反应置换出H2。
(3)钠的保存:钠应密封保存,少量的钠可保存在中。
2、氧化钠、过氧化钠的结构和性质(注意两者的比较)。
钠及其化合物一轮复习

一轮复习第三章金属及其化合物第一讲钠及其化合物(第1课时)教学设计教学目标:知识与技能:1、了解钠的性质及其运用。
2、了解钠的重要化合物性质及其运用。
过程与方法:1、学生自学基本了解钠及其化合物(氧化钠、过氧化钠)的性质。
2、通过思维导图引导学生知道如何复习元素化合物。
3、教师和学生共同通过思维导图学习钠、氧化钠、过氧化钠的性质及运用态度与价值观:1、使学生认识自学是很好且终生的学习的方法。
2、使学生认识思维导图是很好的学习工具。
教学重点:钠和过氧化钠的性质及其运用。
教学难点:学生对知识的整理与归纳的能力的培养。
教学过程:教学过程教学目标教学内容活动设计考纲解读使学生知道学习的方向和要点钠及其化合物在高考纲要求:1、了解钠的性质及其运用。
2、了解钠的重要化合物性质及其运用。
考纲解读:1、掌握钠、过氧化钠、碳酸钠和碳酸氢钠的性质及其运用。
考中的要求和考试形式。
2.了解氧化钠和氢氧化钠。
展示导图:考情分析:此部分内容在选择题和大题中都有可能出现,通常以钠及其化合物考察NA、物质结构、电学、电离和水解等方面。
引导分析了解学习某物质的方法某物质应了解或掌握的内容1、与学生共同回顾在学习元素化合物时通常要知道其哪些方面。
2、展示导图。
思考完善学生用思维导图自学复习钠的性质及用途复习钠的性质及用途学生结合前面讨论完善自己的思维导图。
学生讲述1.培养学生归纳总结的能力2.复习钠的制法、物理性质、化学性质、用钠的制法、物理性质、化学性质、用途及制请优秀学生讲述他的思维导图中关于单质钠的部分。
途及制法法教师作品展示1.巩固钠的相关性质。
2.指导学生思维导图的绘制。
钠的制法、物理性质、化学性质、用途及制法1.展示教师的钠单质的思维导图。
2.与学生作品比较,指出各自的优缺点。
练习巩固、检测钠的相关性质钠的相关性质过渡引入钠的氧化物的复习思维导图体现了每个人对知识的理解认知程度,也是个性的充分表现。
用心画好每张图。
愉快的欣赏每张图,学习是快乐的,生活是美好的。
复习《钠及其化合物》

加热法
足量二氧化碳
二、Na2CO3 与NaHCO3
的除杂
适量NaOH
Na2SO3
2.Na2O2的 氧化性与还原
性
01 能氧化I-、F e2+ 、 S2、SO32-、SO2、 H2S、品红、石蕊等。
02 如:过氧化钠 与 品 红溶 液的反应:能使品红溶 液褪色。
03 遇高锰酸钾等 强 氧 化剂 时,表现出还原性,
04 氧化产物为O 2 1. 遇CO2、H2O、 H+ 发生自身的 氧化还原反应。
Na2O2 与CO2、 H2O的反应规律
物质的量的关系
气体体积关系
电子转移关系
固体质量关系
看P38方法指导 完成37页题组一和题组 二习题
听写:
01 钠与水
02 钠与盐酸
03
钠与FeSO4 溶液
04
Na2O2 与 水
05
Na2O2 与 CO2
06
Na2O2 与 盐酸
07
氧化钠与盐 酸
08
ρ(煤油)<ρ(Na)<ρ(H2O)
二、钠的化学 性质
(一)与非金属反应
1、钠与氧气反应:
失4e-
4Na + O2
2Na2O (白色)
得4e-
失去2e-
2Na + O2
点燃 Na2O2(淡黄色) 得到2e-
2、与其它非金属反应:
高中化学精品课件:钠及其化合物复习

2.某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法不正确 的是 问A题.实1验:前碳p酸H氢(N钠a2C溶O液3)与>氯pH化(N钙a溶HC液O反3) 应得到的沉淀是碳酸钙吗?如果是,
√ 那B么.实碳验酸后根两来溶自液哪中里离?子种类完全相同
问需C题要.N满a22:C足O从什3溶沉么液淀条溶中件解生?平成衡的角沉度淀思比考N,aH碳C酸O3氢钠溶液与氯化钙溶液生成沉淀 溶液中生成的沉淀多
2.焰色反应 (1)焰色反应的概念 某些金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,属于 物理变化,是元素的性质。 (2)焰色反应的操作 铂丝―酒―灼精―烧―灯→无色――蘸―取―→待测物―酒―灼精―烧―灯→观察火焰颜色―用―洗盐―涤―酸→
铂丝―酒―灼精―烧―灯→无色
(3)常见元素的焰色 钠元素: 黄 色;钾元素: 紫 色(透过 蓝色钴玻璃 观察);铜元素: 绿色; 钡元素: 黄绿色;Ca元素: 砖红 色。
该电池负极材料是什么?能否把电极锂外层裹包的聚合物电 解质去掉?
三、探究过氧化钠的性质
向饱和 NaOH 溶液(滴加酚酞)中加入少量的过氧 化钠粉末,会有什么现象? 实验现象:有大量无色气泡产生,溶液红色褪去,并放出热量,有少量晶体析出。 问题 1:Na2O2 与水反应的氧化剂和还原剂是?
问题 2:为什么有晶体析出?恢复到室温后,溶液中的 c(Na+) 和 c(OH-)如 何变化?
问题 1:金属钠与氯化钾反应置换出单质钾是在水溶液中进行的吗?为什么? 问题 2:该反应的温度应该如何控制? 问题3:该反应的反应条件如何控制有利于钾的生成? 问题4:把钠分别投入饱和氢氧化钙溶液、硫酸铜溶液、氯化铵溶液中,会有 什么现象?
问题 5:2013 年 3 月,我国科学家公布了如下图所示的水溶 液锂 离子电池体系。
一、钠及其化合物碱金属【知识网络】1、钠的结构、性质、保存⑴钠与酸

一、钠及其化合物 碱金属【知识网络】1、钠的结构、性质、保存:⑴钠与酸的反应:先与酸反应,过量的钠再与水反应;⑵钠与盐溶液的反应:先与水反应生成碱,再考虑碱与盐的反应。
⑶钠的保存:应密封保存,少量的钠可保存在煤油中。
2、氧化钠、过氧化钠的结构和性质:注意两者的比较,特别是过氧化钠的特性。
⑴具有强氧化性,从而能够漂白某些物质,原理与HClO 的作用一样;①Na 2O 2与SO 2反应:Na 2O 2+SO 2===Na 2SO 4②Na 2O 2投入FeCl 2溶液中,可将Fe 2+氧化成Fe 3+,同时生成Fe (OH )3沉淀。
③Na 2O 2投入氢硫酸中,可将H 2S 氧化成单质硫,溶液变浑浊。
④Na 2O 2投入Na 2SO 3溶液中,可将SO 32-氧化成SO 42-。
⑤Na 2O 2投入品红溶液中,因其有氧化性,所以有漂白性,可使品红溶液褪色。
⑵Na 2O 2与H 2O 和CO 2反应时发生岐化反应,Na 2O 2既是氧化剂,又是还原剂; ⑶与Na 2O 2有关计算的一般规律:与CO 2和H 2O 混合物反应时考虑先与CO 2反应。
3、碳酸钠和碳酸氢钠的性质、转化:注意两者的比较。
(1)水溶性:NaHCO 3的溶解度比Na 2CO 3溶解度小。
(2)稳定性:NaHCO 3<Na 2CO 3(3)与酸反应:Na 2CO 3与酸反应有两步(先生成NaHCO 3,再继续反应生成CO 2),反应较慢,而NaHCO 3与酸反应较快。
(4)与澄清石灰水作用时均生成白色沉淀(不能用此鉴别NaHCO 3与Na 2CO 3)。
(5)相互转化 4、碱金属性质的相似性、差异性与递变性:注意性质的递变性。
随核电荷数的递增,核对电子的引力逐渐减弱,金属性逐渐增强。
与有关物质的反应和Na 类似,只是由于金属性不同,反应的剧烈程度不一样;与氧气反应的产物也越来越复杂。
5、焰色反应(1)焰色反应属于物理性质,它不属于化学方法检验。
2023新高考化学总复习知识清单 05 钠及其重要化合物(通用版)
物质
氧化钠
过氧化钠
氧的价态
-2价
-1价
电子式
所含离子
2个Na+和1个O2-
2个Na+和1个O22-
化学键
离子键
离子键和共价键
氧化物类别
碱性氧化物
过氧化物(不属碱性氧化物)
2.Na2O的晶胞
(1)晶胞中含Na2O个数:4,O2-的堆积方式:面心立方最密堆积
(2)Na+的配位数:4,O2-的配位数8
(2)颜色:除了Cs略带金色光泽外,其余的都是银白色有金属光泽的固体
(3)保存
①一般都保存在煤油或石蜡油中,锂只能保存在石蜡油中
②试剂瓶中的试剂取出后,一般不能放回原瓶,但金属Na、K等需立即放回原瓶
(4)盐的溶解性
①一般情况下,碱金属所形成的盐均溶于水,并且在一定温度下,酸式盐比正盐的溶解度大
②NaHCO3的溶解度比Na2CO3的小
(4)循环利用的物质:CO2
六、有关Na2CO3、NaHCO3的检验、鉴别和除杂
1.Na2CO3、NaHCO3的除杂
序号
混合物(括号内为杂质)
除杂方法
①
Na2CO3(s)(NaHCO3)
加热法
②
NaHCO3(aq)(Na2CO3)
通入足量CO2
③
Na2CO3(aq)(NaHCO3)
滴加适量NaOH溶液
③同时产生该现象:原溶液中含有Na2CO3和NaHCO3
七、碱金属元素
1.碱金属的一般性与特殊性
(1)原子结构与性质
①相同点:最外层上都只有1个电子
②不同点:从Li→Cs电子层数逐渐增多,原子半径逐渐增大
(2)化学性质
《钠及其化合物复习》课件
钠在一些能源领域中具有应用潜力,如钠离子电 池。
3 医药中的应用
4 化妆品中的应用
钠在医药领域中被用作输液和药物配方中的重要 成分。
钠在化妆品中经常用作调节剂和防腐剂。
钠的安全性
钠的危险性
钠具有强烈的火和爆炸性,需要 正确处理和储存。
正确储存和处理钠
钠应储存在干燥的环境中,远离 水和氧气,以防止危险事故的发 生。
安全使用建议
在使用钠时,需要穿戴安全装备, 注意防护措施,遵守实验室和工 作场所的安全规定。
应用广泛
由于钠的特性,它在许多工业和科学领域都有广泛的应用。
钠的制备与提纯
1
产量与分布
钠的产量主要依赖于钠盐矿物的开采和提
制备方法
2
取过程,分布广泛但不均匀。
钠可以通过电解熔融氯化钠溶液的方法制
备,也可以经由铝还原法。
3
提纯方法
钠可以通过升华、真空蒸馏等方法进行提 纯,以去除杂质。
钠的反应
物理性质
氯化钠是一种重要的食盐,广 泛应用于食品工业和日常烹饪 中。
硝酸钠用于制备肥料和火药, 也可用于储存钠金属。
碳酸钠
硫酸钠
碳酸钠是一种重要的化学品,广泛用于玻璃工业、 制药和烘焙食品中。
硫酸钠用于制备洗涤剂和皮革工业,也可用于实验 室分析。
钠在生活中的应用
1 食品工业中的应用
2 能源中的应用
钠盐在食品工业中被广泛用作调味品和防腐剂。
《钠及其化合物复习》 PPT课件
本课件详细介绍了化学元素钠及其化合物的复习内容,包括钠的基本特性、 制备、反应、化合物、应用和安全使用等方面。希望能够为您的学习提供帮 助和指导。
钠的基本特性
金属特性
钠及其化合物复习课件
钠及其化合物复习ppt课 件
欢迎来到钠及其化合物复习的PPT课件!让我们一起探索钠的物理性质、化 学性质以及在生活中的应用,还有钠化合物的分类、制备及应用,以及钠的 安全使用与管理。
钠的物理性质
1 金属特性
钠是一种金属元素,具有良好的电导性和热导性。
2 软性金属
钠的硬度较低,可以用手指轻松压扁,因此在制备中常采用制皂法。
氯化钠的制备及应用
1
制备:盐湖提取
通过将盐水通过蒸发或太阳能萃取的方式,得到氯化钠。
2
应用:食盐
氯化钠被广泛用作食品调味品,提供口感和改善食物的保存性。
3
应用:化学工业
氯化钠用于制备氯气和氢氧化钠等化学品,广泛应用于化学工业生产中。
碳酸钠的制备及应用
制备 天然制备:
工业制备:
应用
矿石中提取,如与钡盐反应生成硝酸钠,经过干 燥后反应得到碳酸钠。
水处理
钠被用于水处理中,以软化水质 和去除不纯物。
钠化合物的分类
氯化物
钠氯化物是最常见的钠化合物之一,广泛用于食 盐和工业制品的生产。
碳酸盐
碳酸钠是ቤተ መጻሕፍቲ ባይዱ种重要的钠化合物,用于制备玻璃、 制浆造纸和调节水质酸碱度。
硫酸盐
钠硫酸盐在工业生产中应用广泛,如制造玻璃、 清洁剂和肥料等。
氧化物
钠氧化物可以用于高温反应和工业生产中的催化 剂。
3 银白色
钠是一种具有银白色外观的金属,具有光泽。
钠的化学性质
高反应性
钠与水反应剧烈,会产生氢气, 并形成碱性溶液。
氧化反应
钠可以与氧气反应生成氧化钠。
与非金属反应
钠可以与非金属元素反应形成 相应的钠化合物。
高三化学一轮复习1.1《钠及其化合物》复习教案(鲁科版)
第一讲钠及其化合物【考纲要求】1.钠的性质及用途。
2.Na2O 和 Na2O2的性质及用途。
3. Na2CO3 、NaHCO3 、NaOH的性质及用途。
4. Na2O2 与 H2O、CO2 的反应原理,以及反应前后气体体积差和质量差在计算中的应用。
碱金属元素【考纲要求】1.碱金属元素的原子结构的相似性及递变性。
2.碱金属单质的性质的相似性及递变性。
3.焰色反应。
碱金属元素基础知识一.金属钠(可保存在中)1、钠的化学性质钠的原子结构示意图:跟非金属反应:(O2、Cl2、S)对应的化学方程式:、、(2)与H+反应(H2O、酸、盐溶液)①钠与水反应,标出电子转移:现象及解释:浮:熔:游:产生气体,在水面上向各方迅速游动最后消失 .嘶红:②钠与盐酸离子方程式:③钠投入硫酸铜溶液中化学方程式:(3)与有机物反应(醇、酚、羧酸)与乙醇化学方程式:二、钠的化合物1、Na2O2:颜色状态电子式: 用途: 与H2O 、CO2化学方程式2、Na2CO3 与NaHCO3Na2CO3 俗名:色态:溶解性:热稳定性:NaHCO3俗名:色态:溶解性:热稳定性:Na2CO3 和NaHCO3分别与酸反应速率:V(Na2CO3)V(NaHCO3)三、钠及化合物之间的关系Na2O2Na Na2O NaO H Na2CO3 NaHCO3(方程式写在背面)四、碱金属元素包括()1、递变规律:从上到下原子半径,原子核对最外层电子的束缚力,失电子能力,元素的金属性,单质的还原性,与水或酸反应置换出氢的能力,最高价氧化物的水化物性.2、锂与氧气化学方程式:钾与氧气化学方程式:3、焰色反应操作步骤:将放在酒精灯上灼烧至与原来颜色相同,蘸取待测溶液,在酒精灯上灼烧,钠为色,钾为色(需透过),用洗净铂丝.。
