2017高三化学一轮复习课件(物质的组成、性质与分类)
合集下载
高三第一轮复习化学基本知识-专题二物质的组成、性质和分类
性质都发生了变化,并伴随有放热、发光、颜色的改变、放出气体、生成沉淀等现象。常借
助某些特殊的反应现象来判断化学变化的发生。对于无明显现象出现的反应,则需通过其他
方法加以判断,如酸碱中和反应,用酸碱指示剂加以测试,并根据测试的结果来判断反应的
程度。
点评
判断物质是否发生化学变化时,要抓住化学变化的主要特征,如颜色变化、生成沉淀、生成
反应
AB CD=AD CB
酸碱 酸盐 酸盐
盐+水
NaOH HCl
新酸 新盐 H2S CuSO4
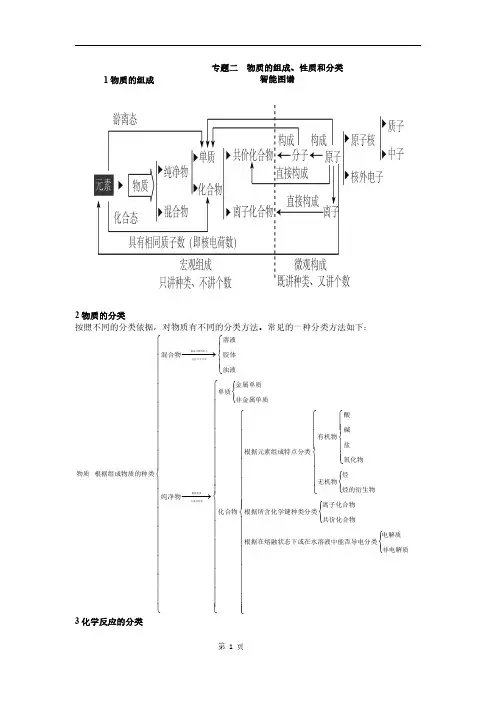
1 物质的组成
专题二 物质的组成、性质和分类 智能图谱
2 物质的分类 按照不同的分类依据,对物质有不同的分类方法。常见的一种分类方法如下:
溶液
混合物
根据分散质粒子 直径大小分类
胶体 浊液
金属单质
单质 非金属单质
酸
物质 根据组成物质的种类
碱 有机物
根据元素组成特点分类
反应 由一种 物质生 成两种 或两种 以上新 物质的
反应
A B AB
氧化还原反应 非氧化还原反应
点燃
2H2 O2
2H2O
CaO H2O
Ca
OH
2
AB A B
氧化还原反应
非氧化还原反应 金属置换金属
2ห้องสมุดไป่ตู้MnO4
K 2MnO4 MnO2 O2
NH 4 HCO3
NH3 H2O CO2
置换 反应
说明
①丁达尔效应是肢体中的分散质微粒对可见光(波长为 400 700 nm )散射而形成的,丁
第3页
反应 类型 化合 反应
分解 反应
达尔效应是一种物理现象。②丁达尔效应是区别溶液和肢体的一种常用的物理方法(如图
高考化学一轮总复习 第一章 第三节物质的组成、性质及分类课件

答案:C
第二十五页,共41页。
实验(shíyàn)·操作—提高素 养
实验课题(kètí):Fe(OH)3胶体的制备
1.实验目的。 探究水解反应法制备Fe(OH)3胶体,并验证胶体的重要性质。 2.实验原理。 (1)FeCl3+3H2O ==△===Fe(OH)3(胶体)+3HCl。 (2)胶体分散(fēnsàn)质微粒的直径介于10-9~10-7m之间,对 光有散射作用,能发生丁达尔效应,这是胶体区别于溶液和浊液的 特性。
2.胶体的性质及应用。 (1)丁达尔现象。 可见光束(guāngshù)通过胶体时,在入射光侧面可看到 ___一_条__光__亮__(_ɡ_u_ā_n_ɡ__li_à_n_ɡ_)_的__通。路
第六页,共41页。
应用:鉴别___溶__液___和____胶__体__。 (2)聚沉。 ①概念:使胶体(jiāo tǐ)凝聚形较成大__颗__粒__而__形__成__沉__淀________析 出的现象。
(2)胶体是电中性的,所谓“胶体带电”是指胶粒带电, 而分散剂与胶粒带相反(nn)电荷,整个胶体不显电性。
第二十四页,共41页。
2.能产生(chǎnshēng)丁达尔效应的是( )
A.酒精
B.CuSO4溶液
C.Fe(OH)3胶体
D.生理盐水
解析:能产生丁达尔效应的物质是胶体,而溶液(róngyè)不 能产生丁达尔效应,故A、B、D三项均错误。
第十三页,共41页。
第十四页,共41页。
混合物
第十五页,共41页。
2.常见无机物之间的转化(zhuǎnhuà)关系。
第十六页,共41页。
【例1】 某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源; ③冰和干冰既是纯净(chúnjìng)物又是化合物;④不锈钢和目前流通 的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石 灰都是碱;⑦豆浆和“雾”都是胶体。上述说法正确的是( )
第二十五页,共41页。
实验(shíyàn)·操作—提高素 养
实验课题(kètí):Fe(OH)3胶体的制备
1.实验目的。 探究水解反应法制备Fe(OH)3胶体,并验证胶体的重要性质。 2.实验原理。 (1)FeCl3+3H2O ==△===Fe(OH)3(胶体)+3HCl。 (2)胶体分散(fēnsàn)质微粒的直径介于10-9~10-7m之间,对 光有散射作用,能发生丁达尔效应,这是胶体区别于溶液和浊液的 特性。
2.胶体的性质及应用。 (1)丁达尔现象。 可见光束(guāngshù)通过胶体时,在入射光侧面可看到 ___一_条__光__亮__(_ɡ_u_ā_n_ɡ__li_à_n_ɡ_)_的__通。路
第六页,共41页。
应用:鉴别___溶__液___和____胶__体__。 (2)聚沉。 ①概念:使胶体(jiāo tǐ)凝聚形较成大__颗__粒__而__形__成__沉__淀________析 出的现象。
(2)胶体是电中性的,所谓“胶体带电”是指胶粒带电, 而分散剂与胶粒带相反(nn)电荷,整个胶体不显电性。
第二十四页,共41页。
2.能产生(chǎnshēng)丁达尔效应的是( )
A.酒精
B.CuSO4溶液
C.Fe(OH)3胶体
D.生理盐水
解析:能产生丁达尔效应的物质是胶体,而溶液(róngyè)不 能产生丁达尔效应,故A、B、D三项均错误。
第十三页,共41页。
第十四页,共41页。
混合物
第十五页,共41页。
2.常见无机物之间的转化(zhuǎnhuà)关系。
第十六页,共41页。
【例1】 某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源; ③冰和干冰既是纯净(chúnjìng)物又是化合物;④不锈钢和目前流通 的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石 灰都是碱;⑦豆浆和“雾”都是胶体。上述说法正确的是( )
(优)高考化学一轮复习-基础课-物质的组成、性质及分类(新人教新)精品PPT课件

(6)同一种元素可能有多种不同原子,同一种原子也可能形成不
同的离子( √ )
2. 化学与社会、生活联系密切。下列有关说法不正确的是( B ) A.天然气、沼气、液化石油气都是清洁能源,它们的主要成分 都是烃类 B.加碘食盐中添加的含碘物质是KI C.碘酒、84消毒液、75%的酒精都可用于消毒 D.生活中常用的淀粉、蔗糖、葡萄糖的组成元素相同 解析 天然气、沼气的主要成分是甲烷,液化石油气的主要成分 是丙烷、丁烷等都属于烃类,A项正确;加碘食盐中添加的含碘 物质是KIO3,B项错误;84消毒液的有效成分是次氯酸钠,碘酒、 84消毒液、75%的酒精都可用于消毒,C项正确;淀粉、蔗糖、 葡萄糖都属于糖类,均由碳、氢、氧元素组成,D项正确。
(3)纯净物只由一种原子组成,而混合物由多种原子组成( × ) (溯源题)(2014·四川理综,2)判断下列关于物质分类的说法的正误。
⑰KAl(SO4)2·12H2O ⑱分子式为C5H10的烃 ⑲分子式为C7H8的芳香烃 ⑳石油的各种馏分 水煤气 熔化、汽化、液化、酸化
(4)只由一种元素的阳离子与另一种元素的阴离子组成的物质一 ④酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物,如乙酸酐[(CH3CO)2O]。
(4)元素在物质中的存在形态 ①游离态:元素以_单__质__形式存在的状态。 ②化合态:元素以_化__合__物___形式存在的状态。 (5)元素、微粒及物质间关系图
提醒:由同种元素组成的物质不一定是纯净物,如O2和O3。
2.同素异形体 (1)_同__种__元__素__形__成__的__不__同__单__质___叫同素异形体。同素异形体的形 成有两种方式:①原子个数不同,如O2和O3;②原子排列方式 不同,如金刚石和石墨。 (2)同素异形体之间的性质差异主要体现在_物__理__性质上,同素 异形体之间的转化属于_化__学__变化。
同的离子( √ )
2. 化学与社会、生活联系密切。下列有关说法不正确的是( B ) A.天然气、沼气、液化石油气都是清洁能源,它们的主要成分 都是烃类 B.加碘食盐中添加的含碘物质是KI C.碘酒、84消毒液、75%的酒精都可用于消毒 D.生活中常用的淀粉、蔗糖、葡萄糖的组成元素相同 解析 天然气、沼气的主要成分是甲烷,液化石油气的主要成分 是丙烷、丁烷等都属于烃类,A项正确;加碘食盐中添加的含碘 物质是KIO3,B项错误;84消毒液的有效成分是次氯酸钠,碘酒、 84消毒液、75%的酒精都可用于消毒,C项正确;淀粉、蔗糖、 葡萄糖都属于糖类,均由碳、氢、氧元素组成,D项正确。
(3)纯净物只由一种原子组成,而混合物由多种原子组成( × ) (溯源题)(2014·四川理综,2)判断下列关于物质分类的说法的正误。
⑰KAl(SO4)2·12H2O ⑱分子式为C5H10的烃 ⑲分子式为C7H8的芳香烃 ⑳石油的各种馏分 水煤气 熔化、汽化、液化、酸化
(4)只由一种元素的阳离子与另一种元素的阴离子组成的物质一 ④酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物,如乙酸酐[(CH3CO)2O]。
(4)元素在物质中的存在形态 ①游离态:元素以_单__质__形式存在的状态。 ②化合态:元素以_化__合__物___形式存在的状态。 (5)元素、微粒及物质间关系图
提醒:由同种元素组成的物质不一定是纯净物,如O2和O3。
2.同素异形体 (1)_同__种__元__素__形__成__的__不__同__单__质___叫同素异形体。同素异形体的形 成有两种方式:①原子个数不同,如O2和O3;②原子排列方式 不同,如金刚石和石墨。 (2)同素异形体之间的性质差异主要体现在_物__理__性质上,同素 异形体之间的转化属于_化__学__变化。
高三化学一轮复习:物质的组成、性质和分类PPT课件(上课用)

Al2O3
HCl、HNO3 H2SO4、H2S
H3PO4
HCl、H2S HClO4、H2SO4
HCl、H2SO4、HNO3 CH3COOH、HF
HNO3、HCl
H2SO4、H3PO4
返回目录
第5讲 物质的组成、性质和分类
知识归纳
NaOH、KOH、Ba(OH)2 Mg(OH)2、Cu(OH)2 NaOH、Ba(OH)2、KOH NH3·H2O BaSO4、KNO3、NaCl NaHCO3、KHSO4 Cu2(OH)2CO3 KAl(SO4)2·12H2O
返回目录
第5讲 物质的组成、性质和分类
知识归纳Biblioteka 钠盐 碳酸盐酸式盐 含氧酸盐
返回目录
第5讲 物质的组成、性质和分类
知识归纳
②树状分类法
酸
碱盐
氧化物
返回目录
第5讲 物质的组成、性质和分类
知识归纳
3.常见无机化合物的分类
HCl、H2S、H2O、NH3
CO、NO
Na2O、CaO
CO2、P2O5
Na2O2、H2O2
【判断思考】 1.判断下列描述的正误(正确的打“√”,错误的打 “×”) (1)硫酸、烧碱、醋酸钠和生石灰分别属于酸、碱、盐 和氧化物( ) (2)按照物质的树状分类和交叉分类,HNO3属于酸、 氢化物、氧化物、一元酸、强氧化性酸( ) (3)冰水混合物属于化合物,高分子化合物属于混合物 ()
返回目录
返回目录
第5讲 物质的组成、性质和分类
[易错警示] (1)同种元素组成的物质不一定是纯净物, 如O2和O2组成的混合物。
(2)酸性氧化物不一定是非金属氧化物,如Mn2O7是酸 性氧化物;非金属氧化物也不一定是酸性氧化物,如CO、 NO是不成盐氧化物;碱性氧化物一定是金属氧化物,但 金属氧化物不一定是碱性氧化物,如Al2O3是两性氧化物、 Mn2O7是酸性氧化物。
高考化学一轮复习 第二章 第1讲 物质的组成、性质和分类

(3)元素与物质的关系
元素-组---成→单 化质 合: 物只:由由一多种种元元素素组组成成的的 纯纯 净净 物物
(4)元素在物质中的存在形态 ①游离态:元素以单质 形式存在的状态。 ②化合态:元素以化合物 形式存在的状态。
(5)元素、微粒及物质间的关系图
2.同素异形体 (1) 同种元素形成的不同单质 叫同素异形体。同素异形 体的形成有两种方式:①原子个数不同,如O2和O3; ②原子排列方式不同,如金刚石和石墨。 (2)同素异形体之间的性质差异主要体现在 物理 性质上, 同素异形体之间的转化属于化学 变化。
3.按要求回答问题。
①冰水混合物 ②爆鸣气 ③铝热剂 ④普通玻璃
⑤水玻璃 ⑥有机玻璃 ⑦漂白粉 ⑧TNT ⑨H2SO4 ⑩含氧40%的氧化镁 ⑪花生油 ⑫福尔马林 ⑬密封保存
的NO2气体 ⑭CaSO4·5H2O ⑮液氯 ⑯王水 ⑰KAl(SO4)2·12H2O ⑱ 分 子 式 为 C5H10 的 烃 ⑲ 分 子 式 为 C7H8的芳香烃 以上物质中一定为纯净物的是_①__⑧__⑨__⑩__⑭__⑮__⑰ ___⑲__,一定为混 合物的是_②__③__④__⑤__⑥__⑦__⑪__⑫ ___⑬__⑯ ____,可能是纯净物,也可能 是混合物的分子;而Si和SiO2都是由 原子直接构成。 答案 A
2.正误判断,正确的划“√”,错误的划“×” (1)只含一种元素的物质一定是纯净物( × ) (2)含水的物质不一定是混合物( √ ) (3)只由一种分子组成的物质一定为纯净物,组成混合物的物 质可能只有一种元素( √ ) (4)纯净物只由一种原子组成,而混合物由多种原子组成( ×) (5)只由一种元素的阳离子与另一种元素的阴离子组成的物质 一定为纯净物( √ ) (6)同位素单质混合在一起一般是纯净物(√ )
高考化学一轮复习 第2章 化学物质及其变化 第1讲 物质的组成、性质和分类课件(共61张PPT)

蛋白质是高分子化合物,D项错误。
答案:A
纯净物和混合物的区别
纯净物 有固定的组成和结构
有一定的熔、沸点 保持一种物质的性质
混合物 无固定的组成和结构
无一定的熔、沸点 保持原有物质各自的性质
常见混合物:①分散系(如溶液、胶体、浊液等);② 高分子(如蛋白质、纤维素、聚合物、淀粉等);③常见
特殊名称的混合物:石油、石油的各种馏分、煤、漂白 粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热 剂、氨水、氯水、王水等。
1.元素、物质及微粒间的关系
(1)宏观上物质是由元素组成的,微观上物质是由分子、原
子或离子构成的。 (2)元素:具有相同核电荷数的一类原子的总称。
(3)元素与物质的关系。 元素―组―成→单化质合:物:只由由一多种种元元素素组组成成的的纯纯净净物物。。 (4)元素在物质中的存在形态。 ①游离态:元素以单质形式存在的状态。
三馏
蒸馏、分馏
干馏
四色
焰色反应
显色反应、颜色反应、指示剂变色 反应
五解
潮解
分解、电解、水解、裂解
十八化
氢化、氧化、水化、风化、炭化、 熔化、汽化、液化、
钝化、催化、皂化、歧化、卤化、 酸化
硝化、酯化、裂化、油脂的硬化
其它
升华、萃取、分液、 脱水、蛋白质变性、同素异形体互
吸附、盐析、金属导 变、熔融盐导电、电解质溶液导电
A.①③⑤⑥⑦
B.②④
B(3.)N氢H3氧催化化铝受氧具化有潮不弱能碱属直性接,于生可成用物N于O制2理。胃酸变中和化剂,铁粉与食品包装袋中的氧气反应,起还
⑥能与酸反应生成盐和水的氧化物一定是碱性氧化物
①葡用萄“糖==是=小”而分原不子用剂化“”合作物,。用蛋,白质避是高免分子O化2合氧物,化D项食错误品。,导致食品变质,属于化学变
答案:A
纯净物和混合物的区别
纯净物 有固定的组成和结构
有一定的熔、沸点 保持一种物质的性质
混合物 无固定的组成和结构
无一定的熔、沸点 保持原有物质各自的性质
常见混合物:①分散系(如溶液、胶体、浊液等);② 高分子(如蛋白质、纤维素、聚合物、淀粉等);③常见
特殊名称的混合物:石油、石油的各种馏分、煤、漂白 粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热 剂、氨水、氯水、王水等。
1.元素、物质及微粒间的关系
(1)宏观上物质是由元素组成的,微观上物质是由分子、原
子或离子构成的。 (2)元素:具有相同核电荷数的一类原子的总称。
(3)元素与物质的关系。 元素―组―成→单化质合:物:只由由一多种种元元素素组组成成的的纯纯净净物物。。 (4)元素在物质中的存在形态。 ①游离态:元素以单质形式存在的状态。
三馏
蒸馏、分馏
干馏
四色
焰色反应
显色反应、颜色反应、指示剂变色 反应
五解
潮解
分解、电解、水解、裂解
十八化
氢化、氧化、水化、风化、炭化、 熔化、汽化、液化、
钝化、催化、皂化、歧化、卤化、 酸化
硝化、酯化、裂化、油脂的硬化
其它
升华、萃取、分液、 脱水、蛋白质变性、同素异形体互
吸附、盐析、金属导 变、熔融盐导电、电解质溶液导电
A.①③⑤⑥⑦
B.②④
B(3.)N氢H3氧催化化铝受氧具化有潮不弱能碱属直性接,于生可成用物N于O制2理。胃酸变中和化剂,铁粉与食品包装袋中的氧气反应,起还
⑥能与酸反应生成盐和水的氧化物一定是碱性氧化物
①葡用萄“糖==是=小”而分原不子用剂化“”合作物,。用蛋,白质避是高免分子O化2合氧物,化D项食错误品。,导致食品变质,属于化学变
衡中高考化学一轮复习PPT第3讲 物质的组成、性质和分类
第二章 化学物质及其变化
高考一轮总复习 • 化学
A.明确分类标准是对物质正确树状分类的关键
返回导航
第二章 化学物质及其变化
高考一轮总复习 • 化学
B.树状分类法在无机化合物分类中的应用
氢化物:HCl、H2S、H2O、NH3等 无 机 化合 物氧化物不 成 过成 盐 氧盐 氧 化氧 化 物化 物 :物N碱 酸 两a:2性 性 性OC2氧 氧 氧、O化 化 化、H2物 物 物NOO: : :2等等NCAalO22O2O、3、等PC2Oa5O等等
返回导航
第二章 化学物质及其变化
高考一轮总复习 • 化学
返回导航
无
一元酸:HCl、HNO3等
按电离出的H+数三二元元酸酸::HH32PSOO44、等H2S等
机 化
酸按酸根是否含氧无含氧氧酸酸::HHCCll、O4H、2SH等2SO4等
合
物
按酸性强弱强弱酸酸::HCHCl3、COHO2SHO、4、HHF、NOH32等SO3等
(4)深刻理解几组概念 概念
含义
返回导航
原子、 分子和
离子
原子是___化__学__变__化___中的最小微粒。 分子是保持物质___化__学__性__质___的一种微粒,一般分子由原子 通过共价键构成,但稀有气体是单原子分子。 离子是带电荷的原子或原子团。
元素
具有相同___核__电__荷__数___(即质子数)的同一类原子的总称,在 自然界中存在___游__离__态___和___化__合__态___两种形式。
4.物质转化及其规律 (1)化学反应的分类
化合反应
化 按反应物、生成物种类分解反应
学 及数目的多少分为
置换反应
反
高考化学一轮复习 第二章 第3讲 物质的组成、性质和分类课件
实例
食盐水、蔗 糖溶液
胶体 _1_~__1_0_0__n_m___
浊液
悬浊液
乳浊液
_>_1_0_0__n_m_
_>_1_0_0_n_m__
少量分子的集 合体或大分子
多数均一、不 透明,较稳 定,介稳性
大量分子聚集成 的固体小颗粒
不均一、不透 明,久置沉淀
大量分子聚集成 的液体小液滴
不均一、不透 明,久置分层
___能_____
___不__能___
__不__能____
___不__能___
Fe(OH)3胶 体、淀粉胶体
泥水、石灰乳
__不__能____
植物油和水的混 合物
4.按照物质的树状分类和交叉分类,HNO3应属于( ) ①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥强氧化性酸 ⑦一元酸 ⑧化合物 A.①②③④⑤⑥⑦⑧ B.①④⑥⑦⑧ C.①⑧ D.①④⑤⑥⑦ 【答案】B
【答案】C
()
A.Na2CO3 B.Cu2(OH)2CO3 C.NaC
D.NaHCO3 【答案】A
符合下图中阴影部分的物质是
二、常见无机物之间的相互转化关系
奥运会会标是五环旗,假定奥运五
环旗中的每一环表示一种物质,相连环物质间
一定条件下能发生常见反应,不相连环物质间不能发生反应。
且四种反应中必须包含化合反应、置换反应及复分解反应,适
【解析】从图中关系可以看出,Z包含Y,Y包含X。纯净 物可以分为单质和化合物,化合物又可以分为酸、碱、盐、氧 化物等,A项符合上述包含关系;分散系是一种混合物,它可 以分为溶液、胶体和浊液,B项符合上述包含关系;氧化物包 括酸性氧化物和碱性氧化物,碱性氧化物包括大多数金属氧化 物,但是有部分金属氧化物不属于碱性氧化物,如Al2O3属于 两性氧化物,Mn2O7属于酸性氧化物,C项不完全符合上述包 含关系;化合物可以分为电解质和非电解质,离子化合物一定 是电解质,D项符合上述包含关系。
高三化学一轮复习精品课件10:物质的组成、性质和分类
(2)溶于水生成酸的氧化物不一定是酸性氧化物,如NO2;溶于水生 成碱的氧化物不一定是碱性氧化物,如Na2O2。
(3)冰水混合物、结晶水合物、液氯、液氨都属于纯净物。
归纳总结1.正确理解“一定”“不一定”,规避概念失分点 (1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧 化物(如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化 物)。 (2)酸性氧化物不一定是非金属氧化物(如Mn2O7为酸性氧化物); 非金属氧化物也不一定是酸性氧化物(如CO、NO不是酸性氧化 物)。 (3)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸 (如SiO2)、碱(如Fe2O3)。 (4)胆矾、明矾等结晶水合物都是纯净物。 (5)确定某酸是几元酸,不能依据分子中氢原子的个数,如 CH3COOH不是四元酸,而是一元酸。
2.物质的分类
金属 非金属
碱盐 氧化物
共价 电解质 非电解质
-7-
3.单质、氧化物、酸、碱和盐的转化关系 (1)转化示意图。
(2)实例:Ca CaO Ca(OH)2 CaCO3
请写出①②③④⑦的化学方程式,并注明反应类型(方程式合理
即可):
①
2Ca+O2==2CaO
, 化合反应 ;
② CaO+H2O==Ca(OH)2
重金D.属雾离属子于能胶使体蛋,能白产质凝生固丁、达变尔性效,A应项正确;NO、NO2都不属于酸性氧
化物,B项错误;苯是最简单的芳香烃,C项正确;雾的分散质粒子直径在 关闭
1B~100 nm之间,属于胶体,D项正确。
解析 答案
易错警示(1)同一种物质,按不同的标准进行分类,可得到不同的
分类结果,如Na2CO3属于钠盐、碳酸盐、含氧酸盐、正盐等。因 此,对物质进行分类时,必须指明分类的依据。
(3)冰水混合物、结晶水合物、液氯、液氨都属于纯净物。
归纳总结1.正确理解“一定”“不一定”,规避概念失分点 (1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧 化物(如Mn2O7为酸性氧化物,Al2O3为两性氧化物,Na2O2为过氧化 物)。 (2)酸性氧化物不一定是非金属氧化物(如Mn2O7为酸性氧化物); 非金属氧化物也不一定是酸性氧化物(如CO、NO不是酸性氧化 物)。 (3)酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸 (如SiO2)、碱(如Fe2O3)。 (4)胆矾、明矾等结晶水合物都是纯净物。 (5)确定某酸是几元酸,不能依据分子中氢原子的个数,如 CH3COOH不是四元酸,而是一元酸。
2.物质的分类
金属 非金属
碱盐 氧化物
共价 电解质 非电解质
-7-
3.单质、氧化物、酸、碱和盐的转化关系 (1)转化示意图。
(2)实例:Ca CaO Ca(OH)2 CaCO3
请写出①②③④⑦的化学方程式,并注明反应类型(方程式合理
即可):
①
2Ca+O2==2CaO
, 化合反应 ;
② CaO+H2O==Ca(OH)2
重金D.属雾离属子于能胶使体蛋,能白产质凝生固丁、达变尔性效,A应项正确;NO、NO2都不属于酸性氧
化物,B项错误;苯是最简单的芳香烃,C项正确;雾的分散质粒子直径在 关闭
1B~100 nm之间,属于胶体,D项正确。
解析 答案
易错警示(1)同一种物质,按不同的标准进行分类,可得到不同的
分类结果,如Na2CO3属于钠盐、碳酸盐、含氧酸盐、正盐等。因 此,对物质进行分类时,必须指明分类的依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
按电离 H+ 数 酸 按电离 程 度
二元酸 多元酸
强酸 弱酸
HCl、HNO3、H2SO4
HF、CH3COOH、H2CO3、H2SiO3 HNO3、H2SO4(浓)、HClO
按酸根 氧化性
按沸点
氧化性酸
非氧化性酸 HCl、H2SO4(稀)、H3PO4 高沸点酸 H2SO4、H3PO4 低沸点酸 HCl、HNO3
2017届高三化学一轮复习课件
——物质的组成、性质与分类
2016年8月14日星期日
1.我国清代《本草纲目拾遗》中记叙无机药物335种, 其中“强水”条目下写到:“性最烈,能蚀五金……其 水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的 “强水”是指
A.氨水
B.硝酸
C.醋
D.卤水
B
2.下列关于物质分类的说法正确的是
考点一
一、物质的组成
物质的组成和分类
1.元素、物质及微粒间的关系
1、定义:
(一)元素
(1)元素 (质子数相同的一类原子) (2)核素 (具有一定质子数和中子数的一种原子) (3)同位素 (具有相同质子数和不同中子数的同种元素不同 原子之间的互称) 自然界大多数元素都有同位素(C、H、O、Cl) 天然存在的元素里,各种同位素所占原子个数比(丰度) 为一定值。 即:元素的相对原子质量等于它的各种同位素的相对原子 质量,乘以其所占的原子百分率之和。 M=M1· a1%+M2· a2%+......+Mn· an% 辨析:四“同”的比较(同位素、同素异形体、同系物、 同分异构体)
上 如铁、铜、镍、锡、铅)
金属
单 质
非金属
含量分类
常见金属 Fe、Al、Cu
稀有金属 Zr 、Nb 、Mo 由分子构成:H2、Cl2、P4、O3 由原子直接构成:金刚石、晶体硅 均为单原子分子
稀有气体单质
化合物
氢 化 物 气态氢化物
一般为气态,共价化合物,H为+1价,非 金属显最低价;如HCl、H2S、NH3等
NaCl、Na2CO3、CuSO4 NaHSO4、NaHCO3、Na2HPO4、NaHSO3
酸式盐 酸式盐:酸被碱部分中和的产物; 盐
碱式盐 Cu2(OH)2CO3、Mg(OH)Cl +)和 复盐:由两种不同的金属阳离子(包括 NH 4 复盐 一种酸根离子组成 KAl(SO4)2 络盐: Ag(NH3)2OH
3、元素存在的状态:
①游离态:只存在单质中, 由同种元素组成的纯净物称为单质。
在室温下:以气态存在的单质共11种, N2、O2、H2、F2、 Cl2、He、Ne、Ar、Kr、Xe、Rn 以液态存在的二种, Br2、Hg(金属) ②化合态:只存在化合物中,由不同种元素组成的纯净物称为化合物
例.H、D、T、H+可以用来表示 (D)
A.四种不同元素
B.化学性质不同的氢原子
D.氢元素的四种不同微粒
C.氢元素的四种同位素
H(氕)、D(氘)、T(氚)是氢元素的三种同位素。
(二)分子、离子、原子比较
(一)如何区分元素和微粒(分子、原子、离子) 1.概念的范畴不同 元素——宏观概念, 只论种类不论个数 微粒——微观概念, 既论种类又论个数 2.决定种类的因素不同 元素——由核电荷数(即质子数)决定 (如16 8O、17 8O、18 8O 为同一种元素) 原子——由质子数和中子数两者共同决定 [如1 1H、 2 1H(D) 、 3 H(T) 为同一种元素的不同原子] 1 分子——由原子的种类、个数及结合方式共同决定(如O2、 O3,H2O、H2O2,CH3COOH、HCOOCH3均为 不同分子) 离子——由它的组成、结构及电荷数共同决定(如MnO4-, MnO42-为不同离子)
能与碱反应生成盐和水的氧化 物,如:CO2、SO2、Mn2O7; 能与酸反应生成盐和水的氧化 物,如:k2O、MgO、CaO 既能与酸又能与碱反应,生成 盐和水的氧化物,如:Al2O3;
酸
按含氧 与 否 无氧酸 HCl、HBr、HF
含氧酸
一元酸
H2SO4、HNO3、HClO4
HCl、HNO3、CH3COOH H2SO4、H2SO3 H3PO4
(1)分子的定义: 是构成物质的一种微粒,它能保持原物质的化学性质。
③酸酐(除SiO2) :SO2、SO3、CO2、P2O5、N2O5、Cl2O7 等 ④酸类:HClO、H2SO3、H2SO4、HClO4、H3PO4、H2SiO3、H2CO3等 ⑤有机物:烃类、烃的衍生物、糖类、氨基酸 等 ⑥其他:N2O、N2O4、CO、H2O2、NO、AlCl3等
2 2 4
⑮CuSO 4·5H 2O ⑱液氯
⑯KAl(SO 4)2·12H 2O C .①⑧⑨⑪⑮⑯⑱
考点一
⑰聚氯乙烯
A.②③④⑥ B.⑦⑩⑫⑬⑭⑮⑯ 结晶水合物、复盐均为纯净物。 D.①④⑧⑨⑪⑫⑰⑱
题组训练
返回
知识梳理
一、分散系
一种物质(或几种物质)分散到另一种物质里
所形成的混合物。
分散质:被分散的物质 (分散成微粒的物质) 溶液、悬(乳)浊液、胶体 (微粒分布在其中的物质) 分散剂:能分散分散质的物质
注意离子晶体、原子晶体的化学式仅表示微粒个数 的最简比,并不能表示其真实组成。而分子晶体的 化学式就是其分子式,表示其真实的组成。 例题1:下列各组化学式中,能真正表示物质分子组成 的是( B ) A. SiO2、NaCl、H2O2、Mg B. P4、CS2、H2SO4、C6H6 C. SiC、CaCl2、Fe、CH3COONH4 D. C、Al2O3、Ar、I2
1、胶体 分散质微粒的直径大小在1nm ~100nm (10-9~10-7m )之间的分散系叫做胶体。
胶体的分类:
胶粒由许多小分子聚积而成
Fe(OH)3 AgI胶体
化合物的其他分类
共价化合物 按结构 离子化合物 化 合 物 一定含有离子键; 熔融状态下可以导电。
电解质 酸、碱、大多数盐和金属氧化物 按电离 与 否
水溶液中或熔融状态下,自身发生电离而导电的化合物。
非电解质
无机化合物
按含碳 与 否
有机化合物
例题: 下列叙述正确的是( A ) A. 碱性氧化物一定是金属氧化物 B. 酸性氧化物一定是非金属氧化物 C. 酸分子中有几个H原子即为几元酸 D. 盐电离时,只生成一种阳离子,一种阴离子.
酸的几个不一定:
1.强酸可以制取弱酸,但弱酸也能制取强酸。CuSO4+H2S=CuS↓+H2SO4; H3PO4(浓)+NaNO3=NaH2PO4+HNO3↑ 2.同种元素在含氧酸中价态越高,氧化性不一定越强。
如氧化性:HClO>HClO4 3.名称叫酸的物质不一定是酸,如石炭酸C6H5OH,是酚不是酸。 4.酸的元数不一定等于酸分子中的H原子数。如亚磷酸(H3PO3) 是二元酸,次磷酸(H3PO2)是一元酸,因为它们的结构分别 是 5.无氧酸不一定是非金属的氢化物,如氢氰酸(HCN)。
②原子团与分子、离子的区别和联系: 例:
NH3 微粒 (分子) NH4+ NH2- -NH2 (原子团) (阳离子) (阴离子)
H N H H [H N H] H H N H]—
电子 式
H H N H
+
[
2.分子和由分子构成的物质
(2)分子的性质: ①分子在不停地运动, ②分子有一定的质量和体积 ③分子之间有一定的间隔和作用力(范德华作用力) ④同种物质的分子性质相同 (3)由分子构成的物质: (分子晶体) ①非金属单质:H2、X2、O2、O3、P4、S 等。 ②非金属气态氢化物:HX、H2S、H2O、 NH3、PH3 等。
5.下列化学用语或名称的表述不正确的是 A.葡萄糖的分子式: B.HCl的电子式: C.2-甲基丙烷的结构简式: D.含有10个中子的氧原子可表示为:
考纲要求
1.了解分子、原子、离子等概念的含义。了解原子 团的定义。 2.理解物理变化与化学变化的区别与联系。 3.理解混合物和纯净物、单质和化合物、金属和非 金属的概念。 4.理解酸、碱、盐、氧化物的概念及其相互联系。 5.了解胶体是一种常见的分散系。
3.离子和由离子构成的物质:
(1)离子是带电荷的原子或原子团,离子也是构成物质的一种微粒。 (2)阳离子:Na+、NH4+、 [Ag(NH3)2]+, 阴离子:Cl-、SO42-
(3)由离子构成的物质: (离子晶体)
NaCl CsCl NaOH
(4)主要离子化合物:强碱、活泼金属氧化物、大多数盐和类盐 (活泼金属氢化物NaH,活泼金属氮化物Mg3N2)如NaOH、Na2O 、 Na2O2 、NaCl
2、元素含量:
地壳中前五位元素的质量分数,O﹥Si ﹥ Al ﹥ Fe ﹥ Ca
四“同”的比较
同位素
相同点
同素异形体
同系物
同分异构体
质子数
中子数 原子
不同 近相同
H、D、T
元素
组成和结构 单质
不同 相似
结构相似
分子组成 有机物
不同 相似
分子式
分子结构 有机物
不同 相似 / 不同
不同点 对象 物理性质 化学性质
(二)原子、分子、离子: 1.原子和由原子构成的物质:
(1)原子的定义:原子是物质在化学变化中的最小微粒 (2)由原子构成的物质:
①由原子直接构成的物质(属原子晶体) : 金刚石、晶体硅、SiO2、SiC、石墨(混合型晶体)
②稀有气体(分子晶体) 金属单质(应由金属离子和自由电子构成) (属金属晶体) (3)原子团 ①概念:由两个或多个原子结合而成的原子集团,在许多化学 反应里作为一个整体参加反应。
题组训练
下列物质中属于纯净物的一组是 组成是水分子; ①冰水混合物
