白蔹饮片工艺验证方案
白蔹
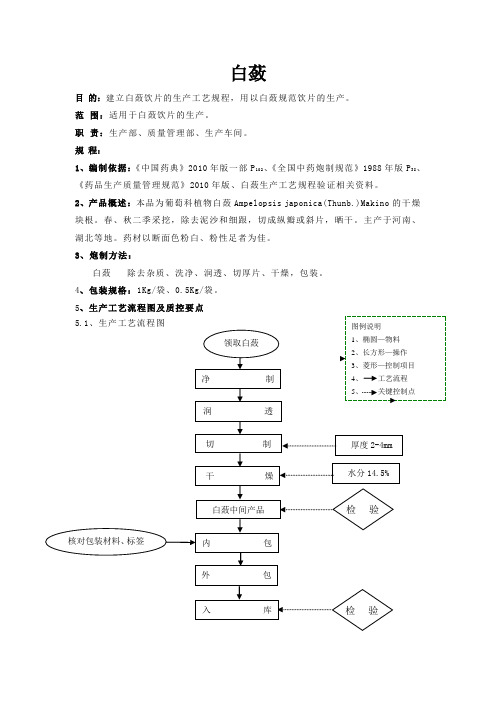
白蔹目 的:建立白蔹饮片的生产工艺规程,用以白蔹规范饮片的生产。
范 围:适用于白蔹饮片的生产。
职 责:生产部、质量管理部、生产车间。
规 程:1、编制依据:《中国药典》2010年版一部P 102、《全国中药炮制规范》1988年版P 38、《药品生产质量管理规范》2010年版、白蔹生产工艺规程验证相关资料。
2、产品概述:本品为葡萄科植物白蔹Ampelopsis japonica(Thunb.)Makino 的干燥块根。
春、秋二季采挖,除去泥沙和细跟,切成纵瓣或斜片,晒干。
主产于河南、湖北等地。
药材以断面色粉白、粉性足者为佳。
3、炮制方法:白蔹 除去杂质、洗净、润透、切厚片、干燥,包装。
4、包装规格:1Kg/袋、0.5Kg/袋。
5、生产工艺流程图及质控要点 5.1、生产工艺流程图厚度2-4mm 领取白蔹净制润 透 白蔹中间产品 检验核对包装材料、标签 图例说明 1、椭圆—物料 2、长方形—操作 3、菱形—控制项目 4、 工艺流程 5、 关键控制点 切 制内包 干 燥 外包入库 检验 水分14.5%5.2、关键工序质量控制点及控制项目6、炮制生产工艺操作步骤及主要技术参数6.1、领料根据《批生产指令单》填写《领料单》,按“领发料标准操作规程”到原药材库领取合格白蔹原料,领料人、发料人根据生产指令单的数量双人复核,及时填写出库记录和领料记录。
6.2、净制 工序 控制点 项目 标准 监控频次净制原药材品种、数量、质量 品种与生产指令单相符 1次/每批 净药材 净度无杂质、无走油、无霉变、无非药用部位、无药屑。
1次/每批洗净 洗药机清洗 清洁度使用流动的饮用水;快速洗至药材表面无泥沙,沥干余水。
1次/每批润透 润药机润透 软化程度温度:60℃、时间:60分钟、真空度:-60kpa--80kpa 。
1次/每批切制 机械切制 厚度 厚片:2-4mm ;厚薄均匀,表面光洁,无整体,异形片不得超过10%。
1次/每批干燥 干燥后药材 温度、水分干燥温度不得超过80℃;水分不得过14.5%。
中药饮片生产工艺验证方案--完整版

冬瓜皮生产工艺验证方案制定人:制定日期:年月日审核人:审核日期:年月日批准人:批准日期:年月日验证方案审批表立项题目冬瓜皮生产工艺验证立项部门生产管理部类别首次验证申请日期年月日计划完成日期年月日概述:冬瓜皮是我公司中药饮片生产线生产品种之一,在本工艺验证中将验证三批产品。
生产包括原药材净选、洗药、切药、干燥、筛选、包装等工序,包括工艺条件、操作程序和设备使用三大方面,文件执行依据为《冬瓜皮生产工艺规程》、岗位操作SOP、清洁SOP、批生产记录、批包装记录等。
按照《药品生产质量管理规范(2010年修订)》、《确认与验证管理规程》等文件的要求,对冬瓜皮生产工艺进行全面的验证,确保工艺流程可以稳定、持续的生产出合格的产品。
验证目的:证明公司现有厂房设施、设备、公共系统能够满足生产的需求;公司质量管理体系能够有效运行;按照冬瓜皮生产工艺规程能够持续、稳定地生产出符合质量标准的产品。
申请人:年月日生产管理部意见:年月日质量管理部意见:年月日验证委员会意见:年月日备注:确认与验证成员及职责姓名签名部门职务职责质量管理部主任验证方案和验证报告的审批生产管理部组长验证方案和验证报告的审核;验证方案的组织实施;按计划指导验证中的相关工作;总结验证结果生产车间成员验证方案和验证报告的起草制定;按计划完成验证过程中的相关工作,确保验证数据的正确可靠供应部成员提供物料,保证物料供应设备动力部成员水、电、能源保障,仪器仪表校验、设备运行保障质量保证科成员对验证过程进行质量跟踪,现场监控,对方案实施监督,监控数据真实性质量控制科成员按计划完成验证中的相关检验及复核工作,确保检验数据正确可靠备注:目录1概述2验证目的3文件依据4产品概述5生产工艺简述、包装规格、工艺流程图、质量控制参数6验证时间及验证产品信息7风险评估8验证范围9工艺验证9.1验证的前提条件9.2原料验证9.3净选工艺验证9.4洗药工艺验证9.5切药工艺验证9.6干燥工艺验证9.7筛选工艺验证9.8包装工艺验证10成品检验11批生产记录、批检验记录审核12偏差处理与变更13验证数据分析14验证过程分析15验证结论16再验证1.概述冬瓜皮是我公司中药饮片生产线生产品种之一,在本工艺验证中将验证三批产品。
白芍生产工艺验证方案

白芍生产工艺验证方案文件编号:验证方案审批表目的证明白芍生产工艺过程确实能够始终如一地生产出符合预定要求及质量标准的中药饮片。
范围白芍的生产工艺验证责任验证小组内容1概述1.1白芍是第一次在本公司车间投产,本验证方案的设计有助于证明白芍生产过程的稳定性及生产系统的可靠性,同时此验证方案为即将进行的生产工艺验证和将来进一步的验证工作奠定了基础。
1.2包装规格:塑料袋装,1 Kg/袋。
1 .3法定制法和依据:1.3.1洗净,除去头尾和细根,置沸水中煮后除去外皮或去皮后再煮,晒干。
1.3.2《中华人民共和国药典》2010年版、《安徽省中药饮片炮制规范》、《白芍生产工艺规程》1.3.3 工艺流程图:拣选→洗润→切药→干燥→筛分→包装→入库1.4 验证目的、期待结果及变更程序1.4.1 验证目的:证明生产工艺过程确实能够始终如一地生产出符合预定要求及质量标准的饮片。
1.4.2 期待结果:通过对白芍生产工艺的,确认该生产工艺是有效的;经过预先设计的工艺参数下做合适的测试,确认按照批准的生产工艺规程生产的最终产品,符合有效性和安全性的所有出厂要求。
1.4.3 变更程序:再验证过程严格按照本方案规定的内容进行,若因特殊原因确实需要变更时,填写验证方案变更申请批准书,报验证委员会批准。
1.5 验证依据及使用的文件1.5.1 验证依据1.5.1.1 《药品生产质量管理规范》1.5.1.2 《药品生产质量管理规范》附录及补充规定1.5.1.3 白芍生产工艺规程1.5.1.4 白芍成品质量标准1.6.2 采用文件2 验证项目、评价方法及标准2.1 人员确认2.1.1 培训2.1.1.1 评价方法:查阅人员培训档案,确认是否对有关操作人进行了相关培训,包括GMP、药品管理法、安全防护的培训,所在岗位、相关设备、清洁、清场标准操作规程的培训;QA进行生产过程质量控制的培训。
2.1.1.2 评价标准:考试合格,已取得上岗证。
中药饮片生产各工艺验证方案

目的:对中药加工过程中的净制工序进行验证,验证净制工序的可行性和稳定性,保证产品质量。
范围:适用于中药加工过程中的净制工序的验证。
责任:验证小组负责对此工艺的验证,生产人员协助操作。
内容:1. 材料及设备:中药材或中间产品、磅秤。
2. 方法:依据中药饮片生产工艺规程对其进行净制。
2.1. 取样:从净制样品中随机抽取5个点采样,每点采样约100g,置样品袋中,并编号。
2.2. 挑选耗率:将净制后饮片称重(含取样样品重),计算挑选耗率。
挑选耗率(%)=〔药材投料量-净制后饮片重量(含取样样品重量)〕/药材投料量×100%2.3. 杂质:以上试验所得样品,挑出未净选干净的杂质和非药用部位,计算杂质含量,计算公式:杂质含量(%)=杂质和非药用部位量/样品量×100%3. 合格标准:根、根茎类、藤木类、花叶类、皮类、动物类、矿物类、菌藻类,含药屑、杂质不得超过2%;果实、种子类、全草类、树脂类,含药屑、杂质不得超过3%。
挑选耗率不得超过15%。
4. 本试验重复3次,并填写验证记录。
5. 再验证:同一药材在使用一年应进行一次净制效果验证。
目的:对生产过程中洗药工艺进行验证,检查并确认洗药效果达到规定要求。
范围:适用于白术、党参、甘草、厚仆、杜仲、莪术、佛手、何首乌、巴戟天、山药等类似质地药材的水洗效果的验证。
责任:验证小组负责对此工艺的验证,生产人员协助操作。
内容:1. 材料与设备原药材或中间产品、磅秤、洗药池。
2. 方法:依据中药饮片生产工艺规程进行洗药。
2.1. 取样:从水洗后的样品中随机抽取5个点采样,置样品袋中,并编号。
2.2. 洗药:选用合适的洗药方式用流动的饮用水对物料进行清洗。
2.3.水洗操作记录:将所取样品中的泥沙与合格品物料分别干燥称重,计算泥沙的含量,计算公式如下:泥沙含量=泥沙/取样量×100%3.合格标准:3.1.洗制后的物料泥沙含量不得超过1.5%。
3.2. 洗后外观不得有损伤。
麸炒白术饮片生产工艺验证方案范文

麸炒白术饮片生产工艺验证方案范文北京某某某药业有限公司制定人制定日期验证小组会审姓名批准人第1页共16页编制依据:《药品生产质量管理规程》(2022年修订)1.目的1.1确认在该生产场地、生产设施、设备相同的条件下,操作人员依据麸炒白术的工艺规程,在规定的SOP范围内能稳定的生产出符合质量标准的产品,工艺的重现性良好。
1.2确认在生产麸炒白术的过程中,各工序工艺条件的合理性和可靠性。
1.3考察麸炒白术工艺参数的可控性,验证工序的物料平衡、收率是稳定的。
2.适用范围本方案仅适用于中药饮片生产车间的厂房、设施、设备、工艺条件下麸炒白术的生产,当上述条件改变时,应重新验证。
3.职责3.1验证小组:负责验证方案的起草、实施,验证周期的确认工作。
3.2验证小组相关人员:参与验证方案的讨论,确立、验证方案的会签工作。
3.3验证小组组长:负责批准验证方案。
3.4质量部职责3.4.1负责验证过程的监控。
3.4.2负责取样、分析、检测及试验后数据收集、记录。
3.5生产部职责3.5.1负责验证方案的起草及具体实施以及判定炮制中各项技术指标是否符合要求。
3.5.2参加验证方案的会审、会签。
3.5.3负责提供验证的全部技术参数。
3.5.4参加验证报告,验证结果的会审、会签。
3.5.5负责保证设备处于完好状态。
3.5.6负责组织试验所需仪器、设备的验证,负责仪器、仪表、量具等的校正,负责设备的维护保养。
4.验证依据及采用文件4.1工艺规程:麸炒白术饮片生产工艺规程(STP-SC/GY-012-00);工艺规程、岗位操作规程管理规程《中国药典》(2022年版)、《北京市中药饮片炮制规范》(2022年版)《药品生产质量管理规范(2022年修订)》《中药饮片附录》4.2本企业制定的内控质量标准及相关的文件、记录。
5.风险评估5.1风险评估方法:使用风险优先分级方式,定量确定风险的严重性,将已识别和分析的风险与风险成分216页第页共定量分级表比较,得出风险评估的结果。
中药饮片工艺验证0009-大黄方案

中药饮片工艺验证0009-大黄方案文件名称大黄工艺验证方案版本号 00-2015文件类别技术标准起草人日期文件编码 M-VL-0009 审核人日期执行日期批准人日期分发部门质量管理部、生产设备部一、概述:1.生产情况概述:中药饮片在进行了关键岗位员工培训及各种设备安装确认、运行确认、计量器具校验后,开始中药饮片的生产。
现对大黄的生产工艺关键工序进行验证,以确定大黄生产过程的稳定性,保证在规定的条件下始终如一地生产出质量可靠的大黄饮片。
2.产品概述:2.1 品名:大黄2.2.规格:2-4mm厚片。
2.3.性状:本品呈类圆柱形、圆锥形、卵圆形或不规则块状,长3,17cm,直径3,lOcm。
除尽外皮者表面黄棕色至红棕色,有的可见类白色网状纹理及星点(异型维管束)散在,残留的外皮棕褐色,多具绳孔及粗皱纹。
质坚实,有的中心稍松软,断面淡红棕色或黄棕色,显颗粒性;根茎髓部宽广,有星点环列或散在;根木部发达,具放射状纹理,形成层环明显,无星点。
气清香,味苦而微涩,嚼之粘牙,有沙粒感。
二、范围:适用于大黄生产工艺的验证。
三、人员与职责:验证小组负责对此工艺的验证,生产人员协助操作,具体见下表:姓名职务所在部门及职务验证过程中的职责批准验证方案及验证报告梁文峰组长总经理落实验证文件起草者,安排验证过程按进度有序进行,审核验证方案、记石殿祥成员生产设备部经理录是否完整及最终验证结果评价。
负责验证方案的审核及验证报告评价。
李文平成员质量部经理负责起草验证方案,负责验证数据的收集、校对、复核确认工作。
负责整梁宗海成员生产设备部理文件记录的归档工作及最终验证报告。
负责验证确认过程中现场检测相关工作。
马富巧成员质量部QA负责取样、检验,出具检验报告,确认验证结果。
陈玉芳成员质量部QC 负责设备运转正常,辅助完成工艺验证王建中成员生产设备部四、验证依据:大黄生产工艺规程(Y/M-TS-0016)五、大黄生产工艺流程:大黄拣选洗润切厚片干燥酒炙蒸制炒炭筛选包装 M-VL-0009 1 /18六、本次验证内容:本验证将对大黄的清洗、润、切、干燥、筛选、包装等关键工序进行验证。
中药饮片切制与净制生产工艺

根及根茎类产品生产工艺果实和种子类生产工艺全草类生产工艺叶类生产工艺藤木类生产工艺皮类生产工艺动物类生产工艺菌藻类生产工艺矿物类生产工艺白茅根生产工艺巴戟天生产工艺白及生产工艺白蔹生产工艺白前生产工艺白芍生产工艺白术生产工艺白头翁生产工艺白薇生产工艺白芷生产工艺板蓝根生产工艺北沙参生产工艺粉萆薢生产工艺苍术生产工艺柴胡生产工艺赤芍生产工艺川牛膝生产工艺川芎生产工艺大黄生产工艺党参生产工艺地榆生产工艺独活生产工艺莪术生产工艺防风生产工艺粉葛生产工艺甘草生产工艺甘松生产工艺高良姜生产工艺藁本生产工艺葛根生产工艺生狗脊片生产工艺骨碎补生产工艺胡黄连生产工艺黄连生产工艺黄芪生产工艺黄芩生产工艺黄药子生产工艺姜黄生产工艺桔梗生产工艺苦参生产工艺龙胆生产工艺漏芦生产工艺芦根生产工艺麻黄根生产工艺绵马贯众生产工艺明党参生产工艺木香生产工艺墓头回生产工艺南沙参生产工艺牛膝生产工艺千斤拔生产工艺千年健生产工艺前胡生产工艺茜草生产工艺羌活生产工艺秦艽生产工艺拳参生产工艺三棱生产工艺山豆根生产工艺山药生产工艺商陆生产工艺射干生产工艺升麻生产工艺生地生产工艺石菖蒲生产工艺天花粉生产工艺天麻生产工艺威灵仙生产工艺天冬生产工艺西洋参生产工艺细辛生产工艺仙茅生产工艺徐长卿生产工艺续断生产工艺玄参生产工艺丹参生产工艺银柴胡生产工艺郁金生产工艺泽泻生产工艺知母生产工艺重楼生产工艺紫草生产工艺紫菀生产工艺槟榔生产工艺陈皮生产工艺大腹毛生产工艺佛手生产工艺瓜蒌皮生产工艺葫芦壳生产工艺橘红生产工艺莲房生产工艺莲子心生产工艺木瓜生产工艺青皮生产工艺石榴皮生产工艺丝瓜络生产工艺香橼生产工艺枳壳生产工艺枳实生产工艺猪牙皂生产工艺白花蛇舌草生产工艺败酱草生产工艺。
白术饮片工艺验证方案

白术饮片工艺验证方案1. 引言本文档旨在提供白术饮片工艺验证方案,包括验证目的、验证方法、可行性评估和验证计划等内容。
通过工艺验证,可以确保生产过程中白术饮片的质量合格,满足药品监管及相关标准的要求。
2. 验证目的白术饮片工艺验证的主要目的是验证当前生产工艺是否能够稳定、可靠地得到合格的白术饮片产品。
具体的验证目标如下:•验证白术饮片的质量特性是否满足产品规格要求;•验证生产工艺的可操作性以及合理性;•确定生产过程中的关键控制点以及适当的控制策略;•评估生产工艺的稳定性和一致性。
3. 验证方法工艺验证的方法包括实验验证和数据分析。
实验验证用于测试生产工艺,在一定范围内改变原料、设备和工艺参数,获取重要工艺参数与产品特性之间的关系。
数据分析则通过采集和分析生产中的数据,评估工艺的稳定性和一致性。
3.1 实验验证实验验证的主要步骤如下:1.设计验证试验方案:根据产品规格和工艺要求,设计验证试验方案,包括验证的变量、测试方法、样品数量等。
2.准备试验样品:选择代表性的原料和辅料,按照工艺要求制备试验样品。
3.设计实验:在一定范围内改变工艺参数,如提高温度、调整浸提时间等,通过正交试验或单因素试验设计验证试验。
4.进行实验:按照验证试验方案执行实验,记录实验数据。
5.数据分析:对实验数据进行统计分析,建立关键工艺参数与产品特性之间的数学模型。
6.结果评估:根据实验数据和统计分析结果评估当前工艺的稳定性、可靠性和一致性。
3.2 数据分析数据分析主要通过采集生产过程中的数据,进行统计分析和评估。
数据分析的步骤如下:1.数据采集:制定数据采集计划,采集生产过程中的关键参数数据,如温度、湿度、时间等。
2.数据整理:对采集到的数据进行整理和归类,建立数据库或电子化记录表格。
3.数据分析:利用统计学方法对采集到的数据进行分析,计算平均值、标准差、方差等参数指标,评估工艺的稳定性和一致性。
4.结果评估:根据数据分析结果评估当前工艺的可行性和稳定性,提出改进建议。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
白蔹饮片工艺
验
证
方
案
河北国金药业有限责任公司
验证方案审批表
验证方案目录
一、引言
二、时间安排
三、工艺条件确认
四、验证项目、评价方法及标准
五、异常情况处理程序
六、变更与偏差
七、再验证周期
八、验证合格证的签发
九、附录
一、引言
1.验证概述
1.1背景概述
本次验证为公司中药饮片车间通过GMP认证基础上,依据《药品生产质量管理规范》2010年版、中药饮片附录、《中国药典》2015年版一部,对中药配方颗粒使用的白蔹饮片生产工艺进行的首次验证,以确定白蔹饮片生产的工艺。
本公司已完成了白蔹饮片生产用设备的确认工作,设备的确认报告符合设计要求以及生产工艺要求。
1.2产品概述
1.2.1来源:本品为葡萄科植物白蔹的干燥块根。
1.2.2产地:河南
1.2.3产品性状:
本品纵瓣呈长圆形或近纺锤形,长4~10cm,直径1~2cm。
切面周边常向内卷曲,中部有1突起的棱线。
外皮红棕色或红褐色,有纵皱纹、细横纹及横长皮孔,易层层脱落,脱落处呈淡红棕色。
斜片呈卵圆形,长2.5~5cm,宽2~3cm。
切面类白色或浅红棕色,可见放射状纹理,周边较厚,微翘起或略弯曲。
体轻,质硬脆,易折断,折断时,有粉尘飞出。
气微,味甘。
1.2.4功能与主治:清热解毒,消痈散结,敛疮生肌。
用于痈疽发背,疔疮,瘰疬,烧烫伤。
1.2.5用法与用量:5~10g。
外用适量,煎汤洗或研成极细粉敷患处。
1.2.6法定炮制方法:除去杂质,洗净,润透,切厚片,干燥。
1.3验证依据标准
1.3.1《药品生产质量管理规范》(2010年修订)
1.3.2《中国药典》2015年版一部
1.3.3白蔹饮片生产工艺规程(草案)
1.3.4白蔹饮片成品质量标准
1.4生产工艺
主要控制点
1.4.2工艺描述
1.4.
2.1领料工序
根据生产指令,认真核对物料名称、数量、产地,合格证,核对无误后,称取规定量的中药材,剩余药材封好密闭,重新贴签,写有品名、批号、当次称量日期、剩余量、称量人签名。
对生产现场进行清场和清洁。
1.4.
2.2拣选工序
将要拣选的白蔹置于拣选台上,按“净制岗位标准操作程序”进行操作,拣去杂质,放于洁净容器内称重,计算杂质的比例,注明品名、批号、数量移至下工序。
对生产现场进行清场和清洁。
1.4.
2.3清洗工序
将拣选后的白蔹投入洗药机或洗药池中清洗,洗净后,用工具捞出、沥净水,放于洁净容器内称重,注明品名、批号、数量移至下工序。
对生产现场进行清场和清洁。
1.4.
2.4软化工序
将白蔹净药材置于透气的料箱内,推入润药机,按“软化岗位标准操作程序”进行操作,设置软化时间40分钟,开启真空泵,真空泵停止运转后,打开进气阀,放入水蒸气,蜂鸣器报警,软化结束,将软化好的药材取出,注明品名、批号、数量移至下工序。
对生产现场进行清场和清洁。
1.4.
2.5切制工序
将润透的白蔹药材,按“切制岗位标准操作程序”进行操作。
将白蔹切制成2~4mm的厚片,过筛,注明品名、批号、数量移至下工序。
对生产现场进行清场和清洁。
1.4.
2.6干燥工序
切制好的白蔹药材,按“药材烘干岗位标准操作程序”进行操作。
将白蔹放入不锈钢托盘内,置于晾药架上,厚度控制在2cm以下。
放入烘箱中,设置温度70℃以下干燥,水分达到内控标准时(13.0%),将干燥好的白蔹段进行过筛,注明品名、批号、数量移至下工序。
对生产现场进行清场和清洁。
2.验证目的
2.1验证白蔹饮片的各工序工艺条件。
2.2验证白蔹饮片各工序的物料平衡、收率限度。
2.3验证白蔹饮片的工艺重现性。
3.验证范围
本方案适用于中药饮片白蔹的生产工艺验证。
二、验证时间安排
本次验证计划于年月日到年月日执行。
三、验证前工艺条件确认
1.人员确认
1.1确认方法:检查在进行工艺验证前,与生产和质量有关的各种人员是否经过培训合格后上岗,同时人员的健康是否符合GMP要求。
1.2合格标准:经过培训合格后上岗,同时人员的健康符合GMP要求。
1.3确认记录:见附件1“验证人员培训情况确认记录”。
2. 生产设备、厂房和容器具确认
2.1确认方法:每批产品生产前,检查所有使用生产设备、厂房和容器具已清洁标识,清洁时间在效期内。
2.2合格标准:所有生产设备、辅助设备、厂房和容器具等都应清洁、干燥,无上批产品生产遗留物。
与中药饮片直接接触的内表面材质光亮。
2.3确认记录:见附件2、“生产设备、厂房和容器具清洁,设备运行、维护保养检查结果记录”。
3. 所需文件准备情况确认
5.1确认方法:检查在进行工艺验证前,各种管理规程,各岗位的标准操作规程,各设备的使用、清洁标准操作规程以及设备的维修保养规程等与生产有关的各种文件签批情况。
3.2合格标准:应已经制定并签字生效。
3.3确认记录:见附件3 “文件准备情况确认记录”。
四、验证项目、评价方法及标准
1.拣选工序
1.1验证方法:按照生产工艺规程和岗位标准操作规程操作,检查挑选后的药材杂质情况。
1.2合格标准:无虫蛀霉变、无杂质,物料平衡限度及收率符合规定。
1.3具体测试结果见“附件4 拣选岗位工艺验证结果记录”
2.清洗工序
2.1验证方法:按照生产工艺规程和岗位标准操作规程操作,清洗后的药材应干净、无杂质。
2.2合格标准:干净、无杂质。
2.3具体测试结果见“附件5清洗岗位工艺验证结果记录”。
3.软化工序
3.1验证方法:按照生产工艺规程和岗位标准操作规程操作,清洗后的药材的软化程度
3.2合格标准:软硬适度,不伤水。
具体测试结果见“附件6软化岗位工艺验证结果记录”。
4.切制工序
4.1验证方法:按照生产工艺规程和岗位标准操作规程操作,检查切制后的段型规格。
4.2合格标准:厚片2~4mm。
具体测试结果见“附件7切制岗位工艺验证结果记录”。
5.干燥工序
5.1验证方法:按照生产工艺规程和岗位标准操作规程操作,检查干燥后的产品水分。
5.2合格标准:不得过13.0%。
5.3具体测试结果见“附件8干燥生产岗位工艺验证结果记录”。
五、异常情况处理程序:白蔹饮片生产工艺验证过程中,应严格按照本方案进行操作;应按照下列程序进行:
1.在不合格点重新操作,重新验证不合格项目或全部项目。
2.若属于生产工艺规程上的原因,必要时报质量部,调整工艺参数。
3 .拟订日常监测程序及再验证周期:验证项目小组负责根据验证情况,拟订再验证周期,报验证领导小组审核。
4. 验证结果评定与结论:验证项目小组组长负责收集各项验证记录、试验结果记录,起草验证报告,报验证领导小组。
验证领导小组负责对验证结果进行综合评审,作出验证结论。
六、变更与偏差
在验证过程中发现的异常情况,如文件资料不全等问题,应立即通知QA人员进行处理,异常情况未解决时,不得进行进一步的验证工作。
对于现场立即可以及时解决的偏差或异常情况,现场立即予以解决,并在“备注与附件”中对处理情况予以说明,最终汇总登记在附件9“变更偏差情况记录”中。
对于需要对偏差原因进行分析调查,由相关专业人员商讨确定偏差处理措施的,应按照相应规程进行处理并填写《偏差处理记录》,然后登记到附件“变
更偏差情况记录”中。
所有《变更处理记录》或《偏差处理记录》作为附件一起归入验证档案。
七、再验证周期
正常情况下,再验证周期为五年,当遇到下列情况时应进行再验证
7.1工艺发生变更后;
7.2关键设备发生变更。
八、验证的评定与结论、验证合格证的签发
验证结束,由验证小组对验证结果进行汇总分析,作出评定结论,QA负责人审核签字后,质量负责人签发验证合格证书。
附件
附件1验证人员培训情况确认记录
附件2生产设备、厂房和容器具清洁,设备运行、维护保养检查结果记录”
附件3文件准备情况确认记录
附件4 拣选生产岗位工艺验证结果记录
附件5清洗生产岗位工艺验证结果记录
附件6软化岗位工艺验证结果记录
附件7切制岗位工艺验证结果记录
附件8干燥岗位工艺验证结果记录
附件9变更偏差情况记录
附件4 拣选生产岗位工艺验证结果记录。
