碘量法测定vc含量
碘量法测定vc含量

五 、实验操作步骤
1. 称取5g菜花,加少量石英砂及15ml偏磷酸 -醋酸研成匀浆,
2. 倒入10ml 离心管中,两两配平后, 8000rpm离心 5min(每组两个离心管);
3. 将上清收集干净的试管中,待用(此为 样品液);
4. 吸取5ml偏磷酸-醋酸,加10mL30%KI溶液。再加 10滴淀粉指示剂溶液。随即用标准硫酸铜溶液 (0.01mol/L)进行滴定,边滴定边振摇,直至显示 出蓝色(或红棕色),且稳定3sec不退,记录滴 定量V0(此为空白对照,注意:会很快变色,要 逐滴加入);
先使用铜盐与过量的KI进行反应生成CuI2
2 2CuSO4+4KI=CuI 2+2K2SO4
CuI2 不稳定随即分解为Cu2I2 和游离的碘
2CuI2=Cu2I2+ I2
生成的碘和维生素C反应 ,直到溶液里的VC被碘 全部氧化为止。 剩余的微量碘与淀粉指示剂生成蓝色。
四.试剂
(1)0.01 mol/L 硫酸铜(CuSO4 5H2O) (2)30% KI 溶液; (3)1%可溶性淀粉指示剂(m/V) (4)偏磷酸-醋酸溶液
在弱酸性条件下 ,可被碘氧化为脱氢抗坏血 酸
可利用此性质滴定: 指示剂——淀粉溶液 (遇碘变ቤተ መጻሕፍቲ ባይዱ)
二、实验目的
学习滴定分析法的基本原理
学习对蔬菜和食品中Vc含量进行测定的方法
三.实验原理
“滴定”(titration)是将已知准确浓度的 溶液——标准溶液通过滴定管滴加到待测 溶液中的过程。待“滴定”进行到化学反 应按计量关系完全作用为止,然后根据所 用标准溶液的浓度和体积计算出待测物质 含量的分析方法称为滴定分析法。
碘量法测维生素C含量

I2 溶液的标定用Na2S2O3标准溶液: 基本反应式:2S2O32-+I2=S4O62-+2I-
I2溶液(0.05mol/L): Na2S2O3标准溶液(0.01mol/L) 淀粉溶液(2g/L) HAc(1+1) 固体Vc样品(维生素片剂) 重铬酸钾(A.R) KI溶液(约200g/L)
维生素C含量的测定:
Na2S2O3标准溶液浓度:
实验序号 记录项目 M药片质量/g V消耗I2体积/ml ω维C含量/% ω维C平均含量/% 1 2
I2标准溶液的浓度:
3
1. 配制I2标准溶液时,为什么要加过量KI?可否 将称得的I2和KI一起加水至一定体积? 2 .溶解样品时,为什么要用新煮沸并冷却的蒸馏 水? 3.加醋酸的目的是什么?
碱性条件下可使反应向右进行完全,但因维生素 C还原性很强,在碱性溶液中尤其易被空气氧化, 在酸性介质中较为稳定,但是在强酸性溶液中I也易被氧化。 故反应应在稀酸(pH为3—4)(如稀乙酸、稀 硫酸或偏磷酸)溶液中进行,并在样品溶于稀酸 后,立即用碘标准溶液进行滴定。
由于碘的挥发性和腐蚀性,不宜在分析天平上直 接称取,需采用间接配制法;用Na2S2O3标准溶 液标定I2 溶液。 标定Na2S2O3溶液: 6I-+Cr2O72-+14H+=2Cr3++3I2+7H2O 2S2O32-+I2=S4O62-+2I- n(K2C2O7): 6n(Na2S2O3)=1:6
I2微溶于水而易溶于KI溶液,但在稀的KI溶液中溶 解得很慢,所以配制I2溶液时不能过早加水稀释,应 先将I2和KI混合,用少量水充分研磨,溶解完全后 再加水稀释。 I与KI间存在如下平衡:I2+I- =I3- 游离I2容易挥发损失,这是影响碘溶液稳定性的原因 之一。因此溶液中应维持适当过量的I-离子 ,以减 少I2的挥发。空气能氧化I-离子,引起I2浓度增加: 4 I-+O2+4H+ =2I2+2H2O 此氧化作用缓慢,但能为光,热,及酸的作用而加 速,因此I2溶液应处于棕色瓶中置冷暗处保存。I2能 缓慢腐蚀橡胶和其他有机物,所以I应避免与这类物 质接触。
直接碘量法测定维生素c含量课件

直接碘量法测定维生素c含量
(3)胡萝卜,称取41.215g,切成小块,加入20ml 2%的稀盐酸研磨 至糊状,加入250ml容量瓶中,加2%的稀盐酸定容250ml,然后用 真空泵抽滤,除去大颗粒和杂质,滤液密封备用。
测定
直接碘量法测定维生素c含量
维生素C的化学性质
• 又具有烯醇式结构 ,还原性强 • 水溶液中可解离成氧化型抗坏血酸
直接碘量法测定维生素c含量
维生素C的化学性质
• 在弱酸性条件下 ,可被碘氧化为脱氢抗坏血酸
可利用此性质滴定: 指示剂——淀粉溶液(
遇碘变蓝)
直接碘量法测定维生素c含量
1.直接碘量法
1、K2Cr2O7浓度
m
1 .2 4 1 g
C K 2 C r 2 O 7 M /V 2 9 4 .1 6 g /m o l 2 5 0 m l 1 0 0 0 m l/l 0 .0 1 6 9 m o l/L
2、Na2S2O3浓度
C N a 2S 2 O 36 C K 2 C V r2 O N 7 a 2 • S 2 V O 3K 2 C r2 O 70 .1 0 0 4 m o l/L
体KI1g和3g 浓盐酸,充分摇匀,放在暗处5min。 • 然后用50ml蒸馏水稀释,用Na2S2O3滴定到浅黄绿色,然后加入
5ml淀粉溶液,滴定至终点。记录消耗的体积。计算Na2S2O3溶液 浓度,平行滴定三次。
直接碘量法测定维生素c含量
• 5 I2 溶液的标定 • 移取Na2S2O3 溶液25ml三份于锥形瓶中,各加入25ml的水,5ml
分析化学实验报告——碘量法测定Vc含量

分析化学实验果汁中Vc含量的测定以及比较化学学院2008级化学二班方基永果汁中维生素C的含量测定以及比较前言:1.维生素C(Vitamin C ,Ascorbic Acid)又叫L-抗坏血酸,是一种水溶性维生素。
食物中的维生素C被人体小肠上段吸收。
一旦吸收,就分布到体内所有的水溶性结构中,正常成人体内的维生素C代谢活性池中约有1500mg维生素C,最高储存峰值为3000mg维生素C。
正常情况下,维生素C绝大部分在体内经代谢分解成草酸或与硫酸结合生成抗坏血酸-2-硫酸由尿排出;另一部分可直接由尿排出体外。
2.Vc在中国现在中国已经掌握了维生素C生产的领导地位,应该可以彻底解决病毒的问题,只是出产的维生素C大部份都外销,中国人服用维生素C的平均剂量,远逊于欧美和日本。
如果我们普遍认识维他命C对预防和治疗病毒传染病症的原理而大量服用,就可以遏止各种病毒的流行。
流行感冒只是一小事,维他命C的真正效用,会显示在治疗禽流感,SARS和AIDS等更严重的病毒传染病上。
3.正常需求1)、成人及孕早期妇女维生素C的推荐摄入量为100mg/d;2)、中、晚期孕妇及乳母维生素C的推荐摄入量为130mg/d。
注意:每个人对于VC的需求量个体化差异是很大的。
有的人补充少量既可满足,有的人可以达到每天10克甚至更高。
在人类对维生素C的研究史上,卡斯卡特医生(Robert F.Cathcart)早在上世纪70年代初就发现并建立了一套使用维生素C的标准。
当一个人口服维生素C达到相当的量,即24小时0.5~200克时,由于肠道渗透压的改变,会产生轻微的腹泻。
卡斯卡特将略低于此的量叫做“维生素C的肠道耐受量”,也就是一个人能承受的不引起轻微腹泻的量。
因为无酸性的VC,使大量口服维生素C成为可能,那么,每个人就可以根据自身体况的不同去服用。
只要在自己的肠道耐受量之内,效果就会很好。
有趣的是,人体对于VC的肠道耐受量是变化的。
在人体有病的时候,肠道耐受量会大幅度的提升,比如平时1克的耐受量,在急性感染或者患有肿瘤、心脏病等慢性疾病,甚至是感冒的时候,都会有不同程度的耐受量提升。
直接碘量法测定Vc片含量
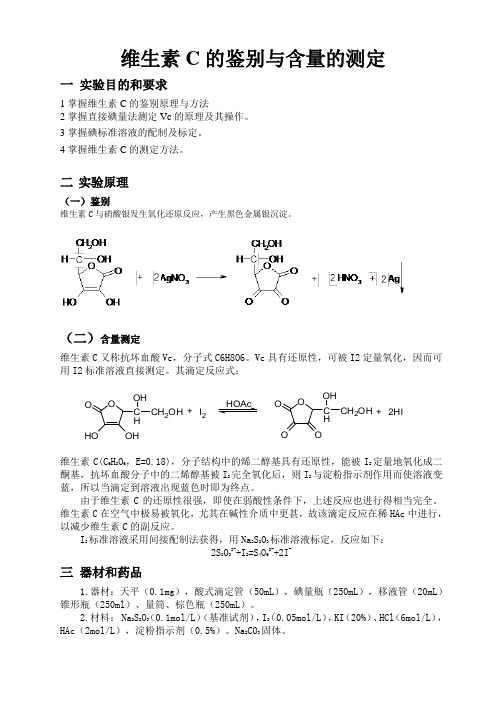
维生素C 的鉴别与含量的测定一 实验目的和要求1掌握维生素C 的鉴别原理与方法2掌握直接碘量法测定Vc 的原理及其操作。
3掌握碘标准溶液的配制及标定。
4掌握维生素C 的测定方法。
二 实验原理(一)鉴别维生素C 与硝酸银发生氧化还原反应,产生黑色金属银沉淀。
(二)含量测定维生素C 又称抗坏血酸Vc ,分子式C6H8O6。
Vc 具有还原性,可被I2定量氧化,因而可用I2标准溶液直接测定。
其滴定反应式:维生素C(C 6H 8O 6,E=0.18),分子结构中的烯二醇基具有还原性,能被I 2定量地氧化成二酮基,抗坏血酸分子中的二烯醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,所以当滴定到溶液出现蓝色时即为终点。
由于维生素C 的还原性很强,即使在弱酸性条件下,上述反应也进行得相当完全。
维生素C 在空气中极易被氧化,尤其在碱性介质中更甚,故该滴定反应在稀HAc 中进行,以减少维生素C 的副反应。
I 2标准溶液采用间接配制法获得,用Na 2S 2O 3标准溶液标定,反应如下:2S 2O 32-+I 2=S 4O 62-+2I -三 器材和药品1.器材:天平(0.1mg ),酸式滴定管(50mL ),碘量瓶(250mL ),移液管(20mL )锥形瓶(250ml )、量筒、棕色瓶(250mL )。
2.材料: Na 2S 2O 3(0.1mol/L )(基准试剂),I 2(0.05mol/L ),KI (20%)、HCl (6mol/L ),HAc (2mol/L ),淀粉指示剂(0.5%)。
Na 2CO 3固体。
OHOOHO C H OH CH 2OH +I 2OOOO C H OH CH 2OH +2HIHOAc四实验内容:(一)鉴别方法取该注射液0.5ml,加硝酸银试液5滴,即生成金属银的黑色沉淀。
(二)含量测定方法1、配制0.1mol/LNa2S2O3标准溶液称取12.5gNa2S2O3·5H2O,溶于500mL新煮沸并冷却的蒸馏水中,加入0.1gNa2CO3使溶液呈碱性,以防止Na2S2O3的分解,保存于棕色瓶中,即可配得的基准试剂0.1mol/LNa2S2O3标准溶液2.0.5%淀粉溶液的配制称取1g淀粉于小烧杯中,加少许水调成浆,搅拌下加到200mL沸水中,冷却后备用3. 配制与标定I2标准溶液1)I2标准溶液的配制称取3.3gI2和5gKI置于小烧杯中,加少量水,搅拌至I2全部溶解,转入250mL棕色瓶中,加水至250mL,混合均匀。
维生素C的含量测定(直接碘量法)
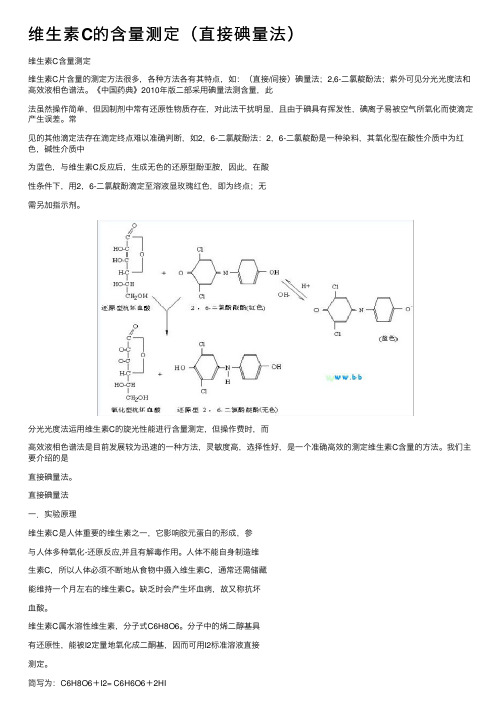
维⽣素C的含量测定(直接碘量法)维⽣素C含量测定维⽣素C⽚含量的测定⽅法很多,各种⽅法各有其特点,如:(直接/间接)碘量法;2,6-⼆氯靛酚法;紫外可见分光光度法和⾼效液相⾊谱法。
《中国药典》2010年版⼆部采⽤碘量法测含量,此法虽然操作简单,但因制剂中常有还原性物质存在,对此法⼲扰明显,且由于碘具有挥发性,碘离⼦易被空⽓所氧化⽽使滴定产⽣误差。
常见的其他滴定法存在滴定终点难以准确判断,如2,6-⼆氯靛酚法:2,6-⼆氯靛酚是⼀种染料,其氧化型在酸性介质中为红⾊,碱性介质中为蓝⾊,与维⽣素C反应后,⽣成⽆⾊的还原型酚亚胺,因此,在酸性条件下,⽤2,6-⼆氯靛酚滴定⾄溶液显玫瑰红⾊,即为终点;⽆需另加指⽰剂。
分光光度法运⽤维⽣素C的旋光性能进⾏含量测定,但操作费时,⽽⾼效液相⾊谱法是⽬前发展较为迅速的⼀种⽅法,灵敏度⾼,选择性好,是⼀个准确⾼效的测定维⽣素C含量的⽅法。
我们主要介绍的是直接碘量法。
直接碘量法⼀.实验原理维⽣素C是⼈体重要的维⽣素之⼀,它影响胶元蛋⽩的形成,参与⼈体多种氧化-还原反应,并且有解毒作⽤。
⼈体不能⾃⾝制造维⽣素C,所以⼈体必须不断地从⾷物中摄⼊维⽣素C,通常还需储藏能维持⼀个⽉左右的维⽣素C。
缺乏时会产⽣坏⾎病,故⼜称抗坏⾎酸。
维⽣素C属⽔溶性维⽣素,分⼦式C6H8O6。
分⼦中的烯⼆醇基具有还原性,能被I2定量地氧化成⼆酮基,因⽽可⽤I2标准溶液直接测定。
简写为:C6H8O6+I2= C6H6O6+2HI使⽤淀粉作为指⽰剂,⽤直接碘量法可测定药⽚、注射液、饮料、蔬菜、⽔果中维⽣素C的含量。
由于维⽣素C的还原性很强,较容易被溶液和空⽓中的氧氧化,在碱性介质中这种氧化作⽤更强,因此滴定宜在酸性介质中进⾏,以减少副反应的发⽣。
考虑到I - 在强酸性中也易被氧化,故⼀般选在pH为3~4的弱酸性溶液中进⾏滴定。
由于碘具有挥发性,碘离⼦易被空⽓所氧化⽽使滴定产⽣误差;⼜由于碘的挥发性和腐蚀性,使碘标准滴定溶液的配制及标定⽐较⿇烦。
直接碘量法测定维生素c含量
直接碘量法测定维生素c含量
维生素C,也被称为抗坏血酸,是一种水溶性维生素。
它在许多生物体内起着重要的生理作用,并且对人体有益。
维生素C含量测定是基于一种叫做碘量法的化学方法。
该方法利用碘酸钾溶液与维生素C反应的化学性质,通过了解反应后剩余的碘酸钾的含量来测定维生素C含量。
碘量法测定维生素C的过程如下:
准备样品:将要测定的样品加入到3%的浓磷酸中,并将其加热到约80℃,然后再冷却。
制备碘酸钾溶液:将20克的碘酸钾加入到1000毫升的蒸馏水中,并充分搅拌,以制备出0.1N的碘酸钾溶液。
测定过程:将取出的样品加入到定容瓶中,加入足够的蒸馏水,直至瓶子充满为止。
然后取出1毫升的样品溶液,并将其加入到滴定瓶中。
加入几滴淀粉溶液。
此时,溶液会变成淡蓝色。
准备滴定剂:将制备好的碘酸钾溶液滴加到另一个滴定瓶中,并加入适量的酒精。
通过滴加,将滴定剂加入到样品溶液中,直至溶液变成深蓝色。
读取数据:记录滴定剂滴入样品溶液的次数,并且根据已知的滴定剂浓度计算出维生素C的含量。
利用碘量法可以准确地测定含有维生素C的食物以及药品的维生素C含量。
然而,由于该测量方法需要使用化学试剂和复杂的实验过程,所以在实践中不太实用。
为了更加方便测量维生素C的含量,也出现了其他测量方法,例如高效液相色谱法和光谱法。
无论使用哪种方法测量维生素C的含量,都可以帮助人们了解他们摄入的营养成分,以及制定更加健康的膳食计划。
维生素c含量测定碘量法实验报告
维生素c含量测定碘量法实验报告
实验目的:
本实验旨在通过维生素c含量测定碘量法,掌握测定维生素c的方法和技能,同时加深对维生素c的认识。
实验原理:
碘量法是一种常用的测定维生素c含量的方法。
其原理是利用维生素c在氯化亚铁和碘酸钾的存在下,被氧化为脱氢抗坏血酸,然后用碘量法测定反应结束时残余的碘量,从而计算出维生素c的含量。
实验步骤:
1.将维生素c样品溶解于少量水中,加入5%的氯化亚铁溶液,使其完全还原。
2.加入2ml的碘酸钾溶液,并用0.1mol/L的氢氧化钠溶液调节溶液pH值为2-3。
3.用0.1mol/L的硫酸滴定溶液滴定反应液,直至溶液呈浅黄色,再加入几滴淀粉指示剂,继续滴定至溶液呈蓝色。
4.测量反应液的体积,计算出维生素c的含量。
实验结果:
在本实验中,我们测定了三个不同维生素c含量的样品,分别为0.1g、0.2g和0.3g。
在滴定过程中,我们发现反应液颜色会在滴定末几滴发生明显变化,这时需谨慎滴加滴定液,避免过度滴定。
最终的实验结果表明,三个样品的维生素c含量分别为0.096g、0.192g和0.284g。
实验结论:
通过本实验,我们掌握了维生素c含量测定碘量法的方法和技能,同时加深了对维生素c的认识。
实验结果表明,维生素c含量与样品添加量成正比,可以通过碘量法准确测定。
实验注意事项:
1.在实验过程中,应注意安全,避免溶液溅出,避免接触皮肤和眼睛。
2.在滴定时,应注意滴定液的速度,避免过度滴定。
3.实验前应检查所用试剂的质量和纯度,避免影响实验结果。
4.实验后应及时清洗实验器材,保持实验室卫生。
碘量法测定Vc的含量
一、实验目的 1.了解用碘量法测定维生素 C 含量的原理。 2.进一步熟悉电子天平的使用和滴定操作。 二、实验原理: 氧化还原法是利用氧化还原反应为基础的容量分析方法。 几乎所有元素和许多有机化合 物的含量,都能直接或间接地利用氧化还原法进行测定,因此它的应用范围极为广泛。根据 所用氧化剂种类的不同,氧化还原法可以分成高锰酸钾法、重铬酸钾法、碘量法和溴酸钾法 等。 I2/I-电对的标准电极电势为 0.535V,因此 I2 是较弱的氧化剂,只能与较强的还原剂作 用;而 I-是中等强度的还原剂,能与许多强氧化剂及一般中等强度的氧化剂作用。由于这些 特点,碘量法在生产实践中获得了广泛的应用。 维生素 C 又名抗坏血酸,分子式为 C6H8O6,通常用于防治坏血病及各种慢性传染病的 辅助治疗。市售维生素 C 药片含淀粉等添加剂。由于维生素 C 分子中的烯二醇基具有较强 的还原性,故能被 I2 定量地氧化成二酮基:
O C O C OH O C O C O C O C H C OH C H H C OH H C OH OH CH H OH CH H+I2+
2HI
维生素 C 的半反应为 C6H8O6 = C6H6O6 + 2H+ + 2e φθ= +0.18V - 1mol 维生素 C 与 1mol I2 定量反应,维生素 C 的摩尔质量为 176.12g·mol 1。 维生素 C 的还原性很强,在空气中极易被氧化,尤其在碱性介质中更甚,所以测定时 加入 HAc 使溶液呈弱酸性,减少维生素 C 的副反应,避免引起实验误差。 I2 溶液的浓度可以由已知浓度的 Na2S2O3 标准溶液滴定,以淀粉溶液为指示剂,滴定至 蓝色刚好消失即为终点,它们之间发生如下反应: - - - 2S2O32 + I2 = S4O62 + 2I 根据以上反应,可计算出药片中维生素 C 的含量:
维生素C药片中Vc含量的测定(碘量法)
1、配制2mol/L醋酸溶液。量取6mL冰醋酸稀释至50mL
2、维生素C的提取。取10片药剂,准确称量其质量。研成细粉末并混均匀,准确称取粉末约0.6g(三份)。置于锥形瓶中,操作一定要快,加50mL蒸馏水稀释,马上进行下一步滴定。(若颜色太深可加蒸馏水稀释)
3、维生素C的测定。向锥形瓶中加入10mL2mol/LHAc溶液,2mL淀粉溶液,立即用标准碘液(酸式滴定管)进行滴定至溶液刚好呈现蓝色,30s内不褪色即为终点.记下体积,平行滴定三次,,计算Vc的含量。
C% %
M(药片)=176.13g/mol
六、注意事项
1、实验中所用指示剂为淀粉溶液。I2与淀粉形成蓝色的加合物,灵敏度很高。温度升高,灵敏度反而下降。淀粉指示剂要在接近终点时加入。
2、用心煮沸并冷却的蒸馏水:否则Na2S2O3因氧气和二氧化碳和微生物的作用而分解,使滴定时消耗Na2S2O3溶液的体积偏大。
2
3
V(I2) / mL
V(Na2S2O3) 初读数/ mL
V(Na2S2O3) 终读数/ mL
V(Na2S2O3) / mL
c (I2)=0.5×C(Na2S2O3)×25.00/V(I2)
表三:维生素C药片Vc含量的测定
1
2
3
m(药片)/ g
V(I2) 初读数/ mL
V(I2) 终读数/ mL
V(I2) / mL
Na2S2O3标定时有:n(K2C2O7): n(Na2S2O3)=1:6
三、实验药品及仪器
实验药品和试剂:
I2分析纯KI溶液100g·L-1Na2S2O3·5H2O溶液0.0170mol.L-1K2C2O7溶液淀粉指示剂5 g·L-1Na2CO3固体 HCl溶液 6mol.L-1冰醋酸维生素C药片
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
先使用铜盐与过量的KI进行反应生成CuI2
2 2CuSO4+4KI=CuI 2+2K2SO4
CuI2 不稳定随即分解为Cu2I2 和游离的碘
2CuI2=Cu2I2+ I2
生成的碘和维生素C反应 ,直到溶液里的VC被碘 全部氧化为止。 剩余的微量碘与淀粉指示剂生成蓝色。
四.试剂
(1)0.01 mol/L 硫酸铜(CuSO4 5H2O) (2)30% KI 溶液; (3)1%可溶性淀粉指示剂(m/V) (4)偏磷酸-醋酸溶液
天然的退烧剂
二、实验目的
学习滴定分析法的基本原理
学习对蔬菜和食品中Vc含量进行测定的方法
三.实验原理
“滴定”(titration)是将已知准确浓度的 溶液——标准溶液通过滴定管滴加到待测 溶液中的过程。待“滴定”进行到化学反 应按计量关系完全作用为止,然后根据所 用标准溶液的浓度和体积计算出待测物质 含量的分析方法称为滴定分析法。
在弱酸性条件下 ,可被碘氧化为脱氢抗坏血 酸
可利用此性质滴定: 指示剂——淀粉溶液 (遇碘变蓝)
3. 维生素C对人体健康的重要作用
组成胶原蛋白的重要成份, 加速术后伤口愈合
增加免疫力,防感冒及病毒和细菌的感染
预防癌症
抗过敏
促进钙和铁的吸收 降低有害的胆固醇,预防动脉硬化 减少静脉中血栓的形成 天然的抗氧化剂
五 、实验操作步骤
1. 称取40g菜花(可分2-3次研磨),加少量石英 砂及少量偏磷酸-醋酸研成匀浆,加偏磷酸-醋酸定 容到100ml,颠倒混匀(两个组做一份); 2. 倒入4个10ml 离心管中,两两配平后,8000rpm 离心 5min(每组两个离心管); 3. 将上清倒入干净的三角瓶中,待用(此为样品 液);
碘量法测定维生素C 含量
一.维生素C简介
1.维生素C的物理性质 六碳多羟基酸性化合物 白色针状结晶 有酸味, 可溶于水
2.维生素C的化学性质
烯醇式己糖酸内酯,有L型和D型的两种异构体 只有L型有生理功效
在酸性环境中稳定存在
测定时pH值以保持在3-5为宜
一般用冰醋酸或偏磷酸-醋酸溶液作介质进行测定
6 .计算: L-抗坏血酸含量(mg/每份)= V×c V:(V1-V0)标准硫酸铜毫升数 c:0.88,即1ml0.01mol/l标准硫酸铜溶液相 当于0.88mg抗坏血酸。 六、实验结果: 计算L-抗坏血酸含量=(mg/100g) 七、结果讨论 计算结果与实际菜花中VC含量取5ml偏磷酸-醋酸,加10mL30%KI溶液。再加 10滴淀粉指示剂溶液。随即用标准硫酸铜溶液 (0.01mol/L)进行滴定,边滴定边振摇,直至显示 出蓝色(或红棕色),且稳定3sec不退,记录滴 定量V0(此为空白对照,注意:会很快变色,要 逐滴加入);
5. 精确吸取5mL样品溶液于100mL三角瓶中,加 10mL30%KI溶液。再加10滴淀粉指示剂溶液。随即 用标准硫酸铜溶液(0.01mol/L)进行滴定。边滴定 边振摇,直至显示出蓝色(或红棕色),且稳定 3sec不退,记录滴定量V1(此为样品值)。
