生理科学实验——medlab 生物信号采集处理系统
生理科学实验设计家兔呼吸运动调节

生理科学实验设计——家兔呼吸运动的调节09级31班第四小组麦华浩莫世杰刘文荣罗国华王辉赵宏伟一:实验目的:(1)熟悉家兔耳缘静脉注射法、家兔颈部手术操作、神经血管分离、气管插管技术。
(2)记录家兔呼吸曲线观察一氧化碳(CO)、纯氧,走神经对呼吸运动的调节及了解其机理。
(3)熟悉Medlab生物信号处理系统、保护电极、氧气瓶,张力换能器在实验中的作用及使用注意事项。
二:立题依据:一氧化碳中毒机理是一氧化碳与血红蛋白的亲合力比氧与血红蛋白的亲合力高200~300倍,它进入人体后会和血液中的血红蛋白结合,使血红蛋白不能与氧气结合,从而造成人体组织缺氧。
急性中毒时,轻者会出现头痛、头晕、耳鸣、心悸、恶心、呕吐、无力,重者会出现心肌损害、脑椎体系损害、昏迷、休克甚至死亡。
及时强制吸氧,置换一氧化碳,能避免死亡。
临床表现主要为缺氧,其严重程度与HbCO的饱和度呈比例关系。
轻者有头痛、无力、眩晕、劳动时呼吸困难,HbCO饱和度达10%—20%。
症状加重,患者口唇呈樱桃红色,可有恶心、呕吐、意识模糊、虚脱或昏迷,HbCO饱和度达30%—40%。
重者呈深度昏迷,伴有高热、四肢肌张力增强和阵发性或强直性痉挛,HbCO饱和度>50%。
患者多有脑水肿、肺水肿、心肌损害、心律失常和呼吸抑制,可造成死亡。
二氧化碳(CO2)是调节呼吸运动最重要的生理性化学因素。
很早就知道,在麻痹的动物或人,当动物血液Pco2降到很低水平时,可出现呼吸暂停。
因此,一定水平的Pco2对维持呼吸中枢的基本活动是必需的。
CO2刺激呼吸运动是用过两条途径实现的:一是通过刺激中枢化学感受器再兴奋呼吸中枢;二是刺激外周化学感受器,冲动经窦神经和迷走神经传入延髓,反射性地使呼吸加深﹑加快,肺通气量增加。
CO2在呼吸调节中经常起作用,动脉血Pco2在一定范围内升高,可加强对呼吸的刺激作用氧中毒机理当吸入性PO2过高时,活性氧产生增加,反可引起组织,细胞损伤,称为氧中毒。
不同麻醉药对小鼠缺氧耐受性的影响及机制研究
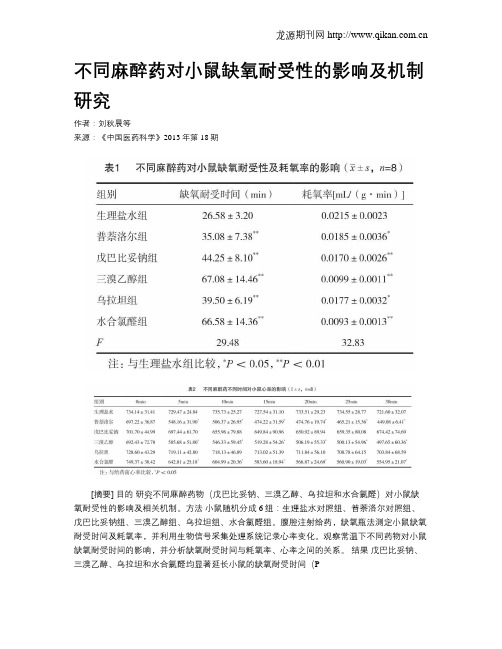
不同麻醉药对小鼠缺氧耐受性的影响及机制研究作者:刘秋晨等来源:《中国医药科学》2013年第18期[摘要] 目的研究不同麻醉药物(戊巴比妥钠、三溴乙醇、乌拉坦和水合氯醛)对小鼠缺氧耐受性的影响及相关机制。
方法小鼠随机分成6组:生理盐水对照组、普萘洛尔对照组、戊巴比妥钠组、三溴乙醇组、乌拉坦组、水合氯醛组。
腹腔注射给药,缺氧瓶法测定小鼠缺氧耐受时间及耗氧率,并利用生物信号采集处理系统记录心率变化。
观察常温下不同药物对小鼠缺氧耐受时间的影响,并分析缺氧耐受时间与耗氧率、心率之间的关系。
结果戊巴比妥钠、三溴乙醇、乌拉坦和水合氯醛均显著延长小鼠的缺氧耐受时间(P[关键词] 麻醉药;缺氧耐受性;小鼠[中图分类号] R364.4 [文献标识码] A [文章编号] 2095-0616(2013)18-29-03缺氧是常见的病理生理过程,缺氧耐受性差的器官如心、脑等,更容易发生缺血-再灌注损伤(ischemia reperfusion injury),心脑血管疾病手术特别是冠脉搭桥术和心脏移植手术等的广泛开展,均涉及缺血-再灌注过程。
近年来研究显示,麻醉药除了其麻醉效能外,还能明显减轻缺血再灌注损伤,但其机制复杂,尚不完全清楚[1-3]。
目前研究主要集中在离体细胞和单个器官上,关于麻醉药预处理对全身缺血缺氧损伤的保护作用研究很少[4]。
因此,研究麻醉药物对机体缺氧耐受性的影响具有重要临床意义,本实验拟通过不同麻醉药物对小鼠缺氧耐受性的影响及相关机制研究,以期为临床相关缺血-再灌注疾病的治疗提供理论依据,对于改善患者预后具有重要价值。
1 材料与方法1.1 动物和试剂健康成年ICR(institute of cancer research)小鼠,体重(20±2)g,购自苏州大学实验动物中心。
普萘洛尔、三溴乙醇购自美国Sigma公司;水合氯醛购自上海金山制药有限公司;戊巴比妥钠、乌拉坦购自国药集团化学试剂有限公司;钠石灰购自上海化学试剂有限公司。
呼吸运动的调节实验教案

1、吸入CO2呼吸运动有何变化?为什么?
2.静脉注入3%的乳酸溶液呼吸运动有何变化?为什么?
3.剪断两侧颈部迷走神经时呼吸运动有何变化?为什么?
教材及参考书:南昌大学医学院编:机能实验学,2005。
姚泰主编:生理学.第6版.北京:人民卫生出版社. 2004
吕国蔚主编:实验神经生物学,北京:科学出版社,2002
第1页总4页(首页)
南昌大学医学院教案
教学内容与方法
时间分配
兔呼吸运动的调节
见《机能实验学》114页。
观看本次实验内容模拟实验,示范操作过程。介绍和强调注意事项,特别是麻醉和静脉注射时的注意事项。介绍MedLab生物信号采集处理系统的使用。
实验目的 观察各种因素对呼吸运动的影响,结合理论,分析其作运用途径,了解呼吸运动的调节机制。
目的与要求:
熟悉哺乳类动物手术方法和气管插管技术。观察各种因素对呼吸运动的影响,结合理论,分析其作用途径,了解呼吸运动的调节机制。
重点与难点:
重点:哺乳类动物手术方法和气管插管技术。吸运动影响的作用途径分析。
媒体与教具:
生理科学模拟实验系统、MedLab生物信号采集处理系统。
沈岳良主编:现代生理学实验教程,北京:科学出版社,2002
教研室(科室)主任
意见
教研室(科室)主任签章:年月日
教学实施情况及分析(此项内容在课程结束后填写):
第4页总4页(尾页)
呼吸节律respiratory rhythm 缺氧 hypoxia(anoxia)
吸气切断机制 inspiratory off-switch mechanism
肺牵张反射 pulmonary stretch reflex or hering-Breuer reflex
生理科学创新性实验第一组

2.3大量静脉输入液体、利尿剂强化利 尿促进药物经肾脏排出,加大药物的排泄 量
精品ppt课件
6
▪ 3.静脉应用纳洛酮 常用0.8—1.2mg/d静滴,兴奋呼吸中枢,减 少巴比妥类药物对呼吸中枢的抑制作用。 (本实验采用呼吸兴奋药加强呼吸解救)
▪ 4.对症支持治疗 包括维持血压、呼吸和体温,昏迷患者预防感
▪ 4、观察记录家兔在注射苯巴比妥之前呼气相, 吸气相,呼吸幅度和频率,血压等各项指标。
精品ppt课件
12
▪ 5、给家兔第二次从耳缘静脉注射苯巴比妥 15mg/kg,观察并记录上述指标的变化,待 中毒症状明显后,然后立即从耳缘静脉注射 美解眠50mg,静脉注射后,每20min追加 25mg直至家兔呼吸曲线趋于正常停药,同 时从右侧颈外静脉滴注生理盐水以稀释血药
浓度同时增加尿量的排出以降低苯巴比妥的
浓度。若同时伴有血压下降等微循环障碍, 应从耳缘静脉注射0.01%去甲肾上腺素 0.1ml/kg。
▪ 6、按上述步骤操作后看上述指标是否恢复
正常。
精品ppt课件
13
四、创新性
▪ 利用Medlab系统同时观察家兔呼吸指数与血压,直观 明了,利于观察相应变化
▪ 实验通过苯巴比妥麻醉,可以观察其麻醉效果
生理科学设计性实验——
家兔急性苯巴比妥中毒及其解救
组 别: 10级临床05班第1 组
精品ppt课件
1
一、实验目的:
▪ 学习制备家兔急性苯巴比妥中毒动物模型 的方法,观察急性苯巴比妥中毒时动物的 一般表现,掌握急性苯巴比妥中毒的发病 原理及其抢救方法。同时了解掌握呼吸兴 奋药美解眠的药理作用,观察其对呼吸运 动的影响。
染等。
精品ppt课件
生理学实验课件 蛙类神经干动作电位的引导及其传导速度、不应期的测定

上相幅值 刺激
伪迹
mV
0
-35
潜下伏相期幅值
时程
刺激伪迹:刺激形成的电变化在神经干表面 的传导,可作为刺激开始的标志。
S
R1
R2 R3
R4
神经干
神经干
标本屏蔽盒
S1 S2
R1 R2 R3 R4
神经干动作电位传导速度测定原理:
V=s/t
通道1 通道2 通道3
t1
t t2
神经干动作电位不应期的测定原理:
三、测定神经干动作电位的传导速度、不应期
实验报告封面
班级: 组别: 姓名: 学号:
日期: 温度:
蛙类神经干动作电位的引导及传导速度、不应期的测定 一、实验目的 二、实验材料及步骤 略(详见《生理科学实验》P83~P87) 三、结果
图1 1通道神经干双相动作电位
表1 蛙类神经干动作电位的引导及传导速度、不应期的测定结果
5-3
本实验中相关数据的记录
•阈刺激 •最大刺激强度 •双相动作电位上下相幅值 •双相相动作电位上下相时程 •动作电位潜伏期(t1、t2) •动作电位间隔时间(t)
实验后数据处理:
• 打印1通道双相动作电位的图谱; • 按表5-2列出实验结果的相关数据; • 分析实验结果,并写出实验报告。
图1 1通道双相动作电位
相呼应。
预习:
实验二 影响血液凝固的因素; 实验三 红细胞渗透脆性的测定。 要点: 各种处理因素对血液凝固的影响及其原理;
红细胞渗透脆性的测定方法,渗透性溶血的 原理。
S
中枢端
R1
R2 R3
R4
神经干
神经干
外周端
标本屏蔽盒
S1 S2
实验1 刺激强度频率对骨骼肌收缩的影响

实验1 刺激强度、频率对骨骼肌收缩的影响【目的】本实验在保持刺激时间恒定的条件下,逐步增加或减小对蟾蜍坐骨神经的刺激强度(脉冲振幅)和改变电脉冲刺激频率,观察记录腓肠肌收缩收缩张力,分析探讨刺激强度和刺激频率与骨骼肌收缩张力的关系。
学习微机生物信号采集处理系统的使用。
【原理】肌肉、神经和腺体组织称为可兴奋组织,它们有较大的兴奋性。
不同组织、细胞的兴奋表现各不相同,神经组织的兴奋表现为动作电位,肌肉组织的兴奋主要表现为收缩活动。
因此,观察肌肉是否收缩可以判断它是否产生了兴奋。
一个刺激是否能使组织发生兴奋,不仅与刺激形式有关,还与刺激时间、刺激强度、强度-时间变化率三要素有关,用方形电脉冲刺激组织,则组织兴奋只与刺激强度、刺激时间有关。
用方形电脉冲刺激组织,在一定的刺激时间(波宽)下,刚能引起组织发生兴奋的刺激称为阈刺激,所达到的刺激强度称为阈强度,能引起组织发生最大兴奋的最小刺激,称为最大刺激,相应的刺激强度叫最大刺激强度;界于阈刺激和最大刺激间的刺激称阈上刺激,相应的刺激强度称阈上刺激强度。
刺激神经使神经细胞产生兴奋,兴奋沿神经纤维传导,通过神经肌接头的化学传递,使肌肉终板膜上产生终板电位,终板电位可引起肌肉产生兴奋(即动作电位),传遍整个肌纤维,再通过兴奋-收缩耦联使肌纤维中粗、细肌丝产生相对滑动,宏观上表现为肌肉收缩。
肌肉收缩的形式,不仅与刺激本身有关,而旦还与刺激频率有关。
当刺激频率较小,使刺激间隔大于一次肌肉收缩舒张的持续时间,则肌肉收缩表现为一连串的单收缩;增大刺激频率,使刺激间隔大于一次肌肉收缩的收缩时间、小于一次肌肉收缩舒张的持续时间,则肌肉产生不完全强直收缩;继续增加刺激频率,使刺激间隔小于一次肌肉收缩的收缩时间,则肌肉产生完全强直收缩。
【预习】1.仪器设备知识参见RM6240微机生物信号采集处理系统介绍。
2.实验理论实验动物知识参见第三章第一节生理科学实验常用实验动物的种类;第四章第一节动物实验的基本操作;统计学知识参见第五章第四节常用统计指标和方法;生理学教材中兴奋性、兴奋的概念,神经肌接头化学传递的机制,骨肌的收缩原理和肌肉收缩的外部表现和力学分析。
生理实验

2008年考研动物生理试验实验一蛙坐骨神经腓肠肌标本制备[目的] 熟悉蛙 (或蟾蜍) 的坐骨神经腓肠肌标本的制备方法,初步掌握几项基本实验操作。
[原理] 蛙类的一些基本生命活动和生理功能与温血动物相类似,而其组织在离体状态下,易于控制和掌握,所以蛙类的神经一肌肉标本常用以研究兴奋性、兴奋过程、刺激的一些规律和特性。
[实验动物] 蛙 (或蟾蜍)[器材及药品] 解剖器械,锌铜弓,培养皿,烧杯,任氏液,棉花线。
[方法及步骤] 1.破坏脑脊髓:取蛙或蟾蜍一只,用蛙针从枕骨大孔垂直插入,向前伸人颅腔,捣毁脑髓;向后插入椎管,捣毁脊髓。
如果蛙处于瘫痪状态,表示脑和脊髓完全破坏。
然后沿两侧腹部将蛙横断为上下两半。
并将前半段弃去,保留后半段备用。
2.剥离皮肤:先剪去尾椎末端及泄殖腔附近的皮肤,然后从脊柱的断端撕下皮肤,将其全部剥去,直至趾端。
除去内脏,将标本放在滴有任氏液的蛙玻璃板上。
将手及使用过的解剖器械洗净。
3.分离标本为两部分:沿脊柱正中线将标本匀称地剪成左右两半,一半浸入盛有任氏液的烧杯中备用,另一半作进一步剥制。
4.分离坐骨神经:在大腿背侧的半膜肌与股二头肌之间用玻璃分针分离出坐骨神经。
注意:分离时要仔细用剪刀剪断坐骨神经的分支,向上分离至基部,向下分离到腘窝。
保留与坐骨神经相连的一小块脊柱,将分离出来的坐骨神经搭于腓肠肌上;去除膝关节周围以上的全部大腿肌肉,刮净股骨上附着的肌肉,保留的部分就是坐骨神经及股骨。
5.分离腓肠肌:在跟键上扎一线,提起结线,剪断结线后的跟腱,腓肠肌即可分离出来。
此时在膝关节下方将其他所有组织全部剪去,到此为止,带有股骨的坐骨神经腓肠肌标本制备完成。
6.标本的检验:将坐骨神经腓肠肌标本放置在蛙玻璃板上,用锌铜弓刺激坐骨神经,若腓肠肌迅速发生收缩反应,说明标本机能良好,制备成功。
应及时移放入盛有任氏液的培养皿中,供实验之用。
[注意事项]1.剥制标本时,切忌用金属器械牵拉或触碰神经干。
实验指导书(生理学部分)

实验项目一:常用实验动物的基本操作(一)实验动物的抓握、固定和处死方法1、小鼠抓取固定方法小鼠温顺,一般不会咬人,抓取时先用右手抓取鼠尾提起,置于鼠笼或实验台向后拉,在其向前爬行时,用左手拇指和食指抓住小鼠的两耳和颈部皮肤,将鼠体置于左手心中,把后肢拉直,以无名指按住鼠尾,小指按住后腿即可。
有经验者直接用左手小指钩起鼠尾,迅速以拇指和食指、中指捏住其耳后颈背部皮肤亦可。
这种在手中固定方式,能进行实验动物的灌胃、皮下、肌肉和腹腔注射以及其他实验操作。
如进行解剖、手术、心脏采血和尾静脉注射时,则需将小鼠作一定形式的固定,解剖手术和心脏采血等均可使动物先取背卧位(必要时先行麻醉),再用大头针将鼠前后肢依次固定在腊板上。
2、小鼠的处死方法可采用颈椎脱臼法。
此法是将实验动物的颈椎脱臼,断离脊髓致死,为大、小鼠最常用的处死方法。
操作时实验人员用右手抓住鼠尾根部并将其提起,放在鼠笼盖或其他粗糙面上,用左手拇指、食指用力向下按压鼠头及颈部,右手抓住鼠尾根部用力拉向后上方,造成颈椎脱臼,脊髓与脑干断离,实验动物立即死亡。
(二)动物血细胞计数方法材料和用品(1)器材:细胞计数板、细口滴管、绸布。
(2)试剂:0.4%台盼蓝。
(3)材料:血细胞悬液。
实验原理细胞计数一般用血细胞计数板,按白细胞计数方法进行计数。
细胞计数时,先将培养细胞或血细胞稀释成细胞悬液,然后将细胞悬液滴入细胞计数板内,计数计数板上计数室四大格内的细胞数。
根据计数室的容积及稀释倍数,即可计算出细胞浓度。
实验步骤:图5-1 血细胞计数板1.采血及稀释用1ml移液管吸取0.38ml白细胞稀释液放入小试管内备用,另用5ml移液管吸取3.98ml红细胞稀释液放入小试管内备用。
用酒精棉球消毒兔的耳缘静脉采血部位,用刺血针刺破血管,让血液自然流出,擦去第一滴血,待流出第二滴血时,用一次性毛细血管分2次准确吸取20ul、和20ul,将血液分别吹入盛有白、红细胞稀释液的小试管内,用滴管放在试管底部轻轻吹出血液,用上清液冲洗毛细取血管2~3次,轻轻摇动,使液体充分混匀。
