小鼠腹腔巨噬细胞制备及提取
小鼠原代腹腔巨噬细胞提取方法(超详细~)

小鼠原代腹腔巨噬细胞提取方法(超详细)
实验前准备:
超净工作台、水平式低速离心机、10ml离心管、2.5mL注射器、细胞吸管、3%肉汤淀粉溶液、无菌眼科剪、无菌眼科镊、75%酒精溶液、无菌PBS溶液、DMEM细胞培养基、胎牛血清、细胞计数版、倒置显微镜等。
实验操作步骤
(1)我们对健康雄性C57BL/6小鼠腹腔注射3%肉汤淀粉溶液1 mL,持续3d,以便刺激腹腔巨噬细胞产生。
注:3%肉汤淀粉溶液提前配制,高温除菌后使用。
(2)小鼠颈椎脱臼处死,用75%酒精溶液对其充分消毒。
(3)固定小鼠,暴露腹腔。
(4)无菌条件下用剪刀沿腹中线剪开皮肤,暴露腹膜,切记勿伤及腹膜壁。
(5)向腹膜腔注射DMEM培养基3mL,并轻柔小鼠腹部片刻。
(6)用吸管反复冲洗腹膜腔并回收灌洗液。
(7)移入无菌的10ml的离心管中,以1000r/min,离心 5min,弃上清液。
(8)加入 5ml DMEM 培养基重悬细胞,上述步骤重复两次。
(9)加入含有10% FBS的DMEM培养液重悬细胞,细胞计数,调整细胞浓度为1×106 个/mL。
(10)将细胞悬液接种于 6 孔培养板中,放于37℃、5%二氧化碳
饱培养箱中培养,待后续实验研究。
小鼠腹腔巨噬细胞原代培养实验具体步骤及方法

小鼠腹腔巨噬细胞原代培养实验具体步骤及方法巨噬细胞属免疫细胞,有多种功能,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。
巨噬细胞容易获得,便于培养,并可进行纯化。
巨噬细胞属不繁殖细胞群,在条件适宜下可生活2-3周,多用做原代培养,难以长期生存。
步骤一、实验材料准备1. 动物:各个品系的小鼠2-4只。
2. 试剂:RPMI1640培养基(含酚红),小牛血清,双抗,培养液(10%小牛血清、RPMI1640、双抗),台盼兰等。
碘酒绵球和酒精绵球。
3. 器械:一次性注射器、手术器械。
二、实验方法如果采用刺激物,则可在实验前三天腹腔注射3%巯基乙醇酸钠每只2 mL,获得的巨噬细胞数要多一些。
不采用刺激物,直接开始下面的步骤。
1. 拉颈处死小鼠,在75%酒精浸泡1-2分钟,移入超净台中,仰卧位固定于解剖板上,碘酒消毒腹部皮肤,酒精绵球脱碘。
用手术直剪充分剪开腹部皮肤,暴露腹部肌层,再用酒精绵球消毒腹部肌层。
2. 用注射器抽取5 mL含双抗的RPMI1640培养基注入腹腔,用绵球轻揉腹部1-2 min,然后,用眼科镊稍提起腹腔,并用眼科剪剪开一个小口,用吸管吸取细胞悬液,移入离心管中(个人认为,此法比用注射器抽吸好一些)。
3. 1 000 rpm离心5 min后,用含双抗的RPMI1640培养基洗涤一次,再次离心,重悬细胞于含10%小牛血清的RPMI1640培养液中,如果是作为饲养细胞使用,则选择相应的培养液。
台盼蓝拒染法计数,将细胞稀释到目的浓度后,接种即可。
4. 如果是作为饲养细胞使用,调整浓度至2x105个/mL,接种到96孔板中,每孔100-200 uL;如果作为其它实验使用,可以调整成2x106/mL,加到24孔平底培养板中,1 mL/孔;5% CO2温箱孵育2 h后,换液,并用RPMI1640培养基洗1-2次,弃去未粘附细胞,贴壁细胞为单层的巨噬细胞。
三、结果巨噬细胞刚贴壁时偏圆形,或者类似鹅卵石形状,然后慢慢伸出伪足,铺开呈三角形或多角形。
小鼠腹腔巨噬细胞吞噬试验

2、菌和细胞在摇床中作用的时间不超过30 min,如果在 37C 条件下作用时间过长,被吞噬的菌很快会被裂解, 也就不能计数为吞噬了菌的细胞。
3、滴片时加入的细胞数依细胞的大小而定,如果使用的 吞噬细胞是细胞系,细胞体积较大,那么加入的细胞 数就相应的少一点。
血球计数板计数法
血球计数板是由一块厚玻片特制而成,其中央有 两个计数室。每个计数室划分出9个大方格(见下图), 每格面积1mm2,加盖玻片后的深度为0.1mm。因此, 每大方格容积为0.1mm3。
计数时,若细胞位于小方格的线上,应遵循“数上 线不数下线,数左线不数右线”的原则,以减少误差。 计数应重复3次,取其平均值。
数完毕后,依下式计算: 每1mL白细胞悬液细胞数=(4个中方格细胞总数 /4) ×104× 稀释倍数
每1mL红细胞悬液细胞数=(80个小方格细胞总数 /80) ×400×104× 稀释倍数
(2)白色念珠菌制备 将白色念珠菌接种于沙氏平皿 培养基中,培养48小时,收集菌,用适量生理盐水 配成悬液,100℃,煮沸30 min灭活,离心去掉上清, 再用1%美兰染色30 min,用生理盐水洗涤二次,用 生理盐水配成1×108/ml菌悬液,4℃冰箱保存备用。
(3)吞噬细胞与菌混合培养 取巨噬细胞0.5ml加白色念珠菌悬液0.5ml,置37℃
实验时眼球放血、断椎处死小鼠,新洁尔灭浸泡5分钟。 剪开腹部皮肤,暴露腹膜,用镊子夹起腹膜剪开一
小口(注意避开血管),用1640灌注腹腔,收集腹腔液于 试管中(约4 ml),1500 r/min,离心10 min,去上清, 沉积细胞用1640离洗一次。最后沉积细胞用含10%小 牛血清1640配成适当浓度备用(1-2×106/ml)。
小鼠腹腔巨噬细胞吞噬试验
小鼠腹腔巨噬细胞的提取与鉴定

小鼠腹腔巨噬细胞的提取与鉴定
张淑莉;张琪;景晓红
【期刊名称】《国际检验医学杂志》
【年(卷),期】2015(036)002
【摘要】目的探讨小鼠腹腔诱导和提取巨噬细胞的简便方法.方法以5%淀粉肉汤刺激诱导小鼠产生炎性腹腔巨噬细胞,分离获取小鼠腹腔巨噬细胞,在含有10%小牛血清的RPMI1640培养液中培养,显微镜观察细胞形态,台盼蓝染色鉴定细胞活力,体内吞噬鸡红细胞测定其吞噬率、吞噬指数,瑞氏染色、免疫细胞化学染色鉴定细胞纯度.结果获得高纯度、高细胞活性的巨噬细胞,具备巨噬细胞的形态特征.结论该研究采用的方法简单实用,可提取大量巨噬细胞.
【总页数】3页(P174-175,178)
【作者】张淑莉;张琪;景晓红
【作者单位】西安医学院医学技术系检验中心,陕西西安710021;陕西省核工业417医院,陕西西安710600;西安医学院医学技术系检验中心,陕西西安710021【正文语种】中文
【相关文献】
1.小鼠腹腔巨噬细胞的分离培养与鉴定 [J], 张淑莉;李素芬
2.快速振荡法高效提取小鼠腹腔巨噬细胞研究 [J], 徐尤年;刘桂林;蒙臣;张诗海
3.3%巯基乙酸盐肉汤诱导法高效提取小鼠腹腔巨噬细胞 [J], 耿田欣;臧光耀;严金川
4.小鼠腹腔巨噬细胞的分离培养与鉴定 [J], 尹美珍;李世普;袁琳;戴红莲
5.小鼠腹腔巨噬细胞的分离培养与鉴定 [J], 尹美珍;李世普;袁琳;戴红莲
因版权原因,仅展示原文概要,查看原文内容请购买。
小鼠腹腔巨噬细胞培养详细方法
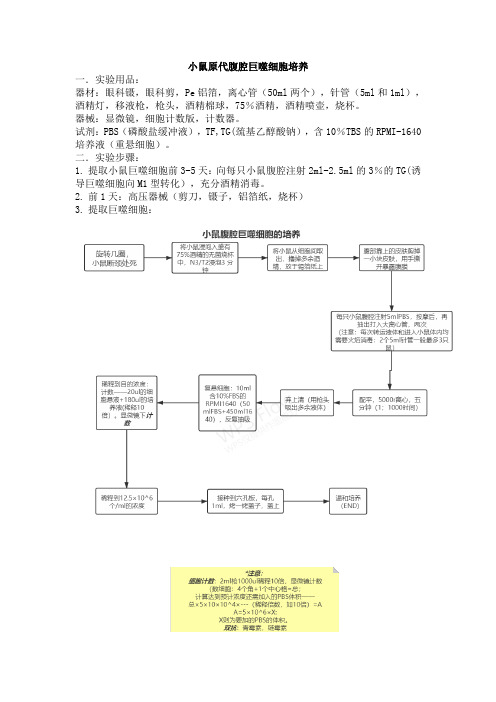
小鼠原代腹腔巨噬细胞培养一.实验用品:器材:眼科镊,眼科剪,Pe铝箔,离心管(50ml两个),针管(5ml和1ml),酒精灯,移液枪,枪头,酒精棉球,75%酒精,酒精喷壶,烧杯。
器械:显微镜,细胞计数版,计数器。
试剂:PBS(磷酸盐缓冲液),TF,TG(巯基乙醇酸钠),含10%TBS的RPMI-1640培养液(重悬细胞)。
二.实验步骤:1.提取小鼠巨噬细胞前3-5天:向每只小鼠腹腔注射2ml-2.5ml的3%的TG(诱导巨噬细胞向M1型转化),充分酒精消毒。
2.前1天:高压器械(剪刀,镊子,铝箔纸,烧杯)3.提取巨噬细胞:三.结果:巨噬细胞:刚贴壁时偏圆形,或者类似鹅卵石形状,然后慢慢伸出伪足,铺开呈三角形或多角形。
巨噬细胞有吞噬的特性,当与细菌混合在一起的时候,在40倍物镜下可以看到巨噬细胞吞噬细菌,因此,巨噬细胞作为饲养细胞可以清除部分污染的细菌、支原体和部分细胞碎片。
巨噬细胞属免疫细胞,有多种功能,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。
巨噬细胞容易获得,便于培养,并可进行纯化。
巨噬细胞属不繁殖细胞群,在条件适宜下可生活2-3周,多用做原代培养,难以长期生存。
小鼠腹腔巨噬细胞原代培养的应用:(1)用于细胞保种;(2)用于分子生物学研究;(3)用于基因治疗研究。
*注意:1. 巨噬细胞是终末分化细胞,不会增殖。
2. 很难消化下来,所以接种的时候,必须直接接种到目的培养器皿中。
3. 严格无菌操作,在超净台内进行。
4. 为避免交叉感染,每一只小鼠更换注射器。
5. 吸管吸取细胞悬液的时候,尽量不要吸到大小肠,否则容易引起成纤维细胞污染。
换液:培养液从4度取出回温,超净台中操作,用移液枪换液即可。
分离巨噬细胞的方法

分离巨噬细胞的方法巨噬细胞是免疫系统中重要的成分之一,其功能是吞噬和消化细菌、病毒、细胞残骸等病原体或异常细胞。
为了研究巨噬细胞的生理和病理功能,科学家需要从体内或体外分离出巨噬细胞。
下面将介绍几种常用的分离巨噬细胞的方法。
1. 腹腔巨噬细胞分离法这是一种常用的方法,适用于小鼠或大鼠的巨噬细胞分离。
首先,用适当的方法将小鼠或大鼠的腹腔打开,将腹腔洗液抽取出来。
洗液中含有大量的巨噬细胞。
然后,将洗液经过离心,将沉淀中的巨噬细胞收集起来。
最后,用适当的培养基培养巨噬细胞,使其继续生长和分化。
2. 骨髓巨噬细胞分离法这种方法适用于从小鼠或大鼠的骨髓中分离巨噬细胞。
首先,将小鼠或大鼠的骨髓从骨骼中取出,并用适当的方法将骨髓细胞洗涤干净。
然后,将洗液经过离心,将沉淀中的骨髓巨噬细胞收集起来。
最后,用适当的培养基培养骨髓巨噬细胞,使其继续生长和分化。
3. 化学法分离巨噬细胞这种方法利用化学试剂的特定性质,使巨噬细胞与其他细胞分离。
例如,可以利用巨噬细胞表面特定的受体,使用特定的抗体标记巨噬细胞,并通过离心或磁珠分离得到纯净的巨噬细胞。
此外,还可以利用化学试剂的特殊性质,如巨噬细胞对特定染料的亲和性,来分离巨噬细胞。
4. 细胞排序分离巨噬细胞细胞排序是一种高级的细胞分离技术,可以根据细胞的特定性质,如大小、形状、表面标记等,将巨噬细胞从混合细胞中分离出来。
这种方法可以高效地分离出纯净的巨噬细胞群体,但设备和技术要求较高。
总结起来,分离巨噬细胞的方法有腹腔巨噬细胞分离法、骨髓巨噬细胞分离法、化学法和细胞排序法。
这些方法各有优缺点,科学家可以根据实验需求选择适合的方法。
通过分离巨噬细胞,科学家可以更好地研究巨噬细胞的生理和病理功能,为疾病的治疗和预防提供理论基础。
小鼠腹腔巨噬细胞吞噬试验

剪开腹部皮肤,暴露腹膜,用镊子夹起腹膜剪
开一小口(注意避开血管),用1640灌注腹腔,收集腹
腔液于试管中(约4 ml),1500 r/min,离心10 min,
去上清,沉积细胞用1640离洗一次。最后沉积细胞
用含10%小牛血清1640配成适当浓度备用(1-2×106
/ml)。
第3页/共17页
(2)白色念珠菌制备 将白色念珠菌接种于沙氏平 皿培养基中,培养48小时,收集菌,用适量生理 盐水配成悬液,100℃,煮沸30 min灭活,离心去 掉上清,再用1%美兰染色30 min,用生理盐水洗 涤二次,用生理盐水配成1×108/ml菌悬液,4℃ 冰箱保存备用。
四角的大方格,又分为16个中方格,适用于 白细胞计数。中央大方格以双线等分为25个中方格。 每个中方格又分16个小方格,通常我们取四角的4个 中方格和中间的1个中方格来计数红细胞。
第11页/共17页
第12页/共17页
第13页/共17页
第14页/共17页
首先用吸管吸取少许稀释后的单细胞悬液,从 盖片端滴一小滴(不宜过多),液体自行向内渗入, 静置数分钟后,再放在微镜下观察计数。
第9页/共17页
3、滴片时加入的细胞数依细胞的大小而定,如果使 用的吞噬细胞是细胞系,细胞体积较大,那么加入 的细胞数就相应的少一点。
第10页/共17页
血球计数板计数法
血球计数板是由一块厚玻片特制而成,其中 央有两个计数室。每个计数室划分出9个大方格(见 下图),每格面积1mm2,加盖玻片后的深度为 0.1mm。因此,每大方格容积为0.1mm3。
第16页/共17页
感谢您的观看!
第17页/共17页
第4页/共17页
(3)吞噬细胞与菌混合培养 取巨噬细胞0.5ml加白色念珠菌悬液0.5ml,置
小鼠腹腔巨噬细胞的分离培养与鉴定

小鼠腹腔巨噬细胞的分离培养与鉴定【摘要】目的建立一种小鼠腹腔巨噬细胞分离培养的简便方法。
方法以无血清的DMEM培养液灌洗小鼠腹腔,分离获取小鼠腹腔巨噬细胞,在含有10%成牛血清的DMEM培养液中培养。
采用倒置显微镜观察细胞形态,台盼蓝染色计算存活率,瑞氏染色计算纯度。
结果获得高纯度的巨噬细胞,具备巨噬细胞的形态特征。
结论该方法是一种简单可行的分离巨噬细胞的方法。
【关键词】小鼠;巨噬细胞;分离;培养;鉴定0.引言巨噬细胞是动物机体内重要的免疫细胞,具有抗肿瘤和免疫调节等重要作用[1,2] ,被广泛应用于体外免疫增强药物的非特异性免疫功能评价[3] 。
有很多文献报到已能从多种组织和器官中分离纯化巨噬细胞,但这些方法大多都是繁琐、复杂,所需时间长且耗资较大。
本实验以小鼠腹腔巨噬细胞为研究对象,探索建立一种巨噬细胞体外分离培养与鉴定简便的方法。
1.材料与方法1.1实验对象清洁级巴贝斯小鼠,体重在(30-32g),由兰州大学实验动物中心提供。
1.2实验方法1.2.1小鼠腹腔单核巨噬细胞的分离培养随机选取巴贝斯小鼠,腹腔注射不含小牛血清的RPMI-1640培养液5ml。
轻柔小鼠腹部2-3min,静置5-7min后将小鼠颈椎脱臼处死,至于解剖板上,无菌条件下打开腹腔,用注射器抽取腹腔液,离心5min (1000r/min),弃上清,用PBS洗涤2遍。
再用含10%成牛血清的RPMI-1640培养液(0.1%双抗溶液)调节至2×106ml-1,接种于培养瓶及6孔板,置37℃,5%CO2培养箱培养2h,弃上清。
用不含小牛血清的RPMI-1640培养液洗涤2遍,然后加含有10%小牛血清的RPMI-1640培养液在37℃CO2培养箱中继续培养[4]。
倒置显微镜观察细胞形态。
1.2.2巨噬细胞的观察与鉴定(1)台盼蓝染色计算存活率。
4%台盼蓝母液:称取4g台盼蓝,加少量蒸馏水研磨,加双蒸水至100ml,用滤纸过滤,4度保存。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠腹腔巨噬细胞制备及提取
实验动物: 6-8周的SPF级雄性BALB/C小鼠,小鼠取细胞前三天每天腹腔注射0.5-1mL淀粉肉汤,或者取细胞前一小时注射1mL淀粉肉汤。
试剂:75% 乙醇、RPMI 1640 (Gibcol/BRL,美国)、含10%小牛血清RPMI-1640液(10%牛胎血清、青霉素100U/ml、链霉素10μg/ml)步骤:
1、取6周左右的小鼠,剃去腹部的毛并消毒。
2、引颈杀死动物,手提鼠尾将全鼠浸入75%酒精中3~5秒。
3、倒立小鼠,置动物于解剖台上,固定四肢,75%酒精擦洗腹膜壁后,用9号针头5ml注射器沿腹中线将预冷的不含小牛血清的PBS5mL注入腹腔中,同时从两侧用手指揉压腹膜壁,令液体在腹腔内充分流动。
轻轻按摩腹部2-3分钟,静置5-7分钟。
4、无菌条件下,剪开腹壁,双手持镊撕开皮肤拉向两侧,暴露出腹膜,但勿伤及腹膜壁。
再用75%酒精擦洗腹壁。
5、用针头轻轻挑起腹壁,使动物体微倾向一侧,使腹腔中液体集于针头下吸入注射器内。
小心拔出针头。
把液体注入50ml离心管中。
再用同样容量的PBS冲洗腹腔2~4次。
合并渗出液于50 mL离心管中。
直至冲洗液变澄清。
6、4℃ 250×g(1000 rpm/min)离心10min,去上清。
7、用PBS培养液洗涤细胞3次,每次4℃ 250×g(1000 rpm/min)离心10min,去上清。
8、用含10%小牛血清RPMI-1640液(10%牛胎血清、青霉素100U/ml、链霉素10μg/ml)悬浮细胞。
将调整细胞浓度调整至 5×106cells/mL 加入培养皿中培养9、将培养皿置于5% CO2、37℃培养箱中培养3 h,然用37℃预温的RPMI-1640培养液清洗培养皿2-3次,去除未贴壁的细胞,即得到纯化的贴壁巨噬细胞。
种96孔板。
2h细胞贴壁。
换液。
墨汁(时间短,可以不灭菌)染色。
观察。
如有侵权请联系告知删除,感谢你们的配合!。
