恶性胶质瘤小分子靶向药物进展
恶性胶质瘤分子靶向药物联合治疗新动态

C ne e t ,u a— n U i ri ;3D p r e to e rs r / uoo cl y a c r a cr C n r n Y s nv s y . e at n N uoug Ne r—noo ,C n e eS t e e t m f y g
o l d mo sr t d a mo e t s r i a e e i i e p n e ae a n i g r m 1 o 5 、 T e o i a o n y e n t e d s u vv b n f w t a r s o s r t r g n f a l t h o 0 t 1 % h c mb n t n i o df r n t g t d ra e t o c mb n t n f ag t d a e t w t c a sc l c ttx c e g n s a d o f i e e t a ee e g n s r o i a o o t re e g n i r i s h ls i a yo o i r a e t n / r r d oh r p ma p o i e rmiig e sr tge f te t n . I ti ril , w r ve e c re t a v n e a i te a y y r v d p o sn n w tae is o r ame t n h s a t e c e e iw d u r n d a c s i a g td n tr ee mo e ua o i a o h rp o li n n l ma . l c r c mb n t n t e y f r ma g a t g i l i a o s KEY ORDS G o s a g td moe u a e a y W : l ma ;T ee lc l t r p ;C e t e a y i r r h h mo r p ;Ra i te a y h do rp h
胶质瘤的分子靶向治疗综述

【关键词】 分子靶向治疗 胶质瘤 [中图分类号]R730.5 [文献标识码]A [文章编号]1810 5734(2013)07 50 03 肿瘤分子靶向治疗是指在肿瘤分子细胞生物学的基础上,利用肿瘤组织或细胞所具有的特异性(或相对特异的)结构分子作为靶点,使用某 些能与这些靶分子特异结合的抗体、配体等达到直接治疗或导向治疗目的的一类疗法。分子靶向药物以某些肿瘤细胞膜上或细胞内特异性 表达的分子为作用靶点,从而能够更加特异性地作用于特定肿瘤细胞,阻断其生长、转移或诱导其凋亡,抑制或杀死肿瘤细胞,达到控制肿瘤之 目的。胶质瘤起于神经胶质细胞,属于脑内肿瘤,发生率占全部颅内肿瘤40%,包括星形细胞瘤,少突胶质瘤,室管膜瘤和髓母细胞瘤, 恶性胶质瘤是很常见的中枢神经系统肿瘤,其预后差,是病死率和致残率都较高的恶性肿瘤。其中,占恶性胶质瘤发病率50%以上的多形 性胶质母细胞瘤(GBM)的中位生存期仅10-12个月,由于其侵袭性生长的特征或位于重要功能区及深部,使肿瘤难以全切,放化疗也不 能改变患者的总体预后,因此寻求和探索新的治疗途径十分迫切。近年来,随着对分子畸变理解的深入,针对细胞受体,关键基因和调控 分子的分子靶向治疗已成为肿瘤治疗研究中的热点,本文回顾了近几年来分子靶向治疗在脑胶质瘤方面的应用和进展。 1 分子靶向疗法及脑胶质瘤的分子病理改变 分子靶向治疗是以在恶性肿瘤中异常表达的基因及其蛋白产物或某些细胞信号转导途径为靶点的一种新的治疗方法,属于生物治疗范 畴。胶质瘤的分子病理改变是对其进行分子靶向治疗的基础和依据,近年的研究表明星形胶质细胞瘤常有抑癌基因TP53的突变和血小板生 长因子及其配体的过度表达,染色体10q 的杂合现象缺失也在高级别的星形胶质瘤中发现,而且在那些缺失染色体10q 的星形细胞瘤中, 有近40%能观察到张力蛋白(PTEN)的失活。而大部分多形性胶质母细胞瘤表现为表皮生长因子受体(EGFR)的放大扩充,依赖细胞周 期素激酶P16NK4A 的突变与缺失以及直周环状染色体10上磷酸酯酶和张力蛋白及其同系物的改变。在初发性胶质母细胞瘤中血管内皮因 子-A 过度表达,而在复发性胶质母细胞瘤中则是血小板生长因子-AB过度表达,这可作为二者的鉴别点之一,以上这些胶质瘤分子水平的 病理改变为分子靶向疗法应用于它本身提供了理论依据。目前,用于脑胶质瘤分子靶向治疗的药物主要有单克隆抗体和小分子激酶抑制剂 等。 2 小分子激酶抑制剂 绝大多数激酶受体介导的细胞内信号转导途径与丝氨酸,苏氨酸, 酪氨酸激酶的激活相关联。激酶被激活后催化来自ATP 的磷酸基的 转移,然后通过第二信使的作用介导信号转导途径的活化。目前在临床试验中研究较多的有表皮生长因子受体(EGFR)抑制剂和血管内 皮生长因子受体(VEGFR)抑制剂等。 2.1 EGFR 抑制剂:EGFR属于酪氨酸激酶受体的ErbB家族,其中EGFRⅧ是EGFR 一种特殊的变异体,它缺乏第二至第七个外显 子,是胶质母细胞瘤病人预后差的一个独立预测因素,EGFR在胶质母细胞瘤中的表达比正常细胞高约50 %,在其它恶性胶质瘤中也有不 同程度的过度表达,且EGFR基因增强的胶质母细胞瘤患者预后往往很差,这些都为EGFR分子靶向治疗的应用提供了依据,针对EGFR的 靶向治疗主要有吉非替尼和埃罗替尼两种小分子抑制剂,吉非替尼在细胞内膜与底物中的ATP 竞争,抑制PTK 磷酸化,阻断肿瘤细胞信号 转导途径,抑制其增殖,诱导其凋亡,埃罗替尼作用与此类似。 2.2 VEGF 酪氨酸激酶抑制剂:在脑肿瘤尤其是恶性胶质瘤中VEGFR呈过度表达,恶性肿瘤特征之一是瘤体内能形成新的血管,而 VEGF 能促进内皮细胞增殖,迁移和管腔形成,对瘤体内新血管的形成起关键作用。在恶性胶质瘤细胞中至少有两种结构上有联系的VEGF 受体:即flt-1(VEGF 受体1)和flk-1(VEGF 受体2),分别为不同基因编码。胶质瘤细胞分泌VEGF 与相邻上皮细胞高水平表达的VEGFR-2 相结合,促进瘤体内血管发生,而小分子抑制剂可通过对VEGFR-2 的抑制而阻止血管生成和限制瘤周水肿,达到限制恶性胶质瘤生长的目 的。SU5416(semaxauib)是VEGF受体2 和PDGF 受体共同的抑制剂,能抑制胶质瘤移植瘤的生长,显著延长移植瘤小鼠生存期。 VEGER-2选择性强抑制剂PTK787(蛋白酪氨酸激酶787)能干扰VEGF和PDGF介导的相关血管形成,PTK787与放疗联用能显著抑制P53 基因缺乏,并对放疗耐受的移植瘤的生长进行抑制,主要副作用包括深静脉血栓形成及肝功能受损等,单独应用PTK787能使66%的恶性胶 质瘤患者病情趋于平稳。 2.3 PDGFR 抑制剂:PDGF调控了血管的发生且在将近75 %的恶性胶质瘤中呈过度表达,伊马替尼是一种PDGFR 抑制剂,无论是 单一治疗或与羟基脲联合化疗或辅以放疗,被证明疗效一般。 2.4 多靶点激酶抑制剂主要对细胞内异常信号转导途径和肿瘤相关脉管系统起作用。ZD6474是一种对EGFR 和EGFR-2 起作用的双重 激酶抑制剂,动物实验表明其能提高胶质瘤荷瘤动物的生存率。AEE788作用机理与ZD6474类似,它能对EGFR 和EGFR-2产生效应。此 外,正在进行试验的多靶点激酶抑制剂还有:R115777,GW572016,CCI-779 等。 3 单克隆抗体 单克隆抗体一般分子量较大,不易透过血脑屏障,由于中枢神经系统的解剖特性,其应用于恶性胶质瘤主要受给药途径限制,此外还 与所构建单抗的无免疫源性及肿瘤抗原完整性等相关。瘤腔内注药或通过术后残留腔隙给药可改善其疗效,或采用系统的抗VEGF 疗法, 以瘤体内新生血管为靶点,可从根本上消除血脑屏障对药物弥散的阻碍。贝伐单抗是一种早在上世纪90 年代就开发出的一种人VEGF 单克 隆抗体的重组体,合,竞争性抑制VEGF 与其受体发 生作用,从而减少瘤体内新生血管的形成。Stark-Vance将贝伐单抗与依立替康联用于胶质母细胞瘤患者,其中只有10%的病例继续恶化,
小分子靶向治疗药物简介
化学抗肿瘤药物经过半个多世纪的发展,已经进入靶向治疗药物时代。
小分子靶向药物在临床上的应用日益增多,在一些肿瘤类别中已经进入一线用药地位,比如肾癌、慢粒白、多发性骨髓瘤等。
本文对小分子靶向治疗药物做一综述。
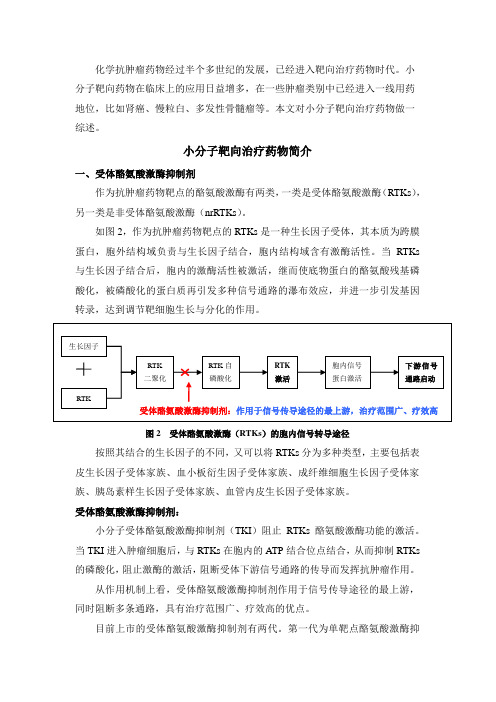
小分子靶向治疗药物简介一、受体酪氨酸激酶抑制剂作为抗肿瘤药物靶点的酪氨酸激酶有两类,一类是受体酪氨酸激酶(RTKs),另一类是非受体酪氨酸激酶(nrRTKs)。
如图2,作为抗肿瘤药物靶点的RTKs是一种生长因子受体,其本质为跨膜蛋白,胞外结构域负责与生长因子结合,胞内结构域含有激酶活性。
当RTKs 与生长因子结合后,胞内的激酶活性被激活,继而使底物蛋白的酪氨酸残基磷酸化,被磷酸化的蛋白质再引发多种信号通路的瀑布效应,并进一步引发基因转录,达到调节靶细胞生长与分化的作用。
图2 受体酪氨酸激酶(RTKs)的胞内信号转导途径按照其结合的生长因子的不同,又可以将RTKs分为多种类型,主要包括表皮生长因子受体家族、血小板衍生因子受体家族、成纤维细胞生长因子受体家族、胰岛素样生长因子受体家族、血管内皮生长因子受体家族。
受体酪氨酸激酶抑制剂:小分子受体酪氨酸激酶抑制剂(TKI)阻止RTKs酪氨酸激酶功能的激活。
当TKI进入肿瘤细胞后,与RTKs在胞内的ATP结合位点结合,从而抑制RTKs 的磷酸化,阻止激酶的激活,阻断受体下游信号通路的传导而发挥抗肿瘤作用。
从作用机制上看,受体酪氨酸激酶抑制剂作用于信号传导途径的最上游,同时阻断多条通路,具有治疗范围广、疗效高的优点。
目前上市的受体酪氨酸激酶抑制剂有两代。
第一代为单靶点酪氨酸激酶抑制剂,如吉非替尼、厄洛替尼。
表已上市的酪氨酸激酶抑制剂注:EGFR:表皮生长因子受体,属HER家族;VEGFR:血管内皮生长因子;PDGFR:血小板衍生因子;HER2:HER家族的一种受体;Abl-Bcr:一种非受体酪氨酸激酶;Raf:酪氨酸激酶的下游信号通路中的一种蛋白;Flt-3:Src:一种非受体酪氨酸激酶;c-kit:Ret:胶质细胞源性神经营养因子的受体吉非替尼为EGFR酪氨酸激酶抑制剂,主要用于非小细胞肺癌,对酪氨酸激酶基因编码区突变型肿瘤的有效率高达80%以上。
肿瘤分子靶向治疗的研究进展

肿瘤分子靶向治疗的研究进展随着生物技术的不断发展和精准医疗的不断普及,以分子为靶点的肿瘤治疗越来越成为研究的热点领域,这种治疗方法被称为肿瘤分子靶向治疗。
与以往的传统治疗方法相比,肿瘤分子靶向治疗具有特异性高、有效性好、毒副作用小等优点,受到了世界范围内的广泛关注。
本文将从靶点的发现、药物的选型、临床应用等方面介绍肿瘤分子靶向治疗的研究进展。
一、靶点的发现靶点是指某个分子或细胞结构,能够与治疗药物紧密结合,从而起到抗癌作用的位置。
对于肿瘤治疗而言,靶点的发现至关重要,因为它们的存在直接决定了治疗药物的精准性和有效性。
目前,靶点发现的方法主要分为以下几类:化学筛选法、基因组学筛选法、蛋白质组学筛选法和细胞治疗方法。
其中,化学筛选法是指利用生物化学技术,从化学物质中筛选出对于某种癌症有特异性的化合物;基因组学筛选法则是指通过对整个基因组的筛选,寻找具有影响肿瘤发生发展的基因或蛋白质;蛋白质组学筛选法则是通过检测肿瘤细胞和正常细胞中蛋白质表达的差异,寻找具有癌症特异性的蛋白质;而细胞治疗方法则是利用生物技术筛选出能够靶向癌细胞特异性基因的细胞,通过对正常细胞和癌细胞靶向细胞的刺激来治疗癌症。
目前,靶点的发现涉及到生物学、医学、化学等多个学科领域,需要各种技术手段之间的协作,其中最重要的一环是开展肿瘤分子基因组学研究,这对于深入了解肿瘤发生、发展及转移过程中的基因和蛋白质变化十分重要。
二、药物的选型药物的选型是肿瘤分子靶向治疗的核心内容之一。
首先,必须找到能够靶向特定肿瘤细胞的药物,并能够在体内达到理想的浓度。
其次,还需要考虑药物的毒副作用,以及它对正常细胞和组织的影响。
根据靶点的不同,肿瘤分子靶向治疗的药物可以分为信号转导抑制剂、细胞周期抑制剂、免疫治疗剂、抗血管生成剂、DNA损伤修复抑制剂等多个种类。
例如,信号转导抑制剂是针对肿瘤细胞信号通路的药物,可以抑制肿瘤细胞的增殖和转移;而免疫治疗剂则是指通过提高机体免疫力,增强机体对癌细胞的抗体和杀伤力,从而达到抗癌的效果。
胶质瘤的未来研究与治疗进展

联合治疗策略:结合手 术、放疗、化疗等多种 手段,进行综合治疗, 提高治愈率和生存率。
个体化治疗:根据患者的 具体情况,制定个性化的 治疗方案,提高治疗效果
和患者的生存质量。
新型治疗技术:探索新型 治疗技术,如基因治疗、 免疫治疗等,为胶质瘤的 治疗提供新的途径和手段。
精准手术与机器人辅助技术
精准手术:通过 先进的影像技术 和导航系统,实 现肿瘤的精确切 除,减少损伤和
联合治疗:基因治疗与细胞治 疗的结合,提高治疗效果
未来展望:基因编辑技术、免 疫疗法等在胶质瘤治疗中的应 用
跨学科合作与转化医学研究
内容:胶质瘤的未来研究方向将涉及跨学科合作,整合医学、生物学、化 学等多学科知识,共同开展研究。
内容:转化医学研究将发挥重要作用,将基础研究成果转化为临床治疗手 段,提高胶质瘤的治疗效果。
其他治疗方法
免疫疗法:利用免疫系统攻击肿瘤细胞,如CAR-T细胞疗法和PD-1抑制剂。 基因疗法:通过修改或替换肿瘤细胞的基因来阻止其生长,如CRISPR-Cas9技术。 溶瘤病毒疗法:利用病毒在肿瘤细胞内复制并破坏其结构,如疱疹病毒和腺病毒。 光热疗法:利用光敏剂和激光照射肿瘤部位,使肿瘤细胞升温并死亡。
添加标题
添加标题
免疫治疗
免疫治疗是利用人体免疫系统来对抗 疾病的一种治疗方法。
针对胶质瘤的免疫治疗,主要是通过 刺激或增强人体免疫系统的功能,来 攻击和消灭肿瘤细胞。
目前已经有一些针对胶质瘤的免疫治 疗药物和治疗方法,例如免疫检查点 抑制剂、肿瘤疫苗等。
免疫治疗在胶质瘤治疗中仍处于研究 和发展阶段,未来仍需要更多的研究 和临床试验来验证其疗效和安全性。
内容:跨学科合作与转化医学研究将有助于打破学科壁垒,促进多领域交 流与合作,推动胶质瘤研究领域的整体发展。
恶性肿瘤的分子靶向治疗(内容参考)

恶性肿瘤的分子靶向治疗【摘要】肿瘤分子靶向治疗是指在肿瘤分子细胞生物学的基础上,利用肿瘤组织或细胞所具有的特异性(或相对特异的)结构分子作为靶点,使用某些能与这些靶分子特异结合的抗体、配体等达到直接治疗或导向治疗目的的一类疗法。
分子靶向药物以某些肿瘤细胞膜上或细胞内特异性表达的分子为作用靶点,从而能够更加特异性地作用于特定肿瘤细胞,阻断其生长、转移或诱导其凋亡,抑制或杀死肿瘤细胞,达到控制肿瘤之目的。
近年来分子靶向治疗的迅速发展使其高选择性和非细胞毒性逐渐受到重视,本文就用于恶性肿瘤的分子靶向治疗药物的分类及其临床研究状况做一综述。
关键词:【关键词】恶性肿瘤;分子靶向;治疗对无法手术切除的肿瘤,化疗和放疗仍然是目前的一线治疗方法,尽管随着新一代化疗药物如紫杉醇、吉西他宾的应用,患者的生存获得一定益处,但大多数癌症患者的预后仍较差。
研究人员一直在试图寻找新的药物以杀灭肿瘤细胞并尽可能减少对正常细胞的损害,近年来分子靶向治疗研究取得重大进展[1],新的抗肿瘤分子靶向药物的数量不断增加并进入临床领域,在肿瘤临床实践中取得了显著疗效,使肿瘤个体化治疗前进了一大步。
这些新药物与传统治疗方法的结合有望成为治疗肿瘤的有效手段,显著提高肿瘤治疗的疗效。
肿瘤分子靶向治疗常用的治疗靶点有:细胞受体、信号传导和抗血管生成等[2]。
本文综述针对这些靶点的几类主要分子靶向药物。
1单抗类药物:单克隆抗体(monoclonal antibody, McAb)是利用抗原抗体特异性结合的特点设计的一种治疗方法。
肿瘤细胞表面有一些特异的肿瘤抗原可供利用作为单克隆抗体攻击的靶点[3]。
当前单克隆抗体在肿瘤治疗中已取得实质性进展,该治疗方法利用某种生物制剂,通过载体注入局部或全身给药进入人体后,在体内选择性地对表达某种基因蛋白的癌细胞起着“对号入座”的杀灭作用,可减少正常组织与细胞的毒副作用。
1.1 曲妥珠单抗Herceptin(Trastuzumab,贺赛汀):是一种针对HER-2/neu原癌基因产物的人/鼠嵌合单抗,能特异地作用于HER-2受体过度表达的乳腺癌细胞。
靶向抗肿瘤药物的研究进展

靶向抗肿瘤药物的研究进展靶向抗肿瘤药物的研究进展近年来,随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增生,随之而来的是抗肿瘤药物研发理念的重大转变。
研发焦点正从传统细胞毒药物向针对肿瘤发生发展过程中众多环节的新药方向发展,这些靶点新药针对正常细胞和肿瘤细胞之间的差异,可达到高选择性、低毒性的治疗效果,从而克服传统细胞毒药物的选择性差、毒副作用强、易产生耐药性等缺点,为此,肿瘤药物进入了一个崭新的研发阶段。
目前发现的药物靶点主要包括蛋白激酶、细胞周期和凋亡调节因子、法尼基转移酶(FTase) 等,现就针对这些靶点的研发药物做一综述。
1、蛋白激酶蛋白激酶是目前已知的最大的蛋白超家族。
蛋白激酶的过度表达可诱发多种肿瘤。
蛋白激酶主要包括丝氨酸/苏氨酸激酶和酪氨酸激酶,其中酪氨酸激酶主要与信号通路的转导有关,是细胞信号转导机制的中心。
蛋白激酶由于突变或重排,可引起信号转导过程障碍或出现异常,导致细胞生长、分化、代谢和生物学行为异常,引发肿瘤。
研究表明,近80%的致癌基因都含有酪氨酸激酶编码。
抑制酪氨酸激酶受体可以有效控制下游信号的磷酸化,从而抑制肿瘤细胞的生长。
酪氨酸激酶受体分为表皮生长因子受体(EGFR)、血管内皮细胞生长因子受体(VEGFR) 、血小板源生长因子受体(PDGFR) 等,针对各种受体的酪氨酸激酶抑制剂目前已开发上市的主要为表皮生长因子受体酪氨酸激酶(EGFR-TK) 抑制剂、血管内皮细胞生长因子受体酪氨酸激酶(VEGFR-TK) 抑制剂和血小板源生长因子受体酪氨酸激酶(PDGFR-TK)抑制剂等。
基于多靶点的酪氨酸激酶抑制剂目前已成为研究重点,具有广阔的发展前景,其中,包括舒尼替尼和索拉芬尼在内的几个上市新药均获得了良好的临床评价结果。
1.1 EGFR-TK抑制剂许多实质性肿瘤均高度表EGFR,EGFR-TK抑制剂是目前抗肿瘤药研发的热点之一。
脑胶质瘤分子靶向药物联合治疗的研究进展

- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
III期临床试验
774 例无法手术晚期、转移性胃、胃食管连接 部腺癌 卡培他滨+顺铂 +AVASTIN OS 12.1 m 卡培他滨+顺铂 +安慰剂 OS 10.1m P=0.1002 PFS ORR有改善 乳腺癌 ASCO1005 结果类似
胶质瘤
2009年5月美国 FDA 加速审批应用于复发 GBM Weill Cornell Medical College,2010, 14 例复发 GBM病人效果良好 UCLA, 2009, 复发GBM/同期对照
副作用
高血压 34% 高血压 危象发生率1.0% 出血 CNS 3.3% 胃肠道穿孔/气管瘘 动脉血栓栓塞/静脉 血栓 伤口愈合延迟 蛋白尿 充血性心力衰竭 肺间F研究人员用基因敲除、RNA干扰等方式抑制胶质瘤细胞中的 VEGF,解除VEGF对MET磷酸化抑制后,MET活性增高。 进一步用划痕试验和动物模型研究发现,同时抑制VEGF和MET后胶 质瘤细胞的迁徙能力下降,实验组小鼠生存期延长。 应用Avastin的胶母治疗前后的病理组织切片检测,结果发现使用 Avastin后肿瘤MET磷酸化水平显著提高。
Angiogenesis
VEGF PDGF MMP-9 FGF VEGFR MAPK PKC AKT phosphorylation HIF-1α VEGF
Direct: endostatin Indirect: Avastin
胶质瘤相关分子机制
原癌基因:Ras、EGFR、c-cis、myc、 myb、VEGF、CDK-4基因等 Signal pathway
机理
EGFR 单抗,竞争性抑制配体与EGFR的结合, 阻断下游信号通路,从而抑制肿瘤细胞增殖、 促凋亡,抑制血管生成,增强放、化疗疗效。 小分子酪氨酸激酶抑制剂: 吉非替尼gefitinib 埃罗替尼erlotinib 单克隆抗体 西妥昔单抗 cetuximab 尼妥珠单抗 Nimotuzumab 帕尼单抗 Panitumumab
尼妥珠单抗 Nimotuzumab
尼妥珠单抗由古巴分子免疫学中心(CIM)研发,是 第一个以EGFR为靶点的人源化单抗药物,2002年古巴 政府(CECMED)快速审批,获准上市。 国家Ⅰ类新药(泰欣生),百泰生物药业有限公司开 发,我国正式上市的第一个人源化单克隆抗体药物。 2007年尼妥珠单抗在美国获准进口,用于儿童脑桥胶 质瘤临床试验。
A phase II, randomized, non-comparative clinical trial of the effect of bevacizumab (BV) alone or in combination with irinotecan (CPT) on 6 month progression free survival (PFS6) in recurrent, treatment refractory glioblastoma (GBM). JCO,2008
恶性胶质瘤小分子靶向药物 研究进展
2013年4月
Glioma
手术+放疗+化疗 生物免疫治疗
小分子靶向药物治疗
• 器官靶向/细胞靶向/分子靶向 • 单靶点/多靶点药物 • 小分子酪氨酸激酶抑制剂/单克隆抗体
中药 其他
单克隆抗体制备
Formation of abnormal tumor vasculature Invasion of glioma cells along neuronal tracts
Primary EGFR/PTEN→PI3K /AKT activation Secondary P53/Rb →inactivation
Proneural Neural Mesenchymal Classical
TCGA
GBM OA O AOA AO AA A
贝伐珠单抗 Bevacizumab
安维汀Avastin由Roche/Genentech开发, 是世界上第一种抗肿瘤血管生成药物 2004年美FDA批准应用于晚期结、直肠 癌,肺癌,肾癌,卵巢癌,胶质母细胞 瘤等;乳腺癌目前已撤消。 2010年2月中国SFDA批准,用于治疗转 移性结直肠癌。
机理
Folkman理论(美国哈佛大学 1990): 肿瘤生长须依靠新生血管生成来提供足够的 氧气和营养物质来维持
适应症
晚期结直肠癌
首次静脉输注时间需持续90分钟。如果 第一次输注耐受性良好,则第二次输注 的时间可以缩短到60分钟 5-7.5mg/kg体重,每两周给药一次
临床疗效
BO20696 (ARTIST中国),E3200 trial
共有214 例中国患者按照 1:2 随机入组接受伊立替康 /5-FU/LV 治疗 (m-IFL 组) 或 伊立替康/5-FU/LV 联 合贝伐珠单抗治疗(贝伐珠单抗 + m-IFL 组)。无进 展生存期明显延长 (8.3m vs 4.2m, p<0.001),疾病进展 或死亡风险下降56% (HR=0.44);6个月无进展生存率 明显提高(62.6% vs 25.0%, p<0.001);总生存期延长 4.3个月(18.7m vs 13.4m, p=0.014)
IgG1,人源化程度高达95% 100或200mg泰欣生稀释于250ml生理 盐水中静脉滴注,输液过程在60分钟 以上;每周1次,共8次;患者同时接 受标准的放、化疗
机理
安维汀可以与肿瘤释放的血管内皮生长因子结 合,阻止VEGF与血管内皮细胞上的受体结合 来抑制肿瘤血管生成,从而切断肿瘤给养,达 到阻止肿瘤生长的目的。 VEGF-A 1、使肿瘤血管退化 2、使存活血管正常化:部分肿瘤血管退化的 同时,许多存活的血管也受影响,内皮窗口和 细胞间隙开始关闭,从而致使血管通透性下降 。这将降低肿瘤组织内的压力,可以改善化疗 药物向肿瘤组织内的传送。 3、持续抑制新生和再生血管生长
