北京市2017届高三化学一轮复习4.3硫及其化合物课时测试(含解析)
人教高考化学一轮复习硫及其化合物 知识点及练习题含答案解析
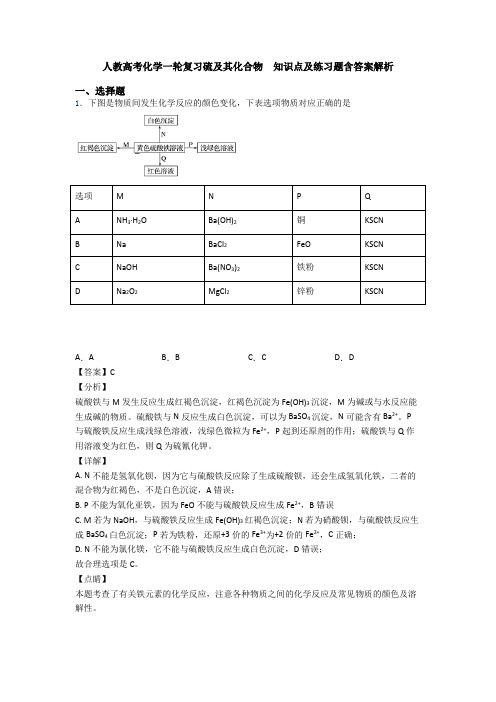
人教高考化学一轮复习硫及其化合物知识点及练习题含答案解析一、选择题1.下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是选项M N P QA NH3·H2O Ba(OH)2铜KSCNB Na BaCl2FeO KSCNC NaOH Ba(NO3)2铁粉KSCND Na2O2MgCl2锌粉KSCNA.A B.B C.C D.D【答案】C【分析】硫酸铁与M发生反应生成红褐色沉淀,红褐色沉淀为Fe(OH)3沉淀,M为碱或与水反应能生成碱的物质。
硫酸铁与N反应生成白色沉淀,可以为BaSO4沉淀,N可能含有Ba2+。
P 与硫酸铁反应生成浅绿色溶液,浅绿色微粒为Fe2+,P起到还原剂的作用;硫酸铁与Q作用溶液变为红色,则Q为硫氰化钾。
【详解】A. N不能是氢氧化钡,因为它与硫酸铁反应除了生成硫酸钡,还会生成氢氧化铁,二者的混合物为红褐色,不是白色沉淀,A错误;B. P不能为氧化亚铁,因为FeO不能与硫酸铁反应生成Fe2+,B错误C. M若为NaOH,与硫酸铁反应生成Fe(OH)3红褐色沉淀;N若为硝酸钡,与硫酸铁反应生成BaSO4白色沉淀;P若为铁粉,还原+3价的Fe3+为+2价的Fe2+,C正确;D. N不能为氯化镁,它不能与硫酸铁反应生成白色沉淀,D错误;故合理选项是C。
【点睛】本题考查了有关铁元素的化学反应,注意各种物质之间的化学反应及常见物质的颜色及溶解性。
2.如图是硫酸试剂瓶标签上的部分内容。
据此下列说法中正确的是()硫酸化学纯(CP)(500 mL)品名:硫酸化学式:H2SO4相对分子质量:98密度:1.84 g·cm-3质量分数:98%A.该硫酸的物质的量浓度18.0 mol·L-1B.1molZn与足量的该硫酸反应能产生22.4L H2C.配制230mL4.6mol·L-1的稀硫酸需取该硫酸62.5mLD.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗【答案】C【详解】A.该硫酸的物质的量浓度为1000wMρ=1000 1.894898%⨯⨯=18.4mol/L,故A错误;B.18.4mol/L的硫酸为浓硫酸,浓硫酸与Zn反应生成二氧化硫,不会生成氢气,故B错误;C.配制230mL4.6mol·L-1的稀硫酸需要选取250 mL容量瓶,设需浓硫酸的体积为V,根据稀释定律,稀释前后溶质硫酸的物质的量不变,则250mL×4.6 mol•L-1=V×18.4mol/L,解得V=62.5mL,故C正确;D.NaOH溶液具有强腐蚀性,会腐蚀皮肤,若不小心将该硫酸溅到皮肤上,应该用水冲洗后,再用稀的碳酸氢钠溶液涂抹,故D错误;故选C。
北京市2017届高三化学一轮复习3.4铝及其化合物课时练习(含解析)

3-4 铝及其化合物1.使溶液中的Al3+完全转化成Al(OH)3,应选择的最好试剂是()A.NH3•H2O B.HCl C.H2SO4 D.CO2【答案】A【解析】Al(OH)3是两性氢氧化物,若用强碱与Al3+发生反应制取Al(OH)3,当加入的碱少量时发生反应:Al3++3OH-= Al(OH)3↓,若碱过量,会继续发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O,不能使所有Al3+完全转化成Al(OH)3,而NH3•H2O是弱碱,不能与Al(OH)3发生反应,因此使溶液中的Al3+完全转化成Al(OH)3,应选择的最好试剂是NH3•H2O,正确选项是A。
2.甲、乙两烧杯中分盛有10mL1mol•L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水.下列有关两个烧杯的说法中,正确的是()A.甲中产生的沉淀一定比乙中多 B.乙中产生的沉淀一定比甲中多C.甲和乙产生的沉淀一定一样多 D.甲和乙中产生的沉淀可能一样多【答案】D【解析】因氨水和NaOH溶液中,各加入10mL 0.1mol•L-1AlCl3溶液,生成氢氧化铝沉淀,但氨水为弱电解质,部分电离,氢氧化钠为强电解质,完全电离,相同体积、相同pH的氨水和NaOH溶液中的溶质一水合氨的物质的量大于氢氧化钠的物质的量;当两者都不足量时,生成的氢氧化铝沉淀的量由一水合氨和氢氧化钠来决定,一水合氨的物质的量大于氢氧化钠的物质的量,所以甲中沉淀比乙中的少;当氨水过量,氢氧化钠不足时,乙中生成的氢氧化铝的物质的量为10mL×10-3L/mL×0.1mol•L-1=0.001mol,甲中生成的氢氧化铝的物质的量小于0.001mol,所以甲中沉淀比乙中少;当氨水过量,氢氧化钠恰好时,生成的沉淀取决于氯化铝,氯化铝的量相等,所以甲和乙中生成的沉淀一样多;当氨水和氢氧化钠都过量时,因氢氧化铝能溶于氢氧化钠但不溶于氨水,乙中生成的氢氧化铝为0.001mol,甲中生成的氢氧化铝溶于过量的氢氧化钠,氢氧化铝沉淀小于0.001mol,所以甲中沉淀比乙中少.通过以上分析知,甲中沉淀少于或等于乙中沉淀,故ABC错误、D正确;答案为D。
2017届高考化学人教版一轮复习课时作业14硫及其化合物Word版含解析

课时作业14硫及其化合物时间:45分钟一、选择题1.(2016·山东实验中学诊断)雾霾,是雾和霾的统称。
空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。
当水汽凝结加剧、空气湿度增大时,霾就会转化为雾。
二氧化硫、氮氧化物和可吸入颗粒物这三项是雾霾主要组成。
以下说法中不正确的是()A.雾霾天,汽车车灯照出通路的现象属于丁达尔效应B.冬天烧煤时可在煤中加入生石灰减少二氧化硫的排放C.防雾霾口罩的原理与过滤类似,防雾霾效果好的口罩往往呼吸阻力较大D.PM2.5是直径小于等于2.5μm的污染物颗粒,完全属于胶体粒子的直径范围答案:D解析:2.5 μm=2.5×103 nm远大于胶体粒子直径范围,D选项错误。
2.(2016·广东十二校联考)下列陈述Ⅰ、Ⅱ正确并且有因果关系的是()解析:A 选项,KSCN 溶液检验Fe 3+与Fe 3+的氧化性无关,错误;C 选项,SO 2不与浓硫酸反应原因是SO 2、H 2SO 4中硫的化合价分别为+4、+6,无中间价态,与SO 2还原性强弱无关,错误;D 选项,浓硫酸不能干燥氨气,错误。
3.下列有关环境问题的说法正确的是( )A .燃煤时加入适量石灰石,可减少废气中SO 2的含量B .臭氧的体积分数超过4%的空气有利于人体健康 C. pH 在5.6~7.0之间的降水通常称为酸雨D .含磷合成洗涤剂易被细菌分解,故不会导致水体污染 答案:A解析:A 项中,CaCO 3=====高温CaO +CO 2↑,2CaO +2SO 2+O 2===2CaSO 4;B 项中,低空臭氧浓度过大对人体有害;C 项中,酸雨的pH<5.6;D 项中,水体含磷量高,会导致水体富营养化。
选A 。
4.(2016·上海)二氧化硫能使溴水褪色,说明二氧化硫具有( ) A .还原性 B .氧化性 C .漂白性 D .酸性答案:A解析:本题考查二氧化硫的性质,意在考查考生的分析判断能力。
高考化学一轮课时作业:4.3硫及其重要化合物(含答案)

温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
课时提升作业(十二)(45分钟100分)一、选择题(本题包括10小题,每小题6分,共60分)1.工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为便于监控,实施环境保护,下列适合测定硫酸尾气SO2含量的试剂是( )A.品红溶液B.浓硝酸C.碘水、淀粉溶液D.以上都能2.下列说法中正确的是( )A.浓硫酸滴在润湿的蓝色石蕊试纸上,试纸先变红,然后褪色,最后变黑,说明浓硫酸具有酸性、氧化性和吸水性B.样品无明显现象出现白色沉淀,说明样品中含SC.常温下浓硫酸能用铁制容器盛装,说明浓硫酸与Fe不反应D.样品得到使澄清石灰水变浑浊的气体,说明样品中含S或HS3.(2018·红桥区模拟)近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万公顷计的森林衰败枯萎,大片土地沙漠化……将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因。
某研究小组研究某地硫酸型酸雨的形成,有人提出以下猜想:猜想一:SO2SO H2SO猜想二猜想三有关上述猜想,收集一定量该地区刚下的雨水进行实验,下列判断中错误的是( )A.若猜想一或猜想三正确,则该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成B.若存在猜想二的过程,则该雨水可能使品红溶液褪色C.若只存在猜想一的过程,则该雨水的pH随时间延长而增大D.上述任意一个猜想正确,该地区雨水的pH均小于5.64.为了除去CO2气体中的SO2气体,下列仪器和药品组合中合理的是( )仪器:①洗气瓶②干燥管药品:③固态生石灰④苏打溶液⑤小苏打溶液A.①⑤B.②⑤C.①③D.①④5.(2018·大连模拟)下列实验报告记录的实验现象正确的是( )6.向5 mL 18 mol·L-1的硫酸中加入足量铜片并加热使其充分反应,下列说法正确的是( )A.有0.09 mol的硫酸被还原B.有0.045 mol的硫酸被还原C.充分反应后体系无硫酸剩余D.消耗的铜的质量一定小于2.88 g7.SO2是常见的大气污染物之一,下列措施中能够减少SO2排放量的是( )①用天然气代替煤炭作民用燃料②使用水煤气或干馏煤气作燃料③硫酸厂使用V2O5作催化剂,加快SO2的转化速率④将块状煤粉碎,提高其燃烧效率⑤在煤中加入生石灰后燃烧⑥循环处理吸收塔放出的尾气A.①②③④⑤B.①③⑤⑥C.①②⑤⑥D.②③④⑥8.下列说法中错误的是( )A.Na2SO3与BaCl2溶液作用,有白色沉淀生成,加硝酸后沉淀不消失B.将SO2气体通入Ba(OH)2溶液中有白色沉淀生成C.将SO2气体通入BaCl2溶液中有白色沉淀生成D.将SO2气体通入硝酸酸化的BaCl2溶液中有白色沉淀生成9.下列实验操作能够达到实验目的的是( )A.实验室采用图①所示装置收集SO2B.可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱C.除去NaHCO3溶液中的Na2CO3可加入Ca(OH)2溶液后过滤D.称取0.40 g NaOH,放入100 mL容量瓶中,配制0.10 mol·L-1的NaOH溶液10.(能力挑战题)如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量的浓硫酸(以不接触纸条为准)。
高考理综高三一轮高考化学复习 第4章 第3讲 硫及其化合物

第3讲 硫及其化合物[考纲要求] 1.了解硫及其重要化合物的主要化学性质及应用。
2.了解硫的氧化物对大气的污染与防治。
考点一 硫单质的主要性质及应用1.硫元素的存在形态形态—⎪⎪⎪⎪—游离态—火山喷口附近或地壳的岩层里—化合态—主要以硫化物和硫酸盐的形式存在2.硫单质的物理性质俗称 颜色状态溶解性 水 酒精 CS 2 硫黄黄色晶体不溶微溶易溶3.从化合价的角度认识硫单质的化学性质S ⎩⎪⎨⎪⎧与金属反应⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫Cu :2Cu +S=====△Cu 2S Fe :Fe +S=====△FeS 表现氧化性与非金属反应⎩⎪⎨⎪⎧O 2:S +O 2=====点燃SO 2,表现还原性H 2:S +H 2=====△H 2S ,表现氧化性深度思考1.如何洗涤附着在试管内壁上的硫?答案 硫单质易溶于CS 2且可以与热的强碱液反应:3S +6NaOH=====△2Na 2S + Na 2SO 3+3H 2O 。
所以当试管壁上沾有单质硫时,可用CS 2或热强碱液洗涤。
2.哪些事实能说明硫的氧化性比Cl 2的氧化性弱?答案 ①与Fe 反应,产物中Fe 的价态不同:Fe +S=====△FeS(Fe 为+2价),2Fe +3Cl 2=====点燃2FeCl 3(Fe 为+3价)。
②利用置换反应:H 2S +Cl 2===S↓+2HCl 。
考点二 硫的氧化物——SO 2和SO 31.二氧化硫(SO 2) (1)物理性质颜色 气味 毒性 密度 溶解性 无色有刺激性气味有毒比空气大易溶于水(2)化学性质按要求完成下列方程式:特别提醒 中学常见的四大还原性离子 还原性:S 2->SO 2-3>I ->Fe 2+(1)易被空气中的O 2氧化而变质。
(2)易被KMnO 4(H +)、HNO 3、溴水、氯水、Fe 3+(不氧化Fe 2+)、漂白粉溶液等氧化。
(3)SO 2、H 2SO 3、Na 2SO 3均有强还原性,且还原性:SO 2-3>H 2SO 3>SO 2。
高考化学复习《硫及其化合物》专项综合练习及答案解析

高考化学复习《硫及其化合物》专项综合练习及答案解析一、高中化学硫及其化合物1.硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题。
(1)将H2S气体通入FeCl3溶液中,现象是_____________________________;反应的离子方程式是______________________________________。
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验。
实验操作实验现象实验1将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合无明显现象实验2将H2S通入Na2SO3溶液中未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀实验3将SO2通入Na2S溶液中有浅黄色沉淀产生已知:电离平衡常数:H2S K1 =1.3×10-7;K2 = 7.1×10-15H2SO3 K1 =1.7×10-2;K2 = 5.6×10-8①根据上述实验,可以得出结论:在_________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(选填编号)。
A. B. C.D.(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
要证明Na2SO3具有还原性,应选用的试剂有______________,看到的现象是____________________。
要证明Na2SO3具有氧化性,应选用的试剂有___________________,反应的离子方程式是________________________________。
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2。
现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_____________________。
高三化学一轮复习课时作业4:硫及其化合物
第3讲 硫及其化合物一、选择题1.以下关于硫及其化合物说法错误的是( )A .硫元素在自然界中既有游离态,又有化合态B .检查病人胃病所用的钡餐,既可以用BaSO 4,也可以用BaCO 3C .浓硫酸不可用来干燥H 2S 气体,因其具有强氧化性D .SO 2、SO 3都为酸性氧化物,都可与水反应生成相应酸 2.下列物质中,既能跟硫化氢反应,又能跟溴水反应的是( )①硫化钠溶液 ②二氧化硫饱和溶液 ③硫酸铜溶液 ④硝酸银溶液 ⑤亚硫酸钠溶液A .①②③④⑤B .①③⑤C .①②④⑤D .②④⑤3.(2010年惠州调研)下列实验报告记录的实验现象正确的是( )4.把SO 2通入Fe(NO 3)3溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入BaCl 2溶液,则会产生白色沉淀。
在上述一系列变化过程中,最终被还原了的是( )A .SO 2B .NO -3 C .Fe 3+D .Fe 2+5.为了除去CO 2气体中混有的SO 2气体,下列有关仪器和药品的组合中,合理的是( )①洗气瓶 ②干燥管 ③固态生石灰 ④苏打溶液 ⑤小苏打溶液 A .①⑤ B .②⑤ C .①③D .①④6.强热硫酸亚铁固体可发生如下反应:2FeSO 4=====高温Fe 2O 3+SO 2↑+SO 3↑,若将此反应生成的气体通入BaCl2溶液中,则()①析出BaSO3沉淀②析出BaSO4沉淀③逸出SO3气体④逸出SO2气体A.①②B.②④C.①③D.③④7.下列说法正确的是() A.SO2、NO x、CO2、固体颗粒物同为大气污染物B.SO2具有较强还原性,故不能用浓H2SO4干燥C.收集的酸雨在放置一段时间后pH会减小D.Cu与浓HNO3、浓H2SO4均可在常温下发生剧烈反应,且反应均放出大量的热8.(2010年苏锡常镇调研)下列各组物质中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中(如图所示),最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)()X Y ZA CO2SO2CaCl2B NH3SO2BaCl2C NH3CO2CaCl2D Cl2SO2BaCl29.下图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊。
高考化学一轮复习硫及其化合物(讲义及答案)及答案
高考化学一轮复习硫及其化合物(讲义及答案)及答案一、选择题1.下列实验中的颜色变化,与氧化还原反应无关的是实验操作现象A向盛FeSO4溶液的试管中滴入NaOH溶液产生白色沉淀,随后变为红褐色B向盛氯水的试管中滴入石蕊溶液溶液变红,随后迅速褪色C向盛品红溶液的试管中通入SO2品红溶液褪色D向装有NO的集气瓶中通入O2无色气体变为红棕色A.A B.B C.C D.D【答案】C【详解】A. 向盛FeSO4溶液的试管中滴入NaOH溶液,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,反应产生的Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化产生Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,因此观察到现象是:反应产生白色沉淀,随后沉淀由白色变为红褐色,A不符合题意;B. Cl2与水反应产生HCl、HClO,酸使紫色石蕊试液变为红色,而HClO具有强氧化性,能够将红色物质氧化变为无色,因此会看到溶液又由红色变为无色,与物质的氧化性有关,B 不符合题意;C. SO2具有漂白性,能够使品红溶液褪色,SO2的漂白是结合漂白,与氧化还原反应无关,C符合题意;D. NO气体是无色气体,遇O2二者反应产生红棕色的NO2气体,因此看到气体由无色变为红棕色,有元素化合价的变化,因此反应属于氧化还原反应,D不符合题意;故合理选项是C。
2.下列反应中,硫酸既表现了氧化性又表现了酸性的是()A.2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑B.2H2SO4(浓)+C CO2↑+2H2O+2SO2↑C.H2SO4(浓)+NaNO3NaHSO4+HNO3↑D.H2SO4+Na2SO3===Na2SO4+H2O+SO2↑【答案】A【详解】A.在2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑中,硫元素的化合价部分降低,部分不变,则浓硫酸既表现强氧化性又表现酸性,故A正确;B.在2H2SO4(浓)+C CO2↑+2H2O+2SO2↑中,硫元素的化合价全部降低,则浓硫酸只表现强氧化性,故B错误;C.在H2SO4(浓)+NaNO3NaHSO4+HNO3↑中,硫元素化合价没有改变,体现浓硫酸是难挥发性酸,故C错误;D.在H2SO4+Na2SO3===Na2SO4+H2O+SO2↑中,硫元素化合价没有改变,体现浓硫酸是强酸,故D错误;故答案为A。
完整版高考化学一轮复习硫及其化合物 复习题及答案
完整版高考化学一轮复习硫及其化合物复习题及答案一、选择题1.下列有关化学实验的说法正确的是A.SO2能使品红溶液、酸性KMnO4溶液褪色,加热后都能恢复原来颜色B.用铂丝蘸取某溶液在酒精灯的火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中含有K+,不含Na+C.用滴加BaCl2溶液观察有无白色沉淀生成的方法鉴别K2CO3和NaHCO3D.少量CO2通入CaCl2溶液能生成白色沉淀,CO2过量时白色沉淀溶解【答案】C【解析】【详解】A. SO2具有漂白性,能使品红溶液,但反应产生的无色物质不稳定,加热物质分解,又恢复原来的颜色;SO2具有还原剂,会将酸性KMnO4溶液还原而褪色,加热后不能恢复原来颜色,A错误;B. 用铂丝蘸取某溶液在酒精灯的火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中含有K+,不能说明是否含Na+,B错误;C. BaCl2与K2CO3反应产生BaCO3白色沉淀,与NaHCO3不能反应,因此可以用滴加BaCl2溶液观察有无白色沉淀生成的方法鉴别K2CO3和NaHCO3,C正确;D. CO2通入CaCl2溶液不能反应,无白色沉淀生成,D错误;故合理选项是C。
2.下列有关物质检验方法不合理的是( )A.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显血红色,该溶液中一定含有Fe2+B.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2C.检验亚硫酸盐是否已氧化变质,可滴入硝酸酸化的BaCl2溶液,再观察溶液是否有沉淀生成。
D.向某溶液中加入NaOH溶液产生红褐色沉淀,说明溶液中含有Fe3+【答案】C【详解】A.滴加KSCN溶液,溶液不变色,则不含铁离子,滴加氯水后溶液显血红色,可知亚铁离子被氧化为铁离子,则原溶液中一定含Fe2+,故A正确;B.KMnO4溶液与FeCl3溶液不发生反应,但与亚铁离子发生氧化还原反应,则用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2,故B正确;C.酸性条件下亚硫酸根离子被硝酸根离子氧化生成硫酸根离子,不能检验,应该滴入盐酸酸化的BaCl2溶液,再观察溶液是否有沉淀生成,故C错误;D.加NaOH溶液产生红褐色沉淀氢氧化铁,则说明溶液中含有Fe3+,故D正确;故选C。
北京市2017届高三化学一轮复习 3.4 铝及其化合物课时测试(含解析)
3-4铝及其化合物(测试时间:45分钟满分 100分)姓名:班级:得分:一、选择题(本题包括10小题,每小题5分,共50分)1.用含有少量Mg的Al片制取纯净的Al(OH)3,下列操作中最恰当的组合是()①加盐酸溶解②加NaOH溶液③过滤④加盐酸生成Al(OH)3⑤通入过量CO2生成Al(OH)3⑥加过量氨水生成Al(OH)3A.②③⑤③B.①③⑥③ C.①⑥③ D.②③④③【答案】A【解析】铝能和氢氧化钠反应,而镁不能,所以先用氢氧化钠溶解金属铝,生成偏铝酸钠,过滤后通入过量的二氧化碳,反应生成氢氧化铝沉淀,再过滤即可氢氧化铝,选A。
2.下列关于铝及其化合物的叙述正确的是()A.铝罐可久盛食醋 B.铝与Fe2O3发生铝热反应,反应后固体物质增重C.氢氧化铝可作胃酸的中和剂 D.明矾用作净水剂不涉及化学变化【答案】C【解析】A、食醋中含有醋酸,能与铝及氧化铝反应,因此铝罐不可久盛食醋,A错误;B、铝与氧化铁反应铝热反应生成氧化铝和铁,根据质量守恒定律可知反应后固体质量不变,B 错误;C、氢氧化铝能与盐酸反应,可作胃酸的中和剂,C正确;D、明矾溶于水电离出的铝离子水解生成氢氧化铝胶体而净水,涉及化学变化,D错误,答案选C。
3.AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,则消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系可用如图来表示,则下列关系图正确的是()【答案】B【解析】混合溶液中加入氢氧化钠,先生成氢氧化镁和氢氧化铝沉淀,后氢氧化铝沉淀溶解剩余氢氧化镁沉淀,剩余选B。
4.新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为:Mg17Al12+17H2=17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气。
下列说法正确的是()A.该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成B.该合金中含有离子键,铝元素呈正价C.1mol Mg17Al12完全吸氢后得到的Y与盐酸完全反应放出H2在标准状况下的体积为1164.8L D.合金的熔点高于金属镁、金属铝的熔点【答案】C【解析】A、镁和氮气反应,错误,不选A;B、合金是金属的混合物,不存在离子键,错误,不选B;C、:1mol Mg17Al12吸氢的反应为:Mg17Al12+17H2=17MgH2+12Al,即吸收了17摩尔的氢气, 1mol Mg17Al12相当于17摩尔镁和12摩尔铝,所以和盐酸反应生成生成的氢气为12+18=35摩尔,所以总共产生的氢气为35+17=52摩尔,其标准状况下的体积为52×22.4=1164.8L ,正确,选C;D、合金的熔点低于各成分金属的熔点,错误,不选D。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4-3 硫及其化合物(测试时间:45分钟满分 100分)姓名:班级:得分:一、选择题(本题包括10小题,每小题5分,共50分)1.浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是()A.酸性 B.脱水性 C.强氧化性 D.吸水性【答案】A【解析】浓硫酸和含有水分的蔗糖作用,被脱水后生成了黑色的炭(碳化),并会产生二氧化硫.反应过程分两步,浓硫酸吸收水,蔗糖(C12H22O11)在浓硫酸作用下脱水,生成碳和水(试验后蔗糖会变黑,黑的就是碳颗粒),这一过程表现了浓硫酸的吸水性和脱水性:第二步,脱水反应产生的大量热让浓硫酸和C发生反应生成二氧化碳和二氧化硫,这一过程表现了浓硫酸的强氧化性,答案为A。
2.探究浓硫酸和铜的反应,下列装置或操作正确的是()A.用装置甲进行铜和浓硫酸的反应 B.用装置乙收集二氧化硫并吸收尾气C.用装置丙稀释反应后的混合液 D.用装置丁测定余酸的浓度【答案】C【解析】A.铜和浓硫酸反应需要加热才可以进行,错误;B.二氧化硫密度比空气大,应该用向上排空气的方法收集,入气管应该伸入到试管底部,出气导管稍微露出橡胶塞即可,错误;C.只有浓硫酸可以与铜反应,稀硫酸不能与水反应,反应后的溶液中含有一定浓度的硫酸,根据硫酸的稀释原则:应该注酸入水,同时不断用玻璃棒搅拌,使热量不断扩散,正确;D.NaOH与未反应的硫酸及反应产生的CuSO4都能发生反应,故不能用该装置丁测定余酸的浓度,错误。
3.常温下单质硫主要以S8形式存在。
加热时,S8会转化为S6、S4、S2等。
当温度达到750℃时,硫蒸气主要以S2形式存在(占92%)。
下列说法中正确的是()A.S8转化为S6、S4、S2属于物理变化 B.不论哪种硫分子,完全燃烧时都生成SO2C.S8、S6、S4、S2均属于共价化合物 D.把硫单质在空气中加热到750℃即得S2【答案】B【解析】A、S8转化为S6、S4、S2有新物质生成,属于化学变化,错误,不选A;B、硫完全燃烧都生成二氧化硫,正确,选B;C、都是单质,错误,不选C;D、硫单质在空气中加热能和氧气反应,错误,不选D。
4.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是()A.洗气瓶中产生的沉淀是BaCO3B.在Z导管出来的气体中无CO2C.洗气瓶中产生的沉淀是BaSO3D.在Z导管口有红棕色气体出现【答案】【解析】碳和浓硫酸反应生成二氧化碳和二氧化硫气体,铜和硝酸反应生成二氧化氮气体,同时通入氯化钡溶液中,二氧化氮和水反应生成硝酸和一氧化氮,硝酸可以氧化二氧化硫生成硫酸,再与氯化钡反应生成硫酸钡沉淀,二氧化碳不反应,所以沉淀为硫酸钡,不是碳酸钡,导管出来的气体有二氧化碳和一氧化氮,一氧化氮遇到空气,和氧气反应生成红棕色的二氧化氮。
所以选D。
5.在BaCl2溶液中通入SO2,溶液仍澄清;若将BaCl2溶液分装两支试管,一支加稀HNO3溶液,另一支加NaOH溶液,然后再分别通入SO2,结果两支试管都有白色沉淀生成。
由此得出下列结论合理的是()A. SO2具有还原性和酸性 B.两支试管中生成的白色沉淀均是BaSO4C. BaCl2有两性 D.甲试管没有白色沉淀生成而乙试管有【答案】A【解析】A.二氧化硫可以与水反应生成亚硫酸,为酸性氧化物,具有酸性,化合价为+4价,还可以失去两个电子变成+6价,故具有还原性,故A正确;B.第一支试管里面生成沉淀为硫酸钡,第二支试管生成沉淀为亚硫酸钡,故B和D错误;C.氯化钡为强酸和强碱生成的盐,所以不具有两性,故C错误。
6.下列关于硫及含硫化合物的叙述正确的是()A.将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化B.SO2具有漂白性所以它能使碘的淀粉溶液由蓝色变为无色C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体D.SO2和Cl2分别与双氧水反应均产生O2【答案】C【解析】A.将Cu片置于浓H2SO4中,无明显现象,说明Cu与冷的浓硫酸不反应,故A错误;B.SO2具有还原性,在溶液中能被单质碘氧化成硫酸,所以它能使碘的淀粉溶液由蓝色变为无色,故B错误;C.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,发生氧化还原反应生成NO,在管口进一步被氧化成NO2,观察到红棕色气体,故C正确;D.SO2与双氧水反应生成硫酸,Cl2与双氧水反应均产生O2,故D错误。
故选C。
7.用如图所示实验装置进行物质性质的探究实验。
下列说法不合理的是()A.若品红溶液①褪色,则说明产物中含有SO2B.若溴水褪色,则说明SO2具有还原性C.若烧瓶中产生黄色浑浊和无色气泡,则说明Na2S203只作氧化剂D.若品红溶液②不褪色、Na2SiO3溶液中出现白色浑浊,则说明亚硫酸比碳酸的酸性强【答案】C【解析】SO2能使品红溶液褪色,故A正确;二氧化硫使溴水褪色表现还原性,故B正确;此反应中Na2S2O3既作氧化剂又作还原剂,故C错误;品红溶液②不褪色说明无二氧化硫,Na2SiO3溶液中出现白色浑浊说明通入了二氧化碳,依据强酸制弱酸的原理说明亚硫酸比碳酸的酸性强,故D正确。
8.下列试剂中可用于除去CO2中少量SO2杂质的有()①饱和NaHCO3溶液;②酸性KMnO4溶液;③溴水;④饱和Na2CO3溶液A、②③④B、①③④C、①②③D、①②④【答案】C【解析】①SO2可与饱和NaHCO3溶液反应生成CO2,但CO2不反应,可用于除杂,正确;②SO2可与酸性高锰酸钾反应产生硫酸,而二氧化碳不能发生反应,可除杂,正确;③SO2可与溴水反应产生硫酸,而二氧化碳不能发生反应,可除杂,正确;④二者均与碳酸钠反应,不能达到除杂的目的,错误;故选项C正确。
9.【2016届北京市石景山区高三下学期统一测试】下列解释事实的反应方程式正确的是()A.亚硫酸钠水溶液显碱性:SO32-+2H2O H2SO3+2OH-B.SO2的水溶液显酸性:SO2+H2O H2SO32H++ SO32-C.燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2 +O2 高温2CaSO4 +2CO2D .浓NaOH 溶液处理少量..二氧化硫:SO 2+ OH -=== HSO 3- 【答案】C【解析】A.多元弱酸的阴离子分布水解,离子方程式为SO 32-+H 2OHSO 3-+OH -、HSO 3-+H 2OH 2SO 3+OH -,A 项错误;B.亚硫酸是多元弱酸,分布电离,方程式为SO 2+H 2O H 2SO 3H ++ HSO 3-,B 项错误;C. 燃煤时加入石灰石减少SO 2排放,发生反应的方程式为2CaCO 3+2SO 2 +O 2 高温2CaSO 4 +2CO 2,C 项正确;D.少量的SO 2与NaOH 溶液反应生成Na 2SO 3和水,离子方程式为SO 2+2OH -===H 2O+SO 32-,D 项错误;答案选C 。
10.现有一Na 2SO 3、Na 2SO 4混合物样品ag ,为了测定其中Na 2SO 3的质量分数,设计了如下方案,其中明显不合理的是 ( )A .将样品配制成溶液V 1 L ,取其中25.00mL 恰好与V 2 mL 浓度为cmol/L 酸性KMnO 4溶液完全反应B .向样品中加足量H 2O 2,再加足量BaCl 2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bgC .将样品与足量稀盐酸充分反应后,再加入足量BaCl 2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c gD .将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHSO 3的洗气瓶、盛有浓H 2SO 4的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测定干燥管Ⅰ增重d g【答案】D【解析】A 、混合物中的Na 2SO 3与KMnO 4溶液发生氧化还原反应,根据得失电子守恒根据消耗标准KMnO 4溶液V 2 mL 计算Na 2SO 3的物质的量,再求其质量,可求出其中Na 2SO 3的质量分数,故A 正确;B 、H 2O 2将Na 2SO 3氧化成硫酸钠,再加足量BaCl 2溶液,过滤,称量其质量得出硫酸钡的物质的量即为233b mol ,再根据硫原子守恒,硫酸钡的物质的量就是Na 2SO 3、Na 2SO 4混合物总物质的量为233b mol ,再结合样品ag ,设Na 2SO 3为xmol ,Na 2SO 4为ymol 列方程组得126142233x y a b x y ++⎧⎪⎨⎪⎩==,可解出x ,再求其质量,可求出其中Na 2SO 3的质量分数,故B 正确;C 、样品与足量稀盐酸充分反应消耗了Na 2SO 3,再加入足量BaCl 2溶液与硫酸钠反应生成硫酸钡沉淀,过滤,将沉淀洗涤、干燥,称量其质量为c g 为硫酸钡质量,根据硫守恒可以计算出硫酸钠的质量为233c ×142g,Na 2SO 3的质量为a-233c ×142g,从而可求出其中Na 2SO 3的质量分数,故C 正确;D 、样品与足量稀盐酸充分反应将Na 2SO 3转化为二氧化硫气体,通过测定二氧化硫的质量来计算亚硫酸钠的质量,从而求出其中Na 2SO 3的质量分数,但与足量稀盐酸充分反应引入氯化氢气体,所以通过亚硫酸钠后二氧化硫气体增加测量不准确,故D 错误;故选D 。
二、非选择题(本题包括4小题,共50分)11.(10分)已知B 是化学中常见的金属单质,E 为地壳中含量最多的元素构成的单质,H 常 温下为无色液体,反应③、④是工业生产C 的重要反应,C 的浓溶液在加热时才与D 反应。
根据下列框图所示,试回答:(1)反应②③④⑤⑥中属于氧化还原反应的是__________;(2)反应①的化学方程式:____________________________________________ ;(3)写出C 的浓溶液在加热时与D 反应的化学方程式: ;(4)F 与A 、H 反应,当有7.8 g F 参加反应时转移的电子数目是 。
【答案】(1)②③⑤⑥(2分)(2)2CuSO 4 + 2H 2O2Cu + 2 H 2SO 4+O 2 ↑(3分) (3) Cu + 2 H 2SO 4(浓)CuSO 4+SO 2 ↑+ 2H 2O (3分)(4)6.02×1022(2分)【解析】E 为地壳中含有最多的元素构成的单质,为氧气,H 常温下为无色液体,是水,C 的浓溶液在加热时才能与D 反应,说明D 为铜,C 为硫酸,则A 为硫酸铜溶液,I 为二氧化硫。
K 为三氧化硫,B 是最忠诚化学中常见的金属单质,和氧气反应后与水与铜可以反应生成焰色反应为黄色的物质,说明B 为金属钠,则F 为过氧化钠,M 为硫酸钠,L 为氢氧化铜。
