蛋白互作几种方法比较
五种蛋白质互作技术

五种蛋白质互作技术介绍由于蛋白质在生物系统中发挥着重要的作用,研究蛋白质的相互作用对于理解生物学过程以及开发药物具有重要意义。
近年来,研究人员开发了许多蛋白质互作技术,用于识别、检测和研究蛋白质间的相互作用关系。
本文将介绍五种主要的蛋白质互作技术。
1. 酵母双杂交技术(Y2H)酵母双杂交技术是一种常用的蛋白质互作检测方法。
该技术利用酵母细胞内的功能酶来检测蛋白质间的相互作用。
其基本原理是将目标蛋白质与一个激活域和一个DNA结合域融合,形成Y2H信号报告蛋白。
当与目标蛋白质相互作用的蛋白质结合至Y2H信号报告蛋白上时,报告蛋白会激活酵母中的启动子,从而导致报告基因的表达。
2. 色谱共轭技术(CCT)色谱共轭技术是一种结合色谱和特定化合物的方法,用于分析和检测蛋白质间的相互作用。
该技术基于蛋白质与特定配体的结合,并利用色谱柱中的固定相与流动相的相互作用将蛋白质分离出来。
通过监测流出的溶液中的吸光度或荧光强度,可以确定蛋白质的浓度和结合状态。
3. 免疫共沉淀技术(IP)免疫共沉淀技术是一种通过免疫学方法来检测蛋白质间的相互作用关系的技术。
该技术首先需要对目标蛋白质进行免疫反应,然后利用抗体与蛋白质结合形成复合物。
通过添加沉淀试剂,使复合物沉淀下来。
最后,通过洗涤、离心等步骤,将复合物从混合液中分离出来,并用于后续的分析。
4. 双标记荧光共振能量转移技术(FRET)双标记荧光共振能量转移技术是一种通过检测荧光共振能量转移来研究蛋白质间的相互作用的技术。
该技术利用两种不同荧光染料标记待检测的蛋白质。
当这两种染料的光谱特性符合一定条件时,能量可以从一个染料转移到另一个染料,这种能量转移随着蛋白质间的相互作用而改变。
通过检测蛋白质标记物的荧光强度变化,可以确定蛋白质间的相互作用状态。
5. 表面等离子共振(SPR)技术表面等离子共振技术是一种通过检测蛋白质的结合与解离过程来研究蛋白质相互作用的技术。
该技术利用光学原理,将待检测蛋白质固定在金属薄膜表面。
研究蛋白质与蛋白质互作的方法

研究蛋白质与蛋白质互作的方法一、研究蛋白质与蛋白质互作的方法1. X-Ray凝聚态晶体学X-Ray凝聚态晶体学方法是用来测定单个蛋白质的空间结构的有效方法,它可以被用来研究蛋白质的互作。
X-Ray凝聚态晶体学方法使用X射线照射晶体,从而创建晶体中蛋白质的X射线衍射图案。
这些图案可以被用来确定蛋白质的空间结构,从而使研究人员能够理解晶格中存在的共振间隙(即两个作用蛋白质间的空间位置),从而提供有关拆分蛋白质之间的紧密互作的信息。
2. 蛋白质-蛋白质交叉反应蛋白质-蛋白质交叉反应是一种可以直接识别作用蛋白质之间的相互作用的技术,它通过检测不同的蛋白质之间的相互作用,从而提供有关他们之间互作的信息。
在蛋白质-蛋白质交叉反应中,首先需要将蛋白质层层复合,然后通过检测复合物的性质来测试蛋白质之间的相互作用。
3. 高通量蛋白质免疫小鼠高通量蛋白质免疫小鼠技术是一种比较新的研究蛋白质互作的技术。
它可以用来检测不同的蛋白质之间的相互作用,在高通量蛋白质免疫小鼠中,研究人员可以同时检测多个蛋白质之间的相互作用,从而提供更多的信息。
4. 免疫印迹免疫印迹技术是一种用来研究蛋白质互作的技术,它利用抗体来检测不同蛋白质之间的互作。
在免疫印迹技术中,研究人员将经过特殊处理的蛋白质溶液滴在特定的'膜'上,然后将抗体滴到它们上面,最后通过观察抗体与膜上的蛋白质之间的作用来判断蛋白质之间的互作情况。
5. 蛋白质-蛋白质结合实验蛋白质-蛋白质结合实验是用来研究蛋白质之间的相互作用的有效的方法,它可以用来研究某一特定蛋白质与其他蛋白质的结合关系。
它以一种可以检测不同蛋白质之间的结合关系的方式,来推断蛋白质之间的相互作用。
蛋白互作

蛋白互作的研究一直以来都受到重视,是研究细胞信号传导等非常重要的方面。
我就我现在做过的方法给大家介绍一下,抛砖引玉了,大家多补充纠正一下吧常用的体外互作研究方法:1、酵母双杂交(yeast two-hybrid,Y2h)酵母双杂交作为最经典的蛋白互作方法一直沿用至今,并且仍然保持着自己的优势。
酵母双杂交系统能在体内测定蛋白质的结合作用,具有高度敏感性。
酵母双杂交系统的最主要的应用是快速、直接分析已知蛋白之间的相互作用及分离新的与已知蛋白作用的配体及其编码基因。
优点在于:优点: ⑴作用信号是在融合基因表达后,在细胞内重建转录因子的作用而给出的,省去了纯化蛋白质的繁琐步骤。
⑵检测在活细胞内进行,可以在一定程度上代表细胞内的真实情况。
⑶检测的结果可以是基因表达产物的积累效应,因而可检测存在于蛋白质之间的微弱的或暂时的相互作用。
⑷酵母双杂交系统可采用不同组织、器官、细胞类型和分化时期材料构建cDNA文库,能分析细胞浆、细胞核及膜结合蛋白等多种不同亚细胞部位及功能的蛋白。
但是酵母双杂交有自己的缺点:⑴双杂交系统分析蛋白间的相互作用定位于细胞核内,而许多蛋白间的相互作用依赖于翻译后加工如糖基化、二硫键形成等,这些反应在核内无法进行。
另外有些蛋白的正确折叠和功能有赖于其他非酵母蛋白的辅助,这限制了某些细胞外蛋白和细胞膜受体蛋白等的研究。
⑵酵母双杂交系统的一个重要的问题是"假阳性"。
由于某些蛋白本身具有激活转录功能或在酵母中表达时发挥转录激活作用,使DNA结合结构域杂交蛋白在无特异激活结构域的情况下可激活转录。
另外某些蛋白表面含有对多种蛋白质的低亲和力区域,能与其他蛋白形成稳定的复合物,从而引起报告基因的表达,产生"假阳性"结果。
“假阳性”对策:即使根据严格的对照实验证明确实发生了蛋白间的相互作用,还应对以下方面进行分析:(1)这种相互作用是否会在细胞内自然发生,即这一对蛋白在细胞的正常生命活动中是否会在同一时间表达且定位在同一区域。
检测蛋白互作的方法

检测蛋白互作的方法有多种,其中包括酵母双杂交技术、免疫共沉淀、GST-pull down实验等。
这些方法都可以用来研究蛋白之间的相互作用,并有助于进一步了解蛋白质的功能和机制。
1. 酵母双杂交技术:这是一种在酵母细胞中检测蛋白互作的方法,主要通过将两个蛋白的基因分别与报告基因的转录激活域融合,在两个蛋白相互作用时,报告基因就会被激活,从而得到蛋白互作的结果。
2. 免疫共沉淀:这是一种通过抗体和抗原之间的专一性作用来研究蛋白互作的方法。
将其中一个蛋白进行免疫沉淀后,与其互作的蛋白也会被沉淀下来,然后通过Western blot等技术检测到被沉淀的蛋白,从而确定两者之间的相互作用。
3. GST-pull down实验:这是一种体外检测蛋白互作的方法,通过将目标蛋白与谷胱甘肽亲和树脂结合,再与待检测的蛋白混合,如果两者之间有相互作用,目标蛋白就会与待检测蛋白结合并被吸附在树脂上,最后通过Western blot等技术检测到结合的蛋白,从而证明两者之间的相互作用。
蛋白互作常用的研究方法
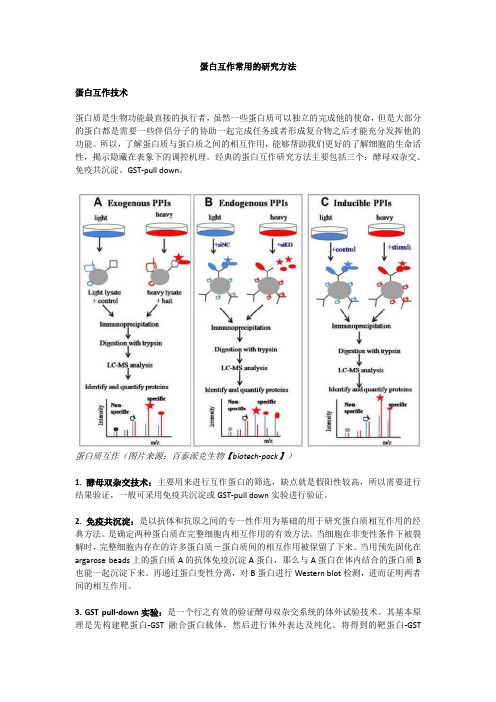
蛋白互作常用的研究方法蛋白互作技术蛋白质是生物功能最直接的执行者,虽然一些蛋白质可以独立的完成他的使命,但是大部分的蛋白都是需要一些伴侣分子的协助一起完成任务或者形成复合物之后才能充分发挥他的功能。
所以,了解蛋白质与蛋白质之间的相互作用,能够帮助我们更好的了解细胞的生命活性,揭示隐藏在表象下的调控机理。
经典的蛋白互作研究方法主要包括三个:酵母双杂交、免疫共沉淀、GST-pull down。
蛋白质互作(图片来源:百泰派克生物【biotech-pack】)1. 酵母双杂交技术:主要用来进行互作蛋白的筛选,缺点就是假阳性较高,所以需要进行结果验证,一般可采用免疫共沉淀或GST-pull down实验进行验证。
2. 免疫共沉淀:是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。
是确定两种蛋白质在完整细胞内相互作用的有效方法。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。
当用预先固化在argarose beads上的蛋白质A的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B 也能一起沉淀下来。
再通过蛋白变性分离,对B蛋白进行Western blot检测,进而证明两者间的相互作用。
3. GST pull-down实验:是一个行之有效的验证酵母双杂交系统的体外试验技术。
其基本原理是先构建靶蛋白-GST融合蛋白载体,然后进行体外表达及纯化。
将得到的靶蛋白-GST(Glutathione-S-transferase谷胱苷肽巯基转移酶)融合蛋白亲和固化在谷胱甘肽亲和树脂上,充当一种“诱饵蛋白”,然后将目的蛋白溶液过柱,可从中捕获与之相互作用的蛋白,将目的蛋白洗脱下来,通过SDS-PAGE电泳及western blot分析证实两种蛋白间的相互作用。
以上三种方法是比较经典的研究筛选和验证蛋白互作关系的方法。
但是也存在一定局限性。
酵母双杂交可以大规模的筛选未知的互作蛋白,但是假阳性高,免疫共沉淀及pull down只是对已知的蛋白互作关系进行验证,不能发现新的未知蛋白。
蛋白互作常用的研究方法

蛋白互作常用的研究方法
蛋白质互作常用的研究方法包括酵母双杂交技术、免疫共沉淀和GST pull-down实验。
1. 酵母双杂交技术:主要用来进行互作蛋白的筛选,缺点就是假阳性较高,所以需要进行结果验证,一般可采用免疫共沉淀或GST-pull down实验进
行验证。
2. 免疫共沉淀:是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。
是确定两种蛋白质在完整细胞内相互作用的有效方法。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。
当用预先固化在argarose beads上的蛋白质A 的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B也能一起沉
淀下来。
再通过蛋白变性分离,对B蛋白进行Western blot检测,进而证明两者间的相互作用。
3. GST pull-down实验:是一个行之有效的验证酵母双杂交系统的体外试
验技术。
其基本原理是先构建靶蛋白-GST融合蛋白载体,然后进行体外表
达及纯化。
但是也存在一定局限性。
这些方法各有优缺点,应根据研究目的和具体情况选择合适的方法。
蛋白互作实验方法
蛋白互作实验方法蛋白互作是指蛋白质之间通过物理或化学相互作用形成复合物的过程。
了解蛋白互作的机制对于揭示细胞内不同蛋白之间的功能关系和信号传递网络具有重要意义。
本文将介绍几种常用的蛋白互作实验方法。
1. 免疫共沉淀法(Co-Immunoprecipitation, Co-IP)免疫共沉淀法是一种常用的检测蛋白互作的方法。
其基本步骤为首先选择目标蛋白A,通过特异性抗体结合于固相支持上(如Protein A/G琼脂糖),形成免疫寡聚体;然后用该寡聚体与细胞提取物混合,使抗体与目标蛋白A结合;接下来通过离心将复合物沉淀下来,洗脱杂质,最后将沉淀复合物进行热解、电泳分离和Western blot进行检测。
如结果显示目标蛋白B出现在沉淀物中,则可以判定蛋白A与蛋白B存在互作关系。
2. 酵母双杂交实验(Yeast Two-Hybrid, Y2H)酵母双杂交实验是一种常用的高通量筛选蛋白互作的方法。
其基本原理是将目标蛋白A与一个转录因子的DNA结合域(DBD)融合,形成A-DNA融合蛋白;同时将潜在互作蛋白B与一个激活因子的激活域(AD)融合,形成B-AD融合蛋白。
当A-DNA与B-AD融合蛋白发生互作后,激活域和DNA结合域相互接触,促使报告基因的表达,从而在选择培养基上形成特定的生长。
通过这种方式,可以大规模筛选蛋白互作。
3. 荧光共定位实验荧光共定位实验是一种直观、快速的检测蛋白互作的方法。
通过融合兴趣蛋白A 与绿色荧光蛋白(GFP)或红色荧光蛋白(mCherry)等荧光标记蛋白,将其表达于细胞中。
如果蛋白A与蛋白B发生互作,并且它们定位于细胞的相同或相邻位置,那么在显微镜下观察到的荧光信号将重叠出现。
通过这种方法,可以直观地观察蛋白互作的情况。
4. 基于亲和柱的互作分析基于亲和柱的互作分析是一种高效的检测蛋白互作的方法。
亲和柱是一种包含特定亲和配体(如金属离子、抗原-抗体、蛋白A/G等)的柱状介质。
首先将一个潜在的互作蛋白A融合到亲和配体上,使其固定在亲和柱上;然后将细胞提取物加载到亲和柱上,使蛋白A能与目标蛋白B结合;接下来通过洗脱步骤将非特异性结合的蛋白去除,最后用适当的方法检测目标蛋白B的存在。
蛋白互作技术
蛋白互作技术蛋白互作技术是一组用于研究蛋白质之间相互作用的实验和分析方法。
这些方法可以帮助科学家们了解蛋白质在细胞中的功能、信号传导、代谢途径等方面的机制。
以下是一些常见的蛋白互作技术:1. 酵母双杂交法(Yeast Two-Hybrid, Y2H):这是一种常用的高通量蛋白互作筛选方法。
该技术利用酵母细胞内的转录激活域(activation domain)和DNA结合域(DNA-binding domain)的相互作用来检测蛋白质蛋白质相互作用。
2. 免疫共沉淀法(Co-Immunoprecipitation, Co-IP):这种方法利用抗体将目标蛋白质与其相互作用的蛋白质一起沉淀下来,以研究它们之间的相互作用。
3. 质谱法(Mass Spectrometry, MS):MS技术可以用于鉴定蛋白质复合物中的成员。
典型的方法包括液相色谱串联质谱(LC-MS/MS)。
4. 表面等离子体共振法(Surface Plasmon Resonance, SPR):SPR技术可以实时监测生物分子之间的相互作用,包括蛋白质与蛋白质之间的相互作用。
5. 蛋白质片段互作法(Protein Fragment Complementation Assay, PCA):这种方法通过将蛋白质分割成两个片段,然后将这些片段连接到蛋白质感兴趣的两个互补位置上,观察是否形成功能性蛋白质复合物。
1/ 26. 拉曼光谱法(Raman Spectroscopy):这是一种基于散射光的技术,可用于研究蛋白质之间的相互作用以及蛋白质结构的变化。
这些技术的选择通常取决于研究者的具体研究问题、目标蛋白质的性质以及实验室可用的设备和资源。
多种方法的综合应用有助于全面理解蛋白质相互作用网络。
2/ 2。
蛋白质相互作用研究方法
蛋白质相互作用研究方法蛋白质相互作用是指两个或多个蛋白质之间的相互作用和相互调节。
研究蛋白质相互作用的方法有很多种,下面将介绍其中一些常用的方法。
1. 酵母双杂交检测(Y2H):该方法是通过基因转录和细胞生理过程来检测蛋白质相互作用。
该方法的基本原理是将感兴趣的两个蛋白质分别连接到酵母细胞中的转录因子的DNA结合结构域和激活结构域,当这两个蛋白质发生相互作用时,转录因子被激活,从而触发报告基因的表达。
通过检测报告基因的表达水平来确定蛋白质之间的相互作用程度。
2. 免疫共沉淀:该方法是利用两个蛋白质之间的特异性相互作用来检测和分离它们。
首先,在一个蛋白质中引入一个标签,比如His标签。
然后,将该蛋白质在体外与另外一个感兴趣的蛋白质一起孵育,使它们发生相互作用。
最后,利用特定的抗体识别标签,并用亲和树脂或磁珠来沉淀包含这些标签的复合物。
通过酶解、电泳等方法对复合物进行分析,可以确定两个蛋白质之间的相互作用。
3. 光学方法:如可以利用荧光共振能量转移(FRET)技术来研究蛋白质相互作用。
该技术基于两个发射荧光染料的距离变化会改变吸光度的原理,当两个蛋白质相互作用时,可以通过激发一个染料并检测另一个染料发射的荧光信号来确定它们之间的相互作用程度。
4. 质谱法:质谱法是一种广泛应用的蛋白质相互作用研究方法。
其中,串联质谱法(MS/MS)可以用来鉴定蛋白质复合物中的组分。
根据质谱分析的结果,可以确定两个蛋白质之间的相互作用和结合部位等信息。
此外,还有其他一些方法如共结晶、核磁共振、冷冻电镜等,可以对蛋白质相互作用进行研究。
这些方法的选择取决于研究者所关注的蛋白质特性、相互作用类型以及研究目的等因素。
需要注意的是,以上方法在研究蛋白质相互作用时有其局限性。
比如,一些方法需要在体外进行,无法反映细胞内环境;一些方法可能对于某些蛋白质的研究不适用;一些方法可能存在假阳性和假阴性等问题。
因此,在选择研究方法时,需要综合考虑各种因素,并采取多重方法相互印证,以获得准确可靠的结果。
蛋白质的相互作用研究方法
蛋白质的相互作用研究方法
蛋白质的相互作用研究方法可以分为以下几种:
1. 蛋白质互作筛选方法:包括酵母双杂交、蛋白质片段互作筛选、蛋白质互作文库筛选等。
这些方法通过检测蛋白质与其他蛋白质之间的相互作用,从而发现可能存在的相互作用蛋白质对。
2. 免疫共沉淀(IP):通过特定抗体与目标蛋白质发生反应,将其与其他相互作用蛋白质一起沉淀下来,然后通过质谱分析等技术鉴定这些共沉淀蛋白质的身份。
3. 荧光共振能量转移(FRET):通过标记在两个相互作用蛋白质上的荧光分子(供体和受体)之间的能量转移来检测蛋白质相互作用。
当供体与受体之间的距离在10-100埃范围内时,能量转移效率会增加。
4. 利用带电荷的染料分析:通过交联反应将具有不同电荷的染料引入到相互作用的蛋白质上,然后通过凝胶电泳或质谱分析等技术来鉴定交联蛋白质对。
5. 表面等离子体共振(SPR):利用表面等离子体共振仪器,将一种蛋白质固定在芯片上,然后将另一种蛋白质溶液通过芯片,通过检测光信号的变化来确定是否存在相互作用。
6. 核磁共振(NMR):利用蛋白质溶液中的核磁共振现象,鉴定蛋白质的三维结
构以及与其他蛋白质之间的相互作用。
以上是常见的蛋白质相互作用研究方法,不同的方法适用于不同的实验需求和研究目的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白互作几种方法比较
IP与CO-IP的关系:
IP就是用抗体把你要的蛋白免疫沉淀下来,然后去检测它。
例如蛋白A在细胞内的蛋白量不同,或者有着不同的翻译后修饰,这是可以用A蛋白的抗体+prorein A beads来IP,从细胞中把A拉下,再用特异的抗体(如磷酸化,泛素化抗体)来检测A的变化。
co-ip的原理和IP是一样的,但是它检测的是和A相互作用的蛋白,也就是说用A的抗体把A拉下来后,用和A相互作用蛋白B的抗体去检测,来证明A和B之间的相互作用。
就是说只要用A的抗体把B拉下来就能证明A和B之间有相互作用。
这种关系只能说是存在相互作用,但这种相互作用并不能确定是直接的还是间接的,也就是所也许是A与c作用,而B也和C作用,这样,用A的抗体可以把C拉下来,但同时C 又把B也拉下来了。
要确定A和B之间直接的相互作用,你可以做体外的GST PULL DOWN实验。
GST pull-down实验是一个行之有效的验证酵母双杂交系统的体外试验技术,近年来越来越受到广大学者的青睐。
其基本原理是将靶蛋白-GST融合蛋白亲和固化在谷胱甘肽亲和树脂上,作为与目的蛋白亲和的支撑物,充当一种“诱饵蛋白”,目的蛋白溶液过柱,可从中捕获与之相互作用的“捕获蛋白”(目的蛋白),洗脱结合物后通过SDS-PAGE电泳分析,从而证实两种蛋白间的相互作用或筛选相应的目的蛋白,“诱饵蛋白”和“捕获蛋白”均可通过细胞裂解物、纯化的蛋白、表达系统以及体外转录翻译系统等方法获得。
此方法简单易行,操作方便。
(GST:谷胱甘肽巯基转移酶(glutathione S-transferase))
GST pull down 和 Coim munoprecipitation关系问题
啥叫GST pull down , Coimmunoprecipitation呢? 学过生物的地球人都知道. 这是研究蛋白质相互作用的两种方法。
简单通俗的打个比方, GST pull down 就像把一男一女放在孤岛上, 除非蜂马牛不相及, 同类男女之间该发生的一般都会发生. 这种关系是直接的。
Coimmunoprecipitation, (Co-IP) 则是, 众里寻他千百度, 那人却在灯火阑珊处. 研究一群男女间的自由恋爱问题. 一个蛋白在本性上可以同时喜欢很多其他的蛋白, 但是最终还是会有个最喜欢的, 而在Co-ip中就能发现他的喜好. 这种关系可能是直接的, 也可能是间接的, 是更接近于东方的。
两个蛋白可能在生物体内素昧平生, 一个在头上, 一个在脚上. 也许两者之间或许很合辙, 生来却天各一方. 在GST pull down 的环境中, 他们可能相遇, 吸引在一起. 但在现实生活中, 这样的浪漫关系可能是不现实的. 脚上的蛋白若是跑到头上与情人幽会, 人就要出大问题. 还有的情况是, 两个蛋白即使独处在一起, 也可能不会互相吸引, 但是到了生物系统的大环境中, 在其他蛋白, 各种因素适当的辅助下, 却有可能形成稳定的搭档关系。
免疫共沉淀实验由于在非变性实验条件性进行,这样蛋白质之间的天然相互作用得以很大程度的保留,因此可以比较真实的反应蛋白质之间的相互作用。
但也基于此点,免疫共沉淀并不能显示蛋白质之间的相互作用是直接还是间接的,因为通过目的蛋白抗体共沉淀下来的是一个蛋白复合物,而不仅仅是和目的蛋白直接相互作用的蛋白。
而GST-Pull down实验可以通过体外实验条件,去除其它蛋白的影响,从而确定目的蛋白和待检测蛋白是否可以发生直接相互作用。
做蛋白质相互作用的三个经典方法,也可以说是逐步严谨的方法。
凝胶迁移或电泳迁移率实验(EMSA)
凝胶迁移或电泳迁移率实验(EMSA, electrophoretic mobility shift assay)是一种研究DNA结合蛋白和其相关的DNA结合序列相互作用的技术,可用于定性和定量分析。
这一技术最初用于研究DNA结合蛋白,目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用。
通常将纯化的蛋白和细胞粗提液和32P同位素标记的DNA或RNA探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
DNA-复合物或RNA-复合物比非结合的探针移动得慢。
同位素标记的探针依研究的结合蛋白的不同,可是双链或者是单链。
当检测如转录调控因子一类的DNA结合蛋白,可用纯化蛋白,部分纯化蛋白,或核细胞抽提液。
在检测RNA结合蛋白时,依据目的RNA结合蛋白的位置,可用纯化或部分纯化的蛋白,也可用核或胞质细胞抽提液。
竞争实验中采用含蛋白结合序列的DNA或RNA片段和寡核苷酸片段(特异),和其它非相关的片段(非特异),来确定DNA或RNA结合蛋白的特异性。
在竞争的特异和非特异片段的存在下,依据复合物的特点和强度来确定特异结合。
GST亲和层析和GST Pull-down方法
此方法的基本原理是:利用重组技术将探针蛋白与GST(Glutathione S transferase)融合,融合蛋白通过GST与固相化在载体上的GTH(Glutathione)亲和结合。
因此,当与融合蛋白有相互作用的蛋白通过层析柱时或与此固相复合物混合时就可被吸附而分离。
在病毒受体研究中,融合蛋白通常设计为病毒吸附蛋白(VAP)。
这方面成功的例子有HBV。
具体做法如下:将GST-融合探针蛋白(VAP)和GTH-Sepharose制成亲和层析柱,然后待分析的蛋白质混合液流经亲和层析柱,梯度洗脱,分离、收集各蛋白组分,这称为GST亲和柱层析(GST affinity column chromatography)。
如果一开始待检蛋白就和GST- 融合探针蛋白与GTH-Sepharose一起共同孵育,经离心收集洗脱复合物和洗涤后,再加入过量GTH获得相互作用蛋白的复合物,那么这种方法则称为GST pull down。
GST亲和层析及相应的GST Pull-down方法的优点是敏感,对混合物中的所有蛋白均“一视同仁”,也可用于受体功能的鉴定。
缺点是GST有可能影响融合蛋白的空间结构,另外,蛋白质浓度对实验也有一定影响。
