化工原理 第九章3
化工原理第九章 吸收

p
* A
cA H
或
cA* HpA
H——溶解度系数 ,单位:kmol/m3·Pa或kmol/m3·atm。
H是温度的函数,H值随温度升高而减小。
易溶气体H值大,难溶气体H值小。
溶解度系数H与亨利系数E间的关系
pA*
cA H
,
pA*
ExA, xA
cA c
E
c H
设溶液的密度为 kg / m3,浓度为 c kmol / m3 ,则
20.6.19
气相: 液相:
yA
nA n
xA
nA n
yA yB yN 1 xA xB xN 1
质量分数与摩尔分数的关系:
xA
nA n
mw A
/ MA
mw A / M A mw B / MB mw N
/ MN
wA/M A
wA/M A wB/MB wN/M N
20.6.19
第二节 气液相平衡
一、气体的溶解度 二、亨利定律 三、气液相平衡与吸收过程 的关系
20.6.19
一、气体的溶解度
1、气体在液体中溶解度的概念
气体在液相中的溶解度 :气体在液体中的饱和浓度 cA*
表明一定条件下吸收过程可能达到的极限程度。
2、溶解度曲线
对于单组分物理吸收,由相律知
f c 2 322 3
2、质量比与摩尔比
质量比:混合物中某组分A的质量与惰性组分B
(不参加传质的组分)的质量之比。 wA mA mB
摩尔比:混合物中某组分的摩尔数与惰性组分摩 尔数之比。
气相:
YA
nA nB
液相: X A
nA nB
20.6.19
化工原理-第九章-液体精馏

化⼯原理-第九章-液体精馏化⼯原理-第九章-液体精馏(⼀)测试⼀⼀.选择题1.蒸馏是利⽤各组分()不同的特性实现分离的⽬的。
CA 溶解度;B 等规度;C 挥发度;D 调和度。
2.在⼆元混合液中,沸点低的组分称为()组分。
CA 可挥发;B 不挥发;C 易挥发;D 难挥发。
3.()是保证精馏过程连续稳定操作的必不可少的条件之⼀。
AA 液相回流;B 进料;C 侧线抽出;D 产品提纯。
4.在()中溶液部分⽓化⽽产⽣上升蒸⽓,是精馏得以连续稳定操作的⼀个必不可少条件。
CA 冷凝器;B 蒸发器;C 再沸器;D 换热器。
5.再沸器的作⽤是提供⼀定量的()流。
DA 上升物料;B 上升组分;C 上升产品;D 上升蒸⽓。
6.冷凝器的作⽤是提供()产品及保证有适宜的液相回流。
BA 塔顶⽓相;B 塔顶液相;C 塔底⽓相;D 塔底液相。
7.冷凝器的作⽤是提供塔顶液相产品及保证有适宜的()回流。
BA ⽓相;B 液相;C 固相;D 混合相。
8.在精馏塔中,原料液进⼊的那层板称为()。
CA 浮阀板;B 喷射板;C 加料板;D 分离板。
9.在精馏塔中,加料板以下的塔段(包括加料板)称为()。
BA 精馏段;B 提馏段;C 进料段;D 混合段。
10.某⼆元混合物,进料量为100 kmol/h ,x F = 0.6,要求塔顶x D 不⼩于0.9,则塔顶最⼤产量为()。
(则W=0) BA 60 kmol/h ;B 66.7 kmol/h ;C 90 kmol/h ;D 100 kmol/h 。
11.精馏分离某⼆元混合物,规定分离要求为D x 、w x 。
如进料分别为1F x 、2F x 时,其相应的最⼩回流⽐分别为1min R 、2min R 。
当21F F x x >时,则()。
AA .2min 1min R R <;B .2min 1min R R =;C .2min 1min R R >;D .min R 的⼤⼩⽆法确定12.精馏的操作线为直线,主要是因为()。
化工原理第9章

反应速率的影响愈大;反应转化率愈高,反应混
合物中残余反应物浓度愈小,返混对反应速率的
影响也愈大。
5-2 以产率和选择性为优化目标
对于复杂反应以产率和选择性为优化目标, 应考虑物料返混对于反应产物分布的影响。 • 平行反应过程优化
• 串连反应过程优化
A R S
k1 k2
反应器选型
i 1
VR ,t VR ,t qV , 0 c A, 0
i 1 i 1
n
• 多釜串联反应器的总有效容积VR,t的逐级解析计算
过程也可以在坐标图上进行 。
§5 均相反应过程优化与反应器选择
5-1 以生产强度为优化目标
生产强度是指单位容积反应器的生产能力。 当处理物料量和要求达到的最终转化率一定时, 对于不同型式的反应器,所需容积的大小,也表 明了该反应器生产强度的大小。
• 活化能较大、反应温度较高的化学反应,对温度十分敏感, 为了强化传热,减少温差,宜采用全混流反应器。 • 当反应物浓度较高易发生剧烈反应时,宜采用全混流反应 器。 • 反应速率较慢、反应时间较长的化学反应,宜选用间歇操 作搅拌釜或连续操作搅拌釜反应器。 • 气相反应多采用管式反应器。 • 高压反应宜采用管式反应器(细长设备耐压高)。 • 在高温条件下进行的强吸热反应(如裂解),通常采用管 式反应器。
• 反应器有效容积VR:
日处理量 VR (t t ') 24
V VR
• 实际所需反应器体积
易起泡和在沸腾下操作的液体: =0.40.6; 不易起泡和不在沸腾条件下操作的液体: =0.70.85
§2 连续操作管式反应器
• 物料中的所有流体微元在反应器内以相同的速度、
化工原理_第九章-吸收

二、吸收速率方程
假设气液相平衡关系满足亨利定律,则
气膜 液膜
cL HpL
pG
组成
又根据双膜模型的假定,可知 ci Hpi
pi
传质方向
NA
pG
1
pi
ci
cL 1
pi
1
pL
pG
p
L
11
kG
kL
HkL kG HkL
Ci
气相主体
G
L
液相主体
p
L
CL
z
pG
目录
第九章 吸收
第一节 概述
一、什么是吸收 二、吸收的目的 三、吸收分类 四、吸收设备及流程 五、吸收剂的选择
1
《化工原理》电子教案/目录
目录
第九章 吸收
第二节 气液相平衡
一、溶解度及溶解度曲线 二、亨利定律
第三节 吸收过程模型及吸收速率方程
一、双膜模型 二、吸收速率方程
第四节 二元低浓气体吸收(或脱吸)的计算
pi
传质方向
Ci
液相主体
G
L
距离
双膜模型
CL
z
22/91
二、吸收速率方程
液膜控制 ----如图,液膜较厚,气膜较薄,即阻力主要由液 膜决定。
难溶体系属于这种情况。
1
1
k x mk y
1 H
kL
kG
气膜 液膜
pG
组成
故 Kx kx KL kL
pi Ci
气相主体
1 1 1 Kx kx kym
p
A
化工原理复习必看 第9章_液体精馏(定稿)
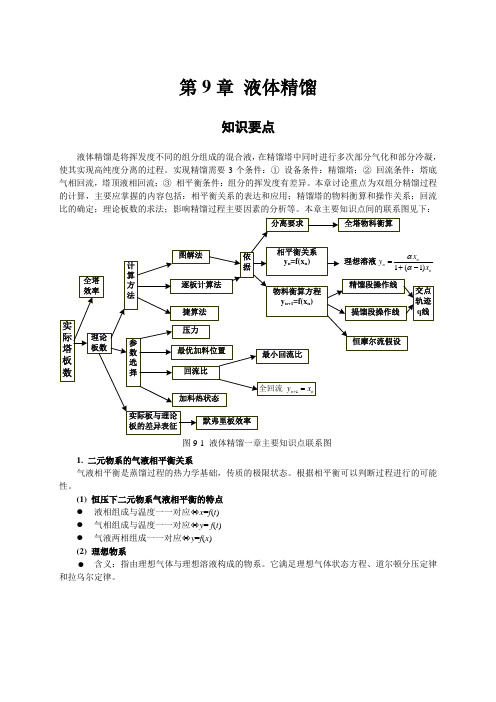
第9章液体精馏知识要点液体精馏是将挥发度不同的组分组成的混合液,在精馏塔中同时进行多次部分气化和部分冷凝,使其实现高纯度分离的过程。
实现精馏需要3个条件:①设备条件:精馏塔;②回流条件:塔底气相回流,塔顶液相回流;③相平衡条件:组分的挥发度有差异。
本章讨论重点为双组分精馏过程的计算,主要应掌握的内容包括:相平衡关系的表达和应用;精馏塔的物料衡算和操作关系;回流比的确定;理论板数的求法;影响精馏过程主要因素的分析等。
本章主要知识点间的联系图见下:图9-1 液体精馏一章主要知识点联系图1. 二元物系的气液相平衡关系气液相平衡是蒸馏过程的热力学基础,传质的极限状态。
根据相平衡可以判断过程进行的可能性。
(1) 恒压下二元物系气液相平衡的特点●液相组成与温度一一对应⇔x=f(t)●气相组成与温度一一对应⇔y= f(t)●气液两相组成一一对应⇔y=f(x)(2) 理想物系含义:指由理想气体与理想溶液构成的物系。
它满足理想气体状态方程、道尔顿分压定律和拉乌尔定律。
拉乌尔定律相对挥发度/1/1A A A B B B p x y xp x y xναν-===⋅- (9-1)11y xy xα-=⋅- (气相服从道尔顿分压定律) 相对挥发度α愈是大于1 ,则y 愈是大于x ,物系愈容易分离。
● 泡点方程x -toB ooA Bp p x p p -=- (9-2) ● 露点方程y -to A BA A Bp p p y p p p -=⋅- (9-3) ● 相平衡方程y-x()11xy xαα=+- (9-4)● t -y (x )相图两端点A 与B :端点A 代表纯易挥发组分A(x =1),端点B 代表纯难挥发组分B(x =0)。
两线:t -x 线为泡点线,泡点与组成x 有关;t-y 线为露点线,露点与组成y 有关。
3区:t -x 线以下为过冷液体区;t-y 线以上为过热蒸汽区;在t-x 与t -y 线之间的区域为气液共存区,只有体系落在气液共存区才能实现一定程度的分离。
化工原理第九章

cH=cg+cwH
(9-7
式中cH——湿空气的比热容,kJ/(kg绝干空气·℃
cg——绝干空气的比热容,kJ/(kg绝干空气·℃
cw——水汽的比热容,kJ/(kg水汽·℃)。
第二节 湿空气的性质及湿度图
在常用的温度范围内,cg、cw可按常数处理,cg=1.01kJ/(kg绝 干空气·℃),cw=1.88kJ/(kg水汽·℃)。将其代入式(9-7),得
化工原理
第九章 干 燥
概述 湿空气的性质及湿度图 干燥过程中的物料衡算和热量衡算 干燥过程中的平衡关系与速率关系 干燥设备
第九章 干 燥
知识目标
掌握湿空气各性质参数的定义及其计算,H-I图的结构 及应用;干燥系统水分蒸发量、空气消耗量、蒸气消耗量、 干燥产量以及干燥时间等的计算。理解湿物料中水分的性质; 干燥过程的机理及速率特征。了解各种干燥器的结构特点及 应用场合及干燥器的选型。
(3)按照传热的方式分类,干燥可分为传导干燥、对流干燥、辐射 干燥、介电加热干燥以及上述两种或两种以上方式组合而成的联合干燥。
第一节 概 述
工业上应用最多的是连续操作的对流干燥过程,即 加热后的干燥介质在流动的情况下以对流传热的方式将 热量传给湿物料,湿物料中的湿分汽化被干燥介质带走。 干燥介质可以是不饱和的热空气、惰性气体及烟道气, 其除去的湿分大都是水分。所以本章主要讨论以不饱和 热空气为干燥介质,湿分为水的干燥过程。
cH=1.01+1.88H
(9-7a)
பைடு நூலகம்
显然,比热容仅是湿度的函数。
第二节 湿空气的性质及湿度图
(五)离心泵的工作原理
当湿空气的温度为t,湿度为H时,1kg绝干空气和Hkg水汽的焓 之和为湿空气的焓值,以IH表示,即
《化工原理》第九章 萃取.
第一节 液-液萃取的基本原理
图9-1 组成在三角形相图上的表示方法
第一节 液-液萃取的基本原理
此外,M点的组成也可由ME线段读出萃取剂S的含量, MF线段读出溶质A的含量,原溶剂B的含量不直接从图上读 出,而是可方便地计算出,即:B=100-(S+A)。
直角等腰三角形可用普通直角坐标纸绘制。有时,也 采用不等腰直角三角形表示相组成,只有在各线密集不便 于绘制时,可根据需要将某直角边适当放大,使所标绘的 曲线展开,以方便使用。
第一节 液-液萃取的基本原理
1.三组分系统组成的表示法
液-液萃取过程也是以相际的平衡为极限。三组分系 统的相平衡关系常用三角形坐标图来表示。混合液的组成 以在等腰直角三角形坐标图上表示最方便,因此萃取计算 中常采用等腰直角三角形坐标图。
在图9-1中,三角形的三个顶点分别表示纯组分。习 惯上以顶点A表示溶质,顶点B表示原溶剂,顶点S表示萃 取剂。三角形任何一个边上的任一点代表一个二元混合物, 如AB边上的H点代表由A和B两组分组成的混合液,其中A的 质量分数为0.7,B为0.3。三角形内任一点代表一个三元 混合物,如图M中的点,过M点分别作三个边的平行线ED、 HG与KF,其中A的质量分数以线段MF表示, B的以线段MK表 示,S的以线段ME表示。由图可读得:WA =0.4,WE=0.3, WS=0.3。可见三个组分的质量分数之和等于1。
(3)萃取剂回收的难易与经济性 萃取剂通常需要回 收后循环使用,萃取剂回收的难易直接影响萃取的操作费 用。回收萃取剂所用的方法主要是蒸馏。若被萃取的溶质 是不挥发的,而物系中各组分的热稳定性又较好,可采用 蒸发操作回收萃取剂。
在一般萃取操作中,回收萃取剂往往是费用最多的环 节,有时某种萃取剂具有许多良好的性能,仅由于回收困 难而不能选用。
化工原理第九章.
I2 I0 cg t2 t0 IV 2 H2 H0
2019/7/17
I2 I0 cg t2 t0 r0 c02t2 H2 H0
1.01t2 t0 2490 1.88t2 H2 H0
3、介电加热干燥
将需干燥的物料置于交频电场内,利用高频电场的交变作 用将湿物料加热,水分汽化,物料被干燥。 优点:干燥时间短,干燥产品均匀而洁净。 缺点:费用大。
2019/7/17
4、对流干燥
热能以对流给热的方式由热干燥介质(通常热空气)传给湿 物料,使物料中的水分汽化。物料内部的水分以气态或液态 形式扩散至物料表面,然后汽化的蒸汽从表面扩散至干燥介 质主体,再由介质带走的干燥过程称为对流干燥。 优点:受热均匀,所得产品的含水量均匀。
热能通过传热壁面以传导的方式传给湿物料 被干燥的物料与加热介质不直接接触,属间接干燥 优点:热能利用较多 缺点:与传热壁面接触的物料易局部过热而变质,受热不 均匀。
2、辐射干燥
热能以电磁波的形式由辐射器发射到湿物料表面,被物
2019/7/17
料吸收转化为热能,而将水分加热汽化。 优点:生产能力强,干燥产物均匀 缺点:能耗大
可见:向干燥系统输入的热量用于:加热空气;加热物料;
蒸发水分;热损失
cm cs Xc
2019/7/17
2、干燥系统的热效率
蒸发水分所需的热量
向干燥系统输入的总热量 100%
蒸发水分所需的热量为
QV W 2490 1.88t2 4.1871W
忽略物料中水分带入的焓
每蒸发1kg水分时,消耗的绝干空气数量l
2019/7/17
化工原理(陈敏恒)第九章
第九章液体精馏1 概述 1.1 蒸馏的目的和依据 (1)目的:分离液体混合物 (2)依据:混合液中各组分挥发度 的不同第九章液体精馏9.1 概述 9.1.1 蒸馏的目的和依据(1)目的:分离液体混合物 (2)依据:混合液中各组分挥发度的不同 挥发度——表征物质挥发程度的量。
pA pB 相平衡时: ν A = 、ν B = xA xBy A yB ν A >ν B ∴ > x A xByA > xAA—轻组分,B—重组分9.1.2 工业蒸馏过程 (1)平衡蒸馏(闪蒸)(2)简单蒸馏9.1.3 精馏操作的经济性 操作费用:加热、冷凝所消耗的费用 操作压强: 技术上:P↑,气、液平衡(饱和)温度↑,冷凝易, 汽化难。
z 对热敏性物质,常采用低压或真空操作。
z经济上:高压、真空精馏都将增加设备投资,应作优化 选择。
z9.2. 双组分溶液的气液相平衡9.2.1 理想物系气液相平衡(1)汽液两相平衡的自由度 相律:F = N–Φ + 2 双组分物系: 独立组分数N=2 相数Φ=2 自由度F=2 描述双组分平衡物系的参数:6个 温度-t,总压-P,两相组成-yA,yB,xA,xB。
双组分物系的组成满足: ¾归一关系: y A + y B = 1 ¾相平衡关系:y A = f ( xA )xA + xB = 1∴独立参数仅有:P,t,xA(yA)。
蒸馏操作中,P是选定的,因此温度与浓度必有一 一对应关系。
(2)双组分理想物系的液相组成-温度(泡点)关系式 理想溶液满足拉乌尔定律:0 p A = x A PA0 pB = x B PB总压: 组成: ∴P = PA + PBxB = 1 − xAPA0 x A + PB0 (1 − x A ) = P0 = f (t ) QPA AP − PB0 ∴x = 0 A PA − PB0P − f B (t ) ∴ xA = f A (t ) − f B (t )——泡点方程 —— x~t关系纯组分的饱和蒸汽压与温度的关系可用安托因方程描述: 安托因方程ln P 0 = A − B t+C(3)双组分理想物系的气相组成-温度(露点)关系0 p A PA xA Q yA = = P P——道尔顿分压定律 拉乌尔定律PA0 P − PB0 ∴ yA = 0 0 P PA − PB——露点方程0 0 PA P − PB f A (t ) P − fB (t ) yA = ⋅ 0 = ⋅ 0 P PA − PB P f A (t ) − fB (t )—— y~t关系(4)双组分物系的t~x(y)图和y~x图bta问题:a,b两点哪一个温度较高?(5) y~x的近似表达式与相对挥发度α定义:易挥发(轻)组分为A, 难挥发(重)组分为B, p 则: ν A = p A ν B = B xA xBPA PB > xA x BνA 相对挥发度:α = ν A >ν B νB yA yB 当气相服从道尔顿分压定律时,α = xA xBα= ∴ p A /x A P ⋅ y A /x A = p B /x B P ⋅ y B /x B yA x =α ⋅( A ) yB xB对于二元溶液,则:yA xA =α ⋅( ) 1 − yA 1 − xA∴ y=α⋅x 1 + (α − 1)x- 相平衡方程⋅∴=+−αxy 1(α1)x-相平衡方程讨论:z 上式反映了双组分物系平衡时两相浓度的关系。
中山大学化工原理课件第9章-干燥
(4) 湿比容-温度线 (H - H)
总压 P = 101.325 kPa 时: v H 0 .00 0 .2 08 0 H t 3 4 2 5 7 5
若已知湿度和温度,即可由对应直线查得气体湿比容。
对于P = 101.325 kPa 的饱和空气:
c a H w c c a H ac w s c H
2019/7/18
tastcrH 0 (HasH)
tasf t,H是湿空气在绝热、冷却、增湿过程中达到
的极限冷却温度。
ta
是
s
湿
空
气
的
性
质水,的而状与态
无
关
对于空气~水系统,c H
kH
tas tw
注意:绝热饱和温度于湿球温度的区别和联系!
1、比热 c H kJ/(kg 干气K)
常压下,将湿空气1Kg绝干空气及相应水汽的温度升高 (或降低)1℃所需要(或放出)的热量,称为湿比热。
cH ca Hw c
c a 干 空 气 的 比 热 , 1.01kJ/(kg·K)
c v 水 气 的 比 热 , 1.88kJ/(kg·K)
2019/7/18
相同之处:
1、湿空气均为等焓变化、 2、均为空气状态(t、H)的函数 3、对于空气水体系, tw tas, 不同之处:
1、湿球温度:大量空气与少量水接触后的稳定的水温,空气的状态, (t , H)不变。
绝热饱和温度:少量空气与大量水经过接触后达到的稳定温度,空 气增湿、降温。 2、 湿球温度:传质、传热仍在进行,因此属动态平衡范畴。
湿度 H
解:tw = tas = 52℃;先确 定 tas = 52℃ 的绝热冷却
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
只考虑轻、重关键组分, 比轻关键组分更轻的组分全部从塔顶蒸出,釜出忽略不计; 比重关键组分更重的组分全部从塔釜排出,顶出忽略不计。
❖非清晰分割
全塔整体考虑。
浙江大学化学工程研究所
例一 常压下沸点
环己烷 苯
糠醛
苯酚
80.8℃ 80.1 161.7℃ 180℃
℃ 萃取剂能显著改变苯的饱和蒸汽 压,而对环己烷影响不明显,使苯 从易挥发组分变为难挥发组分。
浙江大学化学工程研究所
第五节 其他精馏方式
13/18
P-7
乙醇-水
P-13
P-13
E-8 P-22
P-22
无水乙醇
P-23
乙二醇
浙江大学化学工程研究所
3/18
此时有:GW pW0 MW GA pAM A
若令:pA
p
0 A
此时有:GW GA
pW0 MW
p
0 A
M
A
p
p
0 A
MW
p
0 A
M
A
水蒸汽蒸馏的代价
消耗水 ❖负荷增加 由于多一组分水,对传质不利,
同样要求下,所需板数将增加。
浙江大学化学工程研究所
第五节 其他精馏方式
15/18
三、反应精馏
概念:
在精馏的同时伴随着化学反应的单元操作过程。
目的:
(1)利用精馏促进化学反应的进行,如可逆反应和联 串反应系统。
(2)利用化学反应促进精馏的进行,如难分离系统、 共沸物系等。
浙江大学化学工程研究所
第六节 多元精馏
16/18
一、多元精馏的特点
将多个组分进行精馏分离的单元操作过程。对n个组 分,一般需要n1个精馏塔。
第六节 多元精馏
17/18
二、多元精馏的计算简介
1. 多元物系的相平衡 相平衡常数: Ki yi xi
对理想物系:Ki pi0 P
相对挥发度:
ij
yi yj
xi xj
对理想物系: ij
pi0
p
0 j
浙江大学化学工程研究所
第六节 多元精馏
18/18
2. 多元精馏的物料衡算
F DW FxiF DxiD WxiW
在被分离的混合液中加入第三组分,以改 变原混合物组分间的相对挥发度,从而用精馏 将它们分离。
浙江大学化学工程研究所
第五节 其他精馏方式
8/18
1. 恒沸精馏
加入的第三组分与原溶液中的一个或者两个 组分形成 最 低恒沸物,从而形成了“恒沸物-纯组分”的精馏体系,恒 沸物从塔顶蒸出,纯组分从塔底蒸出,这种形式的精馏称为 恒沸精馏,其中所添加的第三组分称为恒沸剂或者夹带剂。
(4)还应满足其它的工业要求,如具备热稳定性、 无毒、不腐蚀、来源容易、价格低廉等。
浙江大学化学工程研究所
第五节 其他精馏方式
12/18
2.萃取精馏
在被分离的二元混合液中加入第三组分,沸点很高,且该组分不 与其它组分形成恒沸物,但与原溶液中 A、B 两组分的分子作用力不 同,从而增大它们的相对挥发度,或打破原恒沸体系,使精馏得以进 行,这种形式的精馏称为萃取精馏。其中所添加的第三组分称为萃取 剂,精馏时从塔底排出。
塔序的排列原则:
对热敏性物质,应优先分出; ❖对纯度要求高的组分,应设计从塔顶采出或侧线采出; 如有难分离的相邻组分,应置于最后(原因是在最后负荷
最小,此时需理论板数较多,回流比较大,较经济);
各组分在流程中的汽化、冷凝次数应尽可能减小,以降低 设备的负荷和能耗。
单塔分离重点: 关键组分
浙江大学化学工程研究所
P-16
E-10 P-17
P-17
水
P-19
乙二醇-水
P-2
P-6
E-1 P-1 E-3
P-15
P-21
E-6
E-7 P-5
无水乙醇生产萃取精馏工艺流程
浙江大学化学工程研究所
第五节 其他精馏方式
14/18
萃取剂的选择原则:
(1)选择性高
加入少量萃取剂就能使原组分间的相对挥发度显著 增大。
(2) 溶解度大
4/18
二、间歇精馏
特点:不稳定;
D, xD
只有精馏段,没有提馏段
间歇精馏通常有恒回流比、恒馏出液组成 这两种操作方式
思考:
间歇精馏与简单蒸馏有何相 同和不同之处?
F, xF 加热蒸汽
浙江大学化学工程研究所
间歇精馏流程简图
第五节 其他精馏方式
5/18
1.恒回流比操作
D, xD
y
c1
c2 F, xF
第五节 其他精馏方式
9/18
P-20 P-7 P-7
E-8 P-10
P-9
乙醇水共沸物
P-13 P-13
P-12
补 充 苯
E-9 P-11
P-8 P-16
乙醇水共沸物
E-10 P-17 P-19
P-17
稀乙醇
P-2
P-3
P-6
E-1 P-1
E-5
P-14
P-4
E-3
Байду номын сангаасE-4
无水乙醇
E-7
P-15
P-5
c3
加热蒸汽
x
浙江大学化学工程研究所
间隙精馏流程简图
第五节 其他精馏方式
6/18
2.恒馏出液组成操作
D, xD
a
y c1
F, xF
c2 加热蒸汽
c3
x
浙江大学化学工程研究所
间隙精馏流程简图
第五节 其他精馏方式
7/18
三、特殊精馏
-----用于 1 的混合液 或 1 的混合液
特 殊 精 馏萃恒 取沸 精精 馏馏
由于p
p
0 A
pW0 ,当总压不变时,沸点
将降低。
水蒸汽消耗量的计算:
摩尔比:nW nA
pW0
p
0 A
GW GA
MW MA
pW0
p
0 A
即质量比:GW GA
pW0 MW
p
0 A
M
A
由于水蒸汽与液体接触时间有限,A的实际分压 pA pA0
一般用直接蒸汽时,由于接触时间较短,
所带出的A的分压达不到饱和状态。
第九章 蒸馏
1/18
第五节 其他精馏方式 一、水蒸汽蒸馏 二、间歇精馏 三、特殊精馏 四、反应精馏
第六节 多元精馏 一、多元精馏的特点 二、多元精馏的计算简介
浙江大学化学工程研究所
第五节 其他精馏方式
2/18
第五节 其他精馏方式 一、水蒸汽蒸馏
原理:使沸点降低 适用范围:不相溶物系(其中一相为水)
恒沸剂的选择原则:
(1)新的最低恒沸物沸点要与另一从塔底排出的组 分要有足够大的差别,一般要求大于10℃。
(2)希望能与料液中含量较少的那个组分形成恒沸 物,而且夹带组分的量要尽可能高,这样夹带剂用量 较少,能耗较低。
(3)最好能形成非均相恒沸物,以便于回收其中的 夹带剂。如在环己烷-苯恒沸精馏中的萃取加精馏的 办法,乙醇-水恒沸精馏中静置分层的办法。
能和任何浓度的原溶液互溶,以避免分层,否则难 以充分发挥萃取精馏的作用。
(3)挥发性小
其沸点比混合液的其它组分高得多,以保证塔顶产品 的质量,也易与另一组分分离,但沸点也不能太高,否 则会造成回收困难。
(4)具有稳定性、无毒、不腐蚀、来源容易、价格低 廉等其它工业要求。
浙江大学化学工程研究所
第五节 其他精馏方式
E-6
无水乙醇生产共沸精馏工艺流程
P-21
废水
浙江大学化学工程研究所
第五节 其他精馏方式
10/18
例 2:环己烷-苯体系,恒沸剂为丙酮
环己烷 80.8℃
苯
80.1 ℃ ℃
常压下沸点 丙酮 环己烷-苯恒沸物 环己烷-丙酮恒沸物
56.2℃
77℃
53℃
浙江大学化学工程研究所
第五节 其他精馏方式
11/18
例 1:乙醇-水体系,乙醇从塔底排出,水被苯从塔顶带出。
乙醇 78.3℃
水 100℃
常压下沸点
苯
乙醇-水恒沸物 苯-乙醇-水恒沸物
80.1℃
78.15℃
64.6℃
乙醇-水恒沸物组成 苯-乙醇-水恒沸物组成
乙醇 0.895 水 0.105 乙醇 0.230 水 0.226 苯 0.554
浙江大学化学工程研究所
