抗体酶ppt课件
合集下载
抗体酶
制备方法
• 1、杂交瘤技术 • 经体内免疫后再进行细胞融合是制备抗体酶的一种传统方法。 杂交瘤技术的基本原理是用不能在培养液中生长的但能产生抗 体的脾脏细胞,与能在培养液中生长的骨髓瘤细胞进行融合, 融合得到的杂交细胞既能产生抗体又能在体外培养,通过选择 培养,以获取能产生单克隆抗体的杂交瘤细胞。再把这些细胞 单克隆化,即繁殖成母体的同一细胞或形成菌落。这些菌落能 够产生单一均匀的抗体,可用于进行单克隆抗体的扩大生产。 对这些菌落用酶联免疫吸附法等方法加以筛选。该制备方法的 关键是要有合适而稳定的过渡态模拟物作半抗原,以产生与过 渡态高度亲和的抗体酶。由于大多数反应过渡态类似物的分子 量较低,即所谓的半抗原,他们本身免疫原性很弱,必须与某 种载体偶联才能表现免疫原性。本方法所得到的抗体酶的催化 能力的高低,在很大程度上取决于化学模型物的设计,现在应 用的设计策略包括:诱导和转化设计,反应免疫,“潜过渡态” 半抗原设计等等。
• 2、抗体结合部位修饰法 • 将催化基团或辅助因子引入到抗体的抗原结合部位,一 般可采用两种方法:即选择性化学修饰法和基因工程定 点突变法。抗体酶和酶一样也可以用化学修饰的方法加 以改造。对抗体酶进行结构修饰的关键,是找到一种吻 合的方法在抗体结合位置或附近引入酶的催化基 空间排布恰到好处,就能产生高活力的抗体酶。为提高 抗体酶的催化能力,可采用邻近效应,静电催化,应变, 功能团催化等方法,在抗体结合位点引入催化基团。基 因工程定点突变法是利用位点专一性突变引起抗体结合 部位氨基酸的改变,能在抗体结合部位换上有催化作用 的氨基酸,进而改变抗体酶的催化效率。目前,定点突 变的方法己成为提高抗体酶活性的一种常规方法。
• 3、克隆免疫反应因子的基因 • 通过PCR技术克隆出全套免疫球蛋白的可变位点 使它们随机地将基因的轻重链结合,这些含上利用了免疫因子的多样性, 通过这种方法我们可从上百万种可能性中选择 抗体酶。[1]
抗体酶

抗体的精细识别使其能结合几乎任何天然的或合 成的分子 抗体酶催化反应的介质效应
酯解反应中介质效应 : 抗体酶在有机溶剂中具稳定性。 脱羧反应中介质效应:有机溶剂引起脱羧反应速率增 加。
ห้องสมุดไป่ตู้
酰基转移反应中介质效应 :在疏水溶剂中,活性较高。
抗体酶的制备
将抗体转变为酶可通过诱导法、拷贝法、引入法、化学修饰法等 途径。
1999年,Okamoto报道多克隆 的抗体酶41s-2-L能够特异识别艾 滋病病毒gp41的一段十分保守的 氨基酸序列并将其降解。 2010年,Haggag阐明了DNA酶 的抗体酶中分子模型中结构和功能 之间的关系。 如今,抗体酶已经在新肿瘤药物的 开发,手性药物的拆分,毒品的戒 除,复杂天然产物的合成方面显示 出巨大的潜在价值
Thank you!
用酶作为抗原免疫动物得到抗 酶的抗体,再将此抗体免疫动 物并进行单克隆化,获得单克 隆的抗抗体。 对抗抗体进行筛选,获得具有 原来酶活性的抗体酶。
引入法
用基因工程方法改造和制备全新的抗体酶是一种很 有前途和发展潜力的抗体酶制备方法。 将催化基因引入到特异抗体的抗原结合位点上,也 可以针对性地改变抗体结合区的某些氨基酸序列, 以获得高效的抗体酶。
—— 洪维剑, 蔡发国, 朱丽如. 抗体酶研究的新进展[J]. 饲料研究, 2009,(10)
1) 存在的问题及解决策略: 问题1:目前, 抗体酶技术工业化面临的最大困难是生产 出的一些抗体酶的底物专一性、反应选择性和催化效率不 如天然酶。 抗体酶催化活性较低的可能原因是:
1.设计出的半抗原与真实过渡态之间总会存在细微的差别; 2.抗体酶的结合位点易受底物抑制和环境因素的影响; 3.同一种类的不同细胞产生的抗体酶的活性有差异,多数特异性的 抗体酶并不是单一的分子种类,这使得抗体酶的分离纯化较为困难。 4.抗体酶多为鼠源性的单克隆抗体, 在诱导中机体内可能会产生抗 催化抗体的蛋白, 使抗体酶失活。
抗体酶

1986年Schultz以对硝基苯酚磷酸胆碱酯(PNPPC) 作为相应的羧酸二酯的过渡态类似物。 诱导产生的抗体酶使水解反应速度加快12000倍。
抗体酶
抗体酶(Abzyme)或催化抗体(Catalytic antibody)是抗体的高度选择性和酶的高效 催化能力巧妙结合的产物。
本质上是一类具有催化活力的免疫球蛋
过渡态理论
过渡态理论认为,酶与底物的结合经历了一个 易于形成产物的过渡态,实际上是降低了反应 所需的活化能。
与反应过渡状态结合作用
在酶催化的反应中,与酶的活性中心形 成复合物的实际上是底物形成的过渡状 态, 酶与过渡状态的亲和力要大于酶与底物 或产物的亲和力。
抗体酶设想
1969年Jencks根据抗体结合抗原的高度 特异性,与天然酶结合底物的高度专一 性相类似的特性,在过渡态理论的基础 上首先提出设想:
10.1 模拟酶
11.1.1 模拟酶的概念
模拟酶又称人工酶或酶模型,是在分子 水平上模拟酶活性部位的形状、大小及其微 环境等结构特征,以及酶的作用机制和立体 化学的一门学科,是从分子水平上模拟生物 功能的一门边缘学科。
模拟酶是20世纪60年代发展起来的一个新的研 究领域,是仿生高分子的一个重要的内容。
–酶的作用机制:过渡态理论
–对简化的人工体系中识别、结合和催化的研究
• 超分子化学
– 主-客体化学:主体和客体在结合部位的空间及 电子排列的互补
– 超分子:该分子形成源于底物和受体的结合, 这种结合基于非共价键相互作用,当接受体与 络合离子或分子结合形成稳定的,具有稳定结 构和性质的实体,形成超分子 – 功能:分子识别、催化、选择性输出
白,在
其可变区赋予了酶的属性。 它是利用现代生物学与化学的理论与技术交叉研 究的成果,是抗体的高度选择性和酶的高效催化 能力巧妙结合的产物。
抗体酶

(二)在前药设计中的应用
抗体酶38C2 是根据I 型缩醛酶的烯胺机理, 通过反应免疫方法得到 的。通过位于底物结合部位疏水口袋的活性赖氨酸残基 , LYS, 抗体酶 38C2 可催化醇醛缩合, 逆醇醛和逆Michael 反应, 以及接受宽范围的底 物, 因而可用作为前药的激活剂。Shabat 等设计了一种全新的前药释放 系统, 利用有次序的逆醛醇缩合和逆Michael 反应可除去前体药物中的保 护基, 释放出活性药物。这种策略已成功地用于喜树碱(Camptothecin), 阿霉素(Doxorubicin), 依托泊甙(Etoposide等抗肿瘤药以及降血糖药胰岛 素(Insulin)的前药设计(如图)。
抗体酶在生物催化领域的应用
LICME
演讲内容
简介 作用 原理
问题及 展反应
抗体(antibody):指机体的免疫 系统在抗原刺激下,由B淋巴细胞或 记忆细胞增殖分化成的浆细胞所产 生的、可与相应抗原发生特异性结 合的免疫球蛋白。
酶(enzyme):具有生物催化功 能的高分子物质。
B.基因工程定点突变法
随着基因工程技术的发展。用基因工程方法改造和制备全 新的抗体酶是一种很有前途和发展潜力的抗体酶制备方法。 对于已产生的单抗,分析抗体结合部位的氨基酸顺序或对 应的碱基顺序,然后通过对抗体酶结合部位氨基酸对应的 基因序列进行定点突变,在抗体结合部位加上有催化作用 的氨基酸,进而改变抗体酶的催化效率. 这就是基因工 程法生产抗体酶的原理。
六.一种催化甲状腺素脱碘的抗体酶
3 , 5 , 3′, 5′-四碘甲状腺原氨酸又称甲状腺素(T4)。在人和 动物体中, 它对机体的生长发育、基础代谢与脑和器官的形成发挥 重要调节功能, 这主要通过其降解产物3 , 5 , 3′-三碘甲状腺原氨 酸(T3)和受体的相互作用来完成。生物体内的T3 主要由T4 在脱碘 酶催化下脱碘产生,这个转变主要由含硒的碘甲状腺原氨酸脱碘酶 同源家族来完成。其中I 型碘甲状腺原氨酸脱碘酶(DI)起主要作用 , 缺乏DI 将导致严重的甲状腺疾病。研究发现I 型脱碘酶的酶学性 质、催化机制、空间结构和生理功能等进行了系统研究, 证实它为 一种分子量27 ku 的含硒酶, 含有一个硒代半胱氨酸催化基团, 能催 化T4 降解为T3 和rT3 。研究表明, 若将硒代半胱氨酸突变为其它 氨基酸, 则酶的活性几乎全部丢失。 本文以脱碘酶的结构和初步催化机制为基础, 采用单克隆抗体 技术和化学修饰法制备了一种新的具有脱碘作用的抗体酶, 并对其 动力学性质进行了研究。
抗体酶PPT课件

抗体是指能与相应抗原特异性结合具有 免疫功能的球蛋白。
Claisen重排
单克隆抗体制备技术
抗体酶的化学及酶学特征
抗体酶与天然酶相同点: (1)都是依赖于分子间的极性互补及立体互补进行识别。 (2)它们都遵守米氏动力学方程; (3)在研究活性部位方法相同
解离常数Kd (抗原—抗体) 和Km(抗体—底物) 来比较分子 识别程度,从而改进分子设计。
(3)酶分子底物识别部位所占有的氨基酸一般为7 个左右, 但抗体酶底物识别部位的氨基酸约为15~20 个。抗体酶识 别部位所含有的氨基酸数量较多,并且识别部位与水解部位 相距较远,因而增强了催化反应的底物特异性。抗体酶的这
(5)天然酶的种类是在物种的长期进化过程中形成的,因 此其数量相对稳定;而抗体酶则是运用化学、免疫学、分子
生物学、分子遗传学等技术人工制备的与天然酶具有相似
酶活性的抗体,甚至可以产生自然界中不存在的新酶即超自 然酶,这对于酶的催化反应机制研究及实验应用都有重要意 义。
抗体酶与天然酶不同点:
(1)酶催化作用机制是“锁钥学说”(lock and ey) 及“诱 导契合学说”(induced - fit);而抗体酶的催化机制目前还没 有完全搞清楚,Janda曾提出“诱饵开关”(bait and switch) 机制。
(2)酶与底物结合程度பைடு நூலகம்亲和力,用Km表示;而抗体可用
些特点在医学上具有重要意义
(4)对于天然酶来说,在研究催化机制时,需要分析蛋白的晶
体结构,探索其空间、电荷分布的情况。如果只用化学修饰、
蛋白质工程技术很难确切知道活性部位的空间结构;而对抗 体酶来说,因为采用事先设计的化合物做为半抗原,根据抗体 和抗原间的互补关系,直接推测抗体酶活性部位的结构,对其 催化机制进行研究。
Claisen重排
单克隆抗体制备技术
抗体酶的化学及酶学特征
抗体酶与天然酶相同点: (1)都是依赖于分子间的极性互补及立体互补进行识别。 (2)它们都遵守米氏动力学方程; (3)在研究活性部位方法相同
解离常数Kd (抗原—抗体) 和Km(抗体—底物) 来比较分子 识别程度,从而改进分子设计。
(3)酶分子底物识别部位所占有的氨基酸一般为7 个左右, 但抗体酶底物识别部位的氨基酸约为15~20 个。抗体酶识 别部位所含有的氨基酸数量较多,并且识别部位与水解部位 相距较远,因而增强了催化反应的底物特异性。抗体酶的这
(5)天然酶的种类是在物种的长期进化过程中形成的,因 此其数量相对稳定;而抗体酶则是运用化学、免疫学、分子
生物学、分子遗传学等技术人工制备的与天然酶具有相似
酶活性的抗体,甚至可以产生自然界中不存在的新酶即超自 然酶,这对于酶的催化反应机制研究及实验应用都有重要意 义。
抗体酶与天然酶不同点:
(1)酶催化作用机制是“锁钥学说”(lock and ey) 及“诱 导契合学说”(induced - fit);而抗体酶的催化机制目前还没 有完全搞清楚,Janda曾提出“诱饵开关”(bait and switch) 机制。
(2)酶与底物结合程度பைடு நூலகம்亲和力,用Km表示;而抗体可用
些特点在医学上具有重要意义
(4)对于天然酶来说,在研究催化机制时,需要分析蛋白的晶
体结构,探索其空间、电荷分布的情况。如果只用化学修饰、
蛋白质工程技术很难确切知道活性部位的空间结构;而对抗 体酶来说,因为采用事先设计的化合物做为半抗原,根据抗体 和抗原间的互补关系,直接推测抗体酶活性部位的结构,对其 催化机制进行研究。
抗体酶

抗体酶的研究,为人们提供了一条合理途径去设 计适合于市场需要的蛋白质,即人为地设计制作 酶。它是酶工程的一个全新领域。 构建有别于天然功能酶的新酶类,是酶工程研究 的又一前沿领地。
2013-11-13
拷贝法
用已知酶作为抗原免疫动物,通过单克 隆技术,制得抗该种酶的抗体。再以此种抗 体免疫动物,再次采用单克隆技术,经筛选 与纯化,就可获得具有原来酶活性的抗体酶 (因为抗原与该抗产生的抗体具有互补性, 经过上述两次拷贝,就把酶的活性部位的信 息翻录到抗体酶上,使该抗体酶能高选择性 地催化原酶所催化的反应)。 这种方法对自然界来源稀少的紧缺酶, 不失为一种有价值的有潜力的方法。
2013-11-13
既然过渡态分子难以捕获,而过渡态类似物 是能够模拟一个酶催化反应过渡态的结构的 稳定物质,于是人们就设想,只要寻找到与 反应中决定性步骤的相应酶紧密结合的酶竞 争性抑制剂,就等于发现了过渡态类似物; 还有一种思路,就是这种类似物也能根据化 学反应机制推测设计出来。然后,以过渡态 类似物为半抗原,利用哺乳动物的免疫系统, 诱导与其互补构象的抗体产生,这种抗体即 具有催化活性——这就是 1969 年Jencks 提出的,他发展了 Pauling 的理论;接着, Kohler 和Milstein 于 1975 年发明了具有 历史意义的单克隆技术,使抗体酶的生产成 为可能。
2013-11-13
诱导法
诱导法是选择适当的化学模型物与载 体蛋白连接后给动物免疫,通过杂交瘤技术 筛选和分离单克隆抗体(所得抗体催化效果 的好坏很大程度上取决于化学模型物的设 计)。
2013-11-13
基因工程法
对于已经获得的单抗,分析其氨基酸 序列和相应基因的碱基序列,将抗原结合部 位的基因换上编码有催化作用的氨基酸的基 因,这就是基因工程法制备抗体酶的主要内 容。为可能。利用抗体库技术,在将来也 许有可能绕开免疫,产生完全由基因工程构 建的全新抗体酶。
核酶和抗体酶
ination library)
将不同的重链和轻链基因随机组合,克隆 到合适的表达载体中,在原核细胞表达不 同的抗体,形成一个抗体库,从这个抗体 库中,用抗原可以筛选到相应的抗体基因。
引入法
随着噬菌体抗体库技术的完善,可根据需 要构建适当序列的基因片断,绕过免疫学 方法,构建全新的抗体酶。 噬菌体展示技术将组建亿万种不同特异性 抗体可变区基因库和抗体在大肠杆菌中功 能性表达,与高效快速的筛选手段结合起 来,彻底改变了抗体酶生产的传统途径。
A. 酯酶的底 物–酯
B.酯的羧基碳原子 受到亲核攻击形成 四面体过渡态
C.设计的磷酸酯 类似物,作为抗原 去免疫实验动物
O –C –
磷酸酯类似物 免
(半抗原)
疫
对酯水解反应有 催化作用的单克
隆抗体
抗体酶用于有机酯的水解,过渡态类似 物磷酸盐和磷酸酯作为免疫原诱导产生 的单克隆抗体催化水解反应比未催化反 应快104倍。
L-19IVS
G- P
- OH +
15nt
P399nt
图 13- 四膜虫 35S RNA 内含子剪接 的转酯反应模型
L-19具有酶的主要特 征:专一性强,加快 反应速度,反应前后 酶分子保持不变
L-19 IVS所催化的水解反应和连接反应
异议
引入法
用基因工程方法改造和制备全新的抗体酶 是一种很有前途和发展潜力的抗体酶制备 方法。
将催化基因引入到特异抗体的抗原结合 位点上,使其获得催化功能。 也可以针对性地改变抗体结合区的某些 氨基酸序列,以获得高效的抗体酶。
引入法
对于已产生的单抗,分析抗体结合部位 的氨基酸顺序或对应的碱基顺序。 通过对抗体酶结合部位氨基酸对应的基 因序列进行定点突变,希望能在抗体结 合部位换上有催化作用的氨基酸。 改变抗体酶的催化效率。
将不同的重链和轻链基因随机组合,克隆 到合适的表达载体中,在原核细胞表达不 同的抗体,形成一个抗体库,从这个抗体 库中,用抗原可以筛选到相应的抗体基因。
引入法
随着噬菌体抗体库技术的完善,可根据需 要构建适当序列的基因片断,绕过免疫学 方法,构建全新的抗体酶。 噬菌体展示技术将组建亿万种不同特异性 抗体可变区基因库和抗体在大肠杆菌中功 能性表达,与高效快速的筛选手段结合起 来,彻底改变了抗体酶生产的传统途径。
A. 酯酶的底 物–酯
B.酯的羧基碳原子 受到亲核攻击形成 四面体过渡态
C.设计的磷酸酯 类似物,作为抗原 去免疫实验动物
O –C –
磷酸酯类似物 免
(半抗原)
疫
对酯水解反应有 催化作用的单克
隆抗体
抗体酶用于有机酯的水解,过渡态类似 物磷酸盐和磷酸酯作为免疫原诱导产生 的单克隆抗体催化水解反应比未催化反 应快104倍。
L-19IVS
G- P
- OH +
15nt
P399nt
图 13- 四膜虫 35S RNA 内含子剪接 的转酯反应模型
L-19具有酶的主要特 征:专一性强,加快 反应速度,反应前后 酶分子保持不变
L-19 IVS所催化的水解反应和连接反应
异议
引入法
用基因工程方法改造和制备全新的抗体酶 是一种很有前途和发展潜力的抗体酶制备 方法。
将催化基因引入到特异抗体的抗原结合 位点上,使其获得催化功能。 也可以针对性地改变抗体结合区的某些 氨基酸序列,以获得高效的抗体酶。
引入法
对于已产生的单抗,分析抗体结合部位 的氨基酸顺序或对应的碱基顺序。 通过对抗体酶结合部位氨基酸对应的基 因序列进行定点突变,希望能在抗体结 合部位换上有催化作用的氨基酸。 改变抗体酶的催化效率。
核酶抗体酶ppt课件
Company Logo
3、核酶作用的特点
化学本质 RNA 底物 RNA 肽键 ā-葡聚糖分支酶 反应特异性(专一性)碱基 催化效率 低 产物
Company Logo
4.核酶的分类
锤头核酶
发夹核酶 剪切型核酶 丁型肝炎病毒(HDV)核酶
根据催化反应
RNaseP
I内含子
剪接型核酶 II内含子
2. 免疫源性低,很少引起免疫反应。 3. 针对锤头核酶而言,催化结构域小,既可作为转基因表达产 物,也可以直接以人工合成的寡核苷酸形式在体内转运。
二、在其他领域的应用
防治动、植物 病毒侵害:马铃薯纺锤形块茎类病毒负链 的多价核酶构建,马铃薯卷叶病毒复制酶基因负链的突变 核酶的克隆等
Company Logo
剪切位点
Company Logo
RNaseP底物的二级结构
Company Logo
1、转核苷酸作用 2CpCpCpCpC CpCpCpCpCpC +CpCpCpC
2、水解作用 CpCpCpCpC CpCpCpC + pC
3、转磷酸作用 CpCpCpCpCpCp+UpCpU
CpCpCpCpCpC + UpCpUp 4、去磷酸作用
核糖核酸酶P(RNaseP)是内切核酸酶,是核
糖核蛋白体复合物,能剪切所有tRNA前体的 5‘端,除去多余的序列,形成3’-OH 和 5’磷酸末端。
RNaseP由M1RNA和蛋白质亚基组成。
体外: M1RNA具催化作用
蛋白质作为辅助因子
体内: M1RNA和蛋白质对酶活性都是必需的。
2、1剪切机制 Mg 2+
2、2结构与功能的关系 M1RNA 5‘端完 整结构对维持催化活性是必需的。
3、核酶作用的特点
化学本质 RNA 底物 RNA 肽键 ā-葡聚糖分支酶 反应特异性(专一性)碱基 催化效率 低 产物
Company Logo
4.核酶的分类
锤头核酶
发夹核酶 剪切型核酶 丁型肝炎病毒(HDV)核酶
根据催化反应
RNaseP
I内含子
剪接型核酶 II内含子
2. 免疫源性低,很少引起免疫反应。 3. 针对锤头核酶而言,催化结构域小,既可作为转基因表达产 物,也可以直接以人工合成的寡核苷酸形式在体内转运。
二、在其他领域的应用
防治动、植物 病毒侵害:马铃薯纺锤形块茎类病毒负链 的多价核酶构建,马铃薯卷叶病毒复制酶基因负链的突变 核酶的克隆等
Company Logo
剪切位点
Company Logo
RNaseP底物的二级结构
Company Logo
1、转核苷酸作用 2CpCpCpCpC CpCpCpCpCpC +CpCpCpC
2、水解作用 CpCpCpCpC CpCpCpC + pC
3、转磷酸作用 CpCpCpCpCpCp+UpCpU
CpCpCpCpCpC + UpCpUp 4、去磷酸作用
核糖核酸酶P(RNaseP)是内切核酸酶,是核
糖核蛋白体复合物,能剪切所有tRNA前体的 5‘端,除去多余的序列,形成3’-OH 和 5’磷酸末端。
RNaseP由M1RNA和蛋白质亚基组成。
体外: M1RNA具催化作用
蛋白质作为辅助因子
体内: M1RNA和蛋白质对酶活性都是必需的。
2、1剪切机制 Mg 2+
2、2结构与功能的关系 M1RNA 5‘端完 整结构对维持催化活性是必需的。
第七章 抗体酶
抗体酶:其本质上是免疫球 蛋白,只是在其可变区被赋予了 酶的属性,因此抗体酶又称为催 化抗体(Catalytic Antibody)。
通过一系列化学与生物技术方法 制备出的具有催化活性的抗体
催化抗体与酶化抗体 与 酶的共同点
能高选择性地与 靶分子结合
酶与底物的结合及抗体 与抗原的结合都是高度 专一性
抗体
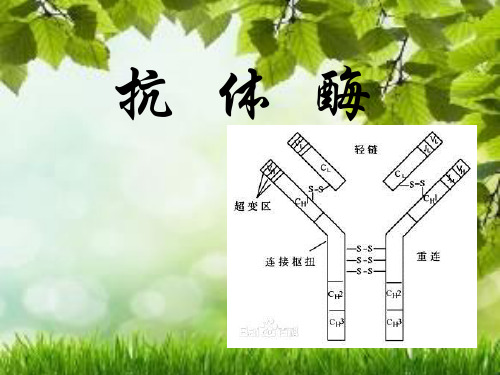
结 合 区: 抗体分 子上有两个抗原结 合区 可变区(V区) 稳定区(C区)
抗体是由B细胞受抗原刺 激后所分泌的蛋白质
抗体分子:由四 条肽链所组成, 两条重链(H链) 两条轻链(L链)
抗体与半抗原的识别包括了 疏水、静电和氢键等的相互作用。 半抗原在抗体结合部位中的取向 是由它的2个羧基的特异相互作用 决定的。
四、抗体酶的应用
1、抗体酶在有机合成中的应用 应用: —抗体酶能催化立体专一性的反应; —能区分动力学上的外消旋混合物; —能催化内消旋底物合成相同手性(homochiral)的产 物。 2. 用于阐明化学反应机制 3. 抗体酶在医疗上的应用
例如,可以设计抗体酶杀死特殊的病原体,也可用抗体酶活化处于靶部位的 药物前体,以降低药物毒性,增加其在体内的稳定性。
稳定半抗原是通过下列因素实现 的:带正电的Arg-L96与带负电的磷 氧基靠近,形成静电吸引;由HisH35,Tyr-H33和Tyr-L94与磷氧基的 氧形成的氢键。
催化抗体制备方法
1 稳定过渡态法 2、抗体与半抗原互补法 4 诱导法 3 拷贝法 5 引入法 6 催化抗体的化学修 饰制备法
随着抗体酶研究的深入,人们利 用了酶催化业已确立的催化机理: ——① 稳定过渡态; ——② 酸碱催化; ——③ 亲电和亲核催化; ——④ 邻近效应 使抗体酶的制备方法不断扩展, 目前已开发出数种产生抗体酶的方法。
通过一系列化学与生物技术方法 制备出的具有催化活性的抗体
催化抗体与酶化抗体 与 酶的共同点
能高选择性地与 靶分子结合
酶与底物的结合及抗体 与抗原的结合都是高度 专一性
抗体
结 合 区: 抗体分 子上有两个抗原结 合区 可变区(V区) 稳定区(C区)
抗体是由B细胞受抗原刺 激后所分泌的蛋白质
抗体分子:由四 条肽链所组成, 两条重链(H链) 两条轻链(L链)
抗体与半抗原的识别包括了 疏水、静电和氢键等的相互作用。 半抗原在抗体结合部位中的取向 是由它的2个羧基的特异相互作用 决定的。
四、抗体酶的应用
1、抗体酶在有机合成中的应用 应用: —抗体酶能催化立体专一性的反应; —能区分动力学上的外消旋混合物; —能催化内消旋底物合成相同手性(homochiral)的产 物。 2. 用于阐明化学反应机制 3. 抗体酶在医疗上的应用
例如,可以设计抗体酶杀死特殊的病原体,也可用抗体酶活化处于靶部位的 药物前体,以降低药物毒性,增加其在体内的稳定性。
稳定半抗原是通过下列因素实现 的:带正电的Arg-L96与带负电的磷 氧基靠近,形成静电吸引;由HisH35,Tyr-H33和Tyr-L94与磷氧基的 氧形成的氢键。
催化抗体制备方法
1 稳定过渡态法 2、抗体与半抗原互补法 4 诱导法 3 拷贝法 5 引入法 6 催化抗体的化学修 饰制备法
随着抗体酶研究的深入,人们利 用了酶催化业已确立的催化机理: ——① 稳定过渡态; ——② 酸碱催化; ——③ 亲电和亲核催化; ——④ 邻近效应 使抗体酶的制备方法不断扩展, 目前已开发出数种产生抗体酶的方法。
Chapter9核酶和抗体酶解析
Ⅰ型IVS:均与四膜虫大核rRNA前体的IVS结构相似、催化自我剪接
需鸟苷(或5′鸟苷酸)和Mg2+参与。
Ⅱ型IVS :结构与四膜虫的不同,而与细胞核mRNA前体中的IVS相 似。它催化自我剪接反应不需要鸟苷或鸟苷酸参与,但仍需Mg2+
2.自我剪切ribozyme的分类
自我剪切ribozyme, 自我剪切的RNA结构有锤头结构和发 夹结构,其中尖头指出自我剪切的部位。
1.酰基转移反应
2.重排反应
3.氧化还原反应
4.金属螯和合反应
5.磷酸酯水解反应
6.磷酸酯闭环反应
7. 光诱导反应
a.光聚合反应(二聚作用)
b.光裂解反应
四. 制备方法
i. 诱导法:即用设计好的半抗原,通过间隔链与载体蛋白 (例如牛血清白蛋白等)偶联制成抗原,然后采用标准 的单克隆抗体来制备、分离、筛选抗体酶。
自我剪接ribozyme:包含剪切与连接两个步骤。
几种能进行自我剪切的RNA结构
3.催化分子间反应的ribozyme的分类
如:L-19IVS具有5种酶活性,可催化多种分 子间反应。
三.Ribozyme研究进展与展望
对各种已知ribozyme结构与功能关系的研究。可找出其 结构功能域和必需基团,据此可进行分子改造,以获得 分子更小的、高效的ribozyme
连接酶活性 金属螯合酶活性 磷酸酯酶活性
生物学意义
第二节结束
点击返回
第三节 抗体酶
一. 概念 是一种具有催化功能的抗体分子,在其可变 区赋予了酶的属性。
二. 抗体酶概述
酶与抗体的差别:酶是能与反应过渡态选择结合
需鸟苷(或5′鸟苷酸)和Mg2+参与。
Ⅱ型IVS :结构与四膜虫的不同,而与细胞核mRNA前体中的IVS相 似。它催化自我剪接反应不需要鸟苷或鸟苷酸参与,但仍需Mg2+
2.自我剪切ribozyme的分类
自我剪切ribozyme, 自我剪切的RNA结构有锤头结构和发 夹结构,其中尖头指出自我剪切的部位。
1.酰基转移反应
2.重排反应
3.氧化还原反应
4.金属螯和合反应
5.磷酸酯水解反应
6.磷酸酯闭环反应
7. 光诱导反应
a.光聚合反应(二聚作用)
b.光裂解反应
四. 制备方法
i. 诱导法:即用设计好的半抗原,通过间隔链与载体蛋白 (例如牛血清白蛋白等)偶联制成抗原,然后采用标准 的单克隆抗体来制备、分离、筛选抗体酶。
自我剪接ribozyme:包含剪切与连接两个步骤。
几种能进行自我剪切的RNA结构
3.催化分子间反应的ribozyme的分类
如:L-19IVS具有5种酶活性,可催化多种分 子间反应。
三.Ribozyme研究进展与展望
对各种已知ribozyme结构与功能关系的研究。可找出其 结构功能域和必需基团,据此可进行分子改造,以获得 分子更小的、高效的ribozyme
连接酶活性 金属螯合酶活性 磷酸酯酶活性
生物学意义
第二节结束
点击返回
第三节 抗体酶
一. 概念 是一种具有催化功能的抗体分子,在其可变 区赋予了酶的属性。
二. 抗体酶概述
酶与抗体的差别:酶是能与反应过渡态选择结合
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗体酶在生物催化领域的应用
LICME
演讲内容
简介
作用 原理
问题及 展望
抗体酶
制备
应用
催化的 反应
抗体(antibody):指机体的免疫 系统在抗原刺激下,由B淋巴细胞或 记忆细胞增殖分化成的浆细胞所产 生的、可与相应抗原发生特异性结 合的免疫球蛋白。
酶(enzyme):具有生物催化功 能的高分子物质。
11
(3) 抗体结合部位修饰法
将催化基团或辅助因子引入到抗体的抗原结合部位,一般 可采用两种方法: 即选择性化学修饰法和基因工程定点突变法。
A.化学修饰法 抗体酶可以用化学惨饰的方法加以改 造。对抗体酶进行结构修饰的关键是 找到一种吻合的方法在抗体结合位置 或附近引入酶的催化基团或辅助基团, 如果引人的催化基团与底物结合部位 取向正确空间排布恰到好处,就能产 生高活力的抗体酶。为提高抗体酶的 催化能力,可采用邻近效应,静电催 化,应变,功能团催化等方法,在抗 体结合位点引入催化基团。
抗体酶可催化趋向性反应及非趋向性反应, 后者可能分为两种情况:一 是在放热分解反应中控制反应构象, 使多产物反应转变为单产物生成为主的 反应;另一种情况是降低反应中过渡态能障。但抗体酶缺少天然酶的韧性或 扭曲性, 没有天然酶所具有的底物去稳作用, 而可能只起稳定过渡态的作用。
6
抗体酶能催化酯水解反应,Oxy—Cope重排反应等多种反应, 而在抗体催化的反应中,研究最广泛的是酯水解反应,所以在这里 只介绍一下酯水解反应的原理。酯水解反应的过渡态是带负电荷的 四面体结构。以MOPCI67催化碳酸脂水解为例说明。首先通过化学 合成过渡态磷酸脂的类似物——硝基苯磷酰胆碱脂,利用过渡态类 似物作为半抗原,并将其与牛血清蛋白偶合,制成抗原注入动物体 内,动物体的血液中就会产生可以和过渡态碳酸脂特异性结合的抗 体MOPCl67,然后采用单克隆技术分离纯化出MOPCI67。在抗体催 化碳酸脂反应中,MOPCI67和过渡态碳酸脂结合后,提高了反应物 过渡态的稳定性,降低了反应的活化能,从而加速了水解反应的进 程。该反应的产物生成速度常数l(c 达到了(o.40±0.04)/min,米 氏常数Km为208±431mol/L。)
7
三.抗体酶的制备
第一阶段 通过免疫动物产生血清多克隆抗体 第二阶段 细胞工程阶段, 即用杂交瘤技术生产单克隆抗体 第三阶段 利用基因工程途径表达和改造抗体
8
(1)诱导法
诱导法是利用反应过渡态类似物为半抗原免疫小鼠, 制作单克隆抗体, 筛选出具高催化活性的单抗即抗体酶。因半抗原没有免疫原性, 需要将设计 好的半抗原分子与载体蛋白(如白蛋白)偶联制成完全抗原, 然后免疫动物, 按 单克隆抗体制备程序获得杂交瘤, 分泌单克隆抗体, 经筛选和纯化得特异性 的抗体酶。
9
制备流程
提取骨髓 细胞培养
提取脾细 胞培养
过渡态类似物 免疫小鼠
细胞融合培养
ELISA效价 检测筛选
杂交瘤细胞 亚克隆
亚类鉴定
冻存细胞株
制备腹水并 纯化
10
(2)拷贝法
拷贝法主要根据抗体生成过程中抗原-抗体互补性来设计的, (如 图)。首先, 用已知的酶作为抗原免疫动物, 通过单克隆技术, 得到抗 酶抗体。然后,再将此抗体作为抗原去免疫动物, 再次采用单克隆技术, 经筛选和纯化就可获得具有原来酶活性的抗体酶。因为抗原与该抗原 产生的抗体具有互补性, 经两次拷贝, 就把酶的活性部位的信息翻录到 抗体酶上了, 使该抗体酶活性中心的空间结构与原酶的形状完全一致, 保证了对同底物的特异性。
制备方法:(1)过渡态类似物的构建:由于准确的过渡状态很难确定或合成, 因此, 制备抗体酶使用的半抗原是过渡态类似物, 这一步是关键。(2)抗原的 制备:将人工设计并构建的过渡态类似物(半抗原), 用化学方法与载体蛋白相 连成完全抗原, 然后免疫动物。(3)利用单克隆抗体筛选技术制备抗体酶, 这 种杂交瘤细胞能够产生单一的抗体, 又能在细胞培养条件下快速繁殖,可以大 量制备单一抗体。
•构
抗体酶主要来自IgG 抗体分子。对抗体结构分 析表明: IgG 分子是由2 条相同的重链及2 条 相同的轻链靠二硫键连接而成。木瓜蛋白酶作 用抗体后,产生3 个片断,其中相同的2 个片 断为Fab ; Fab 中与抗原结合的部位,是高度 可变区( F v ) ,该部位广泛的结构及顺序变化 决定了抗体对外来物质的识别特性,其中电荷 互补及立体互补是其分子识别的主要特征
抗体结构 5
二.抗体酶的作用原理
抗体酶是生物体受抗原诱导产生的具有催化能力的抗体, 其在结构上与 抗原高度互补并能与之特异结合。通过设计化学反应过渡态或中间体类似物 作为半抗原, 诱导机体产生抗体, 产生的抗体能特异性地识别过渡态分子, 降低反应的活化能, 达到催化反应的目的。抗体酶和所有的抗体一样, 都 是由两条轻链和两条重链构成, 抗原与轻链和重链的可变区特异性结合, 因 此可变区的氨基酸的排列顺序决定了抗体分子的特异性, 其本质是一类具 有催化活性的免疫球蛋白, 可变区赋予其酶的属性, 所以也称为催化抗体
12
B.基因工程定点突变法 随着基因工程技术的发展。用基因工程方法改造和制备全 新的抗体酶是一种很有前途和发展潜力的抗体酶制备方法。 对于已产生的单抗,分析抗体结合部位的氨基酸顺序或对 应的碱基顺序,然后通过对抗体酶结合部位氨基酸对应的 基因序列进行定点突变,在抗体结合部位加上有催化作用 的氨基酸,进而改变抗体酶的催化效率. 这就是基因工 程法生产抗体酶的原理。
[共性] :一都是蛋白质; 二都能高选择配体,专一地与靶分子结合。
[区别] :抗体特异性地结合抗原,帮助巨噬细胞摄入, 并摧毁抗原;
酶则高选择地结合底物,并催化反应高效率 进行。
如果能赋予抗体以酶的催化性,则无疑能使酶 的品种极大地扩大,其前途和效能都不可估量。
一.抗体酶简介
•定义
抗体酶是生物体受抗原诱导产生的具有催化能力的抗体, 其在 结构上与抗原高度互补并能与之特异结合,其本质就是一类具有催 化能力的免疫球蛋白,但是在易变区被赋予了酶的属性,所以又被称 为“催化性抗体”。
LICME
演讲内容
简介
作用 原理
问题及 展望
抗体酶
制备
应用
催化的 反应
抗体(antibody):指机体的免疫 系统在抗原刺激下,由B淋巴细胞或 记忆细胞增殖分化成的浆细胞所产 生的、可与相应抗原发生特异性结 合的免疫球蛋白。
酶(enzyme):具有生物催化功 能的高分子物质。
11
(3) 抗体结合部位修饰法
将催化基团或辅助因子引入到抗体的抗原结合部位,一般 可采用两种方法: 即选择性化学修饰法和基因工程定点突变法。
A.化学修饰法 抗体酶可以用化学惨饰的方法加以改 造。对抗体酶进行结构修饰的关键是 找到一种吻合的方法在抗体结合位置 或附近引入酶的催化基团或辅助基团, 如果引人的催化基团与底物结合部位 取向正确空间排布恰到好处,就能产 生高活力的抗体酶。为提高抗体酶的 催化能力,可采用邻近效应,静电催 化,应变,功能团催化等方法,在抗 体结合位点引入催化基团。
抗体酶可催化趋向性反应及非趋向性反应, 后者可能分为两种情况:一 是在放热分解反应中控制反应构象, 使多产物反应转变为单产物生成为主的 反应;另一种情况是降低反应中过渡态能障。但抗体酶缺少天然酶的韧性或 扭曲性, 没有天然酶所具有的底物去稳作用, 而可能只起稳定过渡态的作用。
6
抗体酶能催化酯水解反应,Oxy—Cope重排反应等多种反应, 而在抗体催化的反应中,研究最广泛的是酯水解反应,所以在这里 只介绍一下酯水解反应的原理。酯水解反应的过渡态是带负电荷的 四面体结构。以MOPCI67催化碳酸脂水解为例说明。首先通过化学 合成过渡态磷酸脂的类似物——硝基苯磷酰胆碱脂,利用过渡态类 似物作为半抗原,并将其与牛血清蛋白偶合,制成抗原注入动物体 内,动物体的血液中就会产生可以和过渡态碳酸脂特异性结合的抗 体MOPCl67,然后采用单克隆技术分离纯化出MOPCI67。在抗体催 化碳酸脂反应中,MOPCI67和过渡态碳酸脂结合后,提高了反应物 过渡态的稳定性,降低了反应的活化能,从而加速了水解反应的进 程。该反应的产物生成速度常数l(c 达到了(o.40±0.04)/min,米 氏常数Km为208±431mol/L。)
7
三.抗体酶的制备
第一阶段 通过免疫动物产生血清多克隆抗体 第二阶段 细胞工程阶段, 即用杂交瘤技术生产单克隆抗体 第三阶段 利用基因工程途径表达和改造抗体
8
(1)诱导法
诱导法是利用反应过渡态类似物为半抗原免疫小鼠, 制作单克隆抗体, 筛选出具高催化活性的单抗即抗体酶。因半抗原没有免疫原性, 需要将设计 好的半抗原分子与载体蛋白(如白蛋白)偶联制成完全抗原, 然后免疫动物, 按 单克隆抗体制备程序获得杂交瘤, 分泌单克隆抗体, 经筛选和纯化得特异性 的抗体酶。
9
制备流程
提取骨髓 细胞培养
提取脾细 胞培养
过渡态类似物 免疫小鼠
细胞融合培养
ELISA效价 检测筛选
杂交瘤细胞 亚克隆
亚类鉴定
冻存细胞株
制备腹水并 纯化
10
(2)拷贝法
拷贝法主要根据抗体生成过程中抗原-抗体互补性来设计的, (如 图)。首先, 用已知的酶作为抗原免疫动物, 通过单克隆技术, 得到抗 酶抗体。然后,再将此抗体作为抗原去免疫动物, 再次采用单克隆技术, 经筛选和纯化就可获得具有原来酶活性的抗体酶。因为抗原与该抗原 产生的抗体具有互补性, 经两次拷贝, 就把酶的活性部位的信息翻录到 抗体酶上了, 使该抗体酶活性中心的空间结构与原酶的形状完全一致, 保证了对同底物的特异性。
制备方法:(1)过渡态类似物的构建:由于准确的过渡状态很难确定或合成, 因此, 制备抗体酶使用的半抗原是过渡态类似物, 这一步是关键。(2)抗原的 制备:将人工设计并构建的过渡态类似物(半抗原), 用化学方法与载体蛋白相 连成完全抗原, 然后免疫动物。(3)利用单克隆抗体筛选技术制备抗体酶, 这 种杂交瘤细胞能够产生单一的抗体, 又能在细胞培养条件下快速繁殖,可以大 量制备单一抗体。
•构
抗体酶主要来自IgG 抗体分子。对抗体结构分 析表明: IgG 分子是由2 条相同的重链及2 条 相同的轻链靠二硫键连接而成。木瓜蛋白酶作 用抗体后,产生3 个片断,其中相同的2 个片 断为Fab ; Fab 中与抗原结合的部位,是高度 可变区( F v ) ,该部位广泛的结构及顺序变化 决定了抗体对外来物质的识别特性,其中电荷 互补及立体互补是其分子识别的主要特征
抗体结构 5
二.抗体酶的作用原理
抗体酶是生物体受抗原诱导产生的具有催化能力的抗体, 其在结构上与 抗原高度互补并能与之特异结合。通过设计化学反应过渡态或中间体类似物 作为半抗原, 诱导机体产生抗体, 产生的抗体能特异性地识别过渡态分子, 降低反应的活化能, 达到催化反应的目的。抗体酶和所有的抗体一样, 都 是由两条轻链和两条重链构成, 抗原与轻链和重链的可变区特异性结合, 因 此可变区的氨基酸的排列顺序决定了抗体分子的特异性, 其本质是一类具 有催化活性的免疫球蛋白, 可变区赋予其酶的属性, 所以也称为催化抗体
12
B.基因工程定点突变法 随着基因工程技术的发展。用基因工程方法改造和制备全 新的抗体酶是一种很有前途和发展潜力的抗体酶制备方法。 对于已产生的单抗,分析抗体结合部位的氨基酸顺序或对 应的碱基顺序,然后通过对抗体酶结合部位氨基酸对应的 基因序列进行定点突变,在抗体结合部位加上有催化作用 的氨基酸,进而改变抗体酶的催化效率. 这就是基因工 程法生产抗体酶的原理。
[共性] :一都是蛋白质; 二都能高选择配体,专一地与靶分子结合。
[区别] :抗体特异性地结合抗原,帮助巨噬细胞摄入, 并摧毁抗原;
酶则高选择地结合底物,并催化反应高效率 进行。
如果能赋予抗体以酶的催化性,则无疑能使酶 的品种极大地扩大,其前途和效能都不可估量。
一.抗体酶简介
•定义
抗体酶是生物体受抗原诱导产生的具有催化能力的抗体, 其在 结构上与抗原高度互补并能与之特异结合,其本质就是一类具有催 化能力的免疫球蛋白,但是在易变区被赋予了酶的属性,所以又被称 为“催化性抗体”。
