高考化学平衡图像精选必刷试题
高考化学速率平衡图像专题练习题

化学反应速率、化学平衡图像一、ν-t图像或c-t图像1、对于反应2SO 2(g)+O2(g) 2SO3(g) △H<0,填写改变的条件及平衡移动的方向。
t 1时,,平衡向移动。
t2时,,平衡向移动。
t3时,,平衡向移动。
t4时,,平衡向移动。
改变条件,图像一点保持连续;改变,两点突变,__________使正逆反应速率同等程度的增大而平衡不移动。
2、对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化如右图所示,则图像中关于X、Y、Z、W四种物质的聚集状态为( )A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体3、在密闭容器,一定条件下进行反应,mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )A.正反应是吸热反应B.逆反应是吸热反应C.m+n>p+q D.m+n<p+q4、N2(g)+3H2(g) 2NH3(g) △H<0 在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( ) ,氨的百分含量最高的时间段是( )A.t0-t1B.t2-t3C.t3-t4D. t5-t65、今有X(g)+Y(g) 2Z(g) △H<0。
从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是( )A.增大X或Y的浓度B.增大压强C.增大Z的浓度D.升高温度6、右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。
试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为___________________________。
高二化学(必修一)化学平衡图象练习题

高二化学(必修一)化学平衡图象练习题(含答案解析)学校:___________姓名:___________班级:___________一、单选题1.在2A(g)+B(g)=3C(g)+5D(g)反应中,表示该反应速率最快的是()A.v(A)=2mol·L-1·min-1B.v(B)=0.3mol·L-1·s-1C.v(C)=0.8mol·L-1·s-1D.v(D)=1mol·L-1·s-12.a A(g)+b B(g)⇌c C(g)+d D(g)Δ H=Q,同时符合两图中各曲线规律的是()A.a+b>c+d T1>T2 Q>0B.a+b>c+d T1>T2 Q<0C.a+b>c+d T1<T2 Q<0D.a+b<c+d T1<T2 Q<03.CuCl2溶液中存在平衡:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O,下列说法中错误的是()A.[CuCl4]2-中铜的化合价是+2价B.1mol[Cu(H2O)4]2+中σ键的物质的量为12molC.向溶液中加入AgNO3可使黄绿色的CuCl2溶液变成蓝色D.若升高CuCl2溶液温度,溶液pH不变4.在某恒容密闭容器中充入一定量的O2(g)和O3(g),发生反应2O3(g)3O2(g) △H<0,下列说法正确的是()A.若混合气体的密度不再随时间而改变,则该反应达到平衡B.加入合适的催化剂,反应达到平衡后,O2的体积分数增大C.该反应的生成物的总能量大于反应物的总能量D.若起始时充入少量的稀有气体,则该反应的反应速率保持不变5.中国科学技术大学设计出一种“松果结构”的铂金属催化剂,在催化电解水制氢效果不变的情况下,铂金属的用量降低到传统商业催化剂的175,下列说法不正确的是()A.催化剂的结构会影响催化效果B.使用“松果结构”的铂金属催化剂能够极大提高水的转化率C.使用铂金属催化剂能够降低电解水的活化能D.氢能是一种高能、洁净的可再生能源6.以Cu/Zn O/Al2O3为催化剂,乙醇直接合成乙酸乙酯过程中发生的可逆反应如下:C2H5OH(g)=CH3CHO(g)+H2(g);Δ H=59kJ·mol-12CH3CHO(g)+H2O(g)=C2H5OH(g)+CH3COOH(g);Δ H=-86kJ·mol-1CH3COOH(g)+C2H5OH(g)=CH3COOC2H5(g)+H2O(g);Δ H=-25kJ·mol-12C2H5OH(g)=C2H5OC2H5(g)+H2O(g);Δ H=-44kJ·mol-1其他条件相同,将无水乙醇经预热气化后以一定流速通过装有催化剂的反应管,将出口处收集到的乙酸乙酯、乙醛、乙醚、乙酸、乙醇冷凝,测得部分有机物占全部有机物的质量分数与反应温度的关系如图所示。
2020高三化学高考冲刺—— 化学平衡图像分析【能力提升30题】Word+解析

2020高高高高高考高高—— 高高高高高高高高高高高高高30高高一、单选题(本大题共26小题,共52分)1.以CO2和NH3为原料可合成尿素[CO(NH2)2],反应为:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)。
达到平衡时,NH3的转化率α随温度变化的情况如下图。
下列说法不正确的是()A. 该反应的△H<0B. 若y为压强,则y1>y2C. 若y表示反应起始时的水碳比c(n H2On CO2),则y1>y2D. 在恒温恒容(2L)的容器和绝热恒容(2L)容器中,分别加入2molNH3(g)和1molCO2(g),达到平衡时,恒温恒容体系中氨气的转化率大于绝热恒容体系中氨气的转化率2.有Ⅰ~Ⅳ四个容积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)ΔH,HCl的平衡转化率(α)与Z和温度(T)的关系如图所示。
下列说法正确的是()容器起始时T/℃n(HCl)/mol ZⅠ3000.25aⅡ3000.25bⅢ3000.254A. ΔH<0,a>4>bB. 300℃时该反应的平衡常数的值为640C. 容器Ⅲ某时刻处在R点,则R点的v正<v逆,压强:p(R)>p(Q)D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.2mol⋅L−13.已知反应2SO2(g)+O2(g)⇌2SO3(g)ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。
如图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是()A. O2的体积分数B. 混合气体的密度C. 密闭容器内的压强D. SO2的转化率4.肼(N2H4)和氧气的反应情况受温度影响.某同学设计方案探究温度对产物影响的结果如图所示.下列说法不正确...的是()A. 温度较低时,肼和氧气主要发生的反应N2H4+O2=N2+2H2OB. 900℃时,能发生N2+O2=2NOC. 900℃时,N2的产率与NO的产率之和可能小于1D. 该探究方案是将一定量的肼和氧气、在密闭容器中进行不断升温实验5.X、Y、Z三种气态物质在298K下发生反应,其变化符合下列各图.下列说法一定正确的是()A. 该反应热化学方程式为X(g)+3Y(g)⇌2Z(g),△H=−(E2−E1)B. 若图Ⅲ中甲表示压强,乙表示Z的含量,其变化符合图Ⅲ中的曲线C. 若容器容积为10L,t1=10s,则前10s内的平均反应速率为v(Y)=0.006mol⋅L−1s−1D. 若该体系在373K下反应,则达到平衡所需时间小于t1,且达到平衡时c(X)>0.3mol/L6.向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB.相同温度下,发生反应:A(g)+B(g)⇌xC(g)△H<0.测得两容器中c(A)随时间t 的变化如图所示.下列说法不正确的是()A. x不可能等于2B. 甲、乙两容器中反应达平衡时,平衡常数K(甲)=K(乙)C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同D. 若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol/L<c(A)<1.56mol/L7.在中性、室温下,催化剂FeQ或FeCuQ作用H2O2解离产生的⋅OH来降解浓度为C0的苯酚,降解率D%[D%=(C0C t)/C0]随H2O2浓度、反应时间的关系如图所示(保持其他条件相同)。
化学平衡图像(习题精练含解析)
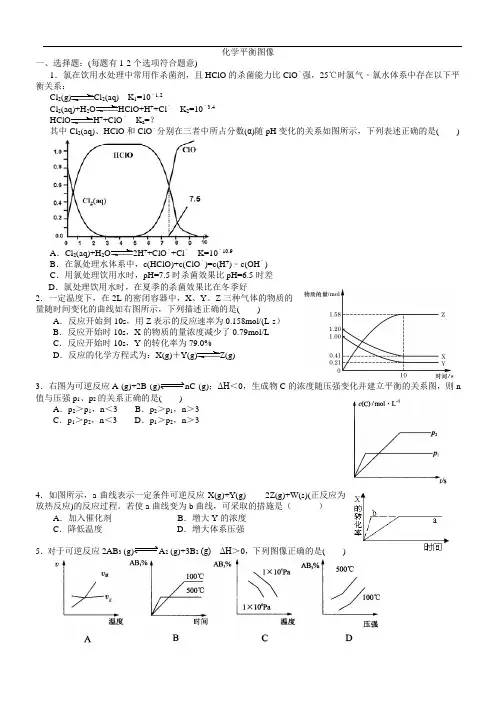
化学平衡图像一、选择题:(每题有1-2个选项符合题意)1.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO﹣强,25℃时氯气﹣氯水体系中存在以下平衡关系:Cl 2(g)Cl2(aq) K1=10﹣1.2Cl 2(aq)+H2O HClO+H++Cl﹣K2=10﹣3.4HClO H++ClO﹣K a=?其中Cl2(aq)、HClO和ClO﹣分别在三者中所占分数(α)随pH变化的关系如图所示,下列表述正确的是( ) A.Cl 2(aq)+H2O2H++ClO﹣+Cl﹣K=10﹣10.9B.在氯处理水体系中,c(HClO)+c(ClO﹣)=c(H+)﹣c(OH﹣)C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差D.氯处理饮用水时,在夏季的杀菌效果比在冬季好2.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)3.右图为可逆反应A (g)+2B (g)nC (g);ΔH<0,生成物C的浓度随压强变化并建立平衡的关系图,则n 值与压强p1、p2的关系正确的是( )A.p2>p1,n<3 B.p2>p1,n>3C.p1>p2,n<3 D.p1>p2,n>34.如图所示,a曲线表示一定条件可逆反应X(g)+Y(g)2Z(g)+W(s)(正反应为放热反应)的反应过程。
若使a曲线变为b曲线,可采取的措施是()A.加入催化剂B.增大Y的浓度C.降低温度D.增大体系压强5.对于可逆反应2AB3 (g)A2 (g)+3B2(g) ΔH>0,下列图像正确的是( )6.已知:4NH 3(g)+5O 2(g)4NO(g)+6H 2(g). △H = -1025kJ/mol 该反应是一个可逆反应。
化学平衡图像专题(精选)

【达标检测16】----化学平衡图像问题一、选择题1、下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断(AB )A、正反应是放热反应B、若A、B是气体,则D是液体或固体C、逆反应是放热反应.D、A、B、C、D均为气体2、在密闭容器中充入A、B或G、H进行可逆反应:aA(气)+bB(气)gG(气)+hH (气);△H=QkJ/mol ,图甲、图乙分别表示在虚线所示部位改变温度(T)或压强对化学平衡与反应速率的影响(t表示时间),则下列结论中正确的是( A )A、开始时充入G和H a+b<g+h Q<0B、开始时充入G和H a+b<g+h Q>0C、开始时充入G和H a+b>g+h Q>0D、开始时充入A和B a+b>g+h Q>03、可逆反应A(气)+2B(气)nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( C )A、P1>P2,n >3B、P1>P2,n <3C、P1<P2,n >3D、P1<P2,n <34、如下图所示a曲线表示一定条件下可逆反应X(g)+Y(g)2Z(g)+W(s)△H <0的反应过程。
若使a曲线变成b曲线,可采取的措施是(AD )A、加入催化剂B、增加Y的浓度C、降低温度D、增大体系压强5、反应A(g)+B(g)C(g)+D(g);△H>0分别在673K和373K时进行,得C 的体积分数和时间的关系曲线如下图所示,其中能正确表示此反应的图象是( C )6、在容器相同的五个容器中,分别充入同量的N2和H2,在不同温度下任其反应:N2+3H22NH3,分别在同时刻测得其中NH3的体积百分比,连成如下图所示曲线,不正确的叙述是( C )。
A、放热反应B、E、F二点尚未达到化学平衡状态C、H、I二点尚未达到化学平衡状态D、G、H、I三点已达到化学平衡状态7、反应:L(s)+ a G(g) b R(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强P1>P2,X轴表示温度,Y轴表示平衡混合气中G的体积分数。
化学平衡图像题_含答案
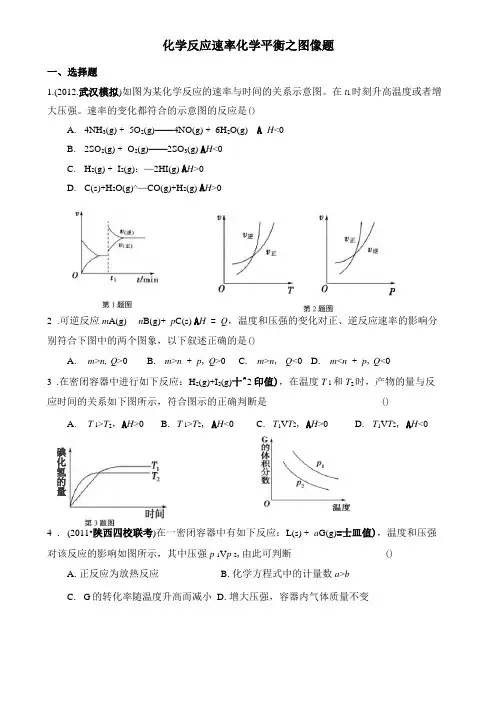
化学反应速率化学平衡之图像题一、选择题1.(2012.武汉模拟)如图为某化学反应的速率与时间的关系示意图。
在t 1时刻升高温度或者增大压强。
速率的变化都符合的示意图的反应是()A. 4NH 3(g) + 5O 2(g)——4NO(g) + 6H 2O(g)B. 2SO 2(g) + O 2(g)——2SO 3(g) A H <0C. H 2(g) + I 2(g):—2HI(g) A H >0D. C(s)+H 2O(g)^—CO(g)+H 2(g) A H >02 .可逆反应m A(g) n B(g)+ p C(s) A H = Q ,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是()A . m >n, Q >0B . m >n + p , Q >0C . m >n , Q <0D . m <n + p , Q <03 .在密闭容器中进行如下反应:H 2(g)+I 2(g)十^2印值),在温度T 1和T 2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是() A . T 1>T 2,A H >0B . T 1>T 2, A H <0C . T 1V T 2, A H >0D . T 1V T 2, A H <04 . (2011•陕西四校联考)在一密闭容器中有如下反应:L(s) + a G(g)=士皿值),温度和压强对该反应的影响如图所示,其中压强p 1V p 2,由此可判断()A .正反应为放热反应B .化学方程式中的计量数a >bC . G 的转化率随温度升高而减小D .增大压强,容器内气体质量不变A H <0 碘化氢的量C . 4NH 3(g) + 5O 2(g) 4NO(g) + 6H 2O(g) A H <05 .下图是表示外界条件(温度和压强)变化对反应的影响,L (s ) +G (g ) ==2R (g ), △H >0,在图中y 轴是指A.平衡混合物中R 的质量分数B.平衡混合物中G 的质量分数6 .在一定条件下,固定容积的密闭容器中反应:2NO 2 (g ) O 2 (g ) + 2NO (g );△H >0,达到平衡。
高考化学小题精练系列专题34化学平衡图像(含解析)
专题34 化学平衡图像(满分42分时间20分钟)姓名:班级:得分:1.在密闭容器中,反应2X(g)+ Y 2(g) 2XY(g)△H<0,达到甲平衡。
在仅改变某一条件后,达到乙平衡,下列分析正确的是A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低C.图Ⅱ中,t时间是增大了压强D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲【答案】D考点:考查化学平衡图像分析。
2.如图是关于反应A2(g)+B2(g) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是A .温度、压强不变,充入一些A 2(g)B .压强不变,降低温度C .压强、温度不变,充入一些与之不反应的惰性气体D .升高温度,同时加压 【答案】A【考点定位】考查化学反应速率与化学平衡【名师点晴】该题的难点是压强对平衡状态的影响,特别是“惰性气体”对化学平衡的影响:①恒温、恒容条件:原平衡体系−−−−→−充入惰性气体体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系−−−−→−充入惰性气体容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
3.在某容积一定的密闭容器中,有下列的可逆反应:A (g)+B (g)xC (g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数)A .P 3>P 4,y 轴表示B 的转化率 B .P 3<P 4,y 轴表示B 的体积分数C .P 3<P 4,y 轴表示混合气体的密度D .P 3<P 4,y 轴表示混合气体的平均摩尔质量 【答案】A【考点定位】考查化学平衡图象【名师点晴】本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义。
完整化学平衡移动图像专题
0
A
B
C
E
D
T
NO转化率
3 、图表示反应N2(g)+3H2(g) 2NH3(g);ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是 ( ) A t0~t1 B t2~t3 C t3~t4 D t5~t6
AB
练习:
D
下列图象中,不能表示反应A2(g)+3B2(g) 2AB3(g)(△H<0)平衡体系的是…( )
练习:
2、下图是在其它条件一定时,反应2NO+O2 2NO2+ Q(Q>0)中NO 的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下图所示的变化,请分析t1时的改变因素可能是什么?并说明理由。
二、速度-时间图:
v逆
t1
t
v
v正
由于v正、v逆相同程 度的增大,t1时的改变因素可能是 a.加入(正)催化剂 b.当m+n=p+q时增大压强。平衡没有移动。
t
v
v正
增大
逆
<
•若对以上反应已知m+n>p+q,平衡后降低压强时,画出相关的 v – t 图。
t1 t2
t
v
v逆
v正
二、速度-时间图:
v逆
t1 t2
t
v
v正
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析引起平衡移动的因素可能是什么?并说明理由。
高三化学作业《化学平衡图像练习》(含答案)
化学平衡图像1.对于反应N2(g)+3H2(g)2NH3(g)ΔH<0,下列研究目的和示意图相符的是()A B C D研究目的压强对反应的影响(p2>p1)温度对反应的影响平衡体系中增加N2的浓度对反应的影响催化剂对反应的影响示意图2.某容积可变的密闭容器中盛有足量的A,通入气体B,发生反应:A(s)+3B(g)2C(g)+D(g)ΔH<0,在一定温度和压强下达到平衡。
若平衡时C的物质的量与加入B的物质的量的变化关系如图所示。
则下列说法中正确的是()A.若保持压强不变,降低温度时,图中角度a将变小B.若缩小容器的体积,增大压强,平衡向正反应方向移动C.若保持压强不变,再通入B,则再次达到平衡时正、逆反应速率均增大D.平衡时B、C的物质的量之比为1:23.工业生产苯乙烯是利用乙苯的脱氢反应:达到平衡后改变反应条件,下列图中曲线变化不正确的是()4.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动5.CO2与H2合成(CH3)2O(二甲醚)是煤化工中的重要反应,有关信息如下:2CO(g)+6H2(g)(CH3)2O(g)+3H2O(g)ΔH<0。
恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是()6.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)()A.P3<P4,y轴表示A的转化率B.P3<P4,y轴表示B的体积分数C.P3<P4,y轴表示混合气体的密度D.P3>P4,y轴表示混合气体的平均摩尔质量7.反应mA(固)+nB(气pC(气)ΔH<0。
化学平衡图像高考真题
化学平衡图像高考真题化学平衡作为高考化学中的一个重要内容,一直是考试中的难点之一。
其中,常常会涉及到化学平衡的图像表达。
通过图像,我们可以更直观地理解化学反应中各种物质的含量变化,从而更好地解决相关问题。
下面就以高考真题为例,来分析化学平衡图像的相关知识。
在一道高考真题中,题目描述了如下化学反应:\[2A + B \rightleftharpoons 3C + D\]并要求根据该反应写出平衡常数表达式,并利用图像表示该反应的化学平衡。
首先,我们知道平衡常数(Kc)的表达式为:\[Kc = \frac{{[C]^3 [D]}}{{[A]^2 [B]}}\]根据上述反应式,我们可以得知,在达到化学平衡时,反应物A和B与生成物C和D的摩尔比为2:1:3:1。
因此,在图像中我们可以通过不同长度的线段,分别表示反应物A和B的浓度,以及生成物C和D 的浓度。
接着,我们可以将该反应表示成图像形式。
在横轴上,我们表示出反应物A和B的初始浓度以及生成物C和D的初始浓度。
在纵轴上,表示各物质的浓度变化。
通过画出不同颜色的线段,分别代表不同物质的浓度变化,并在适当的位置标出各种物质的浓度比例。
通过这样的图像表达,我们可以清晰地看到在达到化学平衡时,反应物和生成物的浓度变化情况,以及它们之间的比例关系。
这样不仅有助于我们更直观地理解化学平衡的概念,也能帮助我们更好地解答相关问题。
综上所述,化学平衡的图像表达在高考化学中起着重要作用。
通过图像,我们可以更直观地理解化学反应中各物质的浓度变化,从而更好地掌握相关知识,并更好地应对考试中的问题。
希望同学们在备战高考时能够充分利用图像表达,提升化学学科的学习效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学平衡图像精选必刷试题1.焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO 2(g) S2(g)+2CO2(g)。
一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是A.该反应的∆H>0 B.C点时达到平衡状态C.增加C的量能够增大SO2的转化率D.T3时增大压强,能增大活化分子百分数【答案】B2.乙烯气相直接水合反应制备乙醇:C 2H4(g)+H2O(g) C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。
下列分析不正确...的是A.乙烯气相直接水合反应的∆H<0B.图中压强的大小关系为:p1>p2>p3C.图中a点对应的平衡常数K =5 16D.达到平衡状态a、b所需要的时间:a>b【答案】B3.一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) xC(g)+D(s)△H<0,在 t1时达平衡。
在 t2 、t3时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。
下列有关说法正确的是A.t2 时刻改变的条件是使用催化剂B.t3时刻v(逆)可能小于t2时刻v(逆)C.t3时刻改变的条件一定是增大反应物的浓度D.t1~t2、t2~t3平衡常数均为0.25【答案】B4.恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。
已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。
如图是不同温度下x(SiHCl3)随时间的变化。
下列说法正确的是A.该反应为放热反应,v正,a<v逆,bB.化学平衡状态时2v消耗(SiHCl3)=v消耗(SiCl4)C.当反应进行到a处时,v正/v逆=16/9D.T2 K时平衡体系中再充入1 mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大【答案】C5.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是A.a、b、c三个状态只有b是平衡状态B.达到平衡时A2的转化率大小为:b>a>cC.若T2<T1,则正反应一定是吸热反应D.b点时,平衡体系中A、B原子数之比接近1∶3【答案】D6.一定条件下,在密闭容器中充入CO 2与H2进行反应:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH。
采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):下列叙述正确的是A.该可逆反应的ΔH>0B.催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能大C.500K下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率高D.d、e两点反应已经达到平衡【答案】D7.已知:2X(g)+Y(g)2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。
下列判断正确的是()A.T1时,v正>v逆B.正反应的ΔH<0C.a、b两点的反应速率v(a)=v(b)D .当温度低于T 1时,ω增大的原因是平衡向正反应方向移动【答案】B8.为探究外界条件对可逆反应:2NO 2(g) 2NO(g) +O 2(g) ΔH =- 1162kJ·mol -1的影响,若保持气体的总质量不变,在温度为T 1、T 2时,通过实验得到平衡体系中 NO 体积分数随压强的变化曲线,实验结果如图所示。
下列说法正确的是( ):A .a 、c 两点混合气体的平均相对分子质量:Ma>McB .b 、c 两点的平衡常数:K b =K cC .从状态a 到状态c ,NO 2气体的转化率减小D .状态a 通过升高温度可变成状态b ,a 、b 两点气体颜色:a 深、b 浅【答案】C9.在恒容密闭容器中通入X 并发生反应:2X(g)Y(g),温度T 1、T 2下X 的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )A .该反应进行到M 点放出的热量大于进行到W 点放出的热量B .T 2下,在0--t 1时间内,v(Y)=C .M 点的正反应速率小于N 点的逆反应速率D .M 点时再加入一定量的X ,平衡后X 的转化率增大【答案】D10.一定条件下,CH 4与H 2O(g)发生反应:CH 4(g)+H 2O(g)CO(g)+3H 2(g),设起始24n(H O)n(CH )=Z ,在恒压下,平衡时(CH 4)的体积分数与Z 和T (温度)的关系如图所示。
下列说法正确的是( )A .该反应的焓变△H<0B .图中Z 的大小为a>3>bC .图中X 点对应的平衡混合物中24n(H O)n(CH )>3 D .温度不变时,图中X 点对应的平衡在加压后(CH 4)减小【答案】C11.已知反应:CH 2=CHCH 3(g)+Cl 2(g)CH 2=CHCH 2Cl(g)+HCl(g)。
在一定压强下,按向密闭容器中充入氯气与丙烯。
图甲表示平衡时,丙烯的体积分数(ϕ)与温度(T)、ω的关系,图乙表示反应的平衡常数K 与温度T 的关系。
则下列说法正确的是A .图甲中11ω>B .若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变C .温度T 1、2ω=, Cl 2的转化率约为33.3%D .图乙中,线A 表示正反应的平衡常数【答案】C12.如图所示的各图中,表示2A (g )+B (g )⇌2C (g )(△H <0)这个可逆反应的正确图象为(注:Φ(C )表示C 的质量分数,P 表示气体压强,C 表示浓度)( )A.B.C.D.【答案】A13.将一定量的X加入某密闭容器中,发生反应:2X(g) 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是( )。
A.升高温度,该反应平衡常数K减小B.压强大小有P3>P2>P1C.平衡后加入高效催化剂使平均摩尔质量增大D.在该条件下M点X平衡转化率为9/11【答案】D14.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-QkJ·mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是A.图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响B.图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响C.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低【答案】B15.生产硫酸的主要反应:2SO 2(g) +O2(g) 2SO3(g) △H=-197 kJ /mol。
图中L(L1、L2)、X可分别代表压强或温度。
下列说法正确的是A.X代表压强B.推断L2>L1C.A、B两点对应的平衡常数相同D.当SO2(g)和SO3(g)生成速率相等时,则反应达到平衡【答案】D16.反应a M(g)+b N(g)c P(g)+d Q(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。
其中z表示反应开始时N的物质的量与M的物质的量之比。
下列说法正确的是A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加B.同压同z时,升高温度,平衡时Q的体积分数增加C.同温同z时,增加压强,平衡时Q的体积分数增加D.同温同压时,增加z,平衡时Q的体积分数减小【答案】B17.向绝热恒容密闭容器中通入一定量的SO 2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。
由图可得出的正确结论是A.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 B.反应在c点达到平衡状态C.反应物的总能量低于生成物的总能量 D.反应物浓度:a点小于b【答案】A18.在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。
下列说法正确的是A.该反应的正反应为放热反应B.压强大小关系:p1<p2<p3C.M点对应的平衡常数K的值约为 1.04×10-2D.在p2及512 K时,图中N点v(正)<v(逆)【答案】AC19.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。
下列说法正确的是A.反应2NO(g)+O 2(g)2NO2(g)的ΔH>0B.图中X点所示条件下,延长反应时间能提高NO转化率C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率D.380℃下,c起始(O2)=5.0×10−4mol·L−1,NO平衡转化率为50%,则平衡常数K>2000【答案】BD20.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)2NH3(g) △H。
(1)已知每破坏1mol有关化学键需要的能量如下表:N N则△H=_____________。
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将_________(填“增大”“减小”或“不变”)(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。
①其中,p1、p2和p3由大到小的顺序是________,其原因是__________。
②若分别用v A(N2)和v B(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则v A(N2)______ v B(N2)(填“>”“<”或“=”)③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=___(保留一位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。
