自来水中铁离子含量检测
自来水中铁含量的测定报告内容

自来水中铁含量的测定报告内容1. 引言自来水是人们日常生活中最基本的饮用水来源之一,其水质安全和优良性是保证人们健康的重要因素之一。
本次实验旨在通过测定自来水中铁含量,评估其水质安全性,并据此提出相关建议。
2. 实验方法2.1 试剂和设备本实验使用的试剂和设备有:- 0.1 mol/L 硫酸亚铁(II)溶液- 稀盐酸溶液- 盐酸- 1% 过硫酸钾溶液- Buret和支架- 手工撇渣设备- 恒温水浴2.2 实验步骤本实验的具体步骤如下:1. 取一定量自来水样品,并用玻璃棒搅拌均匀。
2. 取20 mL 水样,并加入1 mL 盐酸。
3. 将试管放入恒温水浴中,加热至80,保持恒温。
4. 将0.1 mol/L 硫酸亚铁(II)溶液与稀盐酸溶液混合,每次取2 mL。
5. 将步骤4中的试剂滴加入步骤3中的试管中,直至出现深蓝色溶液。
6. 将试管冷却至室温,并转移到支架上,使用手工撇渣设备去除溶液表面浮渣。
7. 取1 mL 1% 过硫酸钾溶液,滴入步骤6中的试管,轻轻搅拌溶解。
8. 使用Buret滴定0.1 mol/L 硫酸亚铁(II)溶液,直到溶液呈翠绿色为止。
9. 记录滴定过程中消耗的0.1 mol/L 硫酸亚铁(II)溶液的体积。
3. 数据分析根据滴定过程中消耗的0.1 mol/L 硫酸亚铁(II)溶液的体积,可以计算出自来水中铁含量的浓度。
假设滴定过程中消耗的硫酸亚铁溶液的体积为V mL,其浓度为C mol/L,则自来水中铁的浓度为C*V/20(mol/L)。
4. 结果与讨论经过实验测定,测得自来水中铁含量为X mol/L。
根据相关标准,自来水的铁含量应低于Y mol/L。
由此可见,本次实验测得的自来水中铁含量在合理的范围内。
然而,尽管铁的含量未超过标准范围,但应注意到,铁的存在可能会影响水质的口感和色泽。
因此,建议采取一些措施来减少自来水中铁的含量,如增加自来水处理中对铁离子的去除步骤。
5. 结论本次实验通过滴定法测定了自来水中铁含量,并根据测定结果对其水质安全性进行了评估。
二甲酚橙分光光度法测定铁含量

二甲酚橙分光光度法测定铁含量X丛晓英(内蒙古化工职业学院,内蒙古呼和浩特 010010) 摘 要:本实验通过利用分光光度计测定样品中微量铁的含量,本实验选定的显色剂为二甲酚橙先测定二甲酚橙的最大吸收波长K =570nm ,二甲酚橙-铁的最大吸收波长K =570nm ,二甲酚橙-盐酸的最大吸收波长K =450nm 。
然后进行了实验条件的摸索:最佳射入波长的选择、缓冲溶液的最佳波长、酸性条件的最佳波长、显色剂用量的最佳量。
在最佳实验条件下测定淀粉、蔗糖、自来水中的微量铁的含量。
关键词:二甲酚橙;分光光度法 中图分类号:T M351 文献标识码:A 文章编号:1006—7981(2012)02—0021—02 分光光度法指紫外,可见分光光度法,属于吸收光度法的一种.该方法是基于物质对光的选择性吸收而建立起来的分析方法。
此课题主要应用为可见分光光度法的测定,分光光度法主要用于微量组分定量测定,也能用于常量组分的测定;可测单组分,也可测多组分。
1 实验部分1.1 仪器与试剂722分光光度计、FA 2004电子天平、HCL (0.05mol /L )、醋酸-醋酸钠缓冲溶液、铁标液(1g /L )、氯化铜溶液(1g /L )、氯化锌溶液(1g /L )、硫酸铝钾溶液(1g /L )、蔗糖溶液、淀粉溶液、自来水。
测定条件的确定及实验结果 二甲酚橙—铁稀液的最大吸收波长的确定以蒸馏水为参比确定二甲酚橙溶液最大吸收波长为570nm 。
以蒸馏水为参比确定铁标液与二甲酚橙(盐酸)的络合物的最大吸收波长为570nm 。
以蒸馏水为参比确定二甲酚橙和盐酸的混合物的最大吸收波长(取1.0ml 二甲酚橙,1.5ml 盐酸以蒸馏水定容至50ml)波长/nm综上所述:二甲酚橙的最大吸收波长K =570nm ,二甲酚橙-铁的最大吸收波长K =570nm ,二甲酚橙—盐酸的最大吸收波长K =450nm 。
根据显色反应的要求,二甲酚橙—铁稀液,二甲酚橙—盐酸溶液的对比度$K =570nm -450nm =120nm >60nm 正符合显色剂与有色化合物的对比度$K =60nm 以上。
自来水硬度的测定原理

自来水硬度的测定原理
自来水硬度是指水中含有的钙、镁等离子的多少,是衡量水质中钙镁离子含量的重要指标之一。
测定水中的硬度可以通过以下原理进行:
1. 络合滴定法:该方法利用测定剂(如EDTA)与水中的钙、镁离子发生络合反应,形成稳定的络合物。
在滴定过程中,添加指示剂(如异硫氰酸铁)来指示络合滴定的终点。
终点出现颜色改变或指示剂指示的值发生突变时,可以计算出水中的钙、镁离子含量。
2. 重金属指示剂法:该方法使用钠盐(如钠酞菁)作为指示剂,它与水中的钙、镁离子反应生成沉淀。
沉淀出现颜色改变时,可以判断水中的钙、镁离子的含量。
3. 酸碱滴定法:该方法通过滴定酸碱溶液来测定水中的碳酸钙含量。
首先将水样中的碳酸钙转化为氢氧化钙沉淀,然后用酸溶解沉淀,并使用酸碱指示剂(如酚酞指示剂)来判断滴定终点,由滴定所消耗的酸溶液量可以计算出水中的碳酸钙含量。
总之,通过这些测定原理和方法,可以准确地测定出自来水中的硬度,为水质的评价和处理提供科学依据。
水质质量的检测方法

水质质量的检测方法在水资源稀缺的环境下,我们更要珍惜水资源,同时检测部门要做好检测工作,为人民群众身体健康供给保障。
检测水是事关民生的大事,不容小觑。
这就是它的紧要意义。
水质检测一般将细菌学指标和感官性状指标列为必检性检测项目,其他指标可依据当地水质条件和需要进行选择。
每月对水源水、出厂水和部分有代表性的管网末端水进行一次全面分析。
自给供水和农村集中供水水质检测的采样点数、采样次数和检测项目可参照上述要求,依据实在情况确定。
一、简单的水质检测方法:1、看:用透亮度高的玻璃装满一杯水,对光看有没有细小的物质悬浮在水中?静置三个小时,然后察看杯底是否有沉淀物?假如有,说明水中的悬浮杂质严重超标;2、闻:取一杯水尽量阔别水龙头,然后用鼻子闻一闻。
有没有漂白粉(氯气)的味道?假如能闻到漂白粉(氯气)的气味,说明自来水中余氯超标;3、尝:喝热水,看看有没有漂白粉(氯气)的味道,假如能闻到漂白粉(氯气)的味道,说明自来水中余氯超标!终端处理也必需使用净水器;4、观:用自来水泡茶,察看一夜茶是否变黑?假如茶叶变黑,说明自来水中的铁、锰严重超标,应使用配备除铁、锰滤芯的净水器进行重端处理;5、品:尝一口白开水,口感是否有涩涩的感觉?假如是这样,说明水的硬度太高了;6、查:检查家里的热水器和开水壶,内壁是否有一层黄色水垢?假如有,也说明水的硬度太高(钙、镁盐含量太高),应尽快进行软化处理!注意:硬度太高的水简单造成热水器管道结垢,因热交换不好会爆管;长期饮用硬度过高的水简单引起各种结石。
二、水质检测方法:(一)水中氯离子的测定⒈原理方法本方法以铬酸钾为指示剂,在pH为5~9.5的范围内用硝酸银标准溶液滴定。
硝酸银与氯化物作用生成白色氯化银沉淀,当有过量硝酸银存在时,则与铬酸钾指示剂反应,生成砖红色铬酸银,表示反应达到尽头。
反应式为:Ag++Cl→AgCl↓(白色)2Ag++CrO42→Ag2CrO4↓(砖红色)⒉分析步骤⒊结果计算氯离子含量以质量浓度ρ1计,数值以mg/L表示,计算公式如下:式中:c硝酸银标准滴定溶液的浓度,mol/L;V1:空白试验消耗硝酸银标准滴定溶液的量,mL;V2:水样消耗硝酸银标准滴定溶液的量,mL;V3:水样体积,mL。
自来水检测标准106项

自来水检测标准106项自来水是人们日常生活中必不可少的资源之一。
为了保证自来水的质量安全,各国都制定了相应的自来水检测标准。
以下是中国的自来水检测标准,共有106项。
1.外观检测:自来水应为无色或淡黄色,无可见悬浮物。
2.气味检测:自来水不应具有异味或恶臭。
3. pH值检测:自来水的pH值应在6.5-8.5之间,以保证水的中性。
4.物理性质检测:包括水温、水流速度、水压等指标,用于评估自来水的运行情况。
5.浊度检测:浊度指水中悬浮物的多少,自来水的浊度应低于5 NTU。
6.溶解氧检测:水中溶解氧的含量需符合国家标准。
7. COD检测:COD(化学需氧量)是评估自来水中有机污染物的指标。
8.氮氧化物检测:包括亚硝酸盐、硝酸盐等指标,用于评估自来水中的氮污染情况。
9.高锰酸盐指数检测:用于评估水中有机物的抗氧化能力。
10.铁浓度检测:衡量自来水中铁含量。
11.锰浓度检测:衡量自来水中锰含量。
12.铜浓度检测:衡量自来水中铜含量。
13.铅浓度检测:衡量自来水中铅含量。
14.镉浓度检测:衡量自来水中镉含量。
15.汞浓度检测:衡量自来水中汞含量。
16.其他重金属检测:包括铬、镍、锌、银等指标,用于评估自来水中的重金属污染情况。
17.细菌总数检测:用于评估自来水中的细菌污染情况。
18.大肠菌群检测:用于评估自来水中是否存在粪便污染。
19.大肠杆菌检测:用于评估自来水中的细菌污染情况,代表着水中存在的病原体。
20.乙型肝炎病毒检测:用于评估自来水中是否存在乙型肝炎病毒。
21.肠道病毒检测:包括轮状病毒、腺病毒等指标,用于评估自来水中是否存在肠道病毒。
22.氯化物检测:衡量自来水中氯离子的含量。
23.氨氮检测:衡量自来水中氨离子的含量。
24.总碱度检测:衡量自来水中总碱含量。
25.一氧化碳检测:评估自来水中的一氧化碳含量。
26.氰化物检测:衡量自来水中氰离子的含量。
27.氟化物检测:评估自来水中氟离子的含量。
28.硝酸盐检测:评估自来水中硝酸盐的含量。
自来水检测指标
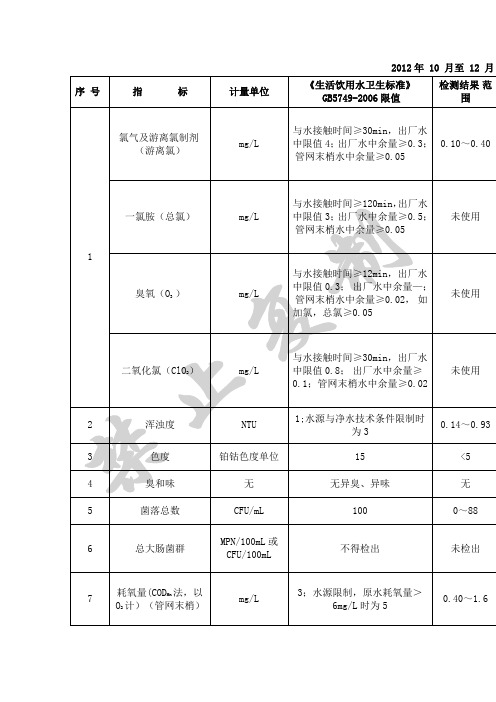
2012年 10 月至 12 月城市自来水的国家标准(GB5749-85)检测项目单位国家标准色度度不超过15度浑浊度NTU 不超过3度嗅和味不得有异嗅异味肉眼可见物不得含有PH 6.5-8.5总硬度(以CaCO3铁锰铜锌挥发酚(以苯酚计)阴离子合成洗涤剂硫酸盐氯化物溶解性总固体氟化物ug/L 50ug/L 10ug/L 1ug/L 10铬(六价铬)mg/L 0.05铅ug/L 50银ug/L 50硝酸盐氮mg/L 20氯仿ug/L 60四氯化碳ug/L 3苯并(a)芘ug/L 0.01滴滴涕ug/L 1六六六ug/L 5细菌总数个/L 100总大肠菌群个/L 3总α放射性Bq/L 0.1总β放射性Bq/L 1.0余氯依据地表水水域环境Ⅰ类主要适用于源Ⅱ类主要适用于集生物栖息地、鱼虾类Ⅲ类主要适用于集冬场、洄游通到、水Ⅳ类主要适用于一Ⅴ类主要适用于农类别分别执行相应类别的标准值。
水域功能类别高能类别低的标准值。
同一水域兼有多类使用功能别对应的标准值。
实现水域功能与达功能类别标准饮水设备找康源。
康源康源,健康源泉。
在我国,1984年卫生部制定了最早的饮用水标准,规定了35 项检测指标,这个标准一用就是20多年。
2007年7月1日,我国颁布了新的《生活饮用水卫生标准》,将检测指标从35 项提高到了106项。
而按照国家规定,新国标要到2012年才全部执行。
一个重要的原因是,全国有600 多个城市,要全部达到这106 项标准非常困难,因此才有了一个宽限期。
新国标主要有三个特点:一是加强了对水质有机物、微生物和水质消毒等方面的要求;二是统一了城镇和农村饮用水卫生标准;三是基本实现了饮用水标准与国际接轨。
特别是对砷、铅、铬这些重金属类的指标检测要求更加严格。
以下我们对部分检测内容进行提示:不重要的指标:酸碱度PH值过低会腐蚀管道,准是6.5—9.5与水的味道有关的指标:溶解性总固体,也就是300mg/L是极好,1200mg/L则是无法饮用了。
普鲁士蓝分光光度法测定饮用水中总铁的含量

普鲁士蓝分光光度法测定饮用水中总铁的含量刘荣森;张长水【摘要】Taking advantage of the fact Fe2+and K3 [Fe (CN) 6] generate soluble prussian blue, a new method for de-termination of the content of total iron in drinking water was established by measuring the generated prussian blue ab-sorbance at 702 nm. The content of iron shows a good linear relationship with absorbance in the range of 0.03μg/mL~8.00μg/mL. The regression equation of calibration is Y=0.184 6X+0.030 1, the correlation coefficient is R2=0.988 and apparent molar coefficientisε=1.87×104 L/mol·cm. Total iron content in 4 drinking water samples was determi-nated by the method and the recovery of the standard was in 98.6%~101.1%. The results are satisfactory, and it can be used for the determination of total iron in drinking water.%利用Fe2+与铁氰化钾反应生成可溶性普鲁士蓝,通过测定普鲁士蓝在702 nm处的吸光度,测定饮用水中总铁的含量。
5-邻二氮菲吸光光度法测定水中铁含量

邻二氮菲吸光光度法测定自来水中铁含量一、目的与要求1.熟悉721型分光光度计使用方法2.了解邻二氯菲测定Fe(ll)的原理和方法。
3.掌握用标准曲线法和标准比较法进行定量测定的原理及方法。
、实验原理邻二氮菲(1,10-邻二氮杂菲)是有机配合剂之一,与Fe2+能形成红色配离子生成的配离子在510nm附近有一吸收峰,摩尔吸光系数达1.1 X 10 4,配离子的lg B 3=21.3,反应灵敏,适用于微量测定。
在 pH 3~9范围内,反应能迅速完成,且显色稳定,在含铁0.5~8ppm范围内,浓度与吸光度符合 Beer定律。
但 Fe3+离子也能与邻二氯菲生成谈蓝色配合物,bA3; 14. 1,故在显色前应先用盐酸疑胺将Fe3+还原为Fe2+,其反应式为2Fe3+ + 2NH2OH• HC1― 2F^+ +N2t +2H2O^4H4 + 2C1-被测溶液用pH4.5—5的缓冲液保持酸度。
比色皿(或称吸收池)不配套,会影响吸光度的测量值,应检验其透光度与厚度的一致性,必要时加以校正。
三、仪器与试剂仪器;721型分光光度汁,电子天平,容量瓶,移液管,洗耳球等试剂:(NH4)SO4 • FeSQ・ 6HO (A.R.),HCI(6mol/l) ,10%盐酸经胺(新配制),乙酸盐缓冲液,邻二氮菲溶液(0 . 15%,新配制)。
四、操作步骤1.试液制备(1)标准铁溶液的制备取分析纯(NH)SO4 • FeSQ・6H20约0.35g,精密称量,置于150mL烧杯中,加入6mol/IHCI溶液20mL和少量水,溶解后,转置1L 容量瓶中用水稀释至刻度,摇匀。
(2)乙酸盐缓冲液的制备乙酸钠136g与冰醋酸120mL加水溶成500ml,摇匀。
2.标准曲线的绘制分别吸取上述标难铁溶液 0.0、1.0、2.0、3.o、4.0、5.0mL于50mL容量瓶中,依次加入乙酸盐缓冲浓5mL盐酸经胺1mL邻二氮菲溶液5mL用蒸馏水稀释至刻度,摇匀,放置10mi n。
