氧化钠的与过氧化钠的比较
氧化钠与过氧化钠的区别

氧化钠与过氧化钠的区别
教学重点
从物理与化学方面区别它们
教学计划
本节课内容对应教学计划中所列第1次课。
教学目标
1
从定义上区分它们
2
从物理方面区分它们
3
从化学方面区分它们
教学过程:
氧化钠与过氧化钠的区别之一
(1)氧和另一种元素组成的化合物叫做氧化物。过氧化物也属于氧化物(实际是盐类)。
过氧化物是指含有[O-O]2-离子,与酸反应除生成盐、水外,还有O2逸出的氧化物。一般的二氧化物,如PbO2、MnO2、TiO2等金属氧化物不能看成是过氧化物,原因是这些氧化物与酸反应不能产生O2。
(2)一般金属氧化物和过氧化物与水、酸、酸性氧化物的反应产物不同。
如氧化钠、过氧化钠分别与硫酸发生反应
反应式如下:
Na2O+H2SO4=Na2SO4+H2O
2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑
(3)氧化钠属于碱性氧化物。
过氧化钠不属于碱性氧化物。虽然过氧化钠与水作用后的溶液显碱性,但同时还生成O2,过氧化钠与酸反应生成盐和水的同时,还有氧气,不符合碱性氧化物的概念(能跟酸起反应,生成盐和水的氧化物叫碱性氧化物(生成物只能有盐和水,不可以有任何其它物质生成))。
过氧化物是指含有oo等金属氧化物不能看成是过氧化物原因是这些氧化物与酸反应不能产生o2一般金属氧化物和过氧化物与水酸酸性氧化物的反应产物不同
教育是一项良心工程
养成良好的学习习惯
学生:________教师:__周志敏_______时间:___2013___年_1__月_23_日___________段
氧化钠与过氧化钠的区别之二
二、本次课后作业:
三、学生对于本次课的评价:
考点突破:钠的氧化物——氧化钠和过氧化钠
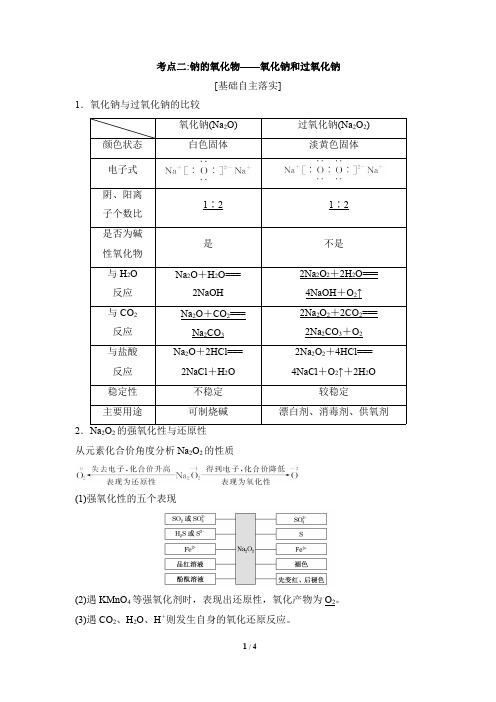
考点二:钠的氧化物——氧化钠和过氧化钠[基础自主落实]1.氧化钠与过氧化钠的比较氧化钠(Na 2O)过氧化钠(Na 2O 2)颜色状态白色固体淡黄色固体电子式阴、阳离子个数比1∶21∶2是否为碱性氧化物是不是与H 2O 反应Na 2O +H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH +O 2↑与CO 2反应Na 2O +CO 2===Na 2CO 32Na 2O 2+2CO 2===2Na 2CO 3+O 2与盐酸反应Na 2O +2HCl===2NaCl +H 2O 2Na 2O 2+4HCl===4NaCl +O 2↑+2H 2O稳定性不稳定较稳定主要用途可制烧碱漂白剂、消毒剂、供氧剂2.Na 2O 2的强氧化性与还原性从元素化合价角度分析Na 2O 2的性质(1)强氧化性的五个表现(2)遇KMnO 4等强氧化剂时,表现出还原性,氧化产物为O 2。
(3)遇CO 2、H 2O 、H +则发生自身的氧化还原反应。
小题热身1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化钠、过氧化钠均为碱性氧化物(×)(2)1mol Na2O2固体中含离子总数为4N A(×)(3)Na2O2溶于水产生O2的离子方程式为Na2O2+H2O===2Na++2OH-+O2↑(×)(4)Na2O2的电子式为(×)(5)1mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A(√)(6)Na2O2与H2O反应时,Na2O2既是还原剂又是氧化剂(√)(7)Na2O2在潮湿的空气中放置一段时间,最终产物是NaOH(×)(8)7.8g Na2O2与足量的CO2反应,转移电子的个数为0.2N A(×)2.如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。
钠及其氧化物的物质的量均为0.1mol,水的质量为100g。
2.1.2+氧化纳和过氧化钠+课件+2023-2024学年高一上学期化学人教版(2019)必修第一册

课堂小结
物质 色、态
氧化钠(Na2O) 白色固体
过氧化钠(Na2O2) 淡黄色固体
氧元素化合价
-2
-1
阴、阳离子个数比
1∶2
1∶2
类别
碱性氧化物
过氧化物、不是碱性氧化物
化学性质 稳定性
二者均能与H2O、CO2、HCl反应,但Na2O2有O2产生 Na2O2更稳定
课堂练习
1.判断正误,正确的画“√”,错误的画“×”。
第二章 海水中的重要元素——钠和氯 第一节 钠的化合物
第2课时氧化钠和过氧化钠
学习目标
1.能从物质类别、元素化合价角度认识Na2O、Na2O2、 Na2CO3、NaHCO3的性质,并能书写有关方程式。
2.能利用钠的典型代表物的性质和反应,设计实验进行验 证和探究,并能分析、解释有关实验现象。
3.了解焰色试验的实验操作及应用。
D.都具有强氧化性,都可用作漂白剂
课堂练习 大本53页
D 题点一 氧化钠和过氧化钠的性质
1.下列对于Na2O、Na2O2的比较正确的是(
)
①Na2O和Na2O2都能与水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换
反应生成O2
③Na2O是淡黄色物质,Na2O2是白色物质
【预测】从物质组成和氧化还原反应的角度,预测Na2O2与H2O反应的产物可能?
Na2O2 + H2O
实验2-3(书本37页)
将1~2 mL水滴入盛有1~2 g过 氧化钠固体的试管中,立即把带火 星的木条伸入试管中,检验生成的 气体。用手轻轻触摸试管外壁,有 什么感觉?用pH试纸检验溶液的酸 碱性。
钠的两种重要的氧化物——氧化钠和过氧化钠

钠的两种重要的氧化物——氧化钠和过氧化钠氧化钠和过氧化钠的比较难点提取Na2O2与CO2和H2O反应的五大关系1.物质的量的关系无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1。
2.气体体积关系若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量为原混合气体体积的12,即为生成氧气的量。
3.固体质量关系相当于固体Na2O2只吸收了CO2中的“CO”,H2O中的“H2”;可以看做发生相应的反应:Na2O2+CO===Na2CO3,Na2O2+H2===2NaOH(实际上两反应都不能发生)。
4.电子转移关系当Na2O2与CO2、H2O反应时,每产生1 mol O2转移2 mol e-。
5.先后顺序关系一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可看做Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。
【互动思考】1.判断正误,正确的划“√”,错误的划“×”(1)过氧化钠能与水反应,所以过氧化钠可以做气体的干燥剂()(2)过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂()(3)78 g Na2O2中含阴离子的个数是2 N A()(4)Na2O2与H2O反应制备O2的离子方程式:Na2O2+H2O===2Na++2OH-+O2↑()(5)Na2O、Na2O2组成元素相同,与CO2反应产物也相同()(6)Na2O2的电子式为()(7)1 mol钠与氧气反应生成Na2O或Na2O2时,失去的电子数目均为N A()(8)1 mol Na2O2与足量CO2反应时,转移2N A个电子()答案(1)×(2)√(3)×(4)×(5)×(6)×(7)√(8)×2.如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应。
(完整版)钠知识点

一.金属钠1.钠的物理性质金属钠是一种柔软,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g /cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
2.钠的化学性质钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)②在空气(或氧气)中燃烧:2Na+O2Na2O2(黄色火焰),以上反应说明Na2O2比Na2O 稳定。
可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2NaCl(白烟)(2)钠与水反应:2Na+2H2O =2NaOH +H2↑现象:①浮:钠投入水中并浮在水面上②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。
③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应2Na+2H2O=NaOH+H2↑ (1)CuSO4+2NaOH=Na2SO4+Cu(OH)2(2)合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2↑②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑3.钠的存放和取用由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。
取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
4.钠的存在与用途自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。
过氧化钠

2、试管变烫
该反应为放热反应
过
3、酚酞先变红,后褪色 1、生成了碱(NaOH)
氧
2、过氧化钠有漂白
化
作用
钠
能使带火星的木条复燃,就说明这个反应有氧气生成,
与
而使反应后的溶液能使酚酞变红,说明溶液成碱性,在这
水
里那就应该是生成了 NaOH。也就是 Na2O2 与 H2O 反应会
反
生成 NaOH 和 O2。接下来是配平反应方程式。首先我们来
详细分析过氧化钠 与水的反应,分析反 应中价态变化
态变化就有交叉的部分,所以要满足这条规律,那在这个
反应中氧的价态变化就只能是中-1→0,-1→-2
失 2e-
2 Na2O2+2H2O==4 NaOH +O2↑
得 2e-
请问在这个反应中,氧化剂是什么?(过氧化钠)还原剂
呢?(过氧化钠)所以在这里过氧化钠既做氧化剂又做还
应
分析氧的化合价。请一位同学上台标出生成物及氧化物中
所有氧元素的化合价。(Na2O-1 2;H2O-2 ;NaO-2 H;O0 2)好,
其中 Na2O2 中氧是以过氧根离子的形式存在,整个离子团
为-2 价,所以平均下来每一个氧就为-1 价。那么显然反一个氧化还原反应。在同一化学方程式中, 同一元素的化合价变化有一条规律是只靠拢,不交叉。如 果氧从-2 价变为 0 价,从-1 价变为-2 价,那这种情况中价
根据反应及实验现 象分析物质性质
原剂。那显然过氧化钠能做氧化剂生成氧气,它的氧化性
比氧气还要强,所以它是强氧化剂。我们之前看到,酚酞
加进去先变红后褪色,褪色是因为过氧化钠有漂白性。所 以过氧化钠常用来做漂白剂,漂白一些织物等。
2.1 第2课时钠的几种化合物焰色试验(教学课件)-高中化学人教版(2019)必修第一册

氧化钠
过氧化钠
与水反应的
Na2O+H2O
2NaOH
2Na2O2+2H2O
4NaOH+O2↑
Na2O+CO2
Na2CO3
2Na2O2+2CO2
2Na2CO3+O2
化学方程式
与 CO2 反应
的化学方程式
用途
制备 NaOH 等
在呼吸面具或潜水艇
中作为氧气的来源
二、碳酸钠和碳酸氢钠的比较
物质名称
碳酸钠
碳酸氢钠
如:2Na2O2+4HCl══4NaCl+2H2O+O2↑。
典型例题
【例题1】 下列有关Na2O、Na2O2的说法正确的是(
)
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃
烧起来,说明Na2O2与H2O反应放出热量
B.Na2O2与CO2反应时有单质O2生成,该反应属于置换反应
C.Na2O、Na2O2与水反应都生成NaOH,两者都属于碱性氧
(1)Na2O和2O2的组成元素相同,与CO2反应的产物也相同。
( × )
(2)Na2O2与水的反应是氧化还原反应,但水不是氧化剂,也不
是还原剂。( √ )
(3)纯碱、烧碱、火碱、苏打的主要成分都是Na2CO3,而小
苏打是NaHCO3。( × )
(4)Na2CO3的水溶液呈碱性,而NaHCO3的水溶液呈酸性。
答案:C
解析:Na2O2是淡黄色固体,A项错误;Na2O中氧元素为-2
价,Na2O2中氧元素为-1价,B项错误;Na2O没有强氧化性,D项
错误。
探究任务2 探究碳酸钠和碳酸氢钠的性质差异及相互间的转化
氧化钠与过氧化钠的性质

2Na2O+H2O==2NaOH
让学生 讨论,从 旁引导
讨论,思 考
让学生 自己思 考,从而 培养学 生的自 学能力, 发散思 维,加深 记忆,学 会应用。
验证:用酚酞试剂
燃烧的三要素: 1.可燃物质; 2.氧气; 3.达到着火点;
设计的实验: 在试管中加入过氧化钠,再滴加水,用带火 星的木条检验
精选可编辑
教学教案
授课 班级 课题
授课
课型
高一某班
时间
氧化钠与过氧化钠的性质
知识目标:使学生掌握氧化钠与过氧化钠的性质,可以写出方程式,并会运用。
教学 目标
能力目标:培养学生通过实验现象探索原理的能力,培养学生发散思维。 情感目标:通过对实验现象的观察总结出原理,对学生进行辩证思维的训练。
重点 钠的氧化物的性质,以及与水反应的现象。
2Na2O2+2CO2==2Na2CO3+ O2
复 习 本 认真听讲 章学习 的内容, 加深学 生的印 象。
用过电 影的方 式让学 生加深 记
总结: Na 的氧化物性质活泼,可以与水反应。过 氧化钠的性质比氧化钠活泼,可以与 CO2 反应。
4.作业 课后习题
布 置 作 记下作业 业
让学生 课后复 习,不要 忘记
化学性质:
2、 Na2O2
.
精选可编辑
Na2O2 与水的反应:
实验现象: 滴加酚酞 带火星的木条 摸摸试管壁 实验原理:
溶液变红 复燃 Biblioteka 热2Na2O2+2H2O==4NaOH+O2
3.总结
吹气生火: 下面,观察下一个实验,吹气生火实验,根 据上一个实验得出的结论,讨论这个实验的原 理。 现象,棉花剧烈燃烧 原理:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化钠与过氧化钠的比较
很久很久以前有两兄弟,哥哥叫氧化钠,弟弟叫过氧化钠。
他们从生下来就爱攀比,只要是哥哥有的弟弟也要有。
哥哥所做的事弟弟也要争着去做。
有一天他们又开始了攀比:
氧化钠说:“我比你活泼,我可以和二氧化碳反应生成碳酸钠和水。
”
过氧化钠说:“我和二氧化碳反应不仅能生成碳酸钠和水,还能生成氧气。
”
氧化钠说:我能与水,盐酸反应生成氢氧化钠,氯化钠。
过氧化钠说:我也能与他们反应,并且还能比你多生成一种产物氧气。
还有就是我能做供氧剂、氧化剂、漂白剂,你行吗?
从他们的对话中你能看出谁的化学性质活泼些吗?。
