发酵生产中还原糖和葡萄糖检测指标的分析
葡萄酒生产分析检验

葡萄酒中还原糖和总糖的检测葡萄酒中的主要糖类是葡萄糖和果糖,成熟的葡萄果糖的含量较高,葡萄中只有极少的蔗糖。
生产过程中添加的蔗糖在酸和酵母转化酶的作用下水解成葡萄糖和果糖后被酵母利用,称之为可发酵性糖,不能被酵母利用的称之为非发酵性糖或残糖。
根据还原斐林试剂的能力,又可分为还原糖和非还原糖。
在葡萄酒中残糖主要由戊糖(如阿拉伯糖、鼠李糖、木糖及少量的未发酵的葡萄糖和果糖,约0.1~0.2g/L)组成。
1.高效液相色谱法(1)原理利用氨柱,将样品中的果糖、葡萄糖、蔗糖与其他组分分离。
示差折光检测器进行鉴定,外标法定量。
(2)试剂与仪器①超纯水:经纯水机制出的电阻率达到18ΜΩ或经0.45μm微滤膜过滤的新鲜的重蒸水。
②乙腈—水(75+25):将乙腈和水按75+25的比例混合(或根据仪器情况调整该比例至分离效果最佳),用脱气装置充分脱气后,再用0.45μm的油系过滤膜过滤。
该溶液用做流动相。
③糖标准溶液(含总糖45.000g/L):分别称取干燥的葡萄糖、果糖、蔗糖各1.500g(准确至0.001g),移入100mL容量瓶中,用超纯水定容至刻度。
该溶液含葡萄糖、果糖、蔗糖分别为15.000g/LNH④高效液相色谱仪,示差折光检侧器:色谱柱为150mm× 5.0mm,Shim-paek CLC-2柱。
⑤微过滤膜:0.45μm,油系。
⑥脱气装置(或超声波装置)。
(3)测定步骤①试样的制备:将样品用超纯水稀释至总糖量为45g/L左右,并用0.45μm油系微过滤膜过滤。
②色谱条件如下。
柱温:室温;流动相:乙腈十水(75+25);流速:2mL/min;进样量:20μL③测定:在同样的色谱条件下,将糖标准溶液和处理好的试样分别注入色谱仪。
测定各糖分峰面积,井计算其含量。
n C A A X si sii i ⨯⨯= P G X +=12X =1X Z 05.1+式中1X ——样品中还原糖含量(以葡萄糖计),L g /; 2X ——样品中总糖含量(以葡萄糖计),L g /; G ——样品中的果糖含量,L g /;P ——样品中的葡萄糖含量,L g /;Z ——样品中的蔗糖的含量,L g /;05.1——由蔗糖换算为葡萄糖的系数;i X ——样品中。
发酵液还原糖的测定方法

中间体化验操作法发酵液中糖含量的测定:1.原理:利用还原性糖类的自由配合基在碱性溶液中能将高价铜还原成为低价铜,过量的高价铜在酸性溶液中与碘化钾作用生成Cu2I2,同时析出碘,析出的碘以标准硫代硫酸钠(Na2S2O3)溶液滴定,同时做一空白对照,从两者之间求出糖的含量。
反应式如下:酸△(C6H10O6)n n(C6H10O6)水解CuSO4+2NaOHCu(OH)2+Na2SO4CHOH—COONa O—CH--COONaCu(OH)2+Cu +2H2OCHOH—COOK O—CH--COOKO-CHCOOK CHOCu +CHOHO4O-CHCOOK CHOHO--CHCOOK COONa HO--CHCOOK2Cu +NaOH+H2O (CHOH)4+Cu2O+O--CHCOOK CH2OH HO--CHCOONaO—CHCOOK CHOHOOK过量的Cu +2H2SO4O—CHCOOK CHOHOONa+CuSO4+Na++K++SO42-2CuSO4+4KI+2Cu↓2K2SO4+I2(在酸化条件下)I2+2Na2S2O32NaI+Na2S4O62.试剂:1)斐林试剂直接配制法:将酒石酸钾钠800g溶于水中,再溶入硫酸铜160g,加入1N的NaOH溶液1318ml (或固体氢氧化钠580g),最后加入KI400g溶后,加入纯化水至总体积为10000ml,摇匀即得。
2)斐林试剂贮备液的制备a.硫酸铜贮备液:称取硫酸铜(CuSO4·5H2O)800g加纯化水溶解(如浊可用玻璃棉过滤),使总体积成10000ml,摇匀即可。
b.酒石酸钾钠贮备液:称取酒石酸钾钠400g,加纯化水使总体积为1000ml摇匀即得。
c.斐林试剂混合液:取硫酸铜贮备液1000ml,加酒石酸钾钠贮备液1000ml,摇匀加11mol/L氢氧化钠(NaOH)659.5ml或固体NaOH290g,最后加入碘化钾(KI)200g,溶后加入水,使总体积为5000ml。
发酵液中还原糖含量测定
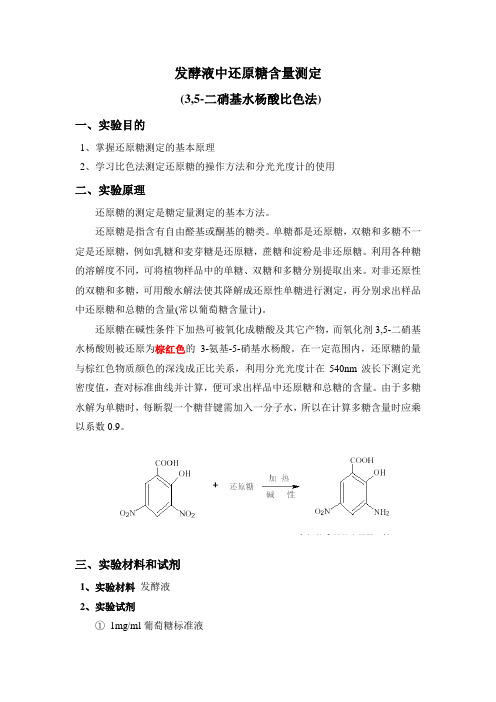
发酵液中还原糖含量测定(3,5-二硝基水杨酸比色法)一、实验目的1、掌握还原糖测定的基本原理2、学习比色法测定还原糖的操作方法和分光光度计的使用二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类。
单糖都是还原糖,双糖和多糖不一定是还原糖,例如乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用各种糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来。
对非还原性的双糖和多糖,可用酸水解法使其降解成还原性单糖进行测定,再分别求出样品中还原糖和总糖的含量(常以葡萄糖含量计)。
还原糖在碱性条件下加热可被氧化成糖酸及其它产物,而氧化剂3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以系数0.9。
三、实验材料和试剂1、实验材料发酵液2、实验试剂①1mg/ml葡萄糖标准液准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100ml容量瓶中,用蒸馏水定容至100ml,混匀,4℃冰箱中保存备用。
②3,5-二硝基水杨酸(DNS)试剂将6.3g DNS和262ml 2M NaOH溶液,加到500ml含有185g酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000ml,贮于棕色瓶中备用。
四、实验器材具塞璃玻刻度试管:20ml×8移液管:2ml×2;10ml×1 微量移液器:1000μL×1容量瓶:100ml恒温水浴锅沸水浴可见光分光光度计五、操作步骤1、制作葡萄糖标准曲线取7支具塞刻度试管编号,按表1分别加入浓度为1mg/ml的葡萄糖标准液、蒸馏水和DNS试剂,配成不同浓度的葡萄糖反应液。
葡萄酒酿制过程中糖酸和酒精度的检测

葡萄酒酿制过程中还原糖、总酸及酒精度的测定方法一、还原糖的测定在葡萄酒发酵前,测定葡萄的还原糖含量,以确定要添加的糖含量;发酵之后测定酒中的残糖含量。
1、测定方法:裴林试剂热滴定法(1)裴林氏A 、B 液标定预备试验:取裴林氏A 、B 液各5.00mL 于250mL 三角瓶中,加50mL 水,摇匀,在电炉上加热沸,在沸腾状态下用制备好的葡萄糖标准溶液滴定,当溶液的蓝色将消失呈红色时,加2滴甲基蓝指示液,继续滴至蓝色消失,记录消耗的葡萄糖标准溶液的体积(V1ml)。
正式试验:取裴林氏A 、B 液各5.00mL 于250mL 三角瓶中,加50mL 水和比预备试验少1ml 葡萄糖标准溶液,加热至沸,并保持2min ,加2滴次甲基蓝指示液,在沸腾态下于1min 内用葡萄糖标准溶液滴至终点(消耗葡萄糖标准液,记录消耗的葡萄糖标准溶液的总体积。
(2)样品的测定预备试验:裴林试剂A 、B 液各5ml 250ml 三角瓶中 加水50ml 加入7.5ml 试样 在沸腾状态下用5g/l 的葡萄糖标液滴定至 蓝色消失成红色时 加2滴亚甲基兰指示剂 继续滴定至蓝色消失,记录体积。
正式试验:裴林试剂A 、B 液各5ml 250ml 三角瓶中 加水50ml 加入7.5ml 试样+比预备试验少1ml 的葡标液,在沸腾状态下用5g/l 的葡萄糖标液滴定至 蓝色消失成红色时 加2滴亚甲基兰指示剂 继续滴定至蓝色消失,记录体积。
结果计算:总糖或还原糖含量g/l =稀释倍数)(取样体积测定试样消耗的葡标液标定消耗的葡标液葡标液⨯-⨯V V V C 2、试剂的配制及仪器需求(1)斐林试剂配制方法将36.4g CuSO4.5H2O 溶于200mL 水中,用0.5mL 浓硫酸酸化,再用水稀释到500mL 待用;取173g 酒石酸钾钠KNaC4H4O6.4H2O ,71g NaOH 固体溶于400mL 水中,再稀释到500mL .使用时取等体积两溶液混合。
发酵工程实验的实验报告

一、实验目的1. 了解发酵工程的基本原理和操作方法。
2. 掌握发酵过程中菌种培养、培养基配制、发酵条件控制等基本技能。
3. 熟悉发酵过程中产物生成的监测方法。
二、实验原理发酵工程是指利用微生物的代谢活动,将生物质资源转化为人类所需产品的一门综合性工程技术。
本实验以谷氨酸棒杆菌为研究对象,通过摇瓶发酵的方式,探究其在适宜条件下对葡萄糖的转化率及谷氨酸的生成情况。
三、实验仪器与试剂1. 仪器:摇床、锥形瓶(250ml)、移液管、pH计、生物传感仪、分析天平、发酵培养基、葡萄糖、酵母膏、胰蛋白胨、磷酸氢二钠、磷酸二氢钠、苯甲酸钠、EDTA钠、氯化钠等。
2. 试剂:葡萄糖、酵母膏、胰蛋白胨、磷酸氢二钠、磷酸二氢钠、苯甲酸钠、EDTA钠、氯化钠等。
四、实验步骤1. 培养基配制:按照实验要求,称取葡萄糖、酵母膏、胰蛋白胨、磷酸氢二钠、磷酸二氢钠、苯甲酸钠、EDTA钠、氯化钠等试剂,加入适量的去离子水,充分溶解后,调节pH至7.0,定容至1000ml。
2. 菌种活化:从菌种保藏管中取出谷氨酸棒杆菌,接种于装有适量培养基的锥形瓶中,置于摇床上,37℃恒温培养24小时。
3. 接种:将活化后的菌种以1%的接种量接种于新鲜培养基中,置于摇床上,37℃恒温培养。
4. 发酵过程监测:每隔2小时取样,测定还原糖含量、谷氨酸含量、pH值等指标。
5. 数据处理与分析:将实验数据绘制成曲线,分析发酵过程中还原糖消耗、谷氨酸生成、pH值变化等规律。
五、实验结果与分析1. 还原糖消耗曲线:在发酵过程中,还原糖含量逐渐降低,表明谷氨酸棒杆菌在消耗葡萄糖的同时,产生谷氨酸。
2. 谷氨酸生成曲线:在发酵过程中,谷氨酸含量逐渐升高,表明谷氨酸棒杆菌在适宜条件下能够高效地将葡萄糖转化为谷氨酸。
3. pH值变化曲线:在发酵过程中,pH值逐渐下降,表明谷氨酸棒杆菌在代谢过程中产生酸性物质。
六、实验结论1. 本实验成功实现了谷氨酸棒杆菌的摇瓶发酵,为谷氨酸生产提供了实验依据。
糖发酵实验报告分析(3篇)

第1篇一、实验背景糖发酵实验是微生物学中一个重要的基础实验,通过观察微生物对糖类的分解利用情况,可以鉴定微生物的种类、研究微生物的代谢特性。
本实验旨在通过糖发酵实验,了解糖发酵的原理、掌握糖发酵实验的操作方法,并对实验结果进行分析。
二、实验目的1. 了解糖发酵的原理和在微生物鉴定中的重要作用。
2. 掌握糖发酵实验的操作方法。
3. 分析实验结果,了解不同微生物对糖类的分解利用情况。
三、实验原理糖发酵实验的基本原理是利用微生物对糖类的分解利用能力,通过观察微生物在发酵培养基中的产酸、产气情况,以及培养基pH值的变化,来鉴定微生物的种类。
实验中常用的糖类有葡萄糖、乳糖、麦芽糖等。
四、实验方法1. 准备实验材料:糖发酵培养基、微生物样本、接种环、培养皿、无菌水等。
2. 将微生物样本接种于糖发酵培养基中。
3. 将培养皿放入恒温培养箱中培养。
4. 定期观察培养基中pH值的变化和产气情况。
5. 记录实验结果。
五、实验结果与分析1. 实验结果(1)pH值变化:实验结果显示,不同微生物对糖类的分解利用能力不同,导致培养基pH值的变化也不同。
例如,大肠杆菌在葡萄糖发酵培养基中产酸,pH值下降;而伤寒杆菌在葡萄糖发酵培养基中只产酸不产气,pH值变化不明显。
(2)产气情况:实验结果显示,部分微生物在糖发酵过程中产生气体。
例如,大肠杆菌在乳糖发酵培养基中产酸产气,而伤寒杆菌在乳糖发酵培养基中只产酸不产气。
2. 实验结果分析(1)pH值变化分析:pH值变化是微生物发酵过程中产生的酸性物质导致的。
不同微生物分解糖类的能力不同,产生的酸性物质种类和数量也不同,从而引起pH值的变化。
通过分析pH值的变化,可以初步判断微生物的种类。
(2)产气情况分析:产气是微生物发酵过程中产生的气体,如二氧化碳、氢气等。
不同微生物的产气情况不同,可以根据产气情况进一步鉴定微生物的种类。
例如,大肠杆菌在乳糖发酵培养基中产酸产气,而伤寒杆菌在乳糖发酵培养基中只产酸不产气。
发酵液还原糖的测定方法

中间体化验操作法发酵液中糖含量的测定:1.原理:利用还原性糖类的自由配合基在碱性溶液中能将高价铜还原成为低价铜,过量的高价铜在酸性溶液中与碘化钾作用生成Cu2I2,同时析出碘,析出的碘以标准硫代硫酸钠(Na2S2O3)溶液滴定,同时做一空白对照,从两者之间求出糖的含量。
反应式如下:酸△(C6H10O6)n n(C6H10O6)水解CuSO4+2NaOHCu(OH)2+Na2SO4CHOH—COONa O—CH--COONaCu(OH)2+Cu +2H2OCHOH—COOK O—CH--COOKO-CHCOOK CHOCu +CHOHO4O-CHCOOK CHOHO--CHCOOK COONa HO--CHCOOK2Cu +NaOH+H2O (CHOH)4+Cu2O+O--CHCOOK CH2OH HO--CHCOONaO—CHCOOK CHOHOOK过量的Cu +2H2SO4O—CHCOOK CHOHOONa+CuSO4+Na++K++SO42-2CuSO4+4KI+2Cu↓2K2SO4+I2(在酸化条件下)I2+2Na2S2O32NaI+Na2S4O62.试剂:1)斐林试剂直接配制法:将酒石酸钾钠800g溶于水中,再溶入硫酸铜160g,加入1N的NaOH溶液1318ml (或固体氢氧化钠580g),最后加入KI400g溶后,加入纯化水至总体积为10000ml,摇匀即得。
2)斐林试剂贮备液的制备a.硫酸铜贮备液:称取硫酸铜(CuSO4·5H2O)800g加纯化水溶解(如浊可用玻璃棉过滤),使总体积成10000ml,摇匀即可。
b.酒石酸钾钠贮备液:称取酒石酸钾钠400g,加纯化水使总体积为1000ml摇匀即得。
c.斐林试剂混合液:取硫酸铜贮备液1000ml,加酒石酸钾钠贮备液1000ml,摇匀加11mol/L氢氧化钠(NaOH)659.5ml或固体NaOH290g,最后加入碘化钾(KI)200g,溶后加入水,使总体积为5000ml。
葡萄酒生产分析检验

葡萄酒中还原糖和总糖的检测葡萄酒中的主要糖类是葡萄糖和果糖,成熟的葡萄果糖的含量较高,葡萄中只有极少的蔗糖。
生产过程中添加的蔗糖在酸和酵母转化酶的作用下水解成葡萄糖和果糖后被酵母利用,称之为可发酵性糖,不能被酵母利用的称之为非发酵性糖或残糖。
根据还原斐林试剂的能力,又可分为还原糖和非还原糖。
在葡萄酒中残糖主要由戊糖(如阿拉伯糖、鼠李糖、木糖及少量的未发酵的葡萄糖和果糖,约0.1~0.2g/L)组成。
1.高效液相色谱法(1)原理利用氨柱,将样品中的果糖、葡萄糖、蔗糖与其他组分分离。
示差折光检测器进行鉴定,外标法定量。
(2)试剂与仪器①超纯水:经纯水机制出的电阻率达到18ΜΩ或经0.45μm微滤膜过滤的新鲜的重蒸水。
②乙腈—水(75+25):将乙腈和水按75+25的比例混合(或根据仪器情况调整该比例至分离效果最佳),用脱气装置充分脱气后,再用0.45μm的油系过滤膜过滤。
该溶液用做流动相。
③糖标准溶液(含总糖45.000g/L):分别称取干燥的葡萄糖、果糖、蔗糖各1.500g(准确至0.001g),移入100mL容量瓶中,用超纯水定容至刻度。
该溶液含葡萄糖、果糖、蔗糖分别为15.000g/LNH④高效液相色谱仪,示差折光检侧器:色谱柱为150mm× 5.0mm,Shim-paek CLC-2柱。
⑤微过滤膜:0.45μm,油系。
⑥脱气装置(或超声波装置)。
(3)测定步骤①试样的制备:将样品用超纯水稀释至总糖量为45g/L左右,并用0.45μm油系微过滤膜过滤。
②色谱条件如下。
柱温:室温;流动相:乙腈十水(75+25);流速:2mL/min;进样量:20μL③测定:在同样的色谱条件下,将糖标准溶液和处理好的试样分别注入色谱仪。
测定各糖分峰面积,井计算其含量。
n C A A X si sii i ⨯⨯= P G X +=12X =1X Z 05.1+式中1X ——样品中还原糖含量(以葡萄糖计),L g /; 2X ——样品中总糖含量(以葡萄糖计),L g /; G ——样品中的果糖含量,L g /;P ——样品中的葡萄糖含量,L g /;Z ——样品中的蔗糖的含量,L g /;05.1——由蔗糖换算为葡萄糖的系数;i X ——样品中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
发酵生产中还原糖和葡萄糖检测指标的分析史建国杨俊慧孟庆军杨艳马耀宏张利群(山东省科学院生物研究所,济南,250014)摘要采用还原糖测定法和葡萄糖酶电极测定法,对谷氨酸发酵生产上淀粉糖原料和发酵液中还原糖和葡萄糖进行了测定,对其变化的特点和意义进行了研究。
结果表明:淀粉糖液中葡萄糖/还原糖比值变化从80% - 94.2%;发酵过程中,谷氨酸生产菌首先消耗葡萄糖,发酵28h,葡萄糖含量接近零,而还原糖含量为 1.0%;还原糖测定仪用于发酵后期还原糖测定,精密度(RSD%)为2.21,对发酵后期的精确控制具有一定的应用价值。
关键词还原糖,葡萄糖,发酵过程控制微生物发酵生产中常以淀粉为基本原料,经水解生成还原糖或葡萄糖,供发酵使用。
糖的检测是生产过程控制的常规生化指标[1]。
近年来,还原糖测定仪和葡萄糖测定仪已在发酵生产中应用,并逐步取代传统的手工滴定法,实现了还原糖和葡萄糖快速、准确的仪器化分析,大大减少了人为测定的误差[2、3]。
但由于测定原理和方法的不同,使测定结果出现了差异。
本文对多年来在谷氨酸发酵生产中测定的还原糖和葡萄糖结果进行了总结,对还原糖和葡萄糖检测指标进行了比较和分析,对发酵生产中仪器分析方法的应用特点和意义进行了探讨。
1材料和方法1.1实验材料淀粉水解液糖化液为莲花集团不同的糖化车间的送检样品;谷氨酸发酵液为菱花集团三分厂送检样品;化学试剂均为分析纯,用蒸馏水配制。
1.2实验方法1.2.1 还原糖测定(1)斐林试剂滴定法采用国家标准测定法(GB/T 5009.7—1985)(2)还原糖测定仪采用山东科学院生物中心提供的SGD-Ⅲ型还原糖测定仪。
该仪器测定原理同还原糖斐林试剂滴定法。
测定方法如下:接通电源(220V),按“开/关”键,自动启动准备程序;用微量注射器将标准品注入反应池,完成后自动定标;测定时,用微量注射器将被测样品注入反应池,仪器自动完成测定过程,并显示和打印测定值。
1.2.2 葡萄糖测定采用山东省科学院生物研究所提供的SBA-40型谷氨酸-葡萄糖双功能分析仪。
其原理是葡萄糖氧化酶(GOD)在有氧条件下催化葡萄糖,在过氧化氢型电极上产生电流。
该电流值与葡萄糖的浓度有线性比例关系。
测定方法如下:仪器开机后,自动进入清洗过程。
当仪器出现进样指令后,用微量进样器取25μL标准溶液注入反应池,仪器自动显示校正结果。
测定时,用微量进样器取25μL样品液注入反应池,20s后仪器自动显示或打印测定值。
2结果与讨论2.1 淀粉糖样品中还原糖和葡萄糖测定将糖化车间送检的淀粉糖化液分别稀释。
还原糖测定时稀释糖浓度至1%以内,采用费林氏剂滴定法测定;葡萄糖测定稀释至0.1% 以内,采用葡萄糖酶电极分析仪测定。
测定值乘以稀释倍数为测定结果(表1)。
该试验所提供的糖化样品DE值都在95以上,且颜色浅,透光率好,按常规质量标准衡量基本一致。
但样品中葡萄糖/还原糖值变化较大。
由表1可以看出:葡萄糖/还原糖比值变化从80% - 94.2%;其中,11、12号样品还原糖含量差别仅有0.2%,而葡萄糖/还原糖比值相差8%以上。
因此,采用发酵生产中葡萄糖和还原糖的测定对常规糖质量控制标具有一定的应用价值。
表1 淀粉糖液中还原糖和葡萄糖测定结果样品还原糖(%)葡萄糖(%)葡萄糖/还原糖(%)1 34.0 31.47 93.02 33.0 31.1 94.23 32.5 30.25 93.14 31.5 29.0 92.15 27.0 25.75 95.46 25.5 23.6 92.67 19.6 18.0 92.08 18.8 17.4 92.69 17.6 15.6 88.610 16.0 14.0 87.511 15.2 13.4 88.212 15.0 12.0 80.013 13.6 11.8 86.82.2 发酵过程还原糖和葡萄糖的测定将发酵液分别稀释,采用斐林氏剂滴定法测定还原糖;采用葡萄糖酶电极分析仪测定葡萄糖。
测定值乘以稀释倍数为测定结果。
根据发酵时间顺序,取不同发酵罐在同一发酵时间上测定结果的平均值进行比较分析,结果见表2。
表 2 发酵过程葡萄糖和还原糖含量的测定结果时间(h)还原糖(%)葡萄糖(%)0 15.2 13.96 14.4 13.08 13.5 11.910 11.8 10.412 10.2 8.914 8.3 7.216 6.4 5.418 5.4 4.320 4.3 3.222 3.0 1.924 1.8 1.026 1.5 0.528 1.0 0.130 0.8 0.132 0.3 0.1由表2可以看出:发酵开始时,发酵液中还原糖含量高于葡萄糖1.09%;葡萄糖/还原糖为92%;在0-8h之间,还原糖代谢速率为0.215% ,葡萄糖为0.225%;8h以后,谷氨酸发酵代谢速率明显提高,在10 –24h,还原糖与葡萄糖平均代谢速率基本相同,在0.8% 左右。
26h以后,发酵进入后酵期,还原糖和葡萄糖消耗速率下降。
在发酵28h,葡萄糖含量接近零,而还原糖含量为 1.0%。
28h以后,发酵是在葡萄糖为零的状态下进行。
说明在发酵过程中,菌体首先消耗葡萄糖,葡萄糖是谷氨酸生产菌的优势碳源和能源。
因此,发酵原料中葡萄糖含量的测定具有重要的意义。
但对于发酵后期控制,还原糖指标的测定更为重要。
2.3 发酵后期还原糖的测定采用还原糖测定仪对谷氨酸发酵后期样品进行测定。
用微量进样器吸取500μL样品,不经稀释直接进行测定。
连续测定8次,结果见表3。
表3 发酵后期还原糖测定结果测定值(%) 0.369 0.373 0.371 0.378 0.392 0.389 0.377 0.374 0.376平均值(%) 0.378标准差(S) 0.008RSD(%) 2.21由以上结果可以看出,对于发酵后期样品(还原糖含量小于1%)还原糖测定仪可以直接测定,不需样品的稀释,而且测定结果准确,相对误差不超过0.1%,一般在0.05%以内,精密度(RSD%)为2.21%。
目前,发酵生产中常用斐林试剂手工滴定法,人为测定误差一般在0.2 - 0.5%之间。
对于一个100吨的发酵罐,放罐前0.5% 的测定误差意味着约有400公斤的还原糖进入下游过程,不仅造成原料的损失,也影响后提取效率,对后期污水处理也带来不稳定控制因素。
因此,发酵后期控制过程需要对还原糖进行精确的测定。
第一作者:博士研究员参考文献[1] Andre Fernando Oliveira, Orlando Fatibello- Filho. Flow injection spectrophotometric determination of reducing sugars using a focalized coiled reactor in a domestic microwave oven[J]. Talanta, 1999,50:899 ~ 904[2] 孙士青,李智红. 电极法测定食品中葡萄糖含量的研究[J]. 营养学报, 1998,(20)2:229 ~ 233[3] 史建国,马耀宏, 张利群等. 还原糖快速测定技术在谷氨酸发酵过程中的应用[J]. 食品与发酵工业,2003,29(11):107 ~ 108Evaluation of Reducing Sugar and Glucose for Fermentation Process ControlShi Jianguo Yang Junhui Meng Qingjun Yang Yan Ma Yaohong Zhang Liqun(Biology Research Institute of Shandong Academy of Sciences, Jinan, 250014, China)ABSTRACT The reducing sugar and glucose in starch sugar products and fermentation liquids were determined by using Fehling reagent method and glucose oxidase electrode respectively. The significance of the two parameters for fermentation process control were discussed. The results showed that the ratios of glucose and reducing sugar in different sugar products varied from 80% to 94.2%; During the fermentation period glucose was preferably consumed, reaching a very low concentration( 0.1%) at 28 h, whereas the reducing sugar remained at a concentration of 1.0%. Reducing sugar in final fermentation stage was determined with higher accuracy and precision (RSD = 2.21%) using the autoanalyzer, which is practical and efficient for the final stage control.Key words reducing sugar, glucose, fermentation process control。
