理想气体的状态方程(习题)
理想气体状态方程练习及答案

例1:如图所示,气缸A和容器B由一细管经阀门K相 连,A和B的壁都是透热的,A是放置在27℃、1atm 的空气中,B浸在127℃的恒温槽内.开始时,K是关 闭的,B内为真空,容积VB=10L,A内装有理想气体 ,体积VA=10L.假设气缸壁和活塞D之间无摩擦,细 管的容积可忽略不计,打开K,使气体由A流入B, 等到活塞D停止移动时,A内气体的体积将是多少? 答案:A内气体的体积将是2.5L
答案: ① p=1.43×105pa ,②fm=600N
例7:一个质量可不计的活塞将一定量的气体封闭在上端开口 的直圆柱形气缸内,活塞的面积为600cm3,活塞上堆放着铁砂, 如图所示。最初活塞搁置在气缸内壁的固定卡环上,气体柱的 高度为H0=20cm,温度为20℃,气体压强为1atm。 (不计活塞 与气缸之间的摩擦) ①现对气体缓缓加热,当气体温度升高到57℃时,活塞(及铁砂) 刚好开始离开卡环而上升,求铁砂的质量。 ②继续加热,当温度又升高多少时,气体柱高度H1长为30cm。 ③此后维持温度不变,逐渐取走铁砂,则直到铁砂全部取走 时,气柱长H2为多少?
答案: ①铁砂的质量为60kg。 ②温度为495K,又升高了165K。 ③H2为33cm。
例8: 、如图所示,气缸放置在水平平台上,活塞质量为 10kg,横截面积50cm2,厚度1cm,气缸全长21cm, 气缸质量20kg,大气压强为1×105Pa,当温度为7℃时, 活塞封闭的气柱长10cm,若将气缸倒过来放置时,活塞 下方的空气能通过平台上的缺口与大气相通 。g取10m/s2求: (1)气柱多长? (2)当温度多高时,活塞刚好接触平台? (3)当温度多高时,缸筒刚好对地面无压力。 (活塞摩擦不计)。
答案:(1)28cm(2)237℃
例5:如图所示,一个内径均匀的双U形曲管,用水银柱 将管的A部分封闭了一定质量的气体,当温度为T1 (K)时,空气柱A的长度为40 cm,右侧曲管的水银面 高度差为16 cm,当温度变为T2(K)时,量得曲管B处 的水银面比原来升高了10 cm,若外界大气压为76 cmHg,则T1: T2应为( ). A.2:1 B.3:1 C.4:1 D.3:2
理想气体状态方程计算题 半张

接着根很细的弹簧,已知活塞的横截面积S=0.01m,大气压强P=1.0×10Pa。
当缸内气体温度为27℃时弹簧的长度为30cm,汽缸内气体压强为缸外大气压的1.2倍,当缸内气体温度升高到327℃时,弹簧的长度为36cm。
不计活塞与缸壁的摩擦且两个过程弹簧都处于拉伸状态,求(1)此时汽缸内气体的压强P2(2)此过程中缸内气体对外做的功2.如图所示,一个内壁光滑的圆柱形汽缸竖直放在水平地面上,缸内部横截面积S=10cm2,用质量m=l0kg的活塞在汽缸内封闭一定质量的气体,活塞可以在缸内无摩擦地滑动,外界大气压p0=1.0×105pa。
当气体温度T1=300K时,封闭气柱长h=40cm,活塞保持静止,重力加速度g=10m/s2,则:(1)在活塞上再放一质量为M=20kg的物块,活塞将向下移动,使活塞停在一个新的位置保持静止,若变化过程中温度不变,求活塞移动的距离△h。
(2)欲使活塞再回到原来的位置,需要使温度升高到T2,求T2。
12p0=76cmHg,气体初始温度t1=57℃。
(i)将气体温度缓慢升高至多少K时,所有水银会全部挤入细管内?(ii)求温度升高至T3=492K时,液柱下端距离玻璃管底部的高度h。
接着根很细的弹簧,已知活塞的横截面积S=0.01m,大气压强P=1.0×10Pa。
当缸内气体温度为27℃时弹簧的长度为30cm,汽缸内气体压强为缸外大气压的1.2倍,当缸内气体温度升高到327℃时,弹簧的长度为36cm。
不计活塞与缸壁的摩擦且两个过程弹簧都处于拉伸状态,求(1)此时汽缸内气体的压强P2(2)此过程中缸内气体对外做的功2.如图所示,一个内壁光滑的圆柱形汽缸竖直放在水平地面上,缸内部横截面积S=10cm2,用质量m=l0kg的活塞在汽缸内封闭一定质量的气体,活塞可以在缸内无摩擦地滑动,外界大气压p0=1.0×105pa。
当气体温度T1=300K时,封闭气柱长h=40cm,活塞保持静止,重力加速度g=10m/s2,则:(1)在活塞上再放一质量为M=20kg的物块,活塞将向下移动,使活塞停在一个新的位置保持静止,若变化过程中温度不变,求活塞移动的距离△h。
理想气体的状态方程习题

理想气体状态方程习题1.如图所示,A、B两点代表一定质量理想气体的两个不同的状态,状态A的温度为T A,状态B的温度为T B。
由图可知A.T A =2T B B.T B =4T AC.T B =6T A D.T B =8T A2.一定质量理想气体A.先等压膨胀再等容降温,其温度必低于起始温度B.先等温膨胀再等压压缩,其体积必小于起始体积C.先等容升温再等压压缩,其温度有可能等于起始温度D.先等容加热再绝热压缩,其内能必大3.对于一定质量的理想气体,下述四个论述中正确的是A.当分子热运动变剧烈时,压强必变大B.当分子热运动变剧烈时,压强可以不变C.当分子间的平均距离变大时,压强必变小D.当分子间的平均距离变大时,压强必变大4.对一定质量的理想气体,下列状态变化中不可能的是A.使气体体积增大,同时温度降低、压强减小B.使气体温度升高,体积不变、压强减小C.使气体温度不变,而压强、体积同时增大D.使气体温度降低,压强减小、体积减小5.在下图中,不能反映理想气体经历了等温变化→等容变化→等压变化,又回到原来状态的图是6.如图所示,一定质量的理想气体,由状态A沿直线AB变化到B,在此过程中,气体分子的平均速率的变化情况是A.不断增大B.不断减小C.先减小后增大D.先增大后减小7.一定质量的某种气体自状态A经状态C变化到状态B,这一过程在V-T图上如图所示,则A.在过程AC中,气体的压强不断变大B.在过程CB中,气体的压强不断变小C.在状态A时,气体的压强最大D .在状态B 时,气体的压强最大8.如图所示,内壁光滑的气缸和活塞都是绝热的,缸内被封闭的理想气体原来体积为V ,压强为p ,若用力将活塞向右压,使封闭的气体体积变为V 2,缸内被封闭气体的 A .压强等于2p B .压强大于2p C .压强小于2p D .分子势能增大了9.甲、乙两个相同的密闭容器中分别装有等质量的同种气体,已知甲、乙容器中气体的压强分别为p 甲、p 乙,且p 甲<p 乙,则A .甲容器中气体的温度高于乙容器中气体的温度B .甲容器中气体的温度低于乙容器中气体的温度C .甲容器中气体分子的平均动能小于乙容器中气体分子的平均动能D .甲容器中气体分子的平均动能大于乙容器中气体分子的平均动能10.已知理想气体的内能与温度成正比.如图所示的实线为汽缸内一定质量的理想气体由状态1到状态2的变化曲线,则在整个过程中汽缸内气体的内能A .先增大后减小B .先减小后增大C .单调变化D .保持不变11.一定质量的气体做等压变化时,其V -t 图象如图所示,若保持气体质量不变,使气体的压强增大后,再让气体做等压变化,则其等压线与原来相比,下列可能正确的是A .等压线与t 轴之间夹角变大B .等压线与t 轴之间夹角不变C .等压线与t 轴交点的位置不变D .等压线与t 轴交点的位置一定改变12.如图所示为一定质量的理想气体沿着所示的方向发生状态变化的过程,则该气体压强变化是A .从状态c 到状态d ,压强减小B .从状态d 到状态a ,压强不变C .从状态a 到状态b ,压强增大D .从状态b 到状态c ,压强不变13.如图所示,一定质量的某种理想气体,由状态A 沿直线AB 变化到状态B ,A 、C 、B 三点所对应的热力学温度分别记为T A 、T C 、T B ,在此过程中,气体的温度之比T A ∶T B ∶T C 为A .1∶1∶1B .1∶2∶3C .3∶3∶4D .4∶4∶314.如图所示是一定质量的理想气体的p-V图线,若其状态由A→B→C→A,且A→B等容,B→C等压,C→A等温,则气体在ABC三个状态时A.单位体积内气体的分子数n a=n B=n CB.气体分子的平均速率v A>v B>v CC.气体分子在单位时间内对器壁的平均作用力F A>F B,F B=F CD.气体分子在单位时间内,对器壁单位面积碰撞的次数是N A>N B,N A>N C15.光滑绝热的活塞把密封的圆筒容器分成A、B两部分,这两部分充有温度相同的气体,平衡时V A∶V B=1∶2,现将A中气体加热到127 ℃,B中气体降低到27 ℃,待重新平衡后,这两部分气体体积的比V′A∶V′B为A.1∶1 B.2∶3 C.3∶4 D.2∶116.一个半径为0.1 cm的气泡,从18 m深的湖底上升.如果湖底水的温度是8 ℃,湖面的温度是24 ℃,湖面的大气压强是76 cmHg,那么气泡升至湖面时体积是多少?17.如图所示粗细均匀一端封闭一端开口的U形玻璃管,当t1=31℃,大气压强P0=76cmHg时,两管水银面相平,这时左管被封闭的气柱长L l= cm,则(1)当温度t2等于多少时,左管气柱长为9 cm?(2)当温度达到上问中的温度t2时,为使左管气柱长为8cm,应在右管中加人多长的水银柱?。
高三物理气体的状态方程试题

高三物理气体的状态方程试题1.图为一定质量理想气体的压强p与体积V关系图象,它由状态A经等容过程到状态B,再经等压过程到状态C,设A、B、C状态对应的温度分别为TA 、TB、TC,则下列关系式中正确的是。
(填选项前的字母)A.TA <TB,TB<TCB. TA>TB,TB=TCC. TA>TB,TB<TCD. TA=TB,TB>TC【答案】C【解析】根据理想气体状态方程可得:从A到B,因体积不变,压强减小,所以温度降低,即TA >TB;从B到C,压强不变,体积增大,故温度升高,即TB<TC,故A、B、D错误,C正确。
【考点】本题考查理想气体状态方程2.一定质量的气体,在保持体积不变的情况下,使压强增大到原来的1.5倍,则其温度由原来的27o C变为___________。
(填选项前的字母)A.40.5o C B.177 o C C.313.5o C D.450o C【答案】B【解析】以气体为研究对象,设气体初状态压强为p,由题意可知,初状态温度:,压强:p,末状态压强:,由查理定律得:即:,解得:;B正确;【考点】考查了理想气体的状态方程.3.一定质量的某种理想气体从状态A开始按图所示的箭头方向经过状态B达到状态C,已知气体在A状态时的体积为2L,求:①气体在状态C时的体积;②说明A→B、B→C两个变化过程是吸热还是放热,并比较A→B、B→C两个过程中热量的大小。
【答案】(1)4L (2)A到B过程吸热 B到C过程放热大于【解析】①气体A状态体积V1,温度T1;C状态体积V2,温度T2。
根据理想气体状态方程(3分)解得: (1分)②气体A到B过程吸热(2分)气体B到C过程放热(2分)气体A到B过程吸收的热量大于气体B到C过程放出的热量(2分)【考点】本题考查理想气体状态方程。
4.题图为伽利略设计的一种测温装置示意图,玻璃管的上端与导热良好的玻璃泡连通,下端插入水中,玻璃泡中封闭有一定量的空气.若玻璃管内水柱上升,则外界大气的变化可能是A.温度降低,压强增大B.温度升高,压强不变C.温度升高,压强减小D.温度不变,压强减小【答案】 A【解析】外界温度降低,若被封闭气体体积不变,根据知:压强减小,液柱上升,内外液柱高度差变大,若外界大气压升高也可能使液柱上升,选项A正确;由可知,当T增大V减小,则p一定增大,而液柱上升,说明外界大气压增大,选项B、C错误;被封闭气体温度不变,液柱升高,气体体积减小,由可知气体压强增大,则外界压强一定增大,选项D错误.5.如图所示,容积一定的测温泡,上端有感知气体压强的压力传感器。
(完整版)理想气体状态方程专题训练
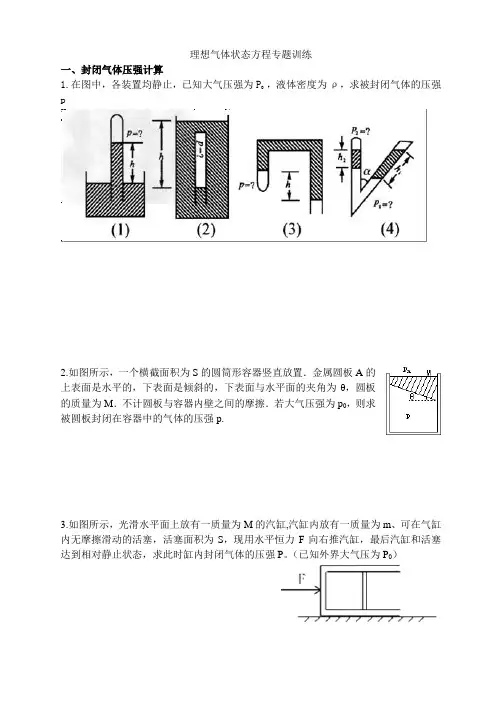
理想气体状态方程专题训练一、封闭气体压强计算1.在图中,各装置均静止,已知大气压强为P0 ,液体密度为ρ,求被封闭气体的压强p2.如图所示,一个横截面积为S的圆筒形容器竖直放置.金属圆板A的上表面是水平的,下表面是倾斜的,下表面与水平面的夹角为θ,圆板的质量为M.不计圆板与容器内壁之间的摩擦.若大气压强为p0,则求被圆板封闭在容器中的气体的压强p.3.如图所示,光滑水平面上放有一质量为M的汽缸,汽缸内放有一质量为m、可在气缸内无摩擦滑动的活塞,活塞面积为S,现用水平恒力F向右推汽缸,最后汽缸和活塞达到相对静止状态,求此时缸内封闭气体的压强P。
(已知外界大气压为P0)二、理想气体状态方程的基础应用4.一定质量的理想气体由状态A经过状态B变为状态C,其有关数据如p-T图象甲所示.若气体在状态A的温度为-73.15℃,在状态C的体积为0.6m3.求:(1)状态A的热力学温度;(2)说出A至C过程中气体的变化情形,并根据图象提供的信息,计算图中V A的值;(3)在图乙坐标系中,作出由状态A经过状态B变为状态C的V-T图象,并在图线相应位置上标出字母A、B、C.如果需要计算才能确定坐标值,请写出计算过程.三、单一封闭气体问题5.一足够长的粗细均匀的玻璃管开口向上竖直放置,管内由15cm长的水银柱封闭着50cm长的空气柱.若将管口向下竖直放置,空气柱长变为多少cm?(设外界大气压强为75cmHg,环境温度不变)6.在如图所示的气缸中封闭着温度为400K的空气,一重物用绳索经滑轮与缸中活塞相连接,重物和活塞均处于平衡状态,这时活塞离缸底的高度为10cm,如果缸内空气变为300K,问:(1)重物是上升还是下降?(2)这时重物将从原处移动多少厘米?(设活塞与气缸壁间无摩擦)7.如图所示,固定的绝热气缸内有一质量为m的“T”型绝热活塞(体积可忽略),距气缸底部h0处连接一U形管(管内气体的体积忽略不计).初始时,封闭气体温度为T0,活塞距离气缸底部为1.5h0,两边水银柱存在高度差.已知水银的密度为ρ,大气压强为p0,气缸横截面积为s,活塞竖直部分长为1.2h0,重力加速度为g.试问:(1)初始时,水银柱两液面高度差多大?(2)缓慢降低气缸内封闭气体的温度,当U形管两水银面相平时封闭气体的温度是多少?8.一汽缸竖直放在水平地面上,缸体质量M= 10kg,活塞质量M=4kg,活塞横截面积S=2×10-3 m2,活塞上面的汽缸内封闭了一定质量的理想气体,下面有气孔O与外界相通,大气压强p0=1.0×105Pa.活塞下面与劲度系数k = 2×103 N/m 的轻弹簧相连.当汽缸内气体温度为127℃时弹簧为自然长度,此时缸内气柱长度L1=20 cm,g取10m/s2,缸体始终竖直,活塞不漏气且与缸壁无摩擦.①当缸内气柱长度L2=24cm时,缸内气体温度为多少K?②缸内气体温度上升到T0以上,气体将做等压膨胀,则T0为多少K?四、多个相互关联的封闭气体问题9.如图,绝热气缸A与导热气缸B均固定于地面,由刚性杆连接的绝热活塞与两气缸间均为摩擦。
理想气体状态方程基础练习题之二(含答案)(231-460题)
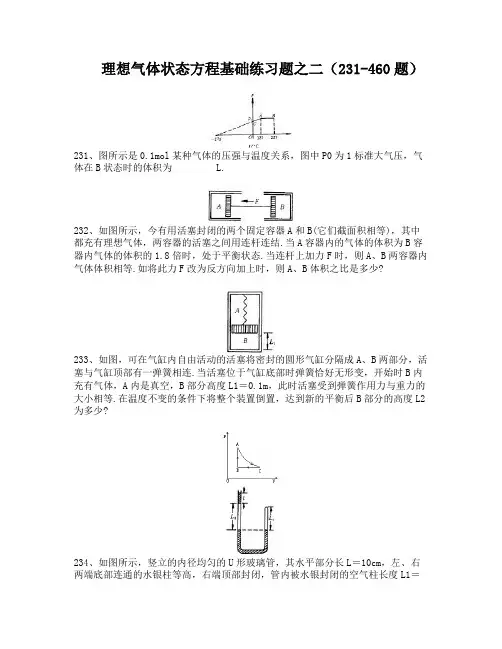
理想气体状态方程基础练习题之二(231-460题)231、图所示是0.1mol某种气体的压强与温度关系,图中P0为1标准大气压,气体在B状态时的体积为 L.232、如图所示,今有用活塞封闭的两个固定容器A和B(它们截面积相等),其中都充有理想气体,两容器的活塞之间用连杆连结.当A容器内的气体的体积为B容器内气体的体积的1.8倍时,处于平衡状态.当连杆上加力F时,则A、B两容器内气体体积相等.如将此力F改为反方向加上时,则A、B体积之比是多少?233、如图,可在气缸内自由活动的活塞将密封的圆形气缸分隔成A、B两部分,活塞与气缸顶部有一弹簧相连.当活塞位于气缸底部时弹簧恰好无形变,开始时B内充有气体,A内是真空,B部分高度L1=0.1m,此时活塞受到弹簧作用力与重力的大小相等.在温度不变的条件下将整个装置倒置,达到新的平衡后B部分的高度L2为多少?234、如图所示,竖立的内径均匀的U形玻璃管,其水平部分长L=10cm,左、右两端底部连通的水银柱等高,右端顶部封闭,管内被水银封闭的空气柱长度L1=8cm,左端开口,管中上部有一段长为ι=5cm的水银柱将长度L2=10cm的空气柱封闭住,现将这U形管由竖立按顺时针方向转动90°成水平放置,则左管内水银柱ι将向何方移动?移动距离为多少?(大气压强为0.98×105Pa)235、图为一定质量的理想气体的p-V图线,BA段表示____过程,CB段表示____过程,AC段是一段双曲线表示____变化过程。
236、温度为273℃,压强为22.4大气压的氢气的密度,是标准状态下氢气密度的____倍237、一定质量的理想气体从状态A开始变化, 先等温压缩至状态B, 由状态B再等压膨胀至状态C, 那么图所示图像哪个能反映上述变化过程( )翰林汇238、用热力学温度表示0oC到100oC的温度变化是().(A)100K (B)273K (C)373K (D)173K239、如图所示,一定质量的理想气体,从状态A→B,状态A的体积是VA, 状态B的体积是VB,两者比较有().(A)VA>VB (B) VA<VB (C) VA=VB (D)无法确定240、如图所示,一端封闭的玻璃管开口向下插入水银槽内,管内封有一定质量的理想气体,形成管内外水银面高度差,如果把玻璃管向上稍提一些,将发生变化的是().(A)管内气体体积减小(B)管内气体体积增大(C)管内外水银面高度差减小(D)管内外水银面高度差增大241、如图所示为一定质量的理想气体的P~V图线,BA段表示________变化过程.BC段表示________变化过程,AC段是一段双曲线表示________变化过程.242、一定质量的理想气体做等温膨胀时,下列说法正确的是().(A)气体对外做功,内能将减小(B)气体吸热,内能将增加(C)分子平均动能增加,但单位体积分子数减少,造成压强降低(D)分子平均动能不变,但单位体积内分子数减少,造成压强降低243、内径均匀的U形玻璃管,封闭着A、B两部分气体,U形管右侧水银面低于左侧水银面hcm,如图所示,当外界温度升高时,B气体的体积将().(A)增大 (B)减小 (C)不变 (D)可能增大,可能减小244、汽缸的横截面积是100 cm2,缸内有一个能自由上下移动的活塞,活塞下封闭着压强是76 mmHg的空气,温度是17℃时,活塞处于静止,和汽缸底相距60cm,若在活塞上加放100 kg的重物,空气温度升高到27℃,求平衡后,活塞下移的距离。
知识点:理想气体状态方程式(综合训练)
求:V0=? 解:空气的质量流量不变,则有
PV P0V0
T
T0
该风量换算为标准状态下风量为
V0
V
PT0 P0T
10200 869 273 760 (273 300)
5556.7
Nm3/h
知识点:理想气体状态方程式
3. 空气压缩机的贮气罐上的压力表读数为0.35MPa,温
度计读数为20℃。该贮气罐容积为2.8m3,求罐内空气质量。 已知大气压力755mmHg。若经过一段时间后,由于漏气使压 力表读数降低为0.305MPa,其余不变,求漏掉的空气质量。
已知:贮气罐初参数pe1=0.35MPa t1=20℃ V1=2.8m3 贮气罐终参数pe2=0.305MPa t2=20℃ V2= V1 大气 压pb=755mmHg
求:初参数下罐内空气质量m1=?、终参数下漏掉的空 气质量m1-m2=?
解:贮气罐初始绝对压力 p1= pb+pe1 =755×133.3+0.35×106=450641.5Pa
由理想气体状态方程,初参数下罐内空气质量
知识点:理想气体状态方程式
m1
p1V1 RT1
450641.5 2.8 287 (273 20)
15
kg
终参数下漏掉的空气质量
m1
m2
V1 RT1
( p1
p2 )
V1 RT1
( pe1
pe2 )
2.8 (0.35 0.305) 106 1.5 kg 287 293
理想气体的状态方程
(1)等容变化 等压变化 (2)-73 ℃
等温变化
V/L
补充:气体状态变化的图像问题
用图像表示气体状态变化的过程及变化规律具有形 象、直观、物理意义明朗等优点.利用图像对气体 状态、状态变化及规律进行分析,会给解答带来很 大的方便. 图像上的一个点表示一定质量气体的一个平衡状态, 它对应着三个状态参量;图像上的某一条直线或曲 线表示一定质量气体状态变化的一个过程. 而理想气体状态方程实质上是三个实验定律的推广 与拓展,它们可以由三个实验定律中的任意两个而 得到.反之,我们也可以把状态方程分三种情况进 行讨论.
pV (105Pam3)
1.00 1.36 2.07
一、理想气体 假设这样一种气体,它在任何温度和任何压强下都能严 格地遵循气体实验定律,我们把这样的气体叫做“理想气 体”。 理想气体的特点: 1、气体分子是一种没有内部结构,不占有体积的刚性质 点; 2、气体分子在运动过程中,除碰撞的瞬间外,分子之间 以及分子和器壁之间都无相互作用力. 3、分子之间、分子与器壁之间的碰撞,都是弹性碰撞。 除碰撞以外,分子的运动是匀速直线运动,各个方向的运 动机会均等. 4、理想气体分子之间无相互作用的势能,理想气体的内 能只与温度和分子总数有关,与气体的体积无关!
公式: pV =C1
2、査理定律:
P C2 公式: T
V 3、盖-吕萨克定律: 公式: C3 T
问题1.气体实验定律成立条件?
一定质量的某种气体在压强不太大,温 度不太低时遵守
问题2.压强很大、温度很低时
p(105Pa)
一定 质量 氦气 1.00 500 1000
V(m3)
1.00 1.36/500 2.07/1000
理想气体是不存在的: 1、在常温常压下,大多数实际气体,尤其是那些不易液 化的气体都可以近似地看成理想气体. 2、在温度不太低(温度不低于负几十摄氏度),压强不 太大(压强不超过大气压的几倍)时,很多气体都可当成 理想气体来处理. 二、理想气体状态方程的推导 对于一定质量的理想气体的状态可用三个状态参量p、 V、T来描述,且知道这三个状态参量中只有一个变而另 外两个参量保持不变的情况是不会发生的。换句话说:若 其中任意两个参量确定之后,第三个参量一定有唯一确定 的值。它们共同表征一定质量理想气体的唯一确定的一个 状态。
气体定律的练习题
气体定律的练习题一、理想气体状态方程理想气体状态方程可表示为PV = nRT,其中P为气体的压力,V为气体的体积,n为气体的物质的量,R为气体常数,T为气体的绝对温度。
1. 一个容器中有2mol的氧气,该容器的体积为10L,温度为20°C。
计算氧气的压力。
解析:首先将温度转换为绝对温度,即20°C + 273.15 = 293.15 K。
代入理想气体状态方程中,得到P * 10 = 2 * 8.314 * 293.15,解得P ≈ 38.85 Pa。
2. 一瓶氮气的体积为5L,温度为25°C,物质的量为0.5mol。
求氮气的压力。
解析:将温度转换为绝对温度,即25°C + 273.15 = 298.15 K。
代入理想气体状态方程中,得到P * 5 = 0.5 * 8.314 * 298.15,解得P ≈ 81.86 Pa。
二、玻意耳-马略特定律根据玻意耳-马略特定律,当气体的物质的量和温度不变时,气体的压力与体积成反比。
3. 一气缸中的气体初始压力为2 atmos,体积为10L。
如果将气体的体积减小为5L,求气体的最终压力。
解析:根据玻意耳-马略特定律,初始压力P1 * 初始体积V1 = 终端压力P2 * 终端体积V2,代入已知条件,得到2 * 10 = P2 * 5,解得P2 = 4 atmos。
4. 一容器中的氧气体积为10L,压力为2 atm。
如果将氧气体积增大到20L,求氧气的最终压力。
解析:根据玻意耳-马略特定律,初始压力P1 * 初始体积V1 = 终端压力P2 * 终端体积V2,代入已知条件,得到2 * 10 = P2 * 20,解得P2 = 1 atm。
三、查理定律根据查理定律,当气体的压力和温度不变时,气体的体积与物质的量成正比。
5. 一个容器中含有3mol的气体,体积为12L。
如果将气体的物质的量增加到6mol,求气体的最终体积。
解析:根据查理定律,初始物质的量n1 / 初始体积V1 = 终端物质的量n2 / 终端体积V2,代入已知条件,得到3 / 12 = 6 / V2,解得V2 = 24L。
专题---理想气体状态方程计算题带答案
Word 资料理想气体状态方程计算题 1、如图所示,竖直放置的粗细均匀的 U 形管,右端封闭有一段空气柱,两管内水 银面高度差为h = 19 cm ,封闭端空气柱长度为 L i = 40 cm.为了使左、右两管中的 水银面相平,(设外界大气压强 p o = 76 cmHg ,空气柱温度保持不 变)试问: ①需从左管的开口端再缓慢注入高度多少的水银柱?此时封 闭端空气柱的长度是多少?②注入水银过程中,外界对封闭空气做 ________ (填“正功” “负功” 或“不做功”),气体将 _____ (填“吸热”或“放热”). 始温度为T °= 200 K ,外界大气压恒定不变为 p 0= 76 cmHg 。
现将玻璃管开口圭寸闭, 将系统温度升至 T = 400 K ,结果发现管中水银柱上升了 2 cm ,若空气可以看作理想气体,试求:①升温后玻璃管内封闭的上下两部分空气的压强分别为多少cmHg?②玻璃管总长为多少?5、如图所示为一简易火灾报警装置。
其原理是:竖直放置的试管中装有水银,当 温度升高时,水银柱上升,使电路导通,蜂鸣器发出报警的响声。
27 C 时,空气柱长度L i 为20cm ,水银上表面与导线下端的距离 L ?为10cm ,管内水银柱的高度 h 为8cm ,大气压强为75cm 水银柱高。
2、如图所示,U 形管右管横截面积为左管横截面积的 2倍,在左管内用水银封闭 一段长为26 cm 、温度为280 K 的空气柱,左、右两管水银面高度 差为36 cm ,外界大气压为76 cmHg 。
若给左管的封闭气体加热, 使管内气柱长度变为 30 cm ,则此时左管内气体的温度为多少?r26 r rn36 cdJdt-Jr —— (1 )当温度达到多少C 时,报警器会报警?(2)如果要使该装置在 87 C 时报警,则应该再往玻璃管 内注入多少cm 高的水银柱? ( 3)如果大气压增大,则该报警器的报警温度会受到怎样的影响?3、如图所示为一可以测量较高温度的装置,左、右两壁等长的 U 形管内盛有温度为0 C 的水银,左管上端开口,水银恰到管口,在封闭的右管上方有空气, 空气柱高h = 24 cm ,现在给空气柱加热,空气膨胀,挤出部分水银,当空气又 冷却到0 C 时,左边开口管内水银面下降了 H =5 空气被加热到的最高温度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
理想气体的状态方程一、选择题1.对于一定质量的理想气体,下述四个论述中正确的是().A.当分子热运动变剧烈时,压强必变大B.当分子热运动变剧烈时,压强可以不变C.当分子间的平均距离变大时,压强必变小D.当分子间的平均距离变大时,压强必变大2.关于理想气体,下列说法中哪些是正确的?()A.严格遵守玻意耳定律和查理定律以及盖一吕萨克定律的气体称为理想气体B.理想气体客观上是不存在的,它只是实际气体在一定程度上的近似C.温度不太低(和室温比较)和压强不太大(和大气压比较)条件下的实际气体可以近似看成理想气体D.和质点的概念一样,理想气体是一种理想化的模型3.一绝热隔板将一绝热长方形容器隔成两部分,两边分别充满气体,隔板可无摩擦移动.开始时,左边的温度为0℃,右边的温度为20℃,当左边的气体加热到20℃,右边的气体加热到40℃时,则达到平衡状态时隔板的最终位置().A.保持不动B.在初始位置右侧C.在初始位置左侧D.决定于加热过程4.常温下,在密闭容器里分别充入两种气体0.1 mol,在一定条件下充分反应后,恢复到原温度时,压强降低为初始的14,则原混合气体可能是().A.H2和O2B.H2和Cl2C.NH3和HCl D.CO和O25.一定质量的理想气体的p-t图象如图所示,在状态A变化到状态曰的过程中,体积().A.一定不变B.一定减小C.一定增加D.可能不变6.如图所示,a、b、c分别是一定质量的理想气体的三个状态点,设a、b、c状态的气体体积分别为V a、V b、V c,则下列关系中正确的是().A.V a<V b<V c B.V a>V b=V c C.V a=V b<V c D.V a=V b>V c7.如图所示,p0为标准大气压,0.2摩尔某种气体在B状态时的体积是().A.48 L B.5.6 L C.4.48 L D.2.24 L8.一定质量的理想气体由状态A沿着图所示的过程变化到B,下列分析正确的是().A.气体的温度保持不变B.气体的温度先不变,后降低C.气体的内能保持不变D.气体的内能先不变,后减小9.如图所示,U型气缸固定在水平地面上,用重力不计的活塞封闭着一定质量的气体,已知气缸不漏气,活塞移动过程无摩擦。
初始时,外界大气压为p0,活塞紧压小挡板。
现缓慢升高缸内气体温度,气缸内气体压强p随热力学温度T的变化规律是().10.如图8-4-33所示,左边容器的体积是右边容器的4倍,两边充以同种气体,温度分别为20℃和10℃,此时连接两容器的细玻璃管内的水银柱保持静止,如果容器两边的气体温度各升高10℃,忽略水银柱及容器的膨胀,则水银柱将().A.向左移动B.向右移动C.静止不动D.条件不足,无法判断11.图所示,一定质量的理想气体由状态A沿平行于纵轴的直线变化到状态B,则它的状态变化过程是().A.气体的温度不变B .气体的内能增加C .气体分子的平均速率减小D .气体分子在单位时间内与器壁单位面积碰撞的次数不变二、解答题12.内径均匀的L 形直角细玻璃管,一端封闭,一端开口竖直向上,用水银柱将一定质量空气封存在封闭端内,空气柱长4 cm ,水银柱高58 cm ,进入封闭端长2 cm ,如图所示,温度是87℃,大气压强为75 cmHg ,求:(1)在图示位置空气柱的压强p 1.(2)在图示位置,要使空气柱的长度变为3 cm ,温度必须降低到多少度?13.如图所示,U 形管左端封闭,右端开口,左管横截面积为右管横截面积的2倍,在左管内用水银封闭一段长为26 cm 、温度为280 K 的空气柱,左右两管水银面高度差为36 cm ,外界大气压为76 cm Hg 。
若给左管的封闭气体加热,使管内气柱长度变为30 cm ,则此时左管内气体的温度为多少?14.如图所示,上端开口的光滑圆柱形气缸竖直放置,截面积为240cm 的活塞将一定质量的气体封闭在气缸内。
在气缸内距缸底cm 60处设有a 、b 两限制装置,使活塞只能向上滑动。
开始时活塞搁在a 、b 上,缸内气体的压强为0p (pa p 50100.1⨯=为大气压强),温度为K 300。
现缓慢加热汽缸内气体,当温度为K 330,活塞恰好离开a 、b 。
求:(1)活塞的质量;(2)当温度升为K 360时活塞上升的高度15.如果病人在静脉输液时,不慎将5 mL 的空气柱输入体内,会造成空气栓塞,致使病人死亡.设空气柱在输入体内前的压强为760 mmHg ,温度为27℃,人的血压为120/80 mmHg ,试估算空气柱到达心脏处时,在收缩压和扩张压两种状态下,空气柱的体积分别为多少?16.如图所示,容积相同的两个容器A 和B 用细管连通,细管容积不计,A 、B 中都有氦气,温度都是27℃,压强都是1 atm .现将A 中氦气冷却到-173℃,而口中温度保持不变,求稳定后A 中气体的压强.17.如图所示直线AB 为一定质量的理想气体等容过程的p-t 图线,原点O 处的压强p=0,温度t=0℃.现使该气体从状态A 出发,经过一等温膨胀过程,体积变为原来体积的2倍,然后保持体积不变,缓慢加热气体,使之到达某一状态F ,此时的压强等于状态B 的压强,试用作图方法,在所给的p-t 图上,画出F 的位置.18.已知一定质量的理想气体的状态变化如图8-4-31所示,试在V-T 图中画出这个循环过程,并标出各状态的对应点.19.如图8-4-32所示,一定质量的理想气体,由状态A 变到状态B ,试比较p A 和p B 的大小.【答案与解析】一、选择题1.【答案】B【解析】分子热运动变剧烈,说明温度T 升高,由“pV T=恒量”知,pV 要变大,但不知体积的变化情况,故无法判定压强变化情况(p 可以不变、变大或变小),因此A 错B对;分子间的平均间距变大,说明体积变大,由“pV T =恒量”知,p T要变小,但温度T 的变化情况不定,故无法确定p 是变大还是变小,因此C 、D 皆错。
本题正确答案是B 。
2.【答案】A 、B 、C 、D3.【答案】B【解析】设温度变化过程中气体的体积不变,据查理定律得:212121121111p p p p T T p p T T T p T T --=⇒=⇒∆=∆。
对左边气体,20273p p ∆=⨯左左;对右边气体,20293p p ∆=⨯右右。
因初始p p =左右,故p p ∆>∆左右,即隔板将向右侧移动。
本题的正确答案为B 。
4.【答案】A 【解析】根据克拉珀龙方程pV nR T=,在同温(T )、恒容(V )下,压强之比等于气体的物质的量之比。
显然,只有反应后容器中的气体(常温下)为10.1mol 20.05mol 4⨯⨯=时,才符合题意。
考查气体之间的有关反应,不难确定答案为A 。
5.【答案】D6.【答案】C7.【答案】B8.【答案】B 、D9.【答案】B【解析】当缓慢升高缸内气体温度时,气体先发生等容变化,根据查理定律,缸内气体的压强p 与热力学温度T 成正比,图线是过原点的倾斜的直线;当缸内气体的压强等于外界的大气压时,气体发生等压膨胀,图线是平行于T 轴的直线。
10.【答案】A【解析】 一定质量的气体。
温度、体积和压强的变化是互相关联的,一动俱动,这是一个动态变化问题,采用计算的办法比较复杂.水银柱如何移动,决定于两容器气体压强的大小.由于初态20℃的气体与10℃的气体压强相同,可分别作出两容器中气体的等容线,如图所示.由图知10℃气体的等容线的斜率较大,因而当两容器温度各升10℃后,右边容器内气体压强比左边容器内气体压强增大得多,故水银柱向左移动.11.【答案】B【解析】 从p-V 图象中的AB 图线看,气体状态由A 变到B 为等容升压,根据查理定律,一定质量的气体,当体积不变时,压强跟热力学温度成正比.选项A 中温度不变是不对的,应该是压强增大,温度升高.气体的温度升高,内能增大,选项B 对.气体的温度升高,分子平均速率增加,故选项C 错.气体压强增大,则气体分子在单位时间内与器壁单位面积碰撞的次数增加.故选项D 是错误的.【点评】 根据图象确定气体的状态变化过程,利用状态方程解决问题.二、解答题12.【答案】(1)133 cmHg. (2)-5℃【解析】(1)p 1=p 0+p h =(75+58) cmHg=133 cmHg.(2)对空气柱:初态:p 1=133 cm Hg ,V 1=4S ,T 1=(273+87) K=360 K 。
末态:p 2=p 0+p h '=(75+57) cmHg=132 cmHg ,V 2=3S 。
由112212p V p V T T =代入数值,解得T=268 K=-5℃。
13.【答案】420K【解析】以封闭气体为研究对象,设左管横截面积为S ,当左管封闭的气柱长度变为30cm 时,左管水银柱下降4cm ,右管水银柱上升8cm ,即两端水银柱高度差为:h ′=24cm 由题意得:1126V L S S ==,101763640P P h cmHg cmHg cmHg =-=-=, 由理想气体状态方程:112212PV PV T T = 解得:2420T K =14.【答案】(1)4kg ;(2)5.5cm【解析】(1)由题意可得:01p p =,K T 3001= 气体经过等容变化:2211T p T p = 解得:kg m 4=(2)由题意可得:K T 3603=,31122400cm Sh V V === 气体经过等压变化:3322T V T V = cm h h h 5.513=-=∆(或cm h h h 45.513=-=∆)15.【答案】32.7mL 49.1mL【解析】空气柱在体外时的状态参量为:p 1=760 mmHg ,V 1=5 mL ,T 1=300 K 。
空气柱在体内收缩压时的状态参量为:p 2=120 mmHg ,T 2=310 K 。
由理想气体状态方程得,空气柱在收缩压下的体积为:空气柱在体内扩张压时的状态参量为 p 3=80 mmHg ,T 3=310 K 。
由理想气体状态方程得,空气柱在扩张压下的体积为16.【答案】0.5 atm【解析】将A 、B 中的气体当作一个整体,用气体分态方程求解:p 1=1 atm ,V 1=2V ,T 1=300 K 。
p 2=p 3=p ,V 2=V ,V 3=V ,T 2=100 K ,T 3=300 K 。
由331122123p V p V p V T T T =+得1atm 2300K 100K 300KV p V p V ⨯⋅⋅=+。
解得 p=0.5 atm 。
17.【答案】见解析【解析】气体从状态A 出发经过一等温过程,体积变为原来的2倍,据玻意耳定律,其压强必为原来的1/2,即此过程是由状态A 出发,沿p 轴向下到OA 的中点C 处.下一过程是等容过程,它在图中是一条直线.因为在p-t 图上任何等容线上Op 轴以左的延长线都必定交于t 轴上同一点(-273.15℃)处.延长BA 得此点O ',虚线连接O 'C ,并延长到p 轴右方实线便得等容线CE .据题设最后状态的压强与B 点压强相等,故过B 点作平行于t 轴的虚线与等容线CE 交于一点,这点即为F 点,如图所示.18.【答案】见解析【解析】从p-V 图中找出各状态及过程的V 、T 值便可画出V-T 图.状态1的体积为V 1、温度为T 1,从状态1到2为等压变化,且V 2>V 1,则在V-T 图中,1、2状态在同一等压线上;而从状态2到状态3为等容变化,且p 3<p 2,注意到1和3状态不在同一等温线上,故有V 3=V 2,T 3>T 1;从状态3到状态4又为等压变化,从状态4到状态1为等容变化,且p 1>p 4,故有V 4=V 1,且T 4=p 4T 1/p 1<T 1,将对应点画出,并利用等压线和等容线的特点,将各点连接起来,即得V-T 图.如图所示.19.【答案】p A <p B【解析】解法一:过A 作通过原点的直线,过B 作水平直线,如图所示,两线交于C .由于V C =V B ,而T C <T B ,由理想气体状态方程知p C <p B ,又因为p C =p A ,故p A <p B .解法二:分别过A 、B 作过原点的直线,如图所示.由于tan tan αβ>,故V A /T A >V B /T B ,又因p A V A /T A =p B V B ,所以得p A <p B .。
