微生物群体感应系统讲课稿
微生物生理学(王海洪)9细菌的群体感应调节PPT课件

通过药物或其他小分子抑制与信号转 导相关的蛋白活性,可以阻断信号转 导途径,从而干扰群体感应的调控。
05 群体感应的研究前景与展 望
群体感应与其他微生物的相互作用
群体感应细菌与病原菌的相互作用
群体感应细菌通过群体感应系统调节其行为,与病原菌相互作用,影响病原菌的感染和 传播。
群体感应细菌与益生菌的相互作用
群体感应的信号转导
信号转导
群体感应的信号转导是指信号分子与受体结合后,通过一系列生化反应,将信号传递至细胞内,影响细菌的生理和行 为。
信号转导途径
群体感应的信号转导途径通常涉及多个蛋白和反应,如激酶、磷酸酶、转录因子等。这些蛋白和反应共同作用,将信 号分子传递的信息转化为细菌可识别的信号,进而影响其行为。
益生菌通过与群体感应细菌的相互作用,可以调节肠道微生物群落的结构和功能,维护 肠道健康。
群体感应与环境因素的关系
要点一
温度、湿度等环境因素对群体感 应细菌的影响
环境因素可以影响群体感应细菌的生理和行为,进而影响 其在生态系统中的作用。
要点二
抗生素对群体感应的影响
抗生素的使用可以影响群体感应细菌的耐药性和致病性, 因此需要深入研究抗生素对群体感应的影响。
AI-2
又称作LuxS代谢产物,是一种由多种革兰氏阴性菌和阳性菌分泌的信号分子。AI-2通过 与 LuxP 受体结合,影响细菌的群体行为。
群体感应的受体
LuxQ
是一种膜蛋白,作为AI-1的受体,能够识别并响应AI-1信号 分子。LuxQ受体的活化可以影响细菌的群体行为。
LuxP
是一种膜蛋白,作为AI-2的受体,能够识别并响应AI-2信号 分子。LuxP受体的活化可以影响细菌的群体行为。
【doc】细菌的群体感应系统

细菌的群体感应系统.360'中华老年多器官疾病杂志2007年10月第6卷第5期ChinJMuItOrganDisElder1yOct2007V o16No5综述?细菌的群体感应系统王瑛综述陈良安审校感染性疾病是临床最为常见也是最难解决的疾病,抗生素是治疗感染的主要手段.抗生素的广泛使用,使得耐药率持续增加,感染成为人们面临的一种越来越难治疗的疾病.当细菌以群体形式存在时,如细菌生物被膜的产生,可使得细菌的生长模式,代谢状态和耐药性发生显着的变化,是造成难治性医院感染的主要原因.过去认为单个细胞对外界环境刺激的反应仅来源于周围环境中的化学信号,现在认为这种细菌学的观点过于简单化,因为细菌之间可以通过细菌本身释放的激素样有机化合物——自诱导物(autoinducter,AI)来交流,从而改变胞内遗传物质的转录和翻译,调节细菌的生长代谢,并导致细菌毒力,耐药性的变化,此被称为群体感应(quorumsensing,Qs)信号系统,简称Qs系统.QS现象是于1977年在一种海洋发光细菌Vibriofischeri中首次发现的l1],是细菌通过分泌可溶性信号分子来监测群体密度并协调细菌生物功能的信息交流机制,经过近十年的研究表明,Qs系统在细菌的许多生理功能方面都有重要的作用,此系统包括AI的产生,释放和检测l2],通过检测周围细菌的密度,当细菌密度达到一定的阈值时,细菌可以通过调整相应的基因表达而改变自身生长方式及行为,从而维持这种多种群社区的稳定,甚至在种内或种问产生冲突时,也发挥一定作用].其功能涉及如生物发光,生物被膜的形成,游走,毒力因子的表达,抗生素的产生,DNA的摄取,细菌的生存和致病能力,这些已逐渐成为医学界研究的热点.1革兰阴性菌QS系统费氏孤菌是最早发现并进行Qs系统研究的革兰阴性菌,虽然每种革兰阴性菌所产生的群体感应机制不同,但其调控蛋白具有高度同源性,目前研究收稿日期:20070615作者单位:100853北京市,解放军总医院呼吸科作者简介:王瑛,女,1971年10月生,山东省济南市人,在读博士研究生,主治医师.Tel*************通讯作者:陈良安,Tel*************的大多数革兰阴性菌都存在与之相同的Qs系统,被称之LuxI—AHL型Qs系统].脂肪酰基高丝氨酸内酯(acylhomoserinelactones,AHL),是一类特殊的小分子水溶性化合物,可作为Qs系统中的自诱导剂,LuxI是一类可催化合成AI的胞内蛋白酶.LuxI类蛋白酶可催化带有酰基的载体蛋白的酰基侧链与s一腺苷蛋氨酸上的高丝氨酸结合生成AHL.不同革兰阴性菌的LuxI—AHL型Qs系统有所差别,其AHL类自诱导剂都是以高丝氨酸为主体,差别只是酰基侧链的有无及侧链的长短不同J.作为革兰阴性菌特有的自诱导剂AHL可自由出入于细胞内外],随着细菌密度的增加,当细胞外周环境中的细菌分泌的AHL积聚到一定浓度阈值时,可与细胞质中的作为受体的IuxR蛋白的氨基残端结合,激活所调控的基因表达.在以AHL为自诱导剂的革兰阴性菌QS系统中,信号传导途径具有多样性,目前以铜绿假单胞菌研究最为成熟,它主要包含四套Qs体系:第一套lasR/lasI体系,由转录激活因子LasR和乙酰高丝氨酸内酯合成酶LasI蛋白组成,lasI能指导AIN一3一氧代十二烷酰一高丝氨酸内酯(3-OXO—C一HSL)的合成,并以主动转运的方式分泌到胞外,达到一定的阈浓度时可结合LasR,并激活转录,增强包括碱性蛋白酶,外毒素A,弹性蛋白酶在内的毒力因子的基因转录,可以使铜绿假单胞菌毒力基因的表达增高.第二套Qs体系rhlR/rhlI系统,rhlR是转录调节子,rhlI可编码AHI合成酶,该系统产生的一种结构为CHSL的高丝氨酸内酯类自体诱导物,可自由通过细胞膜,调控大量基因的表达,如指导鼠李糖脂溶血素,几丁质酶,氰化物,绿脓菌素等物质的产生.2一庚基一3一羟基一4一喹诺酮(pseusomonasqinolonesignal,PQs)是近期发现的铜绿假单胞菌第三套Qs系统——喹喏酮信号系统的信号分子,具有抗菌活性Ⅲ,不溶于水,关于它如何行使菌问信号转导的机制尚不明确,可能是通过一种"胞吐"样转运机制在细菌间传导PQS信号l8].PQS可以连接Las和Rhl两个系统,一方面Las和Rhl控制着中华老年多器官疾病杂志2007年1O月第6卷第5期ChinJMuhOrganDisElderlyOct2007V0l6N05?361?PQS生成,另一方面PQs又影响着Las和Rh1的基因表达,两者之间存在着微妙的平衡关系.此外PQS还在调整细菌密度及释放毒力因子方面起着一定的作用.除上述三种QS系统,最近还发现了另一种铜绿假单胞菌Qs辅助系统GacS/GacA系统,且已证明在提高细菌游走能力,释放可可碱醋酸钠,促进生物被膜形成中发挥重要作用].2革兰阳性菌QS系统革兰阳性菌QS系统主要是用小分子多肽(oli—gopeptide)作为自诱导物(autoinducterpeptide, AIP),不同的细菌其AIP分子大小也不同,不能自由穿透细胞壁,需通过ABC转运系统(ATP—bind—ing—cassette)或其它膜通道蛋白作用,到达胞外行使功能.位于膜上的AIP信号识别系统与AIP结合后,激活膜上的组胺酸蛋白激酶,促进激酶中组氨酸残基磷酸化,磷酸化后的受体蛋白能与DNA特定靶位点结合,从而激活一种或多种靶基因而行使功能j.AIP不仅能检测细菌密度,影响生物被膜的形成,而且还能调控不同菌种之间的关系.以表皮葡萄球菌的自体诱导物与4株金黄色葡萄球菌的QS相互作用,结果有3株受到干扰;但相反,这4株菌的AIP对表皮葡萄球菌的Qs却均无影响u川. 3菌种间的信号传导自然界中细菌所处的小生态环境是相当复杂的,通常在一个很小的空间内有多种细菌共存,细菌间既有共生关系又有竞争关系,若细菌只能在同种之间进行信息交流,就很难建立一个在菌种数量上有一定比例,功能上有一定分工的多细菌群落,很难形成一个稳定的小生态环境.菌种间的信号传导是通过IuxS信号系统完成的,以LuxS蛋白作为关键酶,合成前体分子DPD(4,5dihydroxy一2,3-pen—tanedione).DPD经催化生成信号分子自体诱导物AI一2.AI一2是一种呋喃硼酸二酯分子,介导不同细菌间相互交流.因为大多数革兰阴性菌和革兰阳性菌都能产生AI一2,有人把它称为细菌之间的世界语12,13],如果细菌的LuxS蛋白失活则不能产生AI一2~j.LuxS基因在大多数细菌的基因中是一段相对保守的序列,不同细菌的DPD由于经过自发重排会产生差异,形成具有一定特异性的AI一2分子.细菌可识别自身生成的AI一2分子,也能识别由其他细菌生成的AI一2[15].在一项混合多种细菌共同培养研究中发现,当大肠杆菌产生过多AI一2时,周围的其它细菌启动Qs系统,相应的控制增加细菌的行为来保持微环境的稳态.4结束语目前认为密度感知信号系统与生物被膜的形成,细菌毒力因子的释放及致病力有密切的关系,似乎有望为感染的治疗提供新的途径.如何干扰细菌Qs信号系统,防止生物被膜的产生及减弱致病力,缓解耐药成为目前研究的热点.一种方法是研发可降解信号分子或受体蛋白的药物,使其不能相互结合,从而破坏细菌的Qs体系.另一种方法是通过合成一些AI的结构类似物的拮抗剂,与相应的受体蛋白竞争性结合.此外利用其它非致病菌来干扰致病菌Qs系统也是一种值得研究的方法口.现阶段对细菌Qs系统的研究大多还局限在体外,其机制还不是很明确,涉及的菌种还很少,仅对铜绿假单胞,大肠埃希氏菌,金黄色葡萄球菌,表皮葡萄球菌有了一定了解,它对细菌生物被膜及致病力的影响也得到了证实.因此,为能应用到临床是今后的努力目标.参考文献[1]HastingJW,NealsonKH.Bacterialbioluminescence. AnnuRevMicrobiol,1977,3l:549-595.[2]WaterCM,BasslerBI.Quorumsensing:celltOcell communicationinbacteria.AnnuRevCellDevBiol, 2005,21:319-346.municationinbacteria:an ecologicalandevolutionaryperspective.NatRevMi—crobiol,2006,4:249—258.[4]SchauderS,BasslerBI.Thelanguageofbacteria. GenesDev,2001,15:1468—1480.[5]FuquaC.ParsekMR,GreenbergEP.Regulationof geneexpressionbycell—tO—cellcommunication:acyl—homoserinelactonequorumsensing.AnnuRevGenet, 2001,35:439—468.[6]EberL,MolinS,GivskovM.Surfacemotilityofserra—tialiquefaciensMG1.JBacteriol,1999,181:1703—1712. [7]DezielE,LeplneF,MilotS,eta1.Analysisofpseudomonas aeruginosa4-hydroxy-2一alkylquinolines(HAQs)re—vealsarolefor4-hydroxy-2一heptylquinolineincell—tO—cellcommunication.ProcNatlAcadSciUSA,2004,101:1339—1344.[83MashburnLM,WhiteleyM.Membranevesiclestraffic signalsandfacilitategroupactivitiesinaprokaryote. Nature,2005,437:422—425.(下转第368页)368中华老年多器官疾病杂志2007年10月第6卷第5期ChinJMu1tOrganDisElder1yOct2007vo16No5E9][103[11][123[132[143[15]inLeishmaniainfection.ExpOpinBiolTher,2003,3:875-885.V onBoehmerH.Mechanismsofsuppressionbysup—pressorTcel1.NatImmuno1,2005,6:338—344.McGuirkP,HigginsSC,MillsKH.Regulatorycells andthecontrolofrespiratoryinfection.CurrAllergyAsthmaRep,2005,5:51.55.MillsKH.RegulatoryTcells:friendorfoeinimmu—nitytoinfection?NatRevImmuno1,2004,4:841—855.McGuirkP,McCannC,MillsKH,eta1.Pathogen-specificTregulatory1cellsinducedintherespiratorytractby3bacteria1moleculethatstimulatesinterleu—kin10productionbydendriticcells:3novelstrategy forevasionofprotectiveThelpertype1responsesbybordetellapertussls.JExpMed,2002,195:221—231.RaghavanS,HolmgrenJ.CD4CD25suppressorT cellsregulatepathogeninducedinflammationanddis—ease.Immuno1MedMicrobio1,2005,44:121—127. CapronA,DombrowiczD,CapronM.Helminthin—fectionsandallergicdiseases:fromtheTh2paradigm toregulatorynetworks.ClinRevAllergyImmunol, 2004,26:25—34.WilsonMS,MaizelsRM.RegulatoryTcellsinduced byparasitesandthemodulationofallergicresponses.[16][17][18][19]E2o]E21]ChemImmunolAllergy,2006,90:176—195. SuvasS,KumaraguruU,PackCD,eta1.CD4CD25Tcellregulatevirus—specificprimaryand memoryCD8Tcellsresponse.JExpMed,2003, 198:889—901.MondelliMU,BarnabaV.Vira1andhostimmune regulatorymechanismsinhepatitisCvirusinfection. EurJGastroenterolHepatol,2006,118:327—331. AandahlEM,MichaelssonJ,MorettoWJ,eta1. HumanCD4CD25regulatoryTcellcontrolTcell responsetohumanimmunodeficiencyvirusandcyto—megalovirusantigens.JVirus,2004,78:2454—2459. WeissL,Donkova—PetreginiV,CaccavelliL,eta1. Humanimmunodeficiencyvirus—drivenexpansionof CD4CD25regulatoryTcellswhichsuppressHIV—specificCD4TcellresponsesinHIV-infectedpa—tients.Blood,2004,104:3249-3256.StephensGI,McHughRS,WhittersMJ,eta1.En—gagementofglucocorticoid—inducedTNFRfamily- relatedreceptoroneffectorTcellsbyitsligandmedi—atesresistancetosuppressionbyCD4CD25Tcel1. JImmuno1,2004,173:5008—5020.MaizelsRM.Infectionsandallergy-helminths,hy—gieneandhostimmuneregulation.Curr()pinImmu—no1,2005.17:656—661.(上接第361页)E93KayE,HumairB,DenervaudV,eta1.TwoGacA-de—pendentsmallRNAsmodulatethequorum-sensingre—sponseinPseudomonasaeruginosa.JBacterio1,2006, 188:6026—6033.[102XavierKB,BasslerBL.LuxS.Quorumsensingmore thanjust3numbersgame.CurrOpinMicrobio1,2003,6:191-197.[11]VuongC,GerkeC,SomervilleGA,eta1.Quorum- sensingcontrolofbiofilmfactorinstqphylococcus epidermidis.JInfectDis,2003,188:706—718.[123TagaME,municationamongbacteria. ProcNatAcadSciUSA,2003,100(Suppl2):1549—1554.[132BenJacobE,BeckerI,ShapiraY,eta1.Bacteriallin—guisticcommunicationandsocialintelligence.Trends [143[15][16][17]Microbiol,2004,12:366—372.StrurmeMHJ,KleeebezemM,NalayamaJ.eta1.Celltocellcommunicationbyautoinducingpeptidesin grampositivebacteria.AntonievanIeeuwenhoek, 2002,81:233—243.CamilliA,BasslerBI.Bacterialsmall—moleculesigna—lingpathways.Science,2006,311:1113—1116. XavierKB,BsslerBL.InterferencewithAI-2一mediated bacteria1cell—cel1communication.Nature,2005,437: 750—753.RassaRB,LannuzzoJR,IevineDR,eta1.Bacteria1 communication("quorumsensing")vialigandsand recepors:3novelpharmacologictargetforthedesign ofantibioticdrugs.JPharmacolExpTher,2005,312:4】7—423.。
群体感应
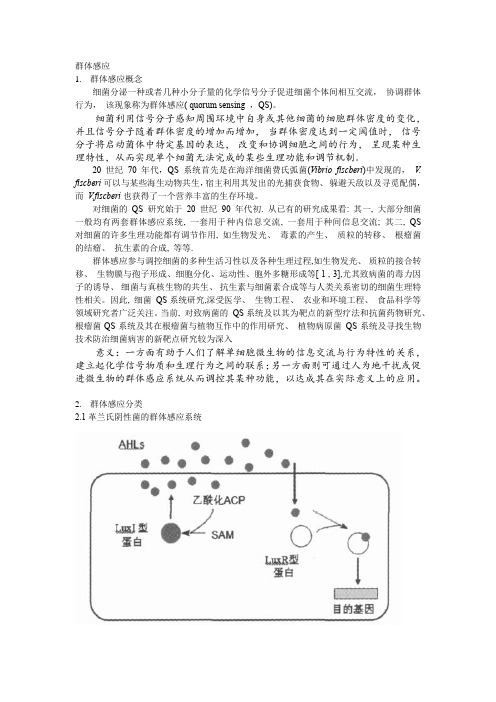
群体感应1.群体感应概念细菌分泌一种或者几种小分子量的化学信号分子促进细菌个体间相互交流,协调群体行为,该现象称为群体感应( quorum sensing ,QS)。
细菌利用信号分子感知周围环境中自身或其他细菌的细胞群体密度的变化,并且信号分子随着群体密度的增加而增加,当群体密度达到一定阈值时,信号分子将启动菌体中特定基因的表达,改变和协调细胞之间的行为,呈现某种生理特性,从而实现单个细菌无法完成的某些生理功能和调节机制。
20世纪70年代,QS系统首先是在海洋细菌费氏弧菌(Vibrio fiscberi)中发现的,V. fiscberi 可以与某些海生动物共生,宿主利用其发出的光捕获食物、躲避天敌以及寻觅配偶,而V.fiscberi也获得了一个营养丰富的生存环境。
对细菌的QS 研究始于20 世纪90 年代初. 从已有的研究成果看: 其一, 大部分细菌一般均有两套群体感应系统, 一套用于种内信息交流, 一套用于种间信息交流; 其二, QS 对细菌的许多生理功能都有调节作用, 如生物发光、毒素的产生、质粒的转移、根瘤菌的结瘤、抗生素的合成, 等等.群体感应参与调控细菌的多种生活习性以及各种生理过程,如生物发光、质粒的接合转移、生物膜与孢子形成、细胞分化、运动性、胞外多糖形成等[ 1 , 3],尤其致病菌的毒力因子的诱导、细菌与真核生物的共生、抗生素与细菌素合成等与人类关系密切的细菌生理特性相关。
因此, 细菌QS系统研究,深受医学、生物工程、农业和环境工程、食品科学等领域研究者广泛关注。
当前, 对致病菌的QS系统及以其为靶点的新型疗法和抗菌药物研究、根瘤菌QS系统及其在根瘤菌与植物互作中的作用研究、植物病原菌QS系统及寻找生物技术防治细菌病害的新靶点研究较为深入意义:一方面有助于人们了解单细胞微生物的信息交流与行为特性的关系,建立起化学信号物质和生理行为之间的联系;另一方面则可通过人为地干扰或促进微生物的群体感应系统从而调控其某种功能,以达成其在实际意义上的应用。
细菌群体感应系统及其应用课件

群体感应在细菌耐药性中的作用
群体感应在细菌耐药性中的作用
群体感应在细菌生物被膜形成中的作用
01
02
03
04
05
05
总结与展望
总结
细菌群体感应系统的基本概念
01
细菌群体感应系统的研究进展
02
细菌群体感应系统的应用领域
03
展望
未来研究方向
随着基因组学、蛋白质组学和代 谢组学等技术的发展,未来将进 一步揭示细菌群体感应系统的分 子机制,为相关应用提供更多可
菌群体感系及
• 细菌群体感应系统概述 • 细菌群体感应系统的组成 • 细菌群体感应系统的应用 • 细菌群体感应系统研究的前景与挑
战
01
细菌群体感应系统概述
群体感应的定义
群体感应 群体感应系统
群体感应的发现与历史
01
1950年代
02
1980年代
03
1990年代
04
2000年代至今
群体感应的机制
AI-1信号分子
AI-2信号分子
群体感应受体蛋白
LuxQ受体蛋白
LuxP受体蛋白
结合AI-2信号分子,影响细菌的生物 膜形成和毒力。
群体感应调控基因
lux操纵子
包含一系列受群体感应调控的基因,如luxCDABE基因编码生物发光所需的酶。
AI-2合成酶基因
如luxS基因,编码AI-2信号分子合成酶。
能性。
应用前景
随着对细菌群体感应系统认识的 深入,其在农业、工业和医疗等 领域的应用将更加广泛,有望为
人类带来更多的益处。
面临的挑战与问题
尽管细菌群体感应系统具有广泛 的应用前景,但仍面临许多挑战 和问题,如如何提高应用的效率 和安全性等,需要进一步研究和
细菌群体感应系统与应用

群体感应
毒力因子的产生:
肠球菌的主要毒力因子是溶
细胞素,由 2 个亚单位CylLL 和CylLS组成,在胞外以具有 毒性的CylLL ″和CylLS″形式 存在。研究表明,CylLS″担 任了QS系统机制中信号分子
的作用。Coburn等发现,
CylLL ″优先与靶细胞结合, 导致游离 CylLS″的积累并超 过诱导阈值,然后激活CylLS 表达,产生高水平的溶细胞
海洋红藻(Delisea pulchra)产生的卤化呋喃酮结构和AHL相似,用
该卤化呋喃酮处理V. fiscberi后,其QS系统被竞争性的抑制。另外吡
咯酮类化合物、某些取代的HSL化合物、二酮哌嗪类化合物等也能够起 到相类似的作用。在G+菌中,尽管AIP分子调控许多致病基因的表达, 但目前还没有专门针对其QS系统的防病策略。仅在金黄色葡萄球菌发现 其产生不同种类的AIP之间可以相互抑制。因此可以通过设计与病菌AIP 分子相似的物质来破坏其QS统,从而增强植物等的抗病性
种内交流:G- 的QS系统
费氏弧菌的AHL-LuxI/LuxR 型系统:
LuxI产生AHL,自由通过 细胞膜,分泌到胞外
AHL随菌体浓度上升在胞 外积累到阈值
AHL扩散入胞内与LuxR蛋 白结合,形成AI/LuxR
复 合体,并结合到 DNA上, 激活发光基因的启动子
转 录
种内交流:G- 的QS系统
谢 谢!
让我们共同进步
群体感应的抑制
1.产生可以使AHL分子灭活的AHL降解酶,使病原菌QS系统不 能启动它所调控的基因
内酯酶(AHL-1actonase) 和酰基转移酶(AHL-acylase) 目前都已经 在一些细菌中被发现。内酯酶可以水解AHL的内酯键,生成的N-酰基高 丝氨酸内酯的生物活性大大降低
群体感应系统

细菌能自发产生、释放一些特定的信号分子,并能感知其浓度变化,调节微生物的群体行为,这一调控系统称为群体感应。
细茵群体感应参与包括人类、动植物病原茵致病力在内的多种生物学功能的调节。
简介群体感应(Quorum-Sensing):近年来的研究证明细菌之间存在信息交流,许多细菌都能合成并释放一种被称为自诱导物质(autoinducer,AI)的信号分子,胞外的AI 浓度能随细菌密度的增加而增加,达到一个临界浓度时,AI能启动菌体中相关基因的表达,调控细菌的生物行为。
如产生毒素、形成生物膜、产生抗生素、生成孢子、产生荧光等,以适应环境的变化,我们将这一现象称为群体感应调节(quorum sensing.QS)。
这一感应现象只有在细菌密度达到一定阈值后才会发生,所以也有人将这一现象称为细胞密度依赖的基因表达(cell density de- pendent control of gene expression)。
[1]自身诱导物质AI细菌可以合成一种被称为自身诱导物质( auto-inducer .AI ) 的信号分子,细菌根据特定的信号分子的浓度可以监测周围环境中自身或其它细菌的数量变化,当信号达到一定的浓度阈值时,能启动菌体中相关基因的表达来适应环境的变化,如芽胞杆菌中感受态与芽胞形成、病原细菌胞外酶与毒素产生、生物膜形成、菌体发光、色素产生、抗生素形成等等。
根据细菌合成的信号分子和感应机制不同,QS系统基本可分为三个代表性的类型:革兰氏阴性细菌一般利用酰基高丝氨酸内酯( AHL) 类分子作为AI ,革兰氏阳性细菌—般利用寡肽类分子(Al P) 作为信号因子,另外许多革兰氏阴性和阳性细菌都可以产生一种AI - 2的信号因子,一般认为AI - 2是种间细胞交流的通用信号分子,另外最近研究发现,有些细菌利用两种甚至三种不同信号分子调节自身群体行为,这说明群体感应机制是极为复杂的。
细菌信息素的特点1,分子量小:细菌信息素都是一些小分子物质,如酰基-高丝氨酸内酯(AHL)衍生物、寡肽、伽马一丁内酯等,能自由进出细胞或通过寡肽通透酶分泌到环境中,在环境中积累。
浅谈微生物细胞的交流方式——群体感应
浅谈微生物细胞的交流方式——群体感应在第一堂课,老师讲述了微生态学绪论后,我便产生了一个疑问。
众所周知,宏观生态学是研究生命系统和环境系统之间相互作用规律和机理的科学。
而一个生态系统则是由群落,种群,个体,系统,器官,细胞逐级构成的。
每个层级之间都有其各自复杂而精密的调节机制。
而微生物却是单细胞生物,现在却谈及由这些单细胞生物构成的生态系统,那么这些看起来各自孤立的单细胞生物之间有相互交流吗?如果有,他们的“语言”又是什么?这些“语言”是否有专一性?我们掌握这些“语言”可以为我们人类做什么?……于是我去查找了相关文献,并在浅薄文尾提出了一些自己的想法,希望老师能提出指正。
微生物群体感应是微生物间通过化学信号分子进行信息传递的一种形式,它以微生物的群体数目为依据以控制特定基因的表达,使其所对应的生物功能得以表现。
这种信息传递一经发现就受到重视,因为它证明了单细胞微生物间的生命活动具有群体性,而且这种群体效应不仅存在于同种微生物细胞间,还可以调节不同微生物间的相互关系,所以又被视为微生物语言。
微生物的群体感应(QS)也称为自诱导,它通过扩散性的小分子即自诱导物在细胞-细胞之间扩散,并通过自诱导物与转录活化蛋白的相互作用,从而使整个群体的细胞中的一系列目标基因表达。
在革兰氏阴性菌中,这种自诱导物通常是N-酰化高丝氨酸内酯(AHL),它可调节的功能包括抗生素的生物合成、毒性因子的产生、胞外多糖的合成、细菌丛集、质粒结合转移、稳定期的进入等。
而革兰氏阳性菌的群体感应过程是通过γ-丁酸内酯及翻译后修饰肽实现的。
群体感应(Quorum sensing,QS)也称为自诱导,最初是指细菌调节自身菌体密度的一种环境感应系统。
通过扩散性信号小分子(又称为自诱导物)与转录活化蛋白的相互作用而打开与细胞群体密度有关的基因表达。
这些信号分子从细菌细胞扩散到环境中,一旦达到一个临界浓度(或者说达到某一特定的群体密度),这些信号分子就可诱导调节一系列目标基因的转录。
第6章群体感应系统
细菌和宿主之间的相互作用中起着重要的调控作用
兼具抗生素活性:Lactococcus lastis产生的乳链球菌素nisin,既作为 信息调节细胞生物合成和免疫基因的表达,也拮抗其他微生物;植
物乳球菌 (L. plantarum) 产生的植物乳杆菌素A也有信息素和抗生素
的双重活性
群体感应的定义
QS信号分子分类
化,
监测菌群密度、调控菌群生理功能,从而适应环境条
件的一种信号交流机制,又称细胞交流或自诱导 (Auto-induce)
群体感应调节
细菌释放自诱导物质 (Auto-inducer, AI) 的信号分子
临界浓度时,AI能启动菌体相关基因的表达,调控细菌的生 物行为(产生毒素、生物膜、抗生素、孢子、荧光等),使
为理解细菌的致病性以及难根除的感染性疾病机制提供了新思路
PNAS, /cgi/doi/10.1073/pnas.1214128109 ,2012
群体感应的生物效应
生物膜形成调控(例2:帮助细菌扩大地盘)
P.Aeruginosa 和生态环境分离菌的群感基因相互 关系韦恩图
QS参与致病菌的毒力因子诱导、细菌与真核生物的共生、 抗生素与细菌素合成等与人类关系密切的细菌生理特性
群体感应的研究意义
了解单细胞微生物的信息交流与行为特性关系,建立化学 信号物质和生理行为的联系,例如:
龋齿周围生物膜形成参与的菌种,所有细菌均参与群体感应
Nature Reviews, Biotechnology
且很快被降解掉
群体感应的分子机制
革兰氏阴性菌QS系统—LuxI-AHL型
AHL可自由出入细胞体内外 细胞达到一定密度,信号分子接近浓度阈值 信号分子通过细胞膜的方式:自由扩散
微生物生物传感器
•以明亮发光杆菌为生物识别元件,以硅光电二极管作为细胞光信号和电 信号转换的敏感元件,构建了细菌发光传感器,分别对苯酚、乐果、乙 醛、Hg+、Cu2+、Zn2+等污染物急性毒性进行快速检测研究,同时和哺乳 动物毒性实验结果做对比。毒性测试结果表明,在pH=7.0,温度20℃, 3.0%NaCI底液条件下,固定化菌膜发光强度达2~4nw,稳定发光时间6 0~80min,毒性测试结果的EC50值与哺乳动物毒性试验的LD50具有良好 的相关性,相关系数r=0.95。
• 蓝细菌传感器,其工作原理与藻类很类似,都是可进行产氧型光合作用,有 研究者利用聚球蓝细菌细胞作为生物基质构建的生物传感器可以用于检测水 体中的除草剂,通过检测细胞中光合成电子传输系统,当有污染物存在时, 会对传输系统产生干扰。该方法非常简单方便,可迅速提供污染信息,适于 在线监测。
5.全细胞生物传感器
• 传统的化学分析方法虽能准确定量分析污染物中主要成分 的含量,但不能直接反映各种有毒物质对环境和生物的综 合影响。
• 传统的生物毒性监测以水蚤、藻类或鱼类等为受试对象, 虽然能反映毒物对生物的直接影响,但是这些方法的最大 缺点是实验周期长,操作复杂,不能及时反映水质情况。
近年来,随着微生物固定化技术的发展,微生物传感器 的研究和应用取得很大进展。开发了使用固定化微生物的 各种传感器,如发光型微生物传感器、硝化细菌传感器、 全细胞微生物传感器等用于水质分析。这些传感器以很高 的灵敏度对各种污染物的浓度进行监测,而且具有简便、 快速、灵敏、经济等优点,在环境监测中应用前景十分广 阔。
1.发光微生物(luminous microbes)传感器
发光微生物指自然界ຫໍສະໝຸດ 在、细胞内具有生物发光代谢 系统的原核和真核微生物,近来还包括导入发光基因而使 原本不发光的微生物具备发光特性的基因工程发光微生物。
细菌群体感应系统与应用
群体感应的研究意义
• 了解单细胞微生物的信息交流与行为特性的关 系,建立起化学信号物质和生理行为之间的联系
• 通过人为地干扰或促进微生物的群体感应系统, 从而调控其某种功能,以达成实际意义上的应 用
群体感应系统的分类
QS 系统由自诱导分子 、 感应分子及下游调控蛋白组成。 从已有的研究成果看,大部分细菌一般均有两套群体感应系统,一套用于 种内信息交流,一套用于种间信息交流;根据细菌合成的自诱导分子和感
群体感应的抑制
1.产生可以使AHL分子灭活的AHL降解酶,使病原菌QS系统不 能启动它所调控的基因
内酯酶(AHL-1actonase) 和酰基转移酶(AHL-acylase) 目前都已经 在一些细菌中被发现。内酯酶可以水解AHL的内酯键,生成的N-酰基高 丝氨酸内酯的生物活性大大降低
Dong等经过大量的实验和研究从芽孢杆菌(Bacillus240B1)中分离
应机制不同,QS系统主要分为3 种:
种内QS 系统
G-菌QS系统
N-酰基高丝氨酸内酯 (AHL)
群体感应
G+菌QS系统
寡肽类物质 (AIP)
种间QS 系统
呋喃酰硼酸二酯
种内交流:G- 的QS系统
LuxI 蛋白是AI合成酶, 能够合成信号分子 N-酰 基高丝氨酸内酯(AHL)
LuxR蛋白是细胞质内AI 感受因子,也是一种 DNA结合转录激活元件; 其 N-端与AHL结合,C端则参与寡聚化以及与 启动子DNA的结合
革兰氏阴性菌中,有超过70种的细菌利用 AHL作为胞 间交流的信号分子。有超过50种的革兰氏阴性菌都是利用这 种AHL-LuxI/LuxR 型系统进行细胞间的交流。费氏弧菌的 LuxI/Lux R双组分系统被视为革兰氏阴性菌群体感应的模式 系统。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
QS系统的特点—复杂性
(1)信号分子功能的复杂性: 有的 QS系统中的信号分子不仅 作为环境信号,而且具有其它功能,如某些乳酸菌中的 QS系统的信号分子具有抗菌活性
(2)系统组成的复杂性: 在 V. harveyi中发现了一个与众不同 的 QS系统,该系统信号分子产生系统与 G-菌相似,而信 号分子的识别则与 G+菌相似
系统一致, 即双组分激酶识别 AI-2分子后把磷酸化基团传 递给受体蛋白并启动相关基因的表达。
生命科学学院 College of Life Science
哈维氏弧菌
生命科学学院 College of Life Science
生命科学学院 College of Life Science
QS系统的特点—多样性
生命科学学院 College of Life Science
生命科学学院 College of Life Science
级联放大的正反馈效应
生命科学学院 College of Life Science
• 自诱导分子:脂肪酰基高丝氨酸内酯(acyl homoserine lactones,AHL) AHL可自由出入于细胞内外
• 不同革兰阴性菌的LuxI—AHL型QS系统有所差别,其AHL类自诱导
剂都是以高丝氨酸为主体,差别只是酰基侧链的有无及侧链的长短不
同
生命科学学院
College of Life Science
生命科学学院 College of Life Science
常见的AHL分子及其功能
生命科学学院 College of Life Science
不同种属群 间的竞争
细菌的 运动
生命科学学院 College of Life Science
一、调控细菌毒力
生命科学学院 College of Life Science
二、对宿主的侵袭和定植
霍乱弧菌:菌体少量时,有利于早期定植,之后细胞密度增 大,信号分子浓度增高,HapR表达,有利于病原菌的释放
(3)不同 QS系统之间关系的复杂性: 多种 QS系统构成复杂 的调控网络,如P.aeruginosa中含有三个 QS系统
生命科学学院 College of Life Science
第二节 群体感应的生物效应
生物 发光
抗生素 合成
孢子 形成
生物被膜 形成
毒力因子 的诱导
致病因子 的产生
细菌与宿 主的斗争
生命科学学院 College of Life Science
金黄色葡萄球菌的群体感应系统
生命科学学院 College of Life Science
三、种间QS系统—AI-2介导的通信
• 信号分子 :AI-2 (呋喃酰硼酸二酯类化合物) • 此类信号分子在G+菌和 G-菌中均可存在; • 费氏弧菌的AI-2受体是周质结合蛋白LuxP • AI-2的产生依赖于一种LuxS蛋白质 • 细菌识别AI- 2 分子的方式与革兰氏阳性菌中双组分识别
常见的AHL分子及其功能
生命科学学院 College of Life Science
多套QS系统相互作用—铜绿假单胞菌
自身诱导调 控系统
las系统
rhl系统
PQS系统
外源诱导调 控系统
毒力基 因表达 和生物 被膜形
成
生命科学学院 College of Life Science
铜绿假单胞菌的群体感应系统
群体感应
种内QS系统 种间QS系统
G-菌QS系统 G+菌QS系统
生命科学学院 College of Life Science
一、G-菌QS系统—LuxI-AHL型QS系统
生命科学学院 College of Life Science
细胞达到一定密度,信号分子接近浓度阈值 信号分子通过细胞膜的方式:自由扩散
• AI合成蛋白:LuxI蛋白酶,可催化带有酰基的载体蛋白的酰基侧链与 S-腺苷L与IuxR蛋白的结合是浓度依赖型的。没有 AHL的情况下,LuxR是无活性的,而且很快被降解掉。
• AHL-LuxR复合物作为转录因子,激活目标基因的表达;还可激活 LuxI的表达,形成级联放大的正反馈效应。
(1)信号分子的多样性 (2)分布的多样性:
细菌种内、 种间,细菌与植物、动物间 (3)信号分子产生机制的多样性:
G-菌—信号分子合成酶, G+菌—前体,经蛋白酶切割 (4)信号分子运输的多样性:
G+菌—ABC转运系统,G-菌—直接透过细胞膜 (5)信号响应的多样性:
G+菌—双组分信号转导系统; G-菌—受体蛋白
微生物群体感应系统
生命科学学院 College of Life Science
群体感应的发现
①1970年,Nealson等首次发现费氏弧菌(Vibrio fischeri)的生物发光现象
②1983年,Engebrecht等找到了费氏弧军群体感应 的相关基因和基本模型。
③群体感应的研究从发光现象扩展到生物被膜形成 、分泌毒力因子等其他领域
生命科学学院 College of Life Science
三、调控生物被膜形成
生命科学学院 College of Life Science
1、黏附期:浮游细菌,可 逆 2、定植期:分泌胞外基质, 微菌落 3、生长期:微菌落融合, 向上生长 4、成熟期:蘑菇状,并含 有液体通道 5、播散期:生物被膜的脱 落、蔓延和释放浮游状细菌
生命科学学院 College of Life Science
二、G+菌QS系统—AIP-TCS三组分系统
生命科学学院 College of Life Science
• 信号分子 :AIP(autoinducing peptides,自诱导肽 ) • AIP前体肽经转录后的一系列修 饰加工,在不同细菌中形成长短 不同、稳定、特异的AIP • AIP通过细胞膜的方式: ABC 转运系统
生命科学学院 College of Life Science
生命科学学院 College of Life Science
群体感应 (quorum sensing, QS)
群体感应系统
自诱导分子 (autoinduc
er, AI)
概念
生命科学学院 College of Life Science
第一节 群体感应的分子机制
