遗传实验报告模板
生科院遗传学-实验报告
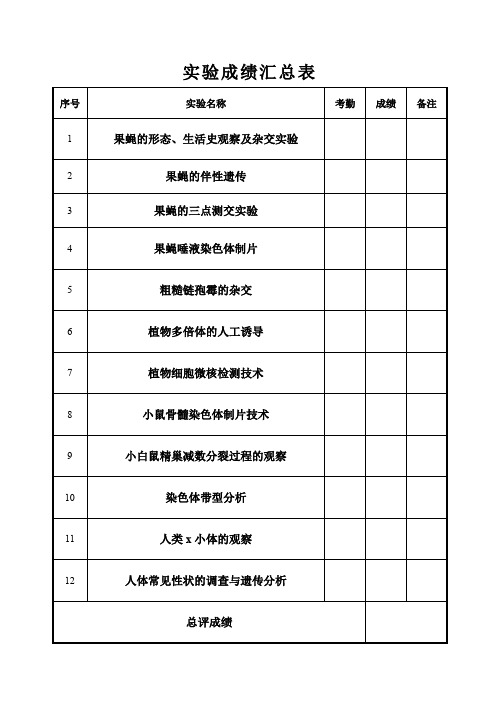
实验成绩汇总表第一次实验实验日期:2022年10月21日实验成绩:实验名称:果蝇的形态、生活史观察及杂交实验维生素、维生素D、脂肪、粗纤维素、碳水化合物、矿物元素及微量元素2等,同时还含有丰富的酶系统和生理活性物质,果蝇喜甜食且葡萄糖能增加酵母活性。
实验操作:A溶液不断搅拌煮沸;B溶液玉米粉和水加热搅拌均匀后再加酵母粉煮沸。
A、B溶液再合到一起煮沸,待其降温至50~60℃时再加0.5 mL丙酸,待培养基冷却至室温后,再分装到各培养管中(每管约3mL)。
灭菌:将分装好的培养基置于高压蒸汽灭菌锅中,103.4 kPa ,121℃,灭菌20 min,冷却后置于-20℃冰箱保存备用。
注意事项:1.A溶液加热过程中不断搅拌,以防琼脂在底部结块。
2.酵母菌加入后,加热的时间必须尽量缩短,避免酵母菌失活;丙酸必须待其降温至50~60℃时再加入,避免丙酸的挥发。
3.分装培养基时要一次性垂直分装到管底,不能污染到管壁、管口。
4.培养管内应晾至表面无水层、管壁无水滴再置于-20℃冰箱保存备用。
(三)野生型果蝇的采集取一个清洁玻璃容器放入腐烂的香蕉,用纱布罩住容器口,在纱布上开几个2〜3 mm 见方的孔,将容器置于室外。
2〜3 d 后即可采集到野生型果蝇,放入冰箱冷冻室(-20℃)冷冻约2 min,待果蝇全部被麻醉之后,再转移到培养管内。
(四)接种将新培养管与装有果蝇的培养管口对口垂直放置。
其中,装有新鲜培养基的培养管倒扣在上方,打开培养管塞后应迅速对好2个管口,将对好的2个培养管翻转,使新培养管位于下方,轻顿几下,待全部果蝇落入新培养管注明两亲本的基因型及交配日期。
7~8天后清空亲本,待F1成蝇羽化后逐日观察、计数对应表型个体数(可靠的计数及观察是培养开始的20天以内,再晚可能有F2了)若须继续试验、观察F2,可从F1内挑出雌雄蝇5-10对另瓶培养。
单因子杂交杂交实验步骤:1、选处女蝇:每两组做正、反交各1瓶,正交选野生型,红眼为母本,反交选突变型白眼为母本,将母本旧瓶中的果蝇全部麻醉处死,在8-12h内收集处女蝇5只将处女蝇和5只雄蝇转移到新的杂交瓶中,贴好标签,于25℃培养。
遗传实训报告

一、实训目的通过本次遗传实训,使我对遗传学的基本理论、实验方法及实验技能有更深入的了解,提高实验操作能力,培养严谨的科学态度和团队合作精神。
二、实训内容1. 遗传学基本理论(1)基因与DNA:了解基因的概念、结构、功能及与DNA的关系。
(2)遗传规律:掌握孟德尔遗传规律、染色体遗传规律及基因重组等基本遗传规律。
(3)遗传咨询:了解遗传咨询的概念、意义及遗传咨询的方法。
2. 实验方法与技能(1)DNA提取:学习DNA提取的原理、方法及操作步骤。
(2)PCR扩增:掌握PCR扩增的原理、操作步骤及注意事项。
(3)基因测序:了解基因测序的基本原理、方法及应用。
三、实训过程1. 实验一:DNA提取(1)原理:利用细胞破碎、蛋白质分解、DNA沉淀等步骤,从细胞中提取DNA。
(2)步骤:①细胞破碎:将植物细胞置于研钵中,加入适量液氮,充分研磨。
②蛋白质分解:加入适量SDS、蛋白酶K等试剂,充分混匀。
③DNA沉淀:加入适量饱和NaCl溶液,充分混匀,离心。
④DNA溶解:将沉淀溶解于适量TE缓冲液。
2. 实验二:PCR扩增(1)原理:利用DNA聚合酶在特定引物引导下,按照模板DNA序列合成新的DNA 链。
(2)步骤:①设计引物:根据目的基因序列设计特异性引物。
②配制PCR反应体系:加入模板DNA、引物、dNTPs、Taq酶等。
③PCR反应:进行94℃变性、55℃退火、72℃延伸等循环。
④产物检测:通过琼脂糖凝胶电泳检测PCR产物。
3. 实验三:基因测序(1)原理:利用Sanger测序法,通过终止子(ddNTPs)与正常dNTPs竞争,产生不同长度的DNA片段,再通过毛细管电泳分离,得到DNA序列。
(2)步骤:①构建克隆:将目的基因插入载体,转化大肠杆菌。
②提取质粒:从转化后的细菌中提取质粒。
③测序:将质粒DNA进行Sanger测序。
四、实训结果与分析1. 实验一:DNA提取成功提取了植物细胞的DNA,经电泳检测,DNA条带清晰。
动物遗传性实验报告单

动物遗传性实验报告单动物遗传性实验报告单实验目的:观察和研究动物的遗传性状,了解遗传规律和遗传变异的原因。
实验原理:遗传物质DNA携带着个体遗传性状的信息,通过基因的组合和表达,决定了个体的遗传特征。
本实验将通过交叉配对、观察后代的表型来推测动物的遗传规律。
实验材料:1. 两对黑色属兔(雌性和雄性各一对)2. 两对白色属兔(雌性和雄性各一对)实验步骤:1. 首先,将黑色属兔的雌性与白色属兔的雄性进行交叉配对,观察后代的表型。
2. 然后,将黑色属兔的雌性与白色属兔的雄性进行交叉配对,再观察后代的表型。
3. 最后,对比两次交叉配对的结果,分析遗传规律和遗传变异的原因。
实验结果:第一次交叉配对结果:- 1/4的后代为黑色- 3/4的后代为灰色第二次交叉配对结果:- 1/2的后代为黑色- 1/2的后代为白色实验分析:从实验结果可以得出以下结论:- 黑色属兔的基因为隐性基因,需两个基因都为黑色才能表现为黑色;- 白色属兔的基因为显性基因,只需一个基因为白色即可表现为白色;- 灰色属兔的基因为杂合子,即一个黑色基因和一个白色基因;- 在第一次交叉配对中,两个灰色属兔杂交产生的黑色属兔的百分比为1/4,即两个灰色杂合子交配形成的黑色属兔;- 在第二次交叉配对中,黑色属兔和白色属兔的交配产生的黑色属兔的百分比为1/2,即一个黑色属兔和一个白色杂合子交配形成的黑色属兔。
结论:根据实验结果,我们可以得出如下结论:- 属兔的黑色基因为隐性基因,白色基因为显性基因;- 具有两个黑色基因的属兔表现为黑色,具有两个白色基因的属兔表现为白色,具有一个黑色基因和一个白色基因的属兔表现为灰色;- 黑色基因和白色基因的遗传规律符合孟德尔的分离定律。
实验总结:通过这次实验,我们深入了解了动物的遗传规律和遗传变异的原因。
同时,也加深了我们对遗传学的理解。
遗传规律的研究对于我们了解生态系统的演化、决定物种多样性和遗传多样性等都具有重要意义,为进一步的生命科学研究提供了重要线索。
遗传学探究实验报告

一、实验目的通过本实验,了解遗传学的基本原理,掌握遗传实验的基本操作,观察和记录实验现象,分析遗传规律,培养科学实验的严谨态度和观察能力。
二、实验原理遗传学是研究生物体遗传现象和遗传规律的科学。
本实验主要涉及孟德尔的两大遗传定律:分离定律和自由组合定律。
实验通过观察杂交后代的表现型比例,验证遗传规律。
三、实验材料与试剂1. 实验材料:玉米种子、豌豆种子、红三叶草种子等。
2. 试剂:清水、蒸馏水、酒精、碘液、稀盐酸等。
四、实验步骤1. 玉米实验(1)取玉米种子,分别种植在两个培养皿中,分别标记为A组(雄性)和B组(雌性)。
(2)待玉米植株长到一定高度,分别进行自交和杂交。
(3)观察并记录A组和B组的杂交后代的表现型比例。
2. 豌豆实验(1)取豌豆种子,分别种植在两个培养皿中,分别标记为C组(母本)和D组(父本)。
(2)分别进行正交和反交。
(3)观察并记录C组和D组的杂交后代的表现型比例。
3. 红三叶草实验(1)取红三叶草种子,分别种植在两个培养皿中,分别标记为E组(雄性)和F 组(雌性)。
(2)分别进行自交和杂交。
(3)观察并记录E组和F组的杂交后代的表现型比例。
五、实验结果与分析1. 玉米实验结果与分析(1)A组自交:F1代中,黄色与绿色的比例为3:1。
(2)B组自交:F1代中,黄色与绿色的比例为3:1。
(3)A组与B组杂交:F1代中,黄色与绿色的比例为1:1。
结果表明,玉米的黄色和绿色基因遵循孟德尔的分离定律。
2. 豌豆实验结果与分析(1)C组正交:F1代中,黄色与绿色的比例为3:1。
(2)C组反交:F1代中,黄色与绿色的比例为3:1。
结果表明,豌豆的黄色和绿色基因遵循孟德尔的分离定律。
3. 红三叶草实验结果与分析(1)E组自交:F1代中,红色与绿色的比例为3:1。
(2)F组自交:F1代中,红色与绿色的比例为3:1。
(3)E组与F组杂交:F1代中,红色与绿色的比例为1:1。
结果表明,红三叶草的红色和绿色基因遵循孟德尔的分离定律。
生物豆子遗传实验报告

一、实验名称:生物豆子遗传实验二、实验目的:通过观察和分析豆子的遗传特征,了解基因的传递规律,探究遗传学的基本原理。
三、实验材料:1. 纯种黄色豆子(YY)2. 纯种绿色豆子(yy)3. 非转基因豆子种子4. 实验记录表格5. 培养土6. 种植容器7. 测量工具(尺子、天平等)四、实验方法:1. 杂交实验法2. 表型观察法3. 数据统计法五、实验步骤:1. 准备阶段:- 收集纯种黄色豆子(YY)和纯种绿色豆子(yy)的种子。
- 将非转基因豆子种子作为对照组。
2. 杂交实验:- 将纯种黄色豆子与纯种绿色豆子进行杂交,得到F1代种子。
- 将F1代种子种植在实验容器中,确保充足的光照和水分。
3. 观察记录:- 每天观察F1代豆子的生长情况,记录生长速度、叶片颜色等特征。
- 待F1代豆子成熟后,收获种子,进行播种。
4. F2代种植与观察:- 将F1代豆子收获的种子进行播种,得到F2代。
- 观察并记录F2代豆子的表型特征,包括豆子颜色、生长速度等。
5. 数据分析:- 对F2代豆子的表型数据进行统计和分析,计算遗传比率。
- 比较F1代和F2代的表型特征,分析遗传规律。
六、实验结果:1. F1代观察结果:- F1代豆子均为黄色,说明黄色为显性性状,绿色为隐性性状。
2. F2代观察结果:- F2代豆子中,黄色豆子与绿色豆子的比例为3:1,符合孟德尔的分离定律。
3. 数据分析结果:- F2代豆子的遗传比率为:黄色(3/4): 绿色(1/4)。
- F2代豆子的生长速度、叶片颜色等特征与F1代相似。
七、实验结论:1. 本实验验证了孟德尔的分离定律,即基因在遗传过程中遵循一定的规律。
2. 黄色豆子为显性性状,绿色豆子为隐性性状。
3. 通过观察和分析豆子的遗传特征,我们了解了基因的传递规律,为后续遗传学研究奠定了基础。
八、实验反思:1. 实验过程中,应注意保持环境条件的一致性,以确保实验结果的准确性。
2. 在数据统计和分析过程中,应注重数据的可靠性,避免人为误差。
高等医学遗传实验报告

一、实验名称人类遗传病基因检测二、实验日期2023年10月25日三、实验目的1. 掌握PCR扩增技术的原理和应用。
2. 学习基因突变检测的方法。
3. 了解常见遗传病的遗传模式。
四、实验原理1. PCR扩增技术:利用DNA聚合酶在特定条件下,按照DNA模板序列合成新的DNA 链,实现对特定基因片段的扩增。
2. 基因突变检测:通过PCR扩增后,利用基因测序或DNA分型等方法,检测基因序列中的突变。
3. 遗传病遗传模式:分析突变基因的遗传方式,判断遗传病的遗传模式。
五、主要仪器与试剂1. 仪器:PCR仪、电泳仪、凝胶成像系统、荧光显微镜等。
2. 试剂:DNA模板、PCR引物、dNTPs、DNA聚合酶、缓冲液、DNA标记染料等。
六、实验步骤1. DNA提取:取外周血或组织样本,按照DNA提取试剂盒说明书提取DNA。
2. PCR扩增:根据突变基因的序列设计PCR引物,进行PCR扩增。
3. 电泳检测:将PCR产物进行琼脂糖凝胶电泳,观察扩增结果。
4. 基因测序:对PCR产物进行基因测序,分析突变基因的序列。
5. 遗传分析:根据突变基因的序列和遗传模式,分析遗传病的遗传方式。
七、实验结果1. DNA提取:成功提取到外周血DNA。
2. PCR扩增:成功扩增出突变基因片段。
3. 电泳检测:PCR产物在琼脂糖凝胶电泳中呈现特异性条带。
4. 基因测序:测序结果显示突变基因存在突变位点。
5. 遗传分析:根据突变基因的遗传模式,判断遗传病的遗传方式。
八、讨论1. PCR扩增技术在基因检测中的应用非常广泛,具有快速、灵敏、特异等优点。
2. 基因突变检测对于遗传病的诊断、治疗和预防具有重要意义。
3. 遗传病的遗传模式分析有助于指导遗传咨询和家族成员的筛查。
九、实验结论1. 成功提取外周血DNA。
2. 成功扩增出突变基因片段。
3. 成功检测到突变基因的突变位点。
4. 通过遗传分析,确定遗传病的遗传方式。
十、注意事项1. 实验过程中应严格遵守操作规程,避免污染。
遗传学实验报告

遗传学实验报告引言:遗传学是生物学的一个重要分支,研究基因在遗传传递中的作用以及对个体特征的影响。
本实验旨在通过分析果蝇的遗传实验,探讨基因的传递规律,并从实验中得出相关结论。
实验设计:本实验选取果蝇作为模型生物,利用果蝇的短世代时间和易于培养的特点,进行杂交实验。
我们选取具有不同表型的果蝇进行交配,观察其后代表型的分布情况,并进行相关分析。
实验方法:1. 实验材料准备:准备实验所需的果蝇品系、实验器材和培养基。
2. 交配组合设计:选取一对表型明显不同的果蝇品系,如白眼与红眼果蝇。
3. 建立交配繁殖群:将白眼果蝇与红眼果蝇分别放入两个培养瓶中,确保他们单独繁殖。
4. 杂交交配操作:利用显微镜和细管将白眼果蝇和红眼果蝇交叉配对。
交配后的果蝇置于培养基中繁殖。
5. 后代分析:观察并记录后代果蝇的表型特征,统计不同表型的数量,并绘制相关图表。
6. 数据分析:采用适当的统计方法,对实验结果进行数据分析,得出结论。
实验结果:通过实验观察和数据统计分析,我们得出以下结论:1. 在交配中,果蝇的表型特征以一定的比例遗传给后代。
例如,白眼果蝇与红眼果蝇杂交后的后代,表现出红眼与白眼的混合表型。
2. 遗传规律中可能存在显性和隐性基因的相互作用。
有些特征可能需要两个显性基因才能表现出来,而有些特征只需要一个显性基因。
这也解释了为什么在交配后代中,会出现隐藏的表型。
讨论:本实验通过果蝇的杂交实验,解释了遗传学中的一些基本原理。
对于基因的传递规律和表型特征的形成所起的作用有了更深入的认识。
通过观察后代果蝇的表型特征,我们可以更好地理解基因在遗传中的作用和表现方式。
此外,实验中的数据分析也提醒我们关注基因的变异和突变。
通过观察果蝇后代中的异常表型,可以了解到不同基因之间的相互作用以及突变对遗传特征的影响。
结论:遗传学实验通过果蝇杂交的方式,揭示了基因的传递规律和表型特征的形成机制。
通过实验的分析和讨论,我们更深入地理解了基因的表达和遗传传递原理。
遗传学实验报告

实验名称:植物细胞有丝分裂染色体观察实验日期:2023年10月15日实验目的:1. 熟悉植物细胞有丝分裂染色体制备的基本原理和步骤。
2. 观察植物细胞有丝分裂过程中染色体的形态特征,了解有丝分裂各个时期的染色体变化。
3. 掌握显微镜操作技能,提高观察和分析能力。
实验原理:植物细胞有丝分裂是细胞分裂的一种重要方式,通过有丝分裂,细胞可以产生两个具有相同遗传信息的子细胞。
在有丝分裂过程中,染色体会经历前期、中期、后期和末期四个阶段,每个阶段染色体的形态和数目都有所不同。
通过对有丝分裂染色体的观察,可以了解植物细胞遗传信息的传递和细胞分裂的机制。
实验材料:- 洋葱根尖- 95%乙醇- 冰醋酸- 甲基绿-派洛宁染色液- 镊子- 显微镜- 载玻片- 盖玻片- 吸水纸实验步骤:1. 材料处理:将洋葱根尖洗净,放入盛有95%乙醇的烧杯中浸泡30分钟,然后用镊子取出根尖,放入盛有冰醋酸的烧杯中浸泡30分钟,以固定细胞。
2. 制片:将固定好的根尖放入盛有甲基绿-派洛宁染色液的烧杯中染色5分钟,然后用吸水纸吸去多余染液,滴加一滴蒸馏水,盖上盖玻片,制成临时装片。
3. 观察:在显微镜下观察洋葱根尖细胞有丝分裂染色体,记录不同时期染色体的形态特征。
4. 绘图:根据观察结果,绘制有丝分裂各个时期染色体的示意图。
实验结果:1. 前期:染色体开始凝缩,呈细长条状,染色质逐渐消失,核仁消失。
2. 中期:染色体高度凝缩,呈X形,位于细胞中央,纺锤丝连接着染色体的着丝粒。
3. 后期:染色体逐渐缩短变粗,纺锤丝断裂,染色体分离,分别移向细胞两极。
4. 末期:染色体到达细胞两极,开始解螺旋,细胞质分裂,形成两个子细胞。
实验结论:通过本次实验,我们成功制备了洋葱根尖细胞有丝分裂染色体标本,并观察到了有丝分裂各个时期染色体的形态特征。
实验结果表明,有丝分裂是植物细胞分裂的重要方式,染色体在有丝分裂过程中经历了复杂的形态和数目变化,保证了遗传信息的准确传递。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠骨髓染色体制备与观察
【实验目的】
掌握动物骨髓细胞染色体制片技术
观察小鼠中期染色体的形态特征并对染色体计数
【器材】
恒温水浴槽、纱布、烧杯、离心管、刀片、镊子、解剖盘、解剖剪、镊子、注射器、离心机、镜头纸、光学显微镜、带数码相机的光学显微镜
【药品】
0.075mKCl、低渗液、固定液(甲醇:醋酸=3:1)、0.4%秋水仙素、改良苯酚、品红溶液、二甲苯
【动物】
体重20克左右的小鼠(2n=40)一只
【实验原理】
核型(karyotype)是指染色体组在有丝分裂中期的表型,是染色体数目、大小、形态特征的总和。
核型具有明显的种属特异性。
中期分裂特点:染色体浓缩成棒状,着丝点在染色体末端,可见三种形状的中期染色体
低渗处理,秋水仙素处理,植物凝集素(PHA)处理是三个关键技术。
血淋巴细胞是动物和人的核型分析最常用的素材,但是动物骨髓中的造血干细胞是各种血细胞的来源,具有很强的分裂能力,便于获取,以直接得到中期细胞而不必象血淋巴细胞或组织那样要经过体外培养,是动物染色体核型分析的理想材料。
与血淋巴细胞相比,造血干细胞具有分裂旺盛的优势,无需PHA处理即可用于核型分析。
制片的流程为:秋水仙素处理-收集骨髓细胞-低渗处理-固定-滴片-染色-水洗-镜检
秋水仙素处理:秋水仙素能够抑制纺锤丝形成,使中期姐妹染色单体无法分离,大量的有丝分裂细胞被阻断在中期。
增加了中期分裂相细胞的比例。
收集骨髓细胞:用生理盐水(0.85% NaCl溶液)收集骨髓细胞,使维持等渗环境,保持细胞自然形态。
低渗处理:营造低渗环境,使细胞内张力增大,细胞更容易破裂,染色体更分散。
固定:终止细胞生长过程及一切生理生化反应,维持细胞结构不变。
滴片:产生的剪切力破坏细胞膜。
预冷的玻片使得液体的表面张力增加,液层更薄,有利于细胞的破裂和染色体的分散。
滴片后,细胞膜破裂,细胞核或核内染色体分散在载玻片上。
【实验方法】
1. 秋水仙素处理
腹腔注射0.01%秋水仙素溶液0.5ml 等待2-4h
2.处死:每四人领取一只小鼠,抓住小鼠尾巴将
其转移到实验台上。
采用颈椎脱臼法处死小鼠。
一
手按住鼠头,另一手抓住鼠尾靠近根部用力向后拉。
将脊髓与脑髓拉断。
注意小鼠咬手,缓慢加力
3.解剖:剪去腿部附近皮毛,取出股骨胫骨,剃去
周围肌肉组织。
4.收集骨髓细胞:剪去骨两端,注射器吸生理盐水
(0.85% NaCl溶液),针头插入骨腔反复冲洗几次,
用1.5ml离心管收集骨髓细胞。
不要多次重复吸取
含有细胞的生理盐水,总体积不要超过1.5ml
5.离心
条件:2000rpm,5min注意用相同溶液配平。
离
心后,用注射器小心吸取上清,弃去。
离心管内
可以留少许液体。
6.低渗处理
低渗液配方:0.075M KCl溶液。
离心收集细胞,去上清。
加入1.5ml 37℃低渗液,振荡(轻弹管壁)使细胞分散,在37 ℃培养箱中保温低渗10min,做好标记。
7.固定
固定液配方:甲醇:乙酸=3:1。
离心收集细胞,去上清。
加入1.5ml固定液,振荡使细胞分散,室温固定10min。
振荡使细胞分散
8.滴片
从40cm以上的高度将细胞悬液滴在预冷的载玻片上,
滴两滴(载玻片1/3 和2/3处)。
滴加悬液时载玻片
可适当倾斜(30度角),滴完后立即用嘴吹散细胞,
空气干燥。
9.染色
染料:石碳酸品红。
染液覆盖所有细胞,载玻片下垫
纸巾,染色5min
10.水洗
用较小的水流冲洗载玻片背面,流水将从载玻片边缘带走染液,滤纸擦干载玻片背面水分,空气干燥,
无需盖玻片,镜检
11.镜检
10倍镜下锁定目标细胞,40倍镜下观察染色体
【注意事项】
安全:老鼠咬手、染液和固定液不要接触皮肤离心前注意配平
标记自己的样品管
水洗过程中要时刻记住载玻片的样品面和背面待玻片完全干燥后再镜检。
