第二章 红外
第二章-红外光谱和拉曼光谱技术

第二章红外光谱和拉曼光谱技术研究阴离子型层状及插层材料的结构红外光谱和拉曼光谱技术是相当成熟的分子结构研究手段,目前已经应用于多种阴离子型层状结构LDHs的层板阳离子、层间阴离子的研究[1-21]。
LDHs中的水是一个很强的红外吸收体,因此,红外光谱中很难观察到层板羟基的伸缩振动吸收峰。
但是,水又是一个很差的散射体,层板羟基的伸缩振动可以很容易在拉曼光谱中观察到,因此拉曼光谱法在LDHs研究中逐渐得到人们的重视[18]。
近年来,红外发射光谱技术、热分析/红外光谱联用技术、原位红外和拉曼光谱技术等已经被用来研究LDHs的热稳定性及有机阴离子插层LDHs的热分解过程[21-26]。
相关红外光谱和拉曼光谱技术在LDHs中的应用研究综述详见文献[27]。
2.1. LDHs层板的振动光谱2.1.1. MgAl-LDHs的振动光谱MgAl-LDHs在目前的文献中研究最多,下面以MgAl-LDHs为例说明LDHs层板的振动光谱峰位归属,并且对不同金属阳离子组成的LDHs层板的振动光谱进行比较分析。
MgAl-LDHs的红外光谱谱图在3450cm-1处可以观察到一个强而宽的吸收峰(图2-1),这是由两个或三个羟基伸缩振动和层间水分子伸缩振动重叠而成的;在3000~3300cm-1附近有时还出现一个肩峰,这是由羟基和层间碳酸根的相互作用而产生的;在650cm-1以下可观察到晶格的平移振动,而在700~1000cm-1范围内观察到归属于羟基和水的平移振动模式的宽而强的吸收峰,450cm-1处的吸收峰归属于[AlO6]3-基团或Al-O的单键振动。
在600~650cm-1之间,观察到由多组分峰相重叠而成的一个宽峰,在555cm-1附近有时有一个独立的峰。
680cm-1处峰形比较复杂,这是由于Al-O和Mg-O键的振动峰与碳酸根的ν4振动峰发生重叠的缘故。
对870cm-1附近的吸收峰的归属存在争议,一些研究者认为此峰是由层间CO32-的ν2振动产生的[28-30],而Kagunya等人[31]则认为856cm-1附近的峰归属于LDHs的层间阴离子CO32-、NO3-及OH-的转动振动模式E u(R)(OH)。
第二章_红外光谱(3)
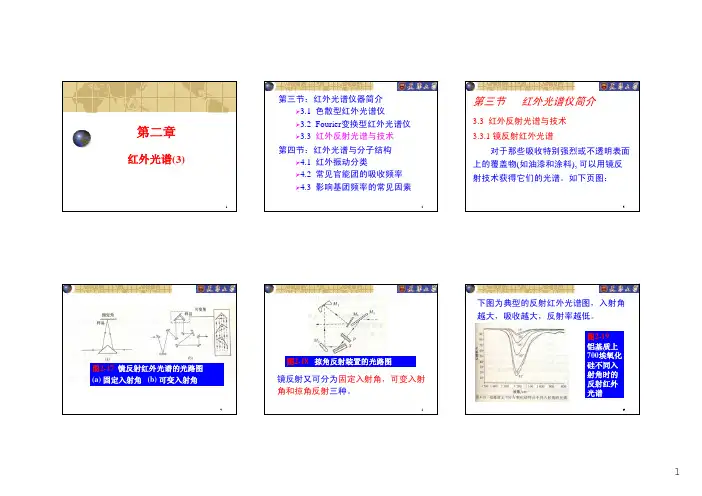
1第二章红外光谱(3)2第三节:红外光谱仪器简介¾3.1 色散型红外光谱仪¾3.2 Fourier 变换型红外光谱仪¾3.3 红外反射光谱与技术第四节:红外光谱与分子结构¾4.1 红外振动分类¾4.2 常见官能团的吸收频率¾4.3 影响基团频率的常见因素33.3 红外反射光谱与技术3.3.1 镜反射红外光谱对于那些吸收特别强烈或不透明表面上的覆盖物(如油漆和涂料), 可以用镜反射技术获得它们的光谱。
如下页图:第三节红外光谱仪简介4图2-17 镜反射红外光谱的光路图(a) 固定入射角(b) 可变入射角5镜反射又可分为固定入射角,可变入射角和掠角反射三种。
图2-18 掠角反射装置的光路图6下图为典型的反射红外光谱图,入射角越大,吸收越大,反射率越低。
图2-19 铝基质上700埃氧化硅不同入射角时的反射红外光谱73.3.2 衰减全反射红外光谱全称:Attenuated Total Reflectance IR Spectra ,简称ATR ,又叫内反射光谱(Internal Reflection Spectra )。
什么是全反射?n sφθn p 8根据折射定律,sin θ/sin φ=n s /n p当n p >n s 时,则有φ>θ, 即由光密介质进入光疏介质时,折射角大于入射角。
当θ增大到一定程度时,折射角达到90o ,则有sin θ=n s /n p9即入射光束全部被反射,这种现象叫做全反射,发生全反射时的入射角叫临界角(Critical Angle)。
arcsin(/)c s p n n θ=10全反射现象不完全是在两种介质的界面上发生的,部分光要进入到样品介质一段距离后才被反射回来,在样品透光区,反射回来的光的能量与入射光几乎相同,但在样品的吸收区,则有部分光被吸收,使反射回来的光,能量发生衰减。
这就是衰减全反射光谱的来源。
第二章 红外吸收光谱(讲课)

6. IR光谱在化学领域中的应用
1. 分子结构基础研究 应用IR测定分子的键长、键角,以此推断出分子的立 体构型; 根据所得的力常数可以知道化学键的强弱,由简正频 率来计算热力学函数等。
2. 化学组成分析
根据光谱中吸收峰的位置和形状来推断未知物结构,依 照特征吸收峰的强度来测定混合物中各组分的含量。
第二章 红外吸收光谱
第一节 概述
1、 红外吸收光谱与紫外吸收光谱一样是一种分子吸收光谱。
红外光的能量( E=0.05-1.0ev)较紫外光( E=1-20ev) 低。红外光照射分子时不足以引起分子中价电子能级的跃迁, 而能引起分子振动能级和转动能级的跃迁,故红外吸收光谱 又称为分子振动光谱或振转光谱。
非线型分子振动自由度数目:3N-6个; 线性分子的振动自由度数目: 3N-5个。
理论上每个自由度在IR中可产生1个吸收峰,实际上IR光 谱中的吸收峰数少于基本振动自由度,原因是:
(1)振动过程中,伴随有偶极矩的振动才能产生吸收峰。 (2)频率完全相同的吸收峰,彼此发生简并(峰重叠)。 (3)强、宽峰覆盖相近的弱、窄峰。 (4)有些峰落在中红外区之外。 (5)吸收峰太弱,检测不出来。
表 化学键的力常数
键 H-F 分子 HF k(×105dyn/cm) 9.7 4.8 4.1 键 H-C H-C C-C 分子 CH≡CH k(×105dyn/cm) 5.9 4.5-5.6 CH2=CH2 5.1
H-Cl HCl H-Br HBr
H-I
H-O H-O H-S H-N H-C
HI
H2 O 游离 H2 S NH3
1. 由虎克定律计算化学键振动频率
振
1 2
k
m
1
第二章 红外光谱2
When you analyze the spectra, it is easier if you follow a series of steps in examining each spectrum.
1. Look first for the carbonyl C::O band. Look for a strong band at 18201660 cm-1. This band is usually the most intense absorption band in a spectrum. It will have a medium width. If you see the carbonyl band, look for other bands associated with functional groups that contain the carbonyl by going to step 2. If no C::O band is present, check for alcohols and go to step 3.
2.5.1 红外光谱的分区
4000-2500cm-1:这是X-H单键的伸缩振动区。 2500-2000cm-1:此处为叁键和累积双键伸缩振
动区 2000-1500cm-1:此处为双键伸缩振动区 1500-600cm-1:此区域主要提供C-H弯曲振动的
信息
2.5.3 红外图谱的解析步骤
CH3 CH3 CH2 CH CH2 CH3
谱峰归属
3000-2800cm-1:饱和C—H的反对称和对称伸缩振 动 ( 甲 基 : 2 9 6 0 和 2 8 7 2 cm-1, 亚 甲 基 : 2 9 2 6 和 2853cm-1)。
1461cm-1:亚甲基和甲基弯曲振动(分别为1470和 1460cm-1)。
第2章 红外光谱

共轭效应使 电子离域,双键性 ,K
(3)中介效应(使振动频率移向低波数区) 含有孤对电子的 O、N 和 S 等原子,能与 相邻的不饱和基团共轭(p-π共轭),其结果 使不饱和基团的振动频率降低,而自身连接 的化学键振动频率升高。
羰基的双键性
K
3、空间效应
(1)环的张力:环减小→环张力增大 →环内各键 被削弱→伸缩振动频率降低→环外的键却增强→ 伸缩振动频率升高。 环酮:环张力增大, 羰基v 增大。 环烯:环张力增大, 双键v 减小。 (2)空间障碍:共轭体系的共平面性被偏离或被 破坏时, v 增大。
O-H(缔合)
2843 cm-1
~ (游离) 3615~3605 cm-1 O-H
2.3 红外光谱仪及样品制备技术
一、红外光谱仪
红外光谱按其发展历程分为三代: 第一代是以棱镜作为单色器 第二代是以光栅作为单色器 第三代干涉型分光光度计
1、色散型红外光谱仪
(1)仪器的工作原理
仪器组成:光源,吸收池,单色器、 检测器、放大器和记录器。 仪器的工作原理:依据“光学零位平衡”
分子振动频率有以下规律:
(1)K:化学键的力常数是衡量价键性质的一个重要 参数(质量相近的基团)。 因 Kc≡c>Kc=c>Kc-c 则红外频率νc≡c>ν c=c> νc-c
(2)与氢原子相连的化学键的折合质量都小,红外吸
收在高波数区(X—H),C-H伸缩振动吸收位于
3000cm-1,O-H伸缩振动吸收位于3000-3600 cm-1,NH伸缩振动吸收位于3300 cm-1。
化学键弯曲振动的类型
弯曲振动
面内弯曲振动 剪式振动 面内摇摆振动 面外弯曲振动 面外摇摆振动 面外扭曲振动
第二章 红外光谱
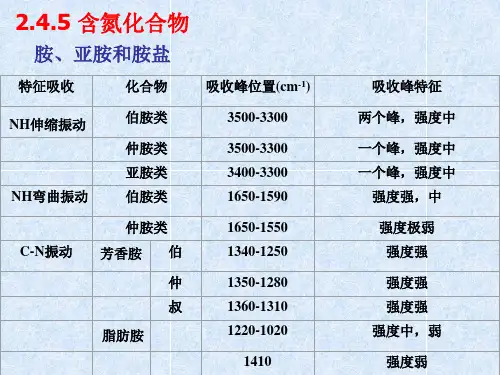
2 . N-H(吸收强度比-OH弱,峰形较尖锐)
胺类: 游离——3500~3300cm-1 缔合——吸收位置降低约100cm-1 伯胺:3500,3400cm-1 仲胺:3400cm-1 叔胺:无吸收 酰胺:伯酰胺:3350,3150cm-1 附近出现双峰 仲酰胺:3200cm-1 附近出现一条谱带 叔酰胺:无吸收
远红外
25 - 1000
400 - 25
红外光谱是用频率4000~400cm-1(2.5~25m)的光波
照射样品,引起分子内振动和转动能级跃迁所产生的
吸收光谱。也称振 - 转光谱。
波长和波数
电磁波的波长( )、频率( v)、能量(E)之间的关系:
二、红外光谱图
I T % 100 % I0
O R C R
O R C H
1715 cm-1
O C
C C
O C R
1665-1685
O
H
(CH3)2N
C
H
1730 CH3C≡N
2255
1690
1663 (CH3)2C=CH-C≡N
2221
同一化合物中,如果同时存在I效应和C效应,则影 响较大的效应决定吸收峰的位移方向
1735 -I>+C
1680
能发生振动能级跃迁,产生吸收光谱。
2. 只有引起分子偶极矩发生变化的振动才能产生
红外吸收光谱。
四、影响特征吸收频率的因素
分为内因(不可变化)和外因(可变)
(一)内部因素 1、电子效应 a. 诱导效应(I 效应)
诱导效应使基团电荷分布发生变化,从而改变了键的力常
数,使振动频率发生变化.
例:
O R C X
υOH ,υNH
第二章:红外光谱R1
近红外光区(0.75 ~ 2.5 µ m)
由低能电子跃迁、含氢原子团(如O—H、N— H、C—H)伸缩振动的倍频吸收等产生的。
中红外光区(2.5 ~ 25 µ m)
绝大多数有机化合物的基频吸收带出现在该光 区。由于基频振动是红外光谱中吸收最强的振动, 所以该区最适于进行红外光谱的定性和定量分析。
远红外光区 (25 ~ 1000 µ m)
1.4.2 电子效应
包括诱导效应和共轭效应,它们都是由于化 学键的电子分布不均匀引起的。
(1)诱导效应(I 效应)
由于取代基具有不同的电负性,通过静电诱导作
用引起分子中电子分布的变化。从而改变了键力常数,
使基团的特征频率发生了位移。
(2)共轭效应 (+ C 效应)
当双键之间以一个单键相连时,双键电子之间 发生共轭而离域,降低了双键的力常数,从而使双 键的伸缩振动频率(波数)降低,但吸收强度提高。
(3) 跨环效应:是一种特殊的空间电子效应。
HClO4
NH NH NH
ClO4
O
O
OH
1675 cm-1
3365 cm-1
(4)环张力:环外双键和环上羰基随着环的张力
增加,其频率(波数)也相应增加。
1.4.4 氢键
(1) 分子内氢键:使谱带大幅度向低频方向移动。
(2)分子间氢键:醇与酚的羟基,在极稀的溶液中 呈游离状态,在3650 ~ 3600cm出现吸收峰,浓度增 大,分子间形成氢键,υOH 向低波数方向移动至3515 cm-1(二聚体)及3350 cm-1(多聚体)。
合频峰:1+2、 21+2、 1+22
组 频
差频峰: 1-2、 21-2、 1-3
第二章_红外光谱(2)
1第二章红外光谱(2)2第二节:红外光谱的基本原理¾2.1 红外吸收光谱法¾2.2 双原子分子的转动光谱¾2.3 双原子分子的振动光谱¾2.4 多原子分子的振-转光谱¾2.5 红外光谱获得的条件第三节:红外光谱仪器简介¾3.1 色散型红外光谱仪¾3.2 Fourier 变换型红外光谱仪¾3.3 红外反射光谱与技术32.4 多原子分子的振动-转动光谱2.4.1 简正振动的数目多原子分子的振动比双原子分子复杂得多,它不仅包括双原子分子中沿化学键(核-核)方向的伸縮振动,而且还有键角参与的各种变形或弯曲振动(分子平面内和平面外),以及伸縮振动和变形振动的偶合。
什么是简正振动呢?4分子在保持质心不变,不产生转动的条件下,分子中的各个原子都以同一频率作振动,这种振动就叫简正振动。
若想了解简正振动的数目,首先必须确定所有原子的相对位置,利用其简正坐标才能求得。
假定分子由N 个原子构成,每个原子的空间位置需要三个坐标才能确定,那么,N 个原子需要3N 个坐标,或者说3N 个运动自由度。
5但原子间通过化学键构成了一个整体,对于非线性多原子分子而言,有3个平动自由度和3个转动自由度,因而,分子振动自由度的数目,即简正振动的数目为3N -6个;而线性多原子分子只有2个转动自由度和3个平动自由度,因而简正振动的数目为3N -5个。
6对于多原子分子振动的描述,需要以原子坐标,质量和原子间力为变量,建立3N 个微分方程,其解是非常复杂的,对于简正振动对称类型的运算,需要用“群论”加以处理。
7下面举例说明简正振动数目的计算:例1计算水分子的简正振动数目H 2O 为非线性分子,故简正振动数目为:3×3-6=3下面用示意图说明一下这几种振动模式:8以上三种简正振动模式在分子振动过程中,都有电偶极矩的变化,所以在红外光谱图上可以观察到三个吸收谱带。
第二章 红外光谱
(3)-OH基在形成氢键缔合后,偶极矩增大,因此在34503200cm-1之间表现为一个强而宽的锋。
01:30:28
若形成分子内氢键,酚羟基伸缩振动谱带向低频移动更为
明显。例如:
O H N O
+
O H O
O H O
OH(cm-1)
3610(游离)
3243
3077
(4)羧酸(-COOH)中的羟基比较特殊,由于氢键缔合,通 常以二聚体或多聚体的形式存在。吸收峰向低波数方向移动,
01:30:28
O
1660±10
波数(cm-1) 1680-1620 1620-1450 1690-1640 1630-1575 1590-1510 1390-1350
~1700
~1745
峰强度 不定
6、 双键的伸缩振动区(16801500 cm-1 )
不定 不定 强 强(稍弱)
讨论:
(1)分子比较对称时,C=C峰很弱,当个相邻基团相差比
O—H、N—H伸缩振动区(OH,NH )
不饱和C-H伸缩振动区( CH) 饱和及醛基C-H伸缩振动区( CH) 三键伸缩振动区( C≡C, C≡N ) 羰基伸缩振动区( C=O) 碳碳双键伸缩振动区( C=C) 碳氢面内弯曲振动和单键伸缩振动区 碳氢面外弯曲振动区
二、分子结构与吸收峰
四、不饱和度
01:30:27
一、特征区、指纹区和相关峰
1、特征区:4000~1300 cm-1,有机化合物主要官能团的 特征吸收区。特点:比较稀疏,容易辨认。与一定结构单元
相联系的、在该范围内出现的吸收峰叫特征吸收或特征峰;
例: 2800 3000 cm-1 1600 1850 cm-1 —CH3 —C=O 特征峰; 特征峰;
第二章 红外光谱原理
1775 cm-1 1850 cm-1
CH2 CH2
1650 cm-1
1657 cm-1
1678 cm-1
1781 cm-1
1639 cm-1
1623 cm-1
1566 cm-1
1541 cm-1
4.氢键效应
分子内氢键:
分子内氢键使伸缩频率向低波数移动,谱带变宽
注意:分子内氢键,不受浓度影响
峰的吸收强度被强化。这种倍频与基频之间的振动
偶合称为费米共振。 如:苯甲酰氯
羰基:1730cm-1; C-Cl的伸缩振动频率875 cm-1, 其倍频峰与羰基发生费米共振,二者吸收强 度都增强。
8.化学键强度及原子杂化类型
化学键越强,力常数K越大,IR吸收频率越大。
C C
2150cm -1
C=C
1650cm-1
60
2867 3533 1328
40
2957
-CH3 -CH2 –CH –CHO –OCH3 3000-2700
911 948 979
1425
1225 1076 1116
20
3424
1378 1245
第二章
红外光谱(IR)
Chapter 2 Infrared spectra
基础知识介绍 红外光谱的重要区段 红外光谱在结构分析中的应用
第一节
红外光谱基本原理
一、分子的能级和吸收光谱
世界是运动的。世界上任何物质中的分子都 处于不停的运动中,分子运动总能量可表示为:
+
E平
平动能
能量量子化 E=E激发态-E基态
剪式振动δ s:振动中键角的变化类似剪刀的开闭
AX 2型分子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
未形成分子内氢键
氢键对氢键给体的影响较大, 对氢键受体的影响相对较小.
分子间氢键
分子间氢键是否能够形成以及缔合程度有多大与该化合物 的浓度有密切关系 例如: 环己醇
浓度<0.01mol/L的CCl4稀溶液中------不形成分子间氢键 浓度<0.1mol/L的CCl4溶液中------ 形成二聚体和多聚体的吸收 浓度<1.0mol/L的CCl4溶液中------几乎都是多聚体
例1:丁醚的红外光谱图(KBr压片法)
例2:苯甲醚的红外光谱图(KBr压片法)
4.羰基化合物的特征吸收频率
νC=O: 1870~1650-1(s, 较窄), 位置较为恒定, 干扰少.
酸酐
1820 1800
酰卤
1740 1730
酯
1715
醛
1700
酮
1690
羧酸
1760
酰胺
⑴. 醛
基团 C=O 振动方式 吸收范围 伸缩振动 说明
动频率向低波数移动, 且吸收强度变大, 峰带变宽.
分子内氢键
H O O O OH
O
O
ν
ν ν
C=O(缔合)
C=O(游离) O--H(缔合)
1622cm-1
1675cm-1 2843cm-1 ν
ν
ν
C=O(游离)
C=O(游离)
1676cm-1
1673cm-1
O--H(游离)
3615~3606cm-1
形成分子内氢键
取决于影响较大的那一个效应的影响.
化合物
O R C R' R O C .. NH2 O R C .. OR' O R C .. Cl
ν
C=O
/cm-1
~1715
~1650
+C>-I
~1735
-I>+C
~1800
-I>+C
电子效应 的净结果
g: 氢键效应的影响
氢键的形成, 使X-H键变长, 键的力常数减小伸缩振
1740~1720 有共轭不饱和键、芳环或氢键,向低波数 cm-1(s) 移动(1710~1680cm-1); α-C上连有吸电 子基, 向高波数移动(1770~1740cm-1) 2820cm-1 (m) 2720cm-1 (m)
O
C-H
两谱带强度相当,特征性很强
C H 伸缩振动
例1:正壬醛的红外光谱图(KBr压片法)
键长不变, 键角改变
对称 伸缩振动 (νas) H C H
不对称 伸缩振动 (ν s )
面外弯曲(δ面外)
非平面摇摆 + H C + H 扭曲振动 + H H
H C
H
H
H
H
C
C
高频区
低频区
亚甲基的振动形式
甲基的振动形式
伸缩振动
ν s(CH3) 2870 ㎝-1
ν
as(CH3) 2960㎝-1
弯曲振动
α-二酮在1730~1710cm-1有一个强谱带 β-二酮(酮式:1730~1690cm-1有两个吸收
带; 烯醇式: 1620~1600 cm-1有一个很强 的吸收带
例如
CH3COCH2COCH3
酮式ν C=O : 1727, 1707cm-1
O CH3 C
H O CH C CH3
烯醇式ν C=O : 1616cm-1
多聚体 游离
0.01mol/L
多聚体
游离 二聚体
0.1mol/L
1.0 mol/L
不同浓度 环己醇的 IR光谱
h: 环张力的影响
当环有张力时, 环内各键削弱(C-C键成弯曲键, P电 子成分增高), 键角的缩小使双键性减弱, 环内双键伸
缩振动频率下降, 而环外双键伸缩振动频率增高.
化合物 ν /cm-1 ~1646
正己烷的红外光谱
红外吸收强度及其表示符号
摩尔消光系数(ε)
>200 75~200 25~75 5~25 0 ~5
强度
很强 强 中等 弱 很弱
符号
VS S M W VW
红外吸收峰形状
宽峰
尖峰
肩峰
双峰
二.红外光谱的应用
1.通过红外光谱图的比较,可以判断是否是同一种化合物. 2.可以获取分子中各种结构信息, 特别是官能团信息.
O
C=C
~1611
O
~1566
O
~1541
O
化合物 ν /cm-1 ~1715 ~1745 ~1775 ~1800
C=O
(2). 原子质量的影响
1 1 m m 值↑, 振动频率↑ 2 1
键类型 ν /cm-1
C-H
3000
C-C
1200
C-O
1100
键类型
ν /cm-1
第二章 红外吸收光谱
一.红外光区电磁波谱与光谱表示法
1.红外光区电磁波谱 红外光: 介于可见光与微波之间的电磁波.
其波长范围为0.8~1000 m
红外光区分三个区段: 近红外区:0.8~2.5m(13333~4000cm-1), 泛音区(用于研究 单键的倍频、组频吸收) 中红外区:2.5~25m,4000~400cm-1, 基频振动区,一般所称 的红外区(各种基团基频振动吸收) 远红外区:25m以上,转动区(价键转动、晶格转动)
Y Z 伸缩振动区 (C C, C N, C=C=C)
Y=Z伸缩振动区 (C=O, C=N, C=C)
红外吸收光谱中各种主要基团的大致分布图
不仅要注意特征官能团的位置. 而且还要注意观察峰的形状和强度.
例如
ν
C=O
/cm-1 ----1850~1630
强
ν
C=C
/cm-1 ---- 1680~1620
例如: 3000±150cm-1区域的任何吸收, 都可以归结为C-H伸缩振动.
1715±100cm-1区域的任何强吸收, 基本上都可以归结为C=O
伸缩振动.
红外吸收光谱中各种主要基团的伸缩振动大致分布图
三.分子的振动类型
键角不变, 键长改变
振动类型 伸缩振动 弯曲振动
面内弯曲(δ面内)
剪式振动 平面摇摆 H C
m1 m2 m1 m2
K: 化学键的力常数, N· m-1 µ:化学键的折合质量, kg m1、m2: 化学键连结的两个原子核的质量,kg
吸收频率用波数(ν)表示
1
c1 2ck来自1 2c
k(
1 1 1 1 ) 130.2 k ( ) m1 m2 m1 m2
δ s(CH3)1380㎝-1
δ
as(CH3)1460㎝
-1
四.化学键的性质对红外吸收的影响
双原子分子的振动方式: 伸缩振动.
如果把双原子分子粗略地 看成弹簧谐振子, 那么化学键 的伸缩振动就是两个原子核在 键轴方向上的简谐振动. 根据虎克定律
K m1 m2
双原子分子伸缩振动示意图
1 2
K
红外光谱
1600~3700cm-1 官能团吸收区
吸收峰密集, 难以 辨认, 但如同人的 指纹一样, 化合物 结构上的细微变 化都有反映 <1600cm-1 指纹区
C-C, C-N, C-O伸缩振动 及弯曲振动
2500~3700cm-1
2100~2400cm-1
1600~1800cm-1
Y-H 伸缩振动区 (O-H, N-H, C-H)
1250800cm-1
弱峰, 特征性不大, 无意义
炔烃:
~3300
cm-1,峰很尖锐 与OH 和NH有重叠;
烯烃、芳烃:
3100~3000
cm-1 两种氢易于混淆
注意: 结晶水的-O-H伸缩振动在3600~3000cm-1, 对醇羟基
和酚羟基的判别有干扰, 通过1670~1600cm-1出现的H-O-H弯 曲振动峰加以区分
例1:4-甲基-3-戊烯-2-酮的红外光谱图(KBr压片法)
例2:苯乙酮的红外光谱图(KBr压片法)
例3:环戊酮的红外光谱图(KBr压片法)
例4:2,4-戊二酮的红外光谱图(KBr压片法)
⑶. 羧酸
基团
O-H
振动方式 吸收范围
说明
伸缩振动 (二聚体) (s, 宽而散) 游离态中3550cm-1(s, 尖峰)
c: 光速, 3×1010cm/s K: N· m-1 µ:原子质量单位为单位
影响吸收频率的因数
(1). 键的力常数K的影响. 化学键键能越大↑ 力常数越大↑ 振动频率↑
a: 成键方式的影响
键类型 力常数 ν /cm-1 2150 1650 1200
C C
C C
C C
b: 振动类型的影响
振动类型 ν /cm-1
例1:正己醇的红外光谱图(KBr压片法)
例2:2-丁醇的红外光谱图(KBr压片法)
例3:对甲基苯酚的红外光谱图(KBr压片法)
3.醚类的特征吸收频率
基团 振动方式 说明 脂肪醚: 1150~1060cm-1(一般1120cm-1, 强吸收) 不对称伸 芳香醚: 1275~1210cm-1 -1, 强吸收) ( 一般 1240cm 缩振动 C-O-C 乙烯基醚: 1225~1200cm-1 醇、醛、酮、酯和内酯在这一区域有干扰.
O O R C H R O C Cl R O C F F O C F
化合物 ν
C=O
R
C R'
/cm-1
~1715
~1730
~1800
~1920
~1928
