甲磺酸帕珠沙星质量标准
甲磺酸达氟沙星内控质量标准
制药GMP管理文件一、目的:制定甲磺酸达氟沙星的内控质量标准,规范公司甲磺酸达氟沙星的采购与使用。
二、适用范围:甲磺酸达氟沙星的采购与验收。
三、责任者:生产部、检验员、仓库保管员四、正文:甲磺酸达氟沙星本品为1-环丙基-6-氟-4-氧代-1,4-二氢-7-[(1S,4S)-5-甲基-2,5-二氮杂双环[2.2.1]庚烷-2-基]-3-喹啉羧酸甲磺酸盐。
按干燥品计算,含C19H20FN3O3·CH4O3S不得少于99.0%【性状】本品为白色至淡黄色结晶性粉末;无臭,味苦。
本品在水中易溶,在甲醇中微溶,在氯仿中几乎不溶。
比旋度取本品,精密称定,加水溶解并稀释制成每1ml中约含10mg的溶液,依法测定,比旋度为-190°至-204°。
【鉴别】(1)取本品约50mg,置干燥试管中,加丙二酸约30mg 与醋酐0.5ml,在80~90℃水浴中加热5~10分钟,显红棕色,(2)取本品,加0.1mol/L盐酸溶液制成每1ml中含5ug的溶液,照分光光度法测定,在282nm与348nm±2nm的波长处有最大吸收。
(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】酸度取溶液的澄清度与颜色项下的溶液,依法测定,PH值应为3.5~4.5。
溶液的澄清度与颜色取本品0.2g,加水20ml溶解后,溶液应澄清;如显浑浊,与1号浊度标准液比较,不得更浓;如显色,与黄绿色6号标准比色液比较,不得更深。
氟取本品约50mg,精密称定,照氟检查法测定,按干燥品计算,含氟量不得少于3.8%。
有关物质取本品,加流动相溶解并制成每1ml中含1.0mg的溶液,作为供试品溶液;量取适量,加流动相制成每1ml中含0.05mg 的溶液,作为对照溶液。
照高效液相色谱法试验,以十八烷基硅烷键合硅胶为填充剂,0.3%四丁基溴化铵溶液-甲醇-冰醋酸(74:26:2)用三乙胺调节PH值至3.0为流动相,检测波长为280nm,理论板数按甲磺酸达氟沙星峰计算不低于1500。
甲磺酸帕珠沙星木糖醇注射液的制备与质量控制

制 备 工 艺 可行 , 量 测 定 方 法 简单 、 捷 、 确 。 含 快 准
关键 词 : 甲磺 酸 帕 殊 沙 星 ; 糖 醇 ; 相 高 效 液 相 色谱 法 木 反 中 图 分 类 号 : Q 6 . ; 9 86 T 406 R 7.9 文献标识码 : A 文 章 编 号 :06—4 3 (0 8 0 0 3 0 10 9 12 0 )7— 0 3— 2
在生产环节抽样检验不符合标准规定的药品名单
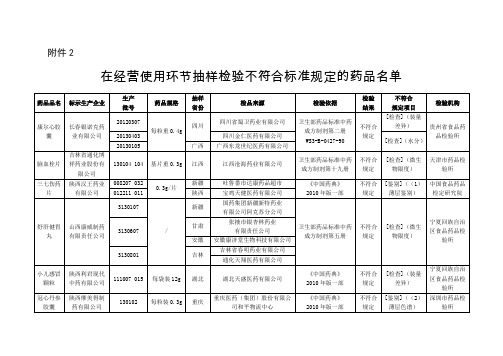
不符合规定
[检查](微生物限度)
宁夏回族自治区食品药品检验所
3130607
甘肃
张掖市银杏林药业
有限责任公司
安徽
安徽康济堂生物科技有限公司
3130801
吉林
吉林省春明药业有限公司
通化天翔医药有限公司
小儿感冒颗粒
陕西利君现代中药有限公司
111007 015
每袋装12g
湖北
湖北天盛医药有限公司
《中国药典》
2010年版一部
不符合规定
[检查](装量差异)
宁夏回族自治区食品药品检验所
冠心丹参胶囊
陕西摩美得制药有限公司
130102
每粒装0.3g
重庆
重庆医药(集团)股份有限公司和平物流中心
《中国药典》
2010年版一部
不符合规定
[鉴别]((2)薄层色谱)
深圳市药品检验所
复方氨林巴比妥注射液
每20粒
重1g
贵州
贵州中鑫医药有限公司
卫生部药品标准中药成方制剂第六册
不符合规定
[检查](溶散时限)
青海省食品药品检验所
转移因子注射液
湖南一格制药有限公司
130515
2ml:3mg(多肽):100μg(核糖)
广东
深圳市健鹏医药有限公司
国家药品标准
化学药品地标升国标第十六册
不符合规定
[检查](可见异物)
不符合规定
[检查](装量差异)、(溶散时限)
甘肃省食品药品检验所
云南
云南湘广药业有限公司
[检查](溶散时限)
四川
四川本草堂药业有限公司
130401 047
药物颜色研究中存在的问题及分析

药物颜色研究中存在的问题及分析一、概述药品质量标准中涉及到颜色的项目有性状描述、颜色检查(液体制剂)或溶液颜色检查(原料药、注射用粉针等)。
在审评多家同品种注册申报资料时发现,申报单位对药物颜色的研究比较随意,不够规范,主要表现在以下几个方面:1、性状描述不准确、不规范;2、溶液颜色检查的溶剂选择较随意,同一品种选择多种溶剂;3、配制成溶液的浓度不同,有时会相差数十倍;4、检测波长选择不合理,不是该品种颜色的特征吸收波长。
由于同一品种性状描述不一致,颜色(溶液的颜色)检查方法、限度等的差异,使得药物的颜色无法灵敏地反映产品的质量及质量变化的情况,更无法进行横向比较,将此重要的质控指标流于形式。
针对上述情况,为规范药物颜色的研究,使质量标准中有关颜色的项目更规范、更灵敏、更具可比性,确实起到控制产品质量的目的,笔者想从药物颜色研究的意义、存在的问题,以及建议的一般研究原则等方面与大家进行讨论,目的是引起申报单位对该部分研究工作的重视,并试图规范药物颜色的研究工作。
二、药物颜色检查的意义药物的颜色与以下三个因素有关:1、药物本身的化学结构。
有颜色药物的分子结构中一般具有不饱和碳链和不饱和碳环的共轭体系,颜色的深浅又与N、S、O等杂原子在这些共轭体系中的原子种类和数目有关。
2、制备工艺中的杂质也是药物颜色的重要引入因素。
另外部分药物在放置过程中,由于氧化、水解,络合、聚合等原因使药物的颜色逐渐加深,如见光易变色的药物维生素C、磺胺嘧啶、硫酸链霉素、葡萄糖、喹诺酮类药物等。
由此可以看出,颜色(溶液的颜色)检查是药物纯度检查的重要指标,其目的是:1、控制生产过程中可能引入的微量有色杂质;2、控制在贮藏过程中产生的有色杂质。
目前多国药典如中国药典(CP)、美国药典(USP)、英国药典(BP)和日本药典(JP)等都收载药物颜色或溶液颜色检查项目。
因不同的制备工艺产生的杂质可能不同,这种不同可能会影响终产品的性状,终产品的颜色可能会有差别。
016药物颜色研究中存在的问题及分析

发布日期20050113栏目化药药物评价>>化药质量控制标题药物颜色研究中存在的问题及分析作者蒋煜霍秀敏部门正文内容审评二部药学组蒋煜霍秀敏一、概述药品质量标准中涉及到颜色的项目有性状描述、颜色检查(液体制剂)或溶液颜色检查(原料药、注射用粉针等)。
在审评多家同品种注册申报资料时发现,申报单位对药物颜色的研究比较随意,不够规范,主要表现在以下几个方面:1、性状描述不准确、不规范;2、溶液颜色检查的溶剂选择较随意,同一品种选择多种溶剂;3、配制成溶液的浓度不同,有时会相差数十倍;4、检测波长选择不合理,不是该品种颜色的特征吸收波长。
由于同一品种性状描述不一致,颜色(溶液的颜色)检查方法、限度等的差异,使得药物的颜色无法灵敏地反映产品的质量及质量变化的情况,更无法进行横向比较,将此重要的质控指标流于形式。
针对上述情况,为规范药物颜色的研究,使质量标准中有关颜色的项目更规范、更灵敏、更具可比性,确实起到控制产品质量的目的,笔者想从药物颜色研究的意义、存在的问题,以及建议的一般研究原则等方面与大家进行讨论,目的是引起申报单位对该部分研究工作的重视,并试图规范药物颜色的研究工作。
二、药物颜色检查的意义药物的颜色与以下三个因素有关:1、药物本身的化学结构。
有颜色药物的分子结构中一般具有不饱和碳链和不饱和碳环的共轭体系,颜色的深浅又与N、S、O等杂原子在这些共轭体系中的原子种类和数目有关。
2、制备工艺中的杂质也是药物颜色的重要引入因素。
另外部分药物在放置过程中,由于氧化、水解,络合、聚合等原因使药物的颜色逐渐加深,如见光易变色的药物维生素C、磺胺嘧啶、硫酸链霉素、葡萄糖、喹诺酮类药物等。
由此可以看出,颜色(溶液的颜色)检查是药物纯度检查的重要指标,其目的是:1、控制生产过程中可能引入的微量有色杂质;2、控制在贮藏过程中产生的有色杂质。
目前多国药典如中国药典(CP)、美国药典(USP)、英国药典(BP)和日本药典(JP)等都收载药物颜色或溶液颜色检查项目。
甲磺酸帕珠沙星凝胶的制备与质量控制

摘
何西 奎
谭 屹
( 河南省信阳市中心医院
信阳 44 0) 60 0
要 : 目的 : 甲磺酸帕珠沙星凝胶 , 制备 建立质量控制方法 。方法 : 以卡波姆 9 4 3 为基质制备凝胶 , 采用高效液相色谱法测定
甲磺酸帕珠沙星含量 , 考察 其稳 定性 。结 果 : 并 甲磺 酸 帕珠沙 星线性 范 围为 2 . ~8 . , m 一 ( =O 9 9 ) 平均 回收率为 0 O O O g・ L r . 9 9 , u 9 . , S =17 %(=6)凝胶稳定性 良 。结论 : 81 R D .7 n , 好 该处方设计合理 , 质量控制方法准确可靠 , 制剂稳定性好 。 关键词: 甲磺酸帕珠沙星 ; 凝胶剂 ; 制备 ; 质量控制
录)凝胶剂 ” “ 项下 的有关 规定 。 3 4 含量测定 .
1 仪器和试药
Agl t 10sr s高效液相 色谱仪 ,3 21型 电动搅拌 in 0 ei e 1 e 7 1- 机( 北京 普析 通 用仪 器 有 限公 司) P - 便携 式 酸 度计 , HB1型 ( mrut T rs 公司) 甲磺酸帕珠 沙星原料( ; 浙江司太 立制药有 限 公司, 批号 :0 61 6 , 2 0 10 ) 甲磺酸帕珠沙星对照 品( 含量 9 . , 99 江苏亚邦医药 有限公 司提供 ) 卡 波姆 9 4 英 国 Gogih公 , 3( or c 司)其 它辅料均为药用规格 。乙腈 、 ; 甲醇为色谱纯 , 酸氢二 磷 钾、 三乙胺 、 甲磺 酸为分析纯 , 水为纯化水 。
白溶液 。
甲磺酸帕珠 沙星 30 , 波姆 10 , 二醇 2 I三 乙 . g卡 .g丙 0T , r l
醇 胺 2 0 , 桂 氮 卓 酮 0 5 , 盘 8 2 , 射 用 水 加 至 . g月 .gห้องสมุดไป่ตู้司 5g 注
甲磺酸帕珠沙星治疗泌尿道感染的临床疗效及安全性分析

[] 朱 雷, 善福 , 芹 , . 面 罩机 械 通 气 治疗 慢 性 阻塞 性肺 病 5 钮 李燕 等 经 呼 吸 衰竭 昏迷 患 者 的疗 效 评 价 [] J. 中国危 重 病 急 救 医学 ,0 8 20,
9 1; 8 2 . ( ) — 9 2
甲磺酸帕珠沙星治疗泌尿道感染的临床疗效及安全性分析
染 ,或 是心源性肺 水肿等 症状 引起 的 。在一 般治疗方 式 的基 础上 ,使
用无 创正 压 通气 技术 。使 用 鼻部 面罩 、 V鼻部 面罩 来 为患者 进 行通 I
气治疗 ,这样 的治疗 方式通 过 医师 的心理 疏导 后较容 易被患者 所接 J 受 。根 据临床结 果研究 表明无创通 气可 以提高患者 的动脉含 氧量 ,改 善冠 脉血液 循环 并提高心脏 的运 作效率 。BP P iA 可减少 回心血 流量 , 以此 减轻心 脏负荷 。无创通 气亦 可减少 心室 内的跨壁压 。BP P i 可改 A 善氧和 ,提高患者 的心急供 氧量 ] 。然而 ,由于 部分患者 出现过敏及
Me ,0 ,6 () 4 — 7 . d2 1 32: 05 7 1 0 5 [] J s rR L c M, t a 2 a me M,u eT Mat y MA. nn a iep st epesr h No iv sv oiv rsue i v niain fra uers iao y fi r Jl et 0 9 1 () e t t o c t epr tr al e[] l o u Ch s, 0 , 16 : 2 1
t n[ . ut r ae 0 81 () 16 . me t ] s C i r, 0 ,52: -3 JA t C 2 5
[] 王 辰 , 鸣 宇, 4 商 黄克 武 , . 创 与 无创 序 贯 性机 械 通 气 治疗 慢 性 等有 阻塞 性 肺疾 病 所 致严 重 呼 吸衰 竭 的研 究 [ _ J 中华结 核 和 呼 吸杂 ]
甲磺酸帕珠沙星眼用即型凝胶的制备及质量控制

甲磺酸帕珠沙星眼用即型凝胶的制备及质量控制【摘要】目的探讨甲磺酸帕珠沙星眼用即型凝胶的制备及含量测定方法。
方法以氯化钠为渗透压调节剂,海藻酸钠为基质,制备甲磺酸帕珠沙星眼用即型凝胶,用高效液相色谱法测定含量。
结果甲磺酸帕珠沙星检测浓度在6.02~60.20 μg/ml范围内与峰面积分值线性关系良好,r=0.99999,平均回收率为101.85%。
RSD 为1.95%。
本品渗透压为280 m0sm/kg,pH值为5.0~7.0。
家兔眼刺激性实验表明,该滴眼剂对家兔眼睛无刺激性,符合《中国药典》滴眼剂的要求。
结论本滴眼剂处方工艺简单,质量容易控制,稳定性良好。
【Abstract】Objective To establish a method for preparation and measuring the content of the pazufloxaxin mesilate in situ forming of eye gel.Methods In this study,the pazufloxacin mesilate in situ forming of eye gel took sodium chloride as buffer to regulate the pH and osmotic pressure.The sustained-release eye gel using sodium alginate as base material was studied.The ultraviolet spectrophtonetric method was established for the determination of pazufloxacin mesilate.Results There was a good linear relationship within the concentration range of 6.02~60.2 μg/ml.r=0.99999.The average recovery of pazufloxacin mesilate was 101.85%.The RSD was 1.95%.The osmotic pressure and pH of the solution were 280 m0sm/kg and 5.0~7.0 respectively.The result of rabbit-eye irritation test showed that the eye drops had no irritation.Conclusion The pazufloxacin mesilate in situ forming of eye gel is promising with simple formula,preparation process,easy quality and stability.【Key words】Pazufloxacin mesilate;In situ forming eye gel;Preparation;Quality control甲磺酸帕珠沙星(Pazufloxacin mesilate)是新一代喹诺酮类抗菌药物,抗菌谱广,对革兰阳性、阴性菌均有效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲磺酸
含甲磺酸应为22.7%~23.6%。
含甲磺酸应为22.8%~23.6%。
11
丙酮
按外标法计算供试品中丙酮不得过0.5%。
按外标法计算供试品中丙酮不得过0.4%。
12
乙醇
按外标法计算供试品中乙醇不得过0.5%。
按外标法计算供试品中乙醇不得过0.3%。
13
N.N-二甲基甲酰胺
按外标法计算供试品中N,N-二甲基甲酰胺不得过0.088%。
按干燥品计算,含C16H15FN2O4为75.4-78.4%
按外标法计算供试品中N,N-二甲基甲酰胺不得过0.08%。
14
有关物质
供试品溶液色谱图中如显杂质峰,单个杂质的峰面积不得大于对照溶液主峰面积的二分之一(0.5%),各杂质峰面积之和不得大于对照溶液的主峰面积(1.0%)
供试品溶液色谱图中如显杂质峰,单个杂质的峰面积不得大于对照溶液主峰面积(0.05%),各杂质峰面积之和不得大于对照溶液的主峰面积(0.5%)
序号
项 目
国家食品药品监督管理局标准YBH03252010
企业内控标准
1
性 状
应为类白色至微黄色结晶性粉末;无臭,味苦;遇光颜色加深
应为类白色至微黄色结晶性粉末;无臭,味苦;遇光颜色加深
2
比旋度
应为-61°~-65°
应为-61.1°~-64.9°
3
鉴 别
(1) 应呈正反应
(2) 应呈正反应
(3) 应呈正反应
6
氯 化 物
不得更浓(0.05%)
不得更浓(0.05%)
7
硫 酸 盐
不得更浓(0.05%)
不得更浓(0.05%)
8
氟
含氟量应为4.1%~4.8%
含氟量应为4.1%~4.8%
9
右旋异构体
供试品的色谱图中若有右旋异构体,其右旋异构体峰面积不得大于左、右旋异构体峰面积总和的0.5%。
供试品的色谱图中若有右旋异构体,其右旋异构体峰面积不得大于左、右旋异构体峰面积总和的0.05%。
(4)本品的红外光吸收图谱应与对照品的图谱一致
(1) 应呈正反应
(2) 应呈正反应
(3) 应呈正反应
(4)本品的红外光吸收图谱应与对照品的图谱一致
4
酸 度
pH值应为3.0~4.0
pH值应为3.1~3.9
5
溶液的澄清度与颜色
溶液应澄清无色;如显色,与黄色或黄绿色4号标准比色液比较,不得更深。
溶液应澄清无色;如显色,与黄色或黄绿色4号标准比色液比较,不得更深。
15
干燥失重
减失重量应不得过1.0%
减失重量应不得过0.9%
16
炽灼残渣
遗留残渣不得过0.1%
遗留残渣不得过0.1%
17
重 金属
含重金属不得过百万分之十
含重金属不得过百万分之十
18
微生物限度
——
每1g供试品细菌数:不得过100cfu
霉菌和酵母菌总数:不得过10cfu
大肠埃希菌:不得检出
19
含量测定
按干燥品计算,含C16H15FN2O4为75.3-78.4%
