酚酞碱度与PH的计算关系

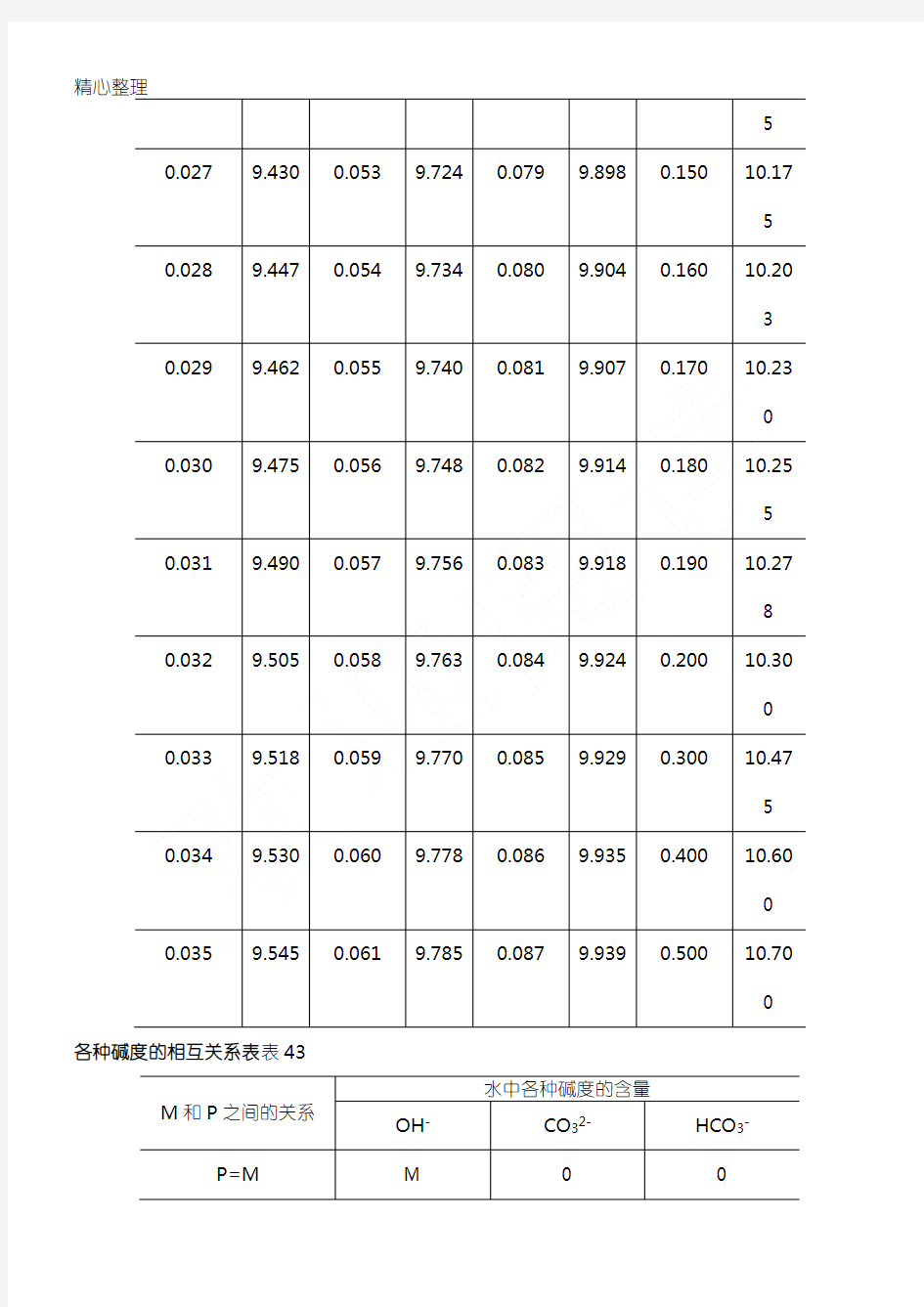
精心整理酚酞碱度与PH的计算关系(t=24℃)表39
各种碱度的相互关系表表43
注:P——用酚酞作指示剂所用取得H2SO4溶液的毫升数(一般为0.1mol/L(1/2H2SO4))M(一
般为
碱度的测定(全套步骤)
一.天平的使用 实验室电子天平:梅特勒-托利多AL204/01 1. 工作原理 电磁力平衡的原理 2. 基本操作 使用环境:首先,放置天平的工作台应稳定牢固,远离震动源;周围没有高强电磁场;没有排放有毒有腐蚀性气体的污染源;尽可能远离门、窗、散热器以及空调装置的出风口。其次,天平室温度和湿度应保持恒定,温度控制在20℃~28℃、湿度在40%RH-70%RH之间。 调整:开机前,首先检查天平是否处于水平状态,即天平水平仪中水平泡是否处于中心位置,如果天平未处于水平,则调节天平底脚两个水平旋钮加以校正。如果在称重过程中不可避免的要移动天平,则每次移动后,都要重新调整水平。 开机预热:连接电源,让秤盘空载,按“On/Off”按钮。天平开启并进行自检,自检通过显示0.0000g,进入预热。为保证获得精确的称量结果,必须至少在校准前60 分钟开机,以达到工作温度。但在一般情况下,天平开机后,让其保持在待机状态下,预热20 分钟,即可称量。 校准:在开机状态下,将天平称盘上的被称量物清除,按“->0/T<-”(清零/ 去皮)键,待显示器稳定显示。接着按住“Cal”键不放,直到显示“Cal 200.0000g”字样,放入标值200g 的校准砝码在秤盘中心位置,天平自动进行校准,当“Cal 0.0000g”闪烁时,移去砝码,随后显示屏上短时间出现“CAL donE”信息,紧接着又出现“0.0000g”时,天平校准结束。天平进入称量工作状态,等待称量。 称量:打开玻璃防风罩密封门,将待测物轻轻放在秤盘中心,关上密封门,待示值稳定后,记录下待测物的质量,再将被测物轻轻取出,关紧密封门;当称量过程中需要去皮,按去皮按钮(O/T),此时示值为“0.0000g”。 关机:称量完毕,确定天平秤盘上清洁无物后,按住“On/Off”按钮直至关机(屏幕上无显示)。如还需要继续使用,可以不关闭天平。 3.注意事项 应使用自带的电源适配器,并按说明书选择适当的电压(~220V 或110V)。 当称量易挥发和具有腐蚀性的物品时,要将物品盛放在密闭的容器内,以免称量不准和腐蚀天平。在称重过程,一定要避免用尖锐的物品接触天平的操作键盘。尽量避免裸指直接接触按键,否则日久天长,手指上的汗渍会侵蚀坏按键保护层。 4.维护和保养方法 经常对电子天平进行自校或定期外校,使其处于最佳工作状态。 当称量易挥发和具有腐蚀性的物品时,要将物品盛放在密闭的容器内,以免腐蚀和损坏电子天平。一般情况下,不要将过热或过冷的物体放在天平内称量,宜当物体的温度与天平室的温度达到一致后,方可进行称量。 在称重时,电子天平严禁超载,称量较重物品时,称量时间应尽可能短。 在对秤盘和外壳擦拭时,可以用一块柔软、没有绒毛的织物来轻轻擦拭,严禁使用具有强溶性的清洁剂清洗。对称量时撒落在称量室的物品要及时清理干净。如果电子分析天平长时间搁置不用,应定期对其进行通电检查,确保电子元器件的干燥。
总碱度测定(pH法)
海水总碱度测定 1术语 海水总碱度是中和海水中弱酸阴离子所需氢离子的量除以海水体积。 海水总碱度用符号A 表示、单位为mmol/L 可用下式表示: A=c(HCO 3-)+2c(CO 32-)+c[B(OH)4-]+c(OH -)+c(H + )+c(剩) 式中最后一项为剩余总碱度,指碳酸、硼酸及氢氧根以外的所有弱酸阴离子浓度的总和,通常其含量较之其他项要低得多,一般情况下可忽略不计。 2技术指标: 2.1 准确度:总碱度为1.5 mmol/L 时相对误差± 3.5%;总碱度为2.2mmol/L 时相对误差±2.5%。 2.2 精密度:相对标准偏差:±1.5%。 3测定方法 3.1 方法原理 向水样中加入过量盐酸标准溶液,用pH 计测定混合溶液pH 值,根据公式计算水样总碱度。 3.2 试剂及其配制 3.2.1 0.05mol/L 邻苯二甲酸氢钾标准缓冲溶液; 3.2.2 0.00600mol/L 盐酸标准溶液(国家二级标准物质),或按以下法配制: a .量取8.4mL 一级浓盐酸(ρ=1.18g/mL)于1000mL 容量瓶,用煮沸15分钟放冷至室温的蒸馏水定容; b .量取上述盐酸(a)60mL ,再定容至1000mL 。配得浓度约0.006mol/mL 稀盐酸溶液。 3.2.3碳酸钠溶液[c(1 2Na 2CO 3)=0.010 00 mol/mL] 称取0.5300g 无水碳酸钠,(一级试剂,预先在220℃恒温2小时,置于干燥器中冷却至室温),用少量蒸馏水溶解后,定容至1000mL 。 3.2.4 甲基红[(CH 3)2NCHN:NC 6H 4COOH]—次甲基蓝混合指示剂 称取0.032g 甲基红溶于80mL95%乙醇中,加入6.0mL 次甲基蓝乙醇溶液(0.01g 次甲基蓝溶于100mL95%乙醇中),混合后加入1.2mL 氢氧化钠溶液[ρNaOH=40.0g/L],溶液成暗色,贮于棕色瓶中。 3.2.5 盐酸标准溶液的标定和浓度计算 吸取碳酸钠标准溶液15.00mL 于三角烧瓶中,加甲基红—次甲基蓝混合指示剂6滴,用稀盐酸溶液滴定。当溶液由橙黄色转变为稳定浅紫红色即为终点。按公式(1)计算盐酸标准溶液浓度: c HCl = c(1 2 Na 2CO 3)×V Na 2CO 3 V HCl --------------------------(1) 式中:c HCl --------盐酸标准溶液的浓度,mol/L ; c(1 2Na 2CO 3)---碳酸钠标准溶液的浓度,mol/L ; V HCl ----------盐酸标准溶液的体积,mL ; V Na 2CO 3-------碳酸钠标准溶液的体积,mL 。 3.3 主要仪器 a .pH 计; b .50mL 具内塞聚乙烯广口瓶; c .具塞滴定管。 3.4 测定步骤
碱度投加量的实例计算
碱度投加量的实例计算! 一、PH对硝化的影响 pH值酸碱度是影响硝化作用的重要因素。硝化细菌对pH反应很敏感,在pH中性或微碱性条件下(pH为8~9的范围内),其生物活性最强,硝化过程迅速。 当pH>9.6或<6.0时,硝化菌的生物活性将受到抑制并趋于停止。 若pH>9.6时,虽然NH4+转化为NO2—和NO3—的过程仍然异常迅速,但是从NH4的电离平衡关系可知,NH3的浓度会迅速增加。由于硝化菌对NH3极敏感,结果会影响到硝化作用速率。 在酸性条件下,当pH<7.0时硝化作用速度减慢, pH <6.5硝化作用速度显著减慢,硝化速率将明显下降。pH<5.0时硝化作用速率接近零。 pH下降的原因 pH下降的原因有两个,一是进水碱度不高。二是进水碳源不足,无法补充硝化消耗的一半的碱度。
由硝化方程式可知,随着NH3-N被转化成NO3—-N,会产生部分矿化酸度H+,这部分酸度将消耗部分碱度,每克NH3-N转化成NO3—-N约消耗7.14g 碱度(以CaC03计)。因而当污水中的碱度不足而TKN 负荷又较高时,便会耗尽污水中的碱度,使混合液中的pH值降低至7.0以下,使硝化速率降低或受到抑制。 如果无强酸排人,正常的城市污水应该是偏碱性的,即pH一般都大于7.0,此时的pH则主要取决于人流污水中碱度的大小。 所以,在生物硝化反应器中,应尽量控制混合液pH>7.0,制pH>7.0,是生物硝化系统顺利进行的前提。 而要准确控制pH,pH<6.5时,则必须向污水中加碱。应进行碱度核算。 二、脱氮需碱量的计算 在硝化过程中需要消耗一定量的碱度,如果污水中没有足够的碱度,硝化反应将导致pH值的下降,使反应速率减缓,所以硝化反应要顺利进行就必须使污水中的碱度大于硝化所需的碱度。在实际工程应用中,对于典型的城市污水,进水中NH3-N浓度一般为20~40mg
水质总碱度检测方法完整版
水质总碱度检测方法 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
水质总碱度检测方法 1.目的 本方法规定了用酸式滴定法测定工厂生产用水及生活饮用水的总碱度。 2.范围 适用于工厂所有生产用水及生活饮用水。 3.原理 碱度是水介质与氢离子反应的定量能力,通过用强酸标准溶液将一定体积的水样滴定至pH 值为所测得的碱度称为总碱度.测定结果用相当于碳酸钙的质量浓度,mg/L 为单位表示。 5.试剂 5.1. L 甲基橙指示剂:称取甲基橙溶于,70℃的纯水中冷却定容至 100ml 。此试剂贮存于棕色玻璃瓶中,有效期3个月 5.2. L 盐酸标准溶液:吸取盐酸(ρ20=mL ),稀释至1000mL 。此试剂贮 存于玻璃瓶中,有效期2个月。按下述方法标定: 5.3. 称取在2500 C 烘箱中烘干过的无水碳酸钠~克于250mL 锥形瓶中,加50mL 纯水溶解,加4滴甲基橙指示剂,用配制的盐酸溶液滴定至溶液由黄色突变为橙色。同时做空白试验。 计算公式:c(HCl)= 0()0.05299 m V V -? 式中:c(HCl)—盐酸标准溶液的浓度,mol/L ; m —碳酸钠的质量,g ; V —滴定碳酸钠所消耗盐酸标准溶液的体积,mL ; Vo —空白试验消耗盐酸标准溶液的体积,mL 。 —与盐酸标准溶液[c(HCl)=L]相当的以克表示的碳酸钠的 质量。 6.仪器 6.1. 酸式滴定管 6.2. 移液管 6.3. 250mL 锥形瓶 7.操作规程
7.1. 吸取水样于250mL 锥形瓶中,加4滴甲基橙指示剂,用盐酸标准溶 液滴定至试液由黄色突变为橙色。 8.计算公式: ρ(CaCO3)= 1()50.041000c HCl V V ??? 式中:ρ(CaCO3) —水样的总碱度,mg/L ; c(HCl)—盐酸标准溶液的的浓度,mol/L ; V 1—滴定水样消耗标准盐酸溶液的体积,mL ; V —所取水样的体积,mL ; —与氢氧化钠标准溶液[c(NaOH)=L]相当的以克表示的总碱 度(CaCO3)的质量。
溶液PH的计算方法.
溶 液 PH 的 计 算 方 法 内蒙古赤峰市松山区当铺地中学024045白广福 众所周知,溶液的酸碱度可用c(H +)或c(OH -)表示,但当我们遇到较稀的溶液时,这时再用 C(H +)或C(OH -)表示是很不方便的,为此丹麦化学家索伦森提出了PH 。它的定义为氢离子浓 度的负常用对数.PH=-lgc(H +)。在高中阶段,以水的电离和溶液PH 计算为考查内容的试题 能有效的测试考生的判断、推理、运算等思维能力;在近几年的高考试题中也是屡见不鲜。 下面介绍几种关于溶液PH 的计算方法。 1、单一溶液PH 的计算 (1)强酸溶液:如H n A,设物质的量浓度为cmoL/L,则c(H +)=ncmoL/L, PH=-lgc(H +)= - lgnc 例1、求0.1 mo1/L 盐酸溶液的pH ? 解析:盐酸是强酸,所以 0.1moL/L 盐酸的c(H +)为0.1moL/L ,带入PH=-lgc(H +)即得PH=1 (2)强碱溶液,如B(OH)n,设溶液物质的量浓度为cmoL/L,则c(H +)=14 10nc -moL/L,PH=-lgc(H +)=14+lgnc 2、两两混合溶液的PH 计算 (1)强酸与强酸混合 由C(H + )混=112212()()c H V c H V V V ++++先求出混合后的C(H +)混,再根据公式求出PH. 技巧一:若两强酸等体积混合,可用速算法:混合后的PH 等于混合前溶液PH 小的加0.3如: (2)强碱与强碱混合 由c(OH - )混=112212()()c OH V c OH V V V --++先求出混合后C(OH -),再通过K w 求出(H +). 技巧二:若两强碱溶液等体积混合,可采用速算法:混合扣溶液的PH 等于混合前溶液PH 大的减去0.3. 例2、(93年高考题)25mLPH=10的氢氧化钾溶液跟50mLPH=10的氢氧化钡溶液混合, 混合液的PH 是( ) A、9.7 B 、10 C 、10.3 D 、10.7 解析:根据技巧二、可得出答案为B (3)强酸与强碱混合 强酸与强碱混合实质为中和反应,可以有以下三种情况: ①若恰好中和,PH=7。 例3、(04年全国新老课程11题)1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完 全反应,则该碱溶液的pH 等于( ) A 。9.0 B 。9.5 C 。10.5 D 。11.0 解析:因为是恰好中和,则中和后溶液的PH=7,设碱的PH=X,则有 2.5141101010X --?=?,解得X=10.5,答案为C。 ②若酸剩余,先求出中和后剩余的c(H +),再求出PH ③若碱剩余,先求出中和后剩余的c(OH -), 再通过K w 求出c(H +),最后求PH。 3、溶液稀释后的PH求法
工业纯碱总碱度的测定
6工业纯碱总碱度的测定 一、实验目的 1.了解利用双指示剂法测定Na 2CO 3和NaHCO 3混合物的原理和方法。 2.学习用参比溶液确定终点的方法。 3.进一步掌握微量滴定操作技术。 二、实验原理 混合碱是NaCO 3与NaOH或NaHCO 3与Na 2CO 3的混合物。欲测定同一份试样中各组分的含 量,可用HCl标准溶液滴定,根据滴定过程中pH值变化的情况,选用酚酞和甲基橙为指示 剂,常称之为“双指示剂法”。 若混合碱是由Na 2CO 3和NaOH组成,第一等当点时,反应如下: HCl+NaOH→NaCl+H
2O HCl+Na 2CO 3→NaHCO 3+H 2O 以酚酞为指示剂(变色pH范围为8.0~10.0),用HCl标准溶液滴定至溶液由红色恰 好变为无色。设此时所消耗的盐酸标准溶液的体积为V 1(mL)。第二等当点的反应 为:HCl+NaHCO 3→NaCl+CO 2↑+H 2O 以甲基橙为指示剂(变色pH范围为3.1~4.4),用HCl标准溶液滴至溶液由黄色变为 橙色。消耗的盐酸标准溶液为V 2(mL)。 当V 1>V 2时,试样为Na 2CO
3与NaOH的混合物,中和Na 2CO 3所消耗的HCl标准溶液为2V 1 (mL),中和NaOH时所消耗的HCl量应为(V 1-V 2)mL。据此,可求得混合碱中Na 2CO 3和NaOH 的含量。 当V 1<V 2时,试样为Na 2CO 3与NaHCO 3的混合物,此时中和Na 2CO 3消耗的HCl标准溶液的 体积为2V 1mL,中和NaHCO 3消耗的HCl标准溶液的体积为(V
碱度
碱度(总碱度、重碳酸盐和碳酸盐) 1 概述 水的碱度是指水中所含能与强酸定量作用的物质总量。 水中碱度的来源较多,地表水的碱度基本上是碳酸盐、重碳酸盐及氢氧化物含量的函数,所以总碱度被当做这些成分浓度的总和。当水中含有硼酸盐、磷酸盐或硅酸盐等时,则总碱度的测定值包含它们所起的作用。废水及其他复杂体系的水体中,还含有有机碱类,金属水解性盐类等,均为碱度组成部分。在这些情况下,碱度就成为一种水的综合性指标,代表能被强酸滴定物质的总和。 碱度的测定值因使用的指示剂重点pH值不同而有很大的差异,只有当试样中的化学组成已知时,才能解释为具体的物质。对于天然水和未污染的地表水,可直接以酸滴定至pH 8.3时消耗的量,为酚酞碱度,以酸滴定至pH为4.4~4.5时消耗的量,为甲基橙碱度。通过计算,可求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量,对于废水、污水,则由于组成成分复杂,这种计算无实际意义,往往需要根据水中物质的组成成分确定其与酸作用达到终点时的pH值。然后,用酸滴定以便获得分析者感兴趣的参数,并作出皆是。 碱度指标通常用于评价水体缓冲能力及金属在其中的溶解性和毒性,是对水和废水处理过程控制的判断性指标。若碱度是由过量的碱金属盐类所形成,则碱度又是确定这种水是否适宜灌溉的重要依据。 2方法选择
用标准算滴定水中碱度是各种方法基础,有两种常用的方法,及酸碱度指示剂滴定法和电位滴定法。电位滴定法根据电位滴定曲线在终点时的突跃,确定特定pH 值下的碱度,它不受水样浊度、色度的影响,使用范围较广。用指示剂判断滴定终点的方法简便快捷,使用于控制性试验及例行分析。二法均可根据需要和条件选用。 (一)酸碱指示剂滴定法 (1)方法原理 水样用标准酸溶液滴定至规定的pH 值,其终点可由加入的酸碱指示剂在该pH 值时的色变来判断。 当滴定至酚酞指示剂由红色变为无色时,溶液pH 值即为8.3,指示水中氢氧根离子已被中和,碳酸盐均被重碳酸盐,反应如下: -+- +-→+→+3232HCO H CO O H H OH 当滴定甲基橙指示剂由橘黄色变成橘红色时,溶液的pH 值为 4.4-4.5,指示水中的重碳酸盐(包括原有的和由碳酸盐转化成的)已被中和,反应如下: ↑+→++-223CO O H H HCO 根据上述两个终点到达时所消耗的盐酸标准滴定溶液的量,可以计算水中碳酸盐、重碳酸盐及总碱度。 上述计算方法不适用于污水及复杂体系中碳酸盐和重碳酸盐的计算。 (2)干扰及消除 水样浑浊、有色均干扰测定,遇此情况,可用电位滴定法测定。
水质总碱度检测方法
水质总碱度检测方法 1.目的 本方法规定了用酸式滴定法测定工厂生产用水及生活饮用水的总碱度。 2.范围 适用于工厂所有生产用水及生活饮用水。 3.原理 碱度是水介质与氢离子反应的定量能力,通过用强酸标准溶液将一定体积的水 样滴定至pH 值为4.0所测得的碱度称为总碱度.测定结果用相当于碳酸钙的质量浓度,mg/L 为单位表示。 5.试剂 5.1. 0.5g/L 甲基橙指示剂:称取0.050g 甲基橙溶于,70℃的纯水中冷却 定容至100ml 。此试剂贮存于棕色玻璃瓶中,有效期3个月 5.2. 0.05mol/L 盐酸标准溶液:吸取4.2mL 盐酸(ρ20=1.19g/mL ),稀 释至1000mL 。此试剂贮存于玻璃瓶中,有效期2个月。按下述方法标定: 5.3. 称取在2500C 烘箱中烘干过的无水碳酸钠0.1~0.2克于250mL 锥形 瓶中,加50mL 纯水溶解,加4滴甲基橙指示剂,用配制的盐酸溶液滴定至溶 液由黄色突变为橙色。同时做空白试验。 计算公式:c(HCl)= 0()0.05299 m V V -? 式中:c(HCl)—盐酸标准溶液的浓度,mol/L ; m —碳酸钠的质量,g ; V —滴定碳酸钠所消耗盐酸标准溶液的体积,mL ; Vo —空白试验消耗盐酸标准溶液的体积,mL 。 0.05299—与1.00mL 盐酸标准溶液[c(HCl)=1.000mol/L]相当的 以克表示的碳酸钠的质量。
6.仪器 6.1. 酸式滴定管 6.2. 移液管 6.3. 250mL 锥形瓶 7.操作规程 7.1. 吸取50.00mL 水样于250mL 锥形瓶中,加4滴甲基橙指示剂,用盐酸标准溶液滴定至试液由黄色突变为橙色。 8.计算公式: ρ(CaCO3)= 1()50.041000c HCl V V ??? 式中:ρ(CaCO3) —水样的总碱度,mg/L ; c(HCl)—盐酸标准溶液的的浓度,mol/L ; V 1—滴定水样消耗标准盐酸溶液的体积,mL ; V —所取水样的体积,mL ; 50.04—与1.00mL 氢氧化钠标准溶液 [c(NaOH)=1.000mol/L]相当的以克表示的总碱度(CaCO3)的质量。
硝化反硝化碱度平衡
污水生物硝化处理工艺pH值控制及碱度核算 污水生物硝化处理工艺pH值控制及碱度核算 一、影响硝化的重要因素 1、pH和碱度对硝化的影响 pH值酸碱度是影响硝化作用的重要因素。硝化细菌对pH反应很敏感,在pH中性或微碱性条件下(pH为8~9的范围内),其生物活性最强,硝化过程迅速。 当pH>9.6或<6.0时,硝化菌的生物活性将受到抑制并趋于停止。 若pH>9.6时,虽然NH4+转化为NO2—和NO3—的过程仍然异常迅速,但是从NH4的电离平衡关系可知,NH3的浓度会迅速增加。由于硝化菌对NH3极敏感,结果会影响到硝化作用速率。 在酸性条件下,当pH<7.0时硝化作用速度减慢,pH<6.5硝化作用速度显著减慢,硝化速率将明显下降。pH<5.0时硝化作用速率接近零。 pH下降的原因 pH下降的原因可能有两个,一是进水中有强酸排入,导致人流污水pH降低,因而混合液的pH也随之降低。 由硝化方程式可知,随着NH3-N被转化成NO3—-N,会产生部分矿化酸度H+,这部分酸度将消耗部分碱度,每克NH3-N转化成NO3—-N约消耗7.14g碱度(以CaC03计)。因而当污水中的碱度不足而TKN负荷又较高时,便会耗尽污水中的碱度,使混合液中的pH值降低至7.0以下,使硝化速率降低或受到抑制。 如果无强酸排人,正常的城市污水应该是偏碱性的,即pH一般都大于7.0,此时的pH 则主要取决于人流污水中碱度的大小。 所以,在生物硝化反应器中,应尽量控制混合液pH>7.0,制pH>7.0,是生物硝化系统顺利进行的前提。 而要准确控制pH,pH<6.5时,则必须向污水中加碱。应进行碱度核算。 2、有机负荷的影响 在采用曝气生物滤池工艺进行硝化除氮时,NH4-N的去除在一定程度上取决于有机负荷。当有机负荷稍高于3.0kgBOD/(m3滤料·d)时,NH3-N的去除受到抑制;当有机负荷高于4.0kgBOD/(m3滤料·d)时,NH3-N的去除受到明显抑制。因此采用曝气生物滤池进行同步除碳和硝化时,必须降低有机负荷。 根据上述分析,在采用曝气生物滤池工艺进行针对去除有机物的工程设计时,首先必须针对处理水类型和排水水质要求选择合适的BOD容积负荷,BOD容积负荷的选取应根据同类型污水处理厂的实际运行数据加以分析后确定,并在设计时留有一定余量。在采用曝气生物滤池进行同步除碳和硝化时,必须降低有机负荷,最好使有机负荷控制在2.0kgBOD/(m3滤料·d)以下。 二、生物滤池硝化需碱量的计算
高炉炉渣碱度计算
浅谈炉渣碱度计算 摘要:通过计算机办公软件Microsoft Excel 编辑公式计算和分析炉渣碱度,并对现在玉钢炼铁作业区高炉工长核料计算提出改进意见。 关键词:碱度Excel 核料 The basicity on slag calculation Kang yun Abstract:through the computer software for office use Microsoft Excel edit formula calculation and analysis the basicity slag, and now working in the blast furnace ironmaking jade steel foreman nuclear material calculation improvements. Keywords: alkalinity Excel nuclear material 一、概论 玉钢炼铁作业区于2005年2月28日开炉投产,现有450m3高炉两座,1080m3高炉一座。开炉后高炉操作沿用昆钢老厂的核料计算,采用每批料需加石灰石量来作为碱度调整的依据,进行核料计算。由于现在炉料结构的变化,碱度调剂采用改变烧结矿和酸性炉料之间配比的方法,取代石灰石调整碱度。原来的核料计算已经不适应现在的生产需求,因此,探索和寻找新的核料方法具有重要的意义。 二、炉渣配料计算 1、Microsoft Excel 简介 Microsoft Excel是微软公司的办公软件Microsoft Office 的组件之一,是微软公司为Windows操作系统编写的一款表格处理软件,它可以进行各种数据的处理,统计分析和辅助决策操作,广泛地应用于管理、统计、金融等众多领域。 本文才用Excel的公式编辑计算炉渣碱度和炉料结构中烧结矿和球团矿的理论配比。解决原料大幅度变化时的配料计算。 2、核料计算 计算方法为:每批料所需的石灰石量=[(入炉点的SiO2量-还原生铁中的
水质碱度酸碱指示剂滴定法
水质碱度(总碱度、重碳酸盐和碳酸盐)的测定 酸碱指示剂滴定法 水的碱度是指水中所含能与强酸定量作用的物质总量。 水中碱度的来源是多种多样的。地表水的碱度,基本上是碳酸盐、重碳酸盐及氢氧化物含量的函数,所以总碱度被当作这些成分浓度的总和。当水中含有硼酸盐、磷酸盐或硅酸盐等时,则总碱度的测定值也包含它们所起的作用。废水及其他复杂体系的水体中,还含有有机碱类、金属水解性盐类等,均为碱度组成部分。在这些情况下,碱度就成为一种水的综合性特征指标,代表能被强酸滴定的物质的总和。 碱度的测定值因使用的终点pH值不同而有很大的差异,只有当试样中的化学组成已知时,才能解释为具体的物质。对于天然水和未污染的地表水,可直接用酸滴定至时消耗的量,为酚酞碱度。以酸滴定至pH为~时消耗的量,为甲基橙碱度。通过计算可求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量;对于废水、污水,则由于组分复杂,这种计算无实际意义,往往需耍根据水中物质的组分确定其与酸作用达终点时的pH值。然后,用酸滴定以便获得分析者感兴趣的参数,并作出解释。 碱度指标常用于评价水体的缓冲能力及金属在其中的溶解性和毒性,是对水和废水处理过程的控制的判断性指标。若碱度是由过量的碱金属盐类所形成,则碱度又是确定这种水是否适宜于灌溉的重要依据。 用标准酸滴定水中碱度是各种方法的基础。有两种常用的方法,即酸碱指示剂滴定法和电位滴定法。电位滴定法根据电位滴定曲线在终点时的突跃,确定特定pH值下的碱度,它不受水样浊度、色度的影响,适用范围较广。用指示剂判断滴定终点的方法简便快速、适用于控制性试验及例行分析。二法均可根据需要和条件选用。 样品采集后应在4℃保存,分析前不应打开瓶塞,不能过滤、稀释或浓缩。样品应于采集后的当天进行分析,特别是当样品中含有可水解盐类或含有可氧化态阳离子时,应及时分析。 1.原理 水样用标准酸溶液滴定至规定的pH值,其终点可由加入的酸碱指示剂在该 pH值时颜色的变化来判断。 当滴定至酚酞指示剂由红色变为无色时,溶液pH值即为,指示水中氢氧根离子(OH-)已被中和, 碳酸盐(CO 32-)均被转为重碳酸盐(HCO 3 -),反应如下:
总碱度计算公式
总碱度计算公式 又称盐基度。 (1)化合物中羟基与铝的摩尔比。一般用符号B来代表碱度%。它是碱式氯化铝的重要质量指标,它直接决定着产品的化学结构形态和许多特性,如聚合度、分子电荷数、混凝能力、贮存稳定性、pH值等。 碱度是指水中吸收质子的能力,通常用水中所含能与强酸定量作用的物质总量来标定。水中碱度的形成主要是由于重碳酸盐、碳酸盐及氢氧化物的存在,硼酸盐、磷酸盐和硅酸盐也会产生一些碱度。废水及其他复杂体系的水体中,还含有有机碱类、金属水解性盐类等,均为碱度组成部分。在这些情况下,碱度就成为一种水的综合性指标,代表能被强酸滴定物质的总和。 化学方程式 各种碱度用标准酸滴定时可起下列反应: 0H-十H+=H20 CO32-十H+=HC03-;
HC03-+H+=Hz0十CO2 自然水体碱度通常是由于碳酸盐、碳酸氢盐及氢氧离子造成的,因此总碱度一般可以表示成这些成分浓度的函数。 碱度的测定值因使用的指示剂终点pH值不同而有很大的差异,只有当试样中的化学组成已知时,才能解释为具体的物质。对于天然水和未污染的地表水,可直接以酸滴定至pH8.3时消耗的量,为酚酞碱度。以酸滴定至pH为4.4~4.5时消耗的量,为甲基橙碱度。通过计算,可求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量;对于废水、污水,则由于组分复杂,这种计算无实际意义,往往需要根据水中物质的组分确定其与酸作用达到终点时的pH值。然后,用酸滴定以便获得分析者感兴趣的参数,并作出解释。 碱度指标常用于评价水体的缓冲能力及金属在其中的溶解性和毒性,是对水和废水处理过程控制的判断性指标。若碱度是由过量的碱金属盐类所形成,则碱度又是确定这种水是否适宜于灌溉的重要依据。
水中总碱度的检测方法
目的 水的碱度是指水中所含能与强酸定量作用的物质总量。这类物质包括强碱、弱碱、强碱弱酸盐等。天然水中的碱度主要是由重碳酸盐、碳酸盐和氢氧化物引起的,其中重碳酸盐是水中碱度的主要形式。引起碱度的污染源主要是造纸、印染、化工、电镀等行业排放的废水及洗涤剂、化肥和农药在使用过程中的流失。碱度是一种水的综合性特征指标,是判断水质和水处理控制的重要指标。总碱度一般表征为相当于碳酸钙的浓度值。 2、检测方法与依据 酸碱指示剂滴定法《水和废水监测分析方法》(第四版) 3、应用范围 本法适用于测定水源水的总碱度测定。水样中含余氯时,会破坏指示剂的显色,可加入1-2滴0.1mol/L硫代硫酸钠溶液消除。 4、原理 水样用标准溶液滴定至规定的pH值,其终点可由加入的酸碱指示剂在该pH值时颜色的变化来判断。 当滴定至酚酞指示剂由红色变为无色时,溶液pH值即为8.3,指示水中氢氧根离子已被中和,碳酸盐均转化为重碳酸盐,反应式:OH-+H+→H2O CO32-+H+ →HCO3- 当滴定至甲基橙指示剂由桔黄色变为桔红色时,溶液的pH值即为4.4-4.5,指示水中重碳酸盐已被中和,反应如下; HCO3-+H+ →H2O+CO2↑ 根据上述两个终点到达时所消耗的盐酸标准滴定溶液的量,可以计算出水中碳酸盐、重碳酸盐及总碱度。 5、仪器 酸式滴定管25mL 锥形瓶250 mL 6、试剂 6.1无二氧化碳蒸馏水:临用前用纯水煮沸15min,冷却至室温,pH值应大于6.0,电导率小于2us/cm. 6.2甲基橙指示剂:称取0.05g甲基橙溶于100mL蒸馏水中。 6.3酚酞指示剂:称取0.5g酚酞溶于50mL95%乙醇中,用水稀释至100mL。 6.4 碳酸钠标准溶液(1/2Na2CO3=0.0250mol/L): 称取1.3249g(于250℃烘干4h)基准试剂无水碳酸钠,溶于少量无二氧化碳水中,移入1000mL容量瓶中,用水稀释至标线,摇匀。存于聚乙烯瓶中,保存时间不要超过一周。 6.5 0.0250mol/L盐酸标准溶液:吸取2.1mL浓盐酸并用蒸馏水稀释至1000mL,对其浓度进行标定:用无分度吸管吸取25.00mL碳酸钠标准溶液于250mL锥形瓶中,加无二氧化碳水稀释至约100mL,加入甲基橙指示剂三滴,用盐酸标准溶液滴定至由桔黄色刚变为桔红色,记录盐酸标准溶液用量,计算其准确浓度:C=25.00×0.0250/V 式中,C——盐酸标准溶液的浓度(mol/L); V——盐酸标准溶液用量(mL) 7、分析步骤 7.1分取100ml水样于250ml锥形瓶中,加入4滴酚酞指示剂,摇匀。当溶液呈红色时,用盐酸标准溶液滴定至刚刚褪至无色,记录用量P(mL).如果加酚酞指示剂后溶液无色,则不需要用盐酸标准溶液滴定,并接着进行一下操作。
总碱度计算公式
碱度是指水中能与强酸发生中和作用的物质的总量。这类物质包括强碱、弱碱、强碱弱酸盐等。天然水中的碱度主要是由重碳酸盐(bicarbonate,碳酸氢盐,下同)、碳酸盐和氢氧化物引起的,其中重碳酸盐是水中碱度的主要形式。引起碱度的污染源主要是造纸、印染、化工、电镀等行业排放的废水及洗涤剂、化肥和农药在使用过程中的流失。碱度和酸度是判断水质和废水处理控制的重要指标。碱度也常用于评价水体的缓冲能力及金属在其中的溶解性和毒性等。工程中用得更多的是总碱度这个定义,一般表征为相当于碳酸钙的浓度值。因此,从定义不难看出测量的方法——酸滴定法。例如,可以用实验室的滴定器、或数字滴定器对水处理过程中的碱度进行监测,当然还有在线的碱度测定仪。 总硬度百度mg/L=V*c*100.09*1000/V0 V--滴定消耗EDTA的体积c--EDTA的浓度V0--水样的体积 100.09--1mL1mol/LEDTA相当于CaCO3的质量总碱度mg/L=V*c*50.04*1000/V0 V--滴定消耗HCl的体积c--HCl的浓度V0--水样的体积 50.04--1mL1mol/LHCl相当于CaCO3的质量总硬度总碱度均以CaCO3计。 总碱度mg/L=V*c*50.04*1000/V0 V--滴定消耗HCl或硫du酸的体积 c--HCl或硫酸的浓度
V0--水样的体积 50.04--1mL1mol/LHCl相当于CaCO3的质量 简介 又称盐基度。 化合物中羟基与铝的摩尔比。一般用符号B来代表碱度%。它是碱式氯化铝的重要质量指标,它直接决定着产品的化学结构形态和许多特性,如聚合度、分子电荷数、混凝能力、贮存稳定性、pH值等。碱度 碱度是指水中吸收质子的能力,通常用水中所含能与强酸定量作用的物质总量来标定。水中碱度的形成主要是由于重碳酸盐、碳酸盐及氢氧化物的存在,硼酸盐、磷酸盐和硅酸盐也会产生一些碱度。废水及其他复杂体系的水体中,还含有有机碱类、金属水解性盐类等,均为碱度组成部分。在这些情况下,碱度就成为一种水的综合性指标,代表能被强酸滴定物质的总和。
常用医学计算公式
不同年龄每日需水量计算式 年龄每日需水量计算式 成人体重(kg)×40(ml) 10~14岁体重(kg)×[50~80(ml)] 8~9岁体重(kg)×[70~100(ml)] 4~7岁体重(kg)×[90~110(ml)] 2~3岁体重(kg)×[100~110(ml)] 1~2岁体重(kg)×[120~160(ml)] 肌酐清除率计算 肥胖中度:=SW+SW×(0.31~0.30) 重度:=SW+SW×(0.31~0.50) 瘦弱:=SW-SW×(0.11~0.20) 严重瘦弱:= SW-SW×0.20(及其0.21以上) 体重指数 体重指数=体重(kg)/BSA(m2) 正常值:男20~25,女19~24(超过此指数为肥胖) 体表面积计算
中国成年男性 BSA=0.00607H+0.0127W-0.0698 中国成年女性BSA=0.00586H+0.0126W-0.0461 小儿体表面积BSA=0.0061H+0.0128W-0.1529 新 30公斤以上:(W-30)*0.02+1.05 30公斤以下:W*0.035+0.1 静息能量消耗计算 Harris-Benedict计算公式: 女性:REE(Kcal/d)=655+9.6W+1.7H-4.7A 男性:REE(Kcal/d)=66+13.7W+5.0H-6.8A [W=体重(Kg);H=身高(cm);A=年龄(岁)] 应补生理盐水(ml)=[142-病人血Na+(mmol/L)]×体重(kg)×3.888 应补3%氯化钠=[142-病人血Na+(mmol/L)]×体重(kg)×1.1666 应补5%氯化钠(ml)=[142-病人血Na+(mmol/L)]×体重(kg)×0.7 女性可选用下列公式 应补钠总量(mmol)=[142-病人血Na+(mmol/L)]×体重(kg)×0.5 应补氯化钠总量(g)=[142-病人血Na+(mmol/L)]×体重(kg)×0.03 应补生理盐水(ml) =[142-病人血Na+(mmol/L)]×体重(kg)×3.311 应补3%氯化钠(ml)=[142-病人血Na+(mmol/L)]×体重(kg)×0.993 应补5%氯化钠(ml)=[142-病人血Na+(mmol/L)]×体重(kg)×0.596
烧结矿的碱度计算
烧结矿的碱度计算 设计时配料计算与现场配料计算相比有以下的不同点:1)原料化学成分要齐全准确,计算前要调整到各成分的数量之和为100%;2)各配料比的总和应为100%;3)选用经验数据应可靠,计算力求准确;4)烧结矿的碱度使得高炉炉料中不添加或少添加石灰石。 烧结矿的碱度是根据高炉冶炼时规定的炉渣碱度来确定的。高炉的炉渣碱度主要决定于入炉原料的碱度。在单一烧结矿入炉的条件下,炉渣的碱度则决定于烧结矿。由于炉渣碱度要求一定,烧结矿的碱度也应一定。最理想的烧结矿碱度应使高炉炉料中不再加入石灰石,炉渣的碱度就达到规定的要求,这种烧结矿称为自熔性烧结矿。有些炼铁厂,高炉炉料配比中有较多的天然矿石,为了不加或少加石灰石,使用高碱度烧结矿,这种烧结矿也称为熔剂性烧结矿。 烧结矿碱度有以下几种表示法: R为烧结矿碱度,CaO,MgO,SiO2,Al2O3,,为烧结矿中各成分的含量%.在原料中Al2O3及MgO含量波动不大的情况下,采用(3)式表示,只有Al2O3或MgO波动较大的情况才用(1)或(2)式。对于我国大多数烧结厂来说,其原料中的Al2O3及MgO都比较稳定,因此采用CaO/SiO2表示烧结矿的碱度。 自熔性烧结矿碱度可由以下步骤计算: 设烧结矿的碱度为R 炉渣的碱度为R′ 混合矿含铁Fe矿% 生铁含铁Fe生铁% 混合矿含CaO及SiO2为CaO矿及SiO2矿% 焦炭含CaO及SiO2为CaO焦及SiO2焦% 高炉焦比K千克/100千克生铁 1)每100千克生铁消耗的混合矿量为:
该式没有考虑生铁中Si要消耗SiO2,,也没有考虑到石灰石及焦粉配入烧结料中带入的SiO2,当焦比低时,生铁中含Si较高时误差较大,若考虑生铁中的Si消耗SiO2,以及焦粉带入的SiO2,则烧结矿的碱度应按下式计算: 式中K′———每100千克烧结矿消耗的焦粉千克数; SiO2焦′———焦粉中含SiO2; A———每千克生铁消耗的烧结矿千克数。 举例:高炉炉渣的碱度为1.05,生铁含Fe为94%,含Si为0.7%.混合矿含Fe为53%,SiO2为9.47%,每100千克烧结矿的焦粉消耗7.5千克。焦炭灰分为11.38%,其中 CaO5.32%,SiO245.12,高炉焦比为575千克。 由(4)式可知:
碱度测定方法
工业循环冷却水中碱度测定方法(指示剂法) 1适用范围 本方法适用于测定循环冷却水和天然水中的碱度。其含量为10mN(毫克当量/升)以下。若超过上述范围,可适当少取水样。 2方法提要 中和1L水样至某一指定的pH值时所需酸的毫克当量数称为碱度。 一般滴定到pH8.3时所测定的碱度为酚酞碱度(P)。它主要归因于水中的OH-及CO32-,继续滴定到pH4.5时所测得的碱度(包括前者酚酞碱度)称为甲基橙碱度(M)。包括OH-,CO32-,HCO32-及其他弱酸盐等所产生的碱度。 3试剂 3.1盐酸; 3.2甲基橙指示剂:0.1%溶液; 3.3酚酞指示剂:0.5%的50%乙醇溶液,滴加0.01N氢氧化钠溶液至出现微红色。 4准备工作 4.1 0.1N盐酸标准溶液的配制和标定。 4.1.1配制方法:取9mL浓盐酸于1L玻璃瓶中,用水稀释至1L,摇匀。 4.1.2标定方法:准确称取经180℃烘干并置于干燥器中冷却的基准碳酸钠0.15g左右,置于250mL锥形瓶中,加入煮沸后冷却的蒸馏水100mL和4滴甲基橙指示剂,用0.1N盐酸标准溶液滴定至溶液出现橙色。记下盐酸标准溶液的毫升数,盐酸的当量浓度按式(1)计算:N=W/(V×53.00) (1) 式中:W-------碳酸钠的重量,mg; V-------滴定用去盐酸标准溶液的体积,mL; 53.00-----碳酸钠的当量。 5试验步骤 5.1酚酞碱度的测定 吸取100mL水样于250mL锥形瓶中,加4滴酚酞指示剂,若水样出现红色,用0.1N 盐酸标准溶液滴定至红色刚好退去,记下用量P(mL)。 注:如果加入酚酞指示剂后,无红色出现,则表示水样中没有酚酞碱度。 5.2甲基橙碱度的测定 在测定过酚酞碱度的上述水样中,再加4滴甲基橙指示剂,若水样出现黄色,用0.1N 盐酸标准溶液滴定至溶液出现橙色。 6计算方法 6.1水样中酚酞碱度X(毫克当量/升),按式(2)计算: X=P×N×1000/V (2) 式中:P------滴定时消耗的盐酸标准溶液的体积,mL; N-----盐酸标准溶液的当量浓度; V-----水样的体积,mL。
碱度总碱度指标检测规程
碱度总碱度指标检测规程1.目的 为了规范化验人员在污水处理厂中的监测方法和操作程序,提高水质监测数据的准确性,特制定本规程。 2.适用范围 本监测规程适用于1水务有限公司。 3.定义、原理及干扰消除 定义:水的碱度是指水中所含能与强酸定量作用的物质总量。水中碱度的来源较多,地表水的碱度基本上是碳酸盐、重碳酸盐及氢氧化物含量的函数,所以总碱度被当做这些成分浓度的总和。当水中含有硼酸盐、磷酸盐或硅酸盐等时。则总碱度的测定值也包含它们所起的作用。废水及其他复杂体系的水体中,还含有有机碱类、金属水解性盐类等,均为碱度组成部分。在这些情况下,碱度就成为一种水的综合性指标,代表能被强算滴定物质的总和。 碱度的测定值因使用的指示剂终点PH值不同而有很大 的差异,只有当试样中化学组成已知时,才能解释为具体的物质。对于天然水和为污染的地表水,可直接以酸滴定至PH 值为8.3时消耗的量,为酚酞碱度。以酸滴定至PH为4.4---4.5时消耗的量,为甲基橙的碱度。通过计算,可求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量,对于废水、污水,则由于组分复杂,这种计算无实际意义。往往需要根据水中物
质的组分确定其与酸作用达到终点时的PH值。然后,用酸滴定以便获得分析者感兴趣的参数,并作出解释。 碱度指标常用于评价水体的缓冲能力及金属在其中的溶解性和毒性,是对水和废水处理过程控制的判断性指标。若碱度是由过量的碱金属盐类所形成,则碱度又是确定这种水是否适宜灌溉的重要依据。 3.1方法选择 用标准酸滴定水中碱度是各种方法的基础。有两种常用的方法,即酸碱指示剂滴定法和电位滴定法。电位滴定法根据电位滴定曲线在终点时的突破,确定特定PH值下的碱度。它不受水样浊度、色度的影响,使用范围较广。用指示剂判断滴定终点的方法简便快速,适用于控制性实验及例行分析。二法均可根据需要和条件选用。 3.2样品保存 样品采集后应在4保存。分析前不应打开瓶塞,不能过滤、稀释或浓缩。样品应于采集后的当天进行分析,特别是当样品中含有可水解盐类或含有可氧化态阳离子时,应及时分析。 3.3方法原理 水样用标准酸溶液滴定至规定的PH值,其终点可由加入饿酸碱指示剂在该PH值时颜色的变化来判断。当滴定至酚酞指示剂由红色变为无色时,溶液的PH值即为8.3,指示水
水中碱度的测定
碱度的测定 1酸碱滴定法 1)适应范围 本方法适用于天然水,循环水及炉水中碱度的测定方法。 2)测定原理 中和1升水样所需酸的毫摩尔数称为碱度,我们把碱度分为碳酸盐碱度、重碳酸盐碱度、氢氧化物碱度及不挥发性弱酸盐碱度几种。一般滴定到PH=8.3时所测的碱度称为酚酞碱度,用P 表示。继续滴定至PH=4.6时所测的碱度称为甲基橙碱度,用M 来表示,总碱度T=M+P 。 3)试剂 3.1) C(HCl)=0.1000mol/L 标准滴定溶液。 3.2) 0.5×10-2甲基橙指示剂:准确称取0.50g 甲基橙,溶于70℃水中,冷却,用水稀释至100mL 。 3.3) 10×10-2酚酞指示剂:准确称取10.0g 酚酞,溶于100mL 乙醇中。 4) 分析步骤 4.1)酚酞碱度的测定 移取100.00mL 水样于250mL 锥形瓶中,加4滴酚酞指示剂,用C HCl =0.1000mol/L 标准液滴定至红色,刚好褪去,计下HCl 的消耗量V 1,mL 。 4.2) 甲基橙碱度的测定 在测定过酚酞碱度的水样中,加4滴甲基橙指示剂,用C HCl =0.1000mol/L 标准液滴定至橙色,记下HCl 的消耗量V 2,mL 。 5)结果计算 5.1) 以mg/L (以CaCO 3)表示的水样中总碱度按下式计算: 312100.08102HCl V V C V +?? ?=()总碱度 5.2) 以mg/L (以CaCO 3)表示的水样中酚酞碱度按下式计算: 31100.08102 HCl V C V ???= 酚酞碱度 5.3) 以mg/L (以CaCO 3)表示的水样中甲基橙碱度按下式计算: 甲基橙碱度(mg/L )=总碱度(mg/L )-酚酞碱度(mg/L ) 式中 V —水样的体积,mL ; c —盐酸标准滴定溶液的浓度,mol/L ; V 1—滴定酚酞碱度时,消耗盐酸标准滴定溶液的体积,mL ; V 2—滴定甲基橙碱度时,消耗盐酸标准滴定溶液的体积,mL ; 100.08—碳酸钙的摩尔质量,g/moL ;
