有机小分子催化不对称羟醛缩合反应的研究
Hajos–Parrish反应 脯氨酸催化羟醛缩合

Hajos–Parrish–Eder–Sauer–Wiechert反应(Hajos–Parrish[1][2]–Eder–Sauer–Wiechert[3] reaction)由脯氨酸催化的不对称羟醛反应。
此反应以其在罗氏(Hajos、Parrish)和先灵公司(Eder、Sauer、Wiechert)的早期研究者的名字而命名。
这是有机催化的早期例子,也是第一个实现的非金属催化的羟醛反应。
最早是在20世纪70年代由Hajos 和Parrish 发现,如下图所示:他们以非手性的三酮作为原料,用天然存在的手性脯氨酸作为催化剂,用3mol%的(S)-(-)-脯氨酸,就可以100%产率和93%ee实现底物的分子内羟醛反应。
反应是在二甲基甲酰胺中进行,温度适中。
他们也因此分离出了羟醛加成产物——双环酮醇。
该加成产物最近才有人利用该实验再次分离出来。
[4]先灵公司的研究组则将反应在非生理条件下进行,以47mol%的(S)-脯氨酸催化,80°C下,在1N 高氯酸的乙腈溶液中进行反应。
他们因此无法分离出酮醇产物,只得到了失水后产生的羟醛缩合产物((7a S)-7a-甲基-2,3,6,7-四氢吲哚-1,5-二酮)。
[5]Hajos 和Parrish 接下来又用圆二色谱和单晶X射线衍射对上述酮醇产物的结构进行了分析,结果显示酮醇中的六元环为椅型构象,其中角甲基占据直键、羟基占平键,与洋地黄糖苷元(digitoxigenin)中CD环的构象类似(左下图)。
[6]但是,酮醇产物的7a-乙基类似物则不然,该分子中乙基处于平键、羟基处于直键,以避免另一构象中乙基与C-4 和C-6 之间更为强烈的1,3-二轴交互作用(右下图)。
2000年[7][8],List 和Barbas 等人尝试用简单的仲胺来模拟以烯胺活化机理催化羟醛反应的天然Ⅰ型醛缩酶[9],选用(S)-脯氨酸来做丙酮和对硝基苯甲醛的分子间直接羟醛反应,实现了68%产率、76%ee。
羟醛缩合反应在有机化学中的应用1

Aldol反应反应在有机化学中的应用摘要:Aldol反应是一个重要的有机化学反应,它在有机合成中有着广泛的应用。
Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛酮或酸,或进一步脱水得到α,β-不饱和醛酮或酸酯的反应。
①分子间的羟醛缩合经常被用来合成一些β-羟基化合物,如1,3-丙二醇、l,3-丁二醇和新戊二醇等。
其可作为进一步生产香料、药物等多聚物或聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二酯(PBT)和聚对苯二甲酸丙二醇酯(PTT)等高聚物的单体;缩合脱水产物α,β-不饱和醛氧化得到相应的可广泛用作精细化工生产原料的羧酸,如2,2-二羟甲基丙酸可用作水性氨脂扩链剂以及制备聚酯、光敏树脂和液晶,2-甲基-2-戊烯酸是具有水果香味的食用香料,可广泛用于食品加工业和其它日化香精产业;此外,α,β-不饱和醛完全氢化时得到饱和伯醛,可用作溶剂或制造洗涤剂、增塑剂。
②关键词:羟醛缩合有机反应应用Aldol反应的机理:Aldol反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛或酸。
有α氢原子的化合物如醛、酮、羧酸和酯分子中,由于羰基的吸电子诱导作用以及碳氧双键和α碳上碳氢σ键之间的σ-π超共轭效应,使得α碳上氢上的电子云密度较低,具有较强的酸性和活性。
Aldol反应既可以在酸催化下反应,也可以在碱催化下反应。
在酸催化下,羰基转变成烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β-羟基化合物。
由于α氢同时受两个官能团的影响,其化学性质活泼,在经质子转移、消除可得α,β-不饱和醛酮或酸酯。
在碱性催化剂下,首先生成烯醇负离子,然后烯醇负离子再对羰基发生亲核加成,加成产物再从溶剂中夺取一个质子生成β-羟基化合物。
得到的β-羟基化合物在碱作用下可失水生成α,β-不饱和醛酮或酸酯。
脯氨酸催化剂的研究进展

脯氨酸催化剂的研究进展摘要:本文简单阐述了脯氨酸催化不对称羟醛缩合反应的基本原理,并总结了基于以脯氨酸为母体的一系列有机小分子催化剂的研究进展及其相关性,对脯氨酸催化剂的进一步开发进行展望。
关键词:脯氨酸、不对称催化、羟醛缩合设计新型高效手性有机催化剂来传递手性进行对映选择性合成已经成为不对称催化研究中的一个热点和难点[1,2]。
羟醛缩合因其不对称是构造碳碳键的最基本的反应以及在合成药物上的广泛应用在不对称催化研究中一直很受关注[3]。
自2000年List等人发现脯氨酸可以催化不对称羟醛缩合反应以来,脯氨酸催化剂因其转化率高、对映选择性强、廉价易得、无污染等特点突破了有机金属催化剂低温无氧的限制,成为有机合成中一个新的明星小分子,对它及它的衍生物催化性质的研究得到了极大的关注[4]。
1 脯氨酸催化功能的发现早在20世纪70年代, Hajos[5]和Eder[6]就发现脯氨酸能够催化分子内的羟醛缩合反应, 并具有高度的对映异构体选择性和较高的化学产率。
该反应还被人们用来合成许多有用的化合物[7], 特别是用于类固醇和许多天然产物的合成中[8]。
后来有关这方面的研究鲜有报道直到2000年, List和Barbas等[9]报道了脯氨酸催化的分子间不对称羟醛缩合反应(如图1), 并进行了深入的研究, 大大拓宽了这一反应的应用前景。
图1 脯氨酸催化的分子间不对称羟醛缩合反应HNO 2O NH COOH 30mol%DMSONO 2OHO OList 课题组用丙酮和对硝基苯甲醛进行羟醛缩合反应时发现脯氨酸具有很好的不对称催化活性,并对一系列类似结构的氨基酸进行了测试如下表1。
表1 氨基酸催化的丙酮和对硝基苯甲醛的羟醛缩合反应研究结果表明: 五元环效果最好, 四元环次之, 六元环活性很低, 而非环状结构的普通氨基酸几乎没有催化活性。
把羧基变成酰胺也不发生反应, 这说明羧基的质子在催化反应中也起了关键作用。
不对称羟醛缩合aldol反应
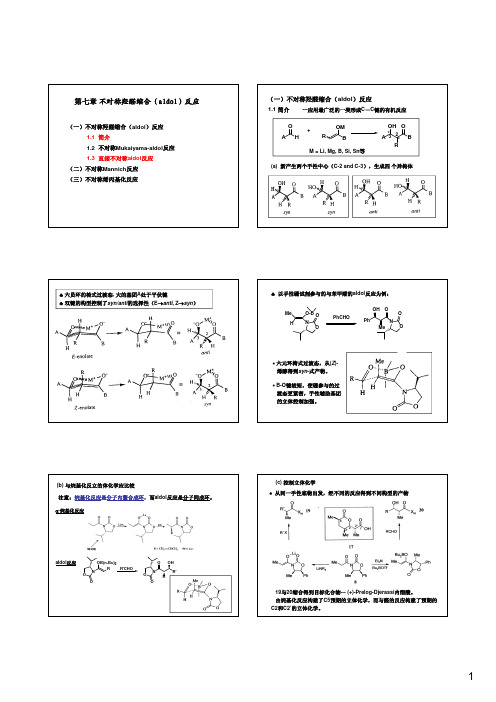
♣以手性硼试剂参与的与苯甲醛的aldol 反应为例:Me O-B NOHPhCHONOPhO Me OHO O ∙六元环椅式过渡态,从(Z )-(b)与烷基化反立的体化学应比较注意:烷基化反应是分子内螯合成环,而aldol 反应是分子间成环。
α-烷基化反应ON R OB(n-Bu)2OR'CHOONO OR'R OH aldol 反应∙从同一手性底物出发,经不同的反应得到不同构型的产物19与20缩合得到目标化合物---(+)-Prelog-Djerassi 内酯酸。
由烷基化反应构建了C5预期的立体化学,而与醛的反应构建了预期的C2和C2’的立体化学。
选择性。
Lewis 酸参与,环状中间体与醛反应,给出syn 构型产物。
Lewis 酸,形成开链(非环)结构,给出anti 构型产物。
醛羰基更易与Lewis 酸配位两类羟醛缩合试剂分别控制syn 和anti 选择性从4得到anti -aldol 产物,而从5得到syn -aldol 产物(2) Mukaiyama-aldol 反应R 1HO +R2R 3OSiMe 31)Lewis acid or R 1R 3OH R 2O Lewis base R 1R3OH R 2O+syn -anti -2)H 2O(a) 硅试剂的种类和特点:anti 构型(syn/anti:5:95)的产物,ee:99%产物的构型与烯醇双键的构型无关。
+RCHO PhOR O MeOH Zr cat.有机铜和锡催化剂(Evans )中心金属(铜或锡)和配体对产物立体化S-t-Bu OTMS MeOMe -78o C (S MeO O HO (2R)-anti-syn /anti (R Sn(OTf)2-11a (10 mol%)Sn(OTf)2-11b(10 mol%)-78o CMeOMeOO Me Cu(OTf)2-11c (10 mol%)NNO O MeMeRR 11b: R=Bn, 11c: R=t -Bu(S -78o C(2S)-anti-syn /anti (2S)-syn-syn /anti 发现了配体的加速作用,配体的加入极大地减小了水解反应PhPhO OH PhPh O OH +chiral cat.H 2O/C 2H 5OH(1:9)(a)手性有机金属催化剂催化直接aldol 反应的历程Trost试剂Up to 99%ee催化剂,一个Lewis酸的作一个Zn起碱的作用。
有机化学中的加成反应与缩合反应

有机化学中的加成反应与缩合反应有机化学是研究有机化合物性质、结构和反应的科学。
在有机化学中,加成反应和缩合反应是两种重要的反应类型。
本文将详细介绍这两种反应的原理和应用。
一、加成反应加成反应是指在反应中,利用两个或多个不同的分子,通过共价键形成新的化学结构。
在这个过程中,多个原子或基团结合在一起,同时也释放出一些小分子,如水或氢气。
加成反应通常发生在互补性较高的化合物之间,其反应速度较快。
1. 电子亲和性反应电子亲和性反应是一种加成反应,其中亲核试剂通过捕获云雾中的电子来作为反应的开始。
这种反应常见于卤代烃与碱金属之间,如卤代烃与氢氧化钠的反应生成相应的醇。
示例反应方程式:R-X + NaOH → R-OH + NaX2. 共轭加成反应共轭加成反应是一种加成反应,其中亲电试剂通过共价键与共轭体系中的π电子结合。
这种反应常见于烯烃与亲电试剂之间,如烯烃与卤代烃的反应生成相应的卤代烯烃。
示例反应方程式:CH2=CH2 + H-Br → CH3-CH2-Br3. 共轭负离子加成反应共轭负离子加成反应是一种加成反应,其中亲电试剂与共轭体系中的负离子结合。
这种反应通常发生在烯烃与负电荷的试剂之间,如烯烃与酰类试剂的反应生成相应的羧酸。
示例反应方程式:CH2=CH2 + O=CR → CH2=CH-C(=O)-R二、缩合反应缩合反应是指两个或多个分子通过共价键的形成结合在一起,形成一个较大的分子。
在这个过程中,通常伴随着脱水或释放氢气的反应,合成的产物通常比原始分子更大。
1. 缩合反应缩合反应是一种加成反应的特殊类型,其中两个或多个分子通过形成共价键结合在一起,同时脱去一个小分子。
这种反应通常发生在醛、酮或酸的存在下。
示例反应方程式:CH3CHO + HCN → CH3CH(OH)CN2. 羟基缩合反应羟基缩合反应是一种缩合反应,其中两个或多个醇分子通过形成醚键结合在一起,并释放出水分子。
这种反应常见于两个醇的反应。
不对称羟醛缩合

中既有羧基又有氨基, 反应中生成的亚胺或烯胺中间体结
构较为稳定, 反应条件易于控制, 因此, 在不对称羟醛缩合 反应中应用广泛。 脯氨酸既可以催化分子内不对称羟醛缩合,也可以 催化分子间不对称羟醛缩合。
氨基的亲 核进攻
醇胺中间体 的脱水
碳—碳键 形成
亚胺的脱 质子化作 用
亚胺-醛中间 物的水解
以-s 脯氨酸催化丙酮和醛的反应体系为例, 反应机理:
羟醛反应 得以实现
List等人使用脯氨酸为催化剂进行分子间的直接羟醛缩合 反应:
并对脯氨酸催化反应机理进行假设,认为脯氨酸类似于 醛缩酶的功能, 它不仅提供亲核的氨基基团, 而且羧基可作 为一种酸/碱助催化剂, 可以促进机理中每一个单独步骤,包 括:
脯氨酸是不对称合成反应中最常用的催化剂,其分子
烯胺中间体9 可以从si或re 面进攻醛10 分子中羰基碳, 形成R或S型过态TS, 所以, 烯胺中间体9和醛10 分子形 成C-C 键的步化合物而言的。比如一个酮,是平 面结构的,按照顺序规则将氧,R1,R2集团排列,如果这三个 集团从大到小是顺时针的,则这个面是Re面;反之是Si面。 含有羰基,碳-氮双键或碳碳双键的化合物,双键处的碳 原子是平面型的,因此是非手性的,但当双键发生加成时, 碳原子变为四面体结构,可能成为新的手性中心,因此双键 处的分子平面为潜手性面,以乙醛为例,如果观察碳原子所 Re面 Pro-R 连三个基团为O→CH3→H,是顺时针方向,此观察面称为 面,也称Re面,反之另一面称为Pro-S面,即Si面。
• 不对称羟醛缩合主要分为:
• 1.底物控制的不对称羟醛缩合反应 • 2.试剂控制的不对称羟醛缩合反应 • 3.手性催化剂控制的不对称羟醛缩合反应 • 4.双不对称羟醛缩合反应
羟醛缩合反应在有机化学中的应用

羟醛缩合反应在有机化学中的应用摘要:羟醛缩合反应是一个重要的有机化学反应,它在有机合成中有着广泛的应用。
羟醛缩合反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛酮或酸,或进一步脱水得到α,β-不饱和醛酮或酸酯的反应。
①分子间的羟醛缩合经常被用来合成一些β-羟基化合物,如1,3-丙二醇、l,3-丁二醇和新戊二醇等。
其可作为进一步生产香料、药物等多聚物或聚对苯二甲酸乙二醇酯(PET)、聚对苯二甲酸丁二酯(PBT)和聚对苯二甲酸丙二醇酯(PTT)等高聚物的单体;缩合脱水产物α,β-不饱和醛氧化得到相应的可广泛用作精细化工生产原料的羧酸,如2,2-二羟甲基丙酸可用作水性氨脂扩链剂以及制备聚酯、光敏树脂和液晶,2-甲基-2-戊烯酸是具有水果香味的食用香料,可广泛用于食品加工业和其它日化香精产业;此外,α,β-不饱和醛完全氢化时得到饱和伯醛,可用作溶剂或制造洗涤剂、增塑剂。
②关键词:羟醛缩合有机反应应用羟醛缩合反应的机理:羟醛缩合反应是指含有活性α氢原子的化合物如醛、酮、羧酸和酯等,在催化剂的作用下与羰基化合物发生亲核加成,得到α-羟基醛或酸。
有α氢原子的化合物如醛、酮、羧酸和酯分子中,由于羰基的吸电子诱导作用以及碳氧双键和α碳上碳氢σ键之间的σ-π超共轭效应,使得α碳上氢上的电子云密度较低,具有较强的酸性和活性。
羟醛缩合反应既可以在酸催化下反应,也可以在碱催化下反应。
在酸催化下,羰基转变成烯醇式,然后烯醇对质子化的羰基进行亲核加成,得到质子化的β-羟基化合物。
由于α氢同时受两个官能团的影响,其化学性质活泼,在经质子转移、消除可得α,β-不饱和醛酮或酸酯。
在碱性催化剂下,首先生成烯醇负离子,然后烯醇负离子再对羰基发生亲核加成,加成产物再从溶剂中夺取一个质子生成β-羟基化合物。
得到的β-羟基化合物在碱作用下可失水生成α,β-不饱和醛酮或酸酯。
③故羟醛缩合从机理上讲,是碳负离子对羰基碳的亲核加成。
精细有机合成技术之羟醛缩合介绍课件

羟醛缩合反应可以制备具有特定生物活性的
04
材料,如药物、生物传感器等。
3
羟醛缩合反应 的挑战与优化
反应选择性
反应选择性
1 是羟醛缩合 反应的关键
反应选择性
3 可以通过优 化反应条件 来提高
反应选择性
2 决定了产物 的纯度和质 量
反应选择性的
4 提高有助于提 高反应效率和 减少副产物
反应效率
选择性:提高反 应选择性,减少 不必要的副反应
应用领域的拓展
01
医药领域:开发新型药物, 提高药物疗效
02
材料领域:制备新型材料, 提高材料性能
03
食品领域:开发新型食品添 加剂,提高食品品质
04
环保领域:开发新型环保材 料,减少环境污染
05
能源领域:开发新型能源材 料,提高能源利用效率
06
生物技术领域:开发新型生 物技术,提高生物技术水平
谢谢
随着研究的深入,未来可能会发现更多新型羟醛 缩合反应,为有机合成提供更多的可能性。
新反应的发现和应用将有助于提高有机合成的效 率和环保性,推动有机合成技术的发展。
反应机理的深入研究
D 羟醛缩合反应机理与绿色化学的关联
C
羟醛缩合反应机理在合成中的应用
B
羟醛缩合反应机理的优化与改进
A
羟醛缩合反应机理的研究进展
04 发展趋势:随着有机合成技术的不断发展,羟醛缩合反 应在药物合成中的应用将更加广泛和深入。
材料合成
羟醛缩合反应在材料合成中的应用广泛,如
01
聚合物、有机半导体、药物等。
羟醛缩合反应可以制备具有特定结构和性能的
02
材料,如高分子量聚合物、液晶材料等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机小分子催化不对称羟醛缩合反应的研究不对称羟醛缩合反应是有机合成中最有效的碳—碳键形成反应之一。
反应产物β-羟基酮的特殊结构,使其在天然产物的合成中占有非常重要的地位[1]。
发展不对称羟醛缩合反应成为有机合成化学中的一项热门研究课题。
不对称羟醛缩合反应大体可以分成两类:一类是将底物酮或酯衍生为烯醇的形式进行反应,如Mukaiyama Aldol 反应[2];另一类是醛与酮之间的直接不对称羟醛缩合反应(Scheme 1),如有机小分子的不对称催化反应。
这类反应因具有操作简单和原子经济性的显著优点而成为化学家们近年来的研究热点。
有机小分子作为不对称催化剂,还具有许多特殊的优点:与过渡金属催化剂相比,无毒无害易得、反应体系无重金属残留、较小的分子量、易于从产物中分离出来重复利用等特点,符合当前大力倡导的环境友好的绿色化学要求。
脯氨酸是不对称合成反应中最常用的催化剂[3,4],其分子中既有羧基又有氨基,反应中生成的亚胺或烯胺中间体结构较为稳定,反应条件易于控制,因此,在不对称羟醛缩合反应中应用广泛。
本文将主要讨论脯氨酸催化的不对称羟醛缩合反应予以介绍。
1 非水相中的不对称羟醛缩合反应1.1 脯氨酸及其衍生物1.1.1 L-脯氨酸早在20世纪70年代, Hajos[5a]和Eder[5b]就发现脯氨酸能够催化分子内的羟醛缩合反应, 并具有高度的对映异构体选择性和较高的化学产率。
该反应还被人们用来合成许多有用的化合物[6], 特别是用于类固醇和许多天然产物的合成中[7]。
后来有关这方面的研究鲜有报道。
直到2000年, Barbas和List 等[8]报道了脯氨酸催化的分子间不对称羟醛缩合反应, 并进行了深入的研究(Eq.1),大大拓宽了这一反应的应用前景。
Barbas研究小组[8a]首先以丙酮和对硝基苯甲醛作为反应物,研究了各种氨基酸对此反应的催化能力。
研究结果表明:五元环效果最好,四元环次之,六元环活性很低,而非环状结构的普通氨基酸几乎没有催化活性。
把羧基变成酰胺也不发生反应,这说明羧基的质子在催化反应中也起了关键作用。
作者由此对脯氨酸催化反应的机理进行了假设(Scheme 2),认为脯氨酸类似于醛缩酶(micro-aldo-ase)的功能,它不仅提供亲核的氨基基团,而且羧基可作为一种酸/碱助催化剂,可以促进机理中每一个单独步骤,包括:(a)氨基的亲核进攻, (b)醇氨中间体的脱水,(c)亚胺的脱质子化作用,(d)碳—碳键形成, (e, f)亚胺-醛中间物的水解。
近年来陆续有文献对此反应机理进行报道[9],通过计算等多方面研究,证实了这种独特新颖的不对称羟醛缩合反应可能是通过上述烯胺机理进行的。
2002年,MacMillan等进一步研究了醛与α-位无取代的醛进行的分子间缩合反应,也得到较好的结果。
从表1中,我们可以看出,产物的ee值普遍较高,但反应的非对映选择性受作为电子受体的醛的影响较大,用异丁醛作为电子受体时,反应的非对映选择性明显要比其它醛作为电子受体时高。
表 1 脯氨酸催化的醛与醛的分子间羟醛缩合反应Table 1 The proline-catalyzed cross-aldol addition reaction of aldehydes1.1.2 脯氨酸衍生物张雅文等[10,11]在研究Aldol反应中发现,若在四氢吡咯环的3-位引入取代基, 对催化性能影响不大,而5-位取代会使催化能力大大降低,乃至丧失。
而研究4-位取代的脯氨酸的催化活性(Scheme 3),取得了一些很好的结果。
由于取代基的引入使催化剂的溶解性增强, 催化剂的用量明显降低(2 mol%)。
温度在-25 ℃,可以得到较高的产率(81.3%)和较好的ee 值(89.7%)。
同时由于溶剂是丙酮,后处理也更为方便。
Scheme 32 水相中的不对称羟醛缩合反应2.1 吡咯烷-四唑Yamamoto[12]报道了一种能催化水溶性醛如三氯乙醛与酮的Aldol反应的催化剂(Eq.4),得到85%的产率和84%的ee值。
当催化剂17用量为5 mol%,并加入100mol%水时,反应的产率为85%,ee值为84%,而无水条件下,经过60 h,反应基本不发生。
更为有趣的是作者还发现当含水量超过100 mol%时,水含量增加(200mol%或500mol%),产物的ee值也随之增加(92% ee或94% ee),而脯氨酸的反应就很慢(46 h反应产率约为10%)。
底物酮还可以进一步扩展。
表2 催化剂17 催化的各种酮与三氯乙醛-水化物的羟醛缩合反应Table 2 Reaction of various ketones with chloral monohydrate in the presence of 172.2 吡咯烷-咪唑Vincent等[13]开发了一种能催化羟醛缩合反应的吡咯烷-咪唑催化剂(BIP)。
与脯氨酸催化相同的条件下, 仅得到40%的产率和44%的ee值, 但当有酸加入时, 反应的速率和产率大幅度提高(Entries 2, 3 vs1)。
溶剂、温度及所加的质子酸都是影响反应的重要因素, 如Entry 11, 2 mol%的BIP/TFA催化剂用量,丙酮为溶剂, 可以得到87%的产率和82%的ee值。
它的另一个显著优点是反应只需用等量的酮和醛,而在脯氨酸催化中,酮需大大过量。
另外,作者还发现配体BIP与Lewis酸如Zn(OTf)2也能够有效催化Aldol反应(Entry15),由此说明此类配体也可以作为金属不对称催化的潜在的双齿配体。
与脯氨酸相比,BIP-TFA催化剂的高效性主要是由于具有两个潜在的亲核位置,分析可能的过渡态构型。
这类催化剂的应用使我们意识到:可以通过对配体结构的修饰来不断提高不对称催化反应的产率和对映选择性。
3 展望越来越多的有机小分子催化剂涌现出来,催化活性和有效性都在不断提高, 有些报道还应用了离子溶液[14]或高压[15]等方法来扩大其合成应用范围。
由于它们的显著优点:反应条件温和,副反应少,反应的立体和区域选择性高,可以迅速实现反应规模的放大,引起了化学工作者极大的关注。
但是这类催化剂在适用性和通用性方面都有一定的局限性,底物范围较窄,通用性也还不够。
因此,设计并合成能广泛应用于不对称催化有机小分子催化剂应成为今后的发展趋势。
参考文献:[1] For an overview of total syntheses involving the aldol bond formation, see:(a) Mukaiyama, T. Tetrahedron 1999, 55, 8609.(b) Nicolaou, K. C.; Vourloumis, D.; Winssinger, N.; Baran, P. S. Angew. Chem., Int. Ed.2000, 39, 44.[2] Reviews:(a) Nelson, S. G. Tetrahedron: Asymmetry 1998, 9, 357.(b) Gröger, H.; Vogl, E. M.; Shibasaki, M. Chem. Eur. J. 1998, 4, 1137.(c) Bach, T. Angew. Chem., Int. Ed. Engl. 1994, 33, 417.(e) Denmark, S. E.; Stavenger, R. A.; Wong, K.-T. J. Org. Chem. 1998, 63, 918.[3] Lu,X.-Y.Prog.Chem.1998,10,123(in Chinese).[4] List,B.Tetrahedron 2002,58,5573.[5] (a) Hajos, Z. G.; Parrish, D. R. J. Org. Chem. 1974, 39,1615.(b) Eder, U.; Sauer, G.; wiechert, R. Angew. Chem., Int. Ed. Engl. 1971, 10, 496.[6] Cohen, N. Acc. Chem. Res. 1976, 9, 412.[7] (a) Danishefsky, S.; Cain, P. J. Am. Chem. Soc. 1976, 98,4975.(b) Kwiatkowski, S.; Syed, A.; Brock, C. P.; Watt, D. S.Synthesis 1989, 818.(c) Ramamurthi, N.; Swaminathan, S. Indian J. Chem., Sect.B 1990, 29, 401.(d) Przezdziecka, A.; Stepanenko, W.; Wicha, J.Tetrahedron: Asymmetry 1999, 10, 1589[8] (a) List, B.; Lerner, R. A.; Barbas, III, C. F. J. Am. Chem.Soc. 2000, 122, 2395.(b) List, B.; Notz, W. J. Am. Chem. Soc. 2000, 122, 7386.(c) Sakthivel, K.; Notz, W.; Bui, T.; Barbas, III, C. F. J. Am.Chem. Soc. 2001, 123, 5260.[9] (a) Bahmanyar, S.; Houk, K. N. J. Am. Chem. Soc. 2001,123, 12911.(b) Rankin, K. N.; Gauld, J. W.; Boyd, R. J. J. Phys. Chem. A 2002, 106, 5155.(c) Domingo, M. A. R. Theor. Chem. Acc. 2002, 108, 232.(d) Hoang, L.; Bahmanyar, S.; Houk, K. N.; List, B. J. Am.Chem. Soc. 2003, 125, 16.(e) Bahmanyar, S.; Houk, K. N.; Martin, H. J.; List, B. J. Am. Chem. Soc. 2003, 125, 2475.[10] Shen, Z.-X.; Zhou, H.; Ma, J.-M.; Liu, Y.-H.; Zhang, Y.-W.Chin. J. Org. Chem. 2004, 24,1213 (in Chinese).[11] Shen, Z.-X.; Chen, W.-H.; Zhang, Y.-W. Chirality 2005, 17, 119.[12] Torii, H.; Nakadai, M.; Ishihara, K.; Saito, S.; Yamamoto,H. Angew. Chem., Int. Ed. 2004,43, 1983.[13] Lacoste, E.; Landais, Y.; Schenk, K.; Verlhaca, J.-B.Vincent, J.-M. Tetrahedron Lett. 2004, 45, 8035.[14] Loh, T.-P.; Feng, L.-C.; Yang, H.-Y.; Yang, J.-Y.Tetrahedron Lett. 2002, 43, 8741.[15] Hayashi, Y.; Tsuboi, W.; Shojia, M.; Suzuki, N.Tetrahedron Lett. 2004, 45, 4353.。
