配位化合物习题答案
配位化合物(习题参考答案)
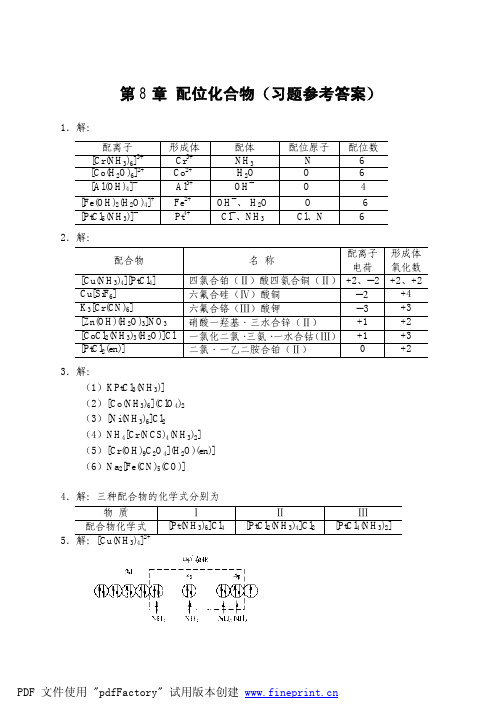
由(2)、(3)计算结果看出,AgCl 能溶于稀 NH3·H2O,而 AgBr 须用浓 NH3·H2O 溶解。 12.解: (1)[HgCl4]2− + 4 I−
K =
ψ
K fψ ([HgI 4 ] 2 − ) K fψ ([HgCl 4 ] )
= 5.78 ×10 14
K ψ 很大,故反应向右进行。
y = 0.49
可见 KCN 可溶解较多的 AgI。 10.解:设 1.0 L 1.0 mol·L−1 氨水可溶解 x mol AgBr,并设溶解达平衡时 c([Ag(NH3)2]+) = x mol·L−1(严格讲应略小于 x mol·L−1)c(Br− ) = x mol·L−1 AgBr(s) + 2NH3·H2O [Ag(NH3)2]+ + Br− + 2H2O 平衡浓度/(mol·L−1) 6.0 − 2 x x x
(2)[Cu(CN)2]− + 2NH3·H2O [Cu(NH3)2]+ + 2CN− + 2H2O
−
Kψ =
K fψ ([Cu(NH 3 ) 2 ] + ) K fψ ([Cu(CN) 2 ] )
= 7.24×10−14
(3)[Fe(NCS)2]+ + 6F−
[FeF6]3− + 2SCN−
+
Kψ =
PDF 文件使用 "pdfFactory" 试用版本创建
[CoF6]3-
[Ru(CN)6]4-
[Co(NCS)4]2―
6.解:已知:[MnBr4]2―μ=5.9 B.M,[Mn(CN)6]3―μ=2.8 B.M。 由: µ= n(n+2) 式求得:
中国药科大学《无机化学》第四章配位化合物习题及答案

中国药科大学《无机化学》第四章配位化合物习题及答案一、选择题1. 对于配合物中心体的配位数,说法不正确的是………………………………………()(A) 直接与中心体键合的配位体的数目(B) 直接与中心体键合的配位原子的数目(C) 中心体接受配位体的孤对电子的对数(D) 中心体与配位体所形成的配价键数2. [Ni(CN)4]2-是平面四方形构型,中心离子的杂化轨道类型和d电子数分别是……()(A) sp2,d7(B) sp3,d8(C) d2sp3,d6(D) dsp2,d8二、填空题3. 配合物[PtCl(NH3)5]Br和[Co(NO2)(NH3)5]2+ 存在的结构异构体的种类和结构简式分别为_______________________________ 和_______________________________________。
4. 已知铁的原子序数为26,则Fe2+在八面体场中的晶体场稳定化能(以△0 =10 Dq表示)在弱场中是_____________ Dq,在强场中是______________ Dq。
5. 对于八面体构型的配离子,若中心离子具有d7电子组态,则在弱场中,t2g轨道上有____个电子,e g轨道上有____个电子;在强场中,t2g轨道上有____个电子,e g轨道上有____个电子。
三、问答题6. 试举例说明π 配合物与π酸配合物的区别。
7. 画出[CoCl2(NH3)2(H2O)2]+配离子的几何异构体。
参考答案一、选择题1. (A)2. (D)二、填空题3. 电离异构体[PtBr(NH3)5]Cl键合异构体[Co(ONO)(NH3)5]2+4. -4 Dq;-24 Dq5. 5,2;6,1三、问答题6.π配合物:由配体提供π电子给中心体原子(离子)的空轨道,形成配位σ 键,例蔡斯盐[PtCl3(C2H4)]-。
Pt – C2H4间存在σ 键及反馈d -π*π键π酸配合物:由CO、NO等一类π酸配体(π受体)与金属原子或d电子较多的过渡金属原子、离子形成的配合物,一方面它们可以提供孤对电子与中心体形成配位σ 健,另一方面,它有空的π轨道可接受来自中心体原子上d轨道上积累的负电荷,配体本身是Lewis 碱,又是Lewis酸。
无机答案第11章 配位化合物

第11章 配位化合物习 题1.给出下列中心金属离子的特征配位数:(a)Cu+;(b)Cu2+;(c)Co3+;(d)Zn2+;(e)Fe2+;(f)Fe3+。
2.按照摩尔导电率的大小将下列配合物排序:(a)K[Co(NH3)2(NO2)4];(b)[Cr(NH3)3(NO2)3];(c)[Cr(NH3)3(NO2)] 3 [Co(NO2)6]2;(d)Mg[Cr(NH3)(NO2)5]。
3.解释为什么EDTA钙盐可作为铅的解毒剂?为什么用EDTA的钙盐而不能用游离的EDTA?4.指出下列配离子中金属元素的氧化态:(1) [Cu(NH3)4]2+;(2) [Cu(CN)2]-;(3) [Cr(NH3)4(CO3)]+;(4) [Co(en)3]2+;(5) [CuCl4]2-;(6) Ni(CO)4.5.命名下列配合物:(1)K3[Co(NO3)6];(2)[Cr(Py)2(H2O)2Cl2];(3)[Cr(H2O)5Cl]Cl2•H2O;(4)K2[Ni(en)3];(5)[Co(NH3)4(NO2)Cl]Cl;(6)K3[Fe(C2O4)3]•3H2O;(7)K2[Cu(C2H2)3];(8)[Pt(Py)4][PtCl4].6.根据下列配合物的名称,写出其化学式:(1)亚硝酸•溴三氨合铂(Ⅱ);(2)一水合二氨•二乙二胺合铬(Ⅲ);(3)溴化硫酸根•五氨合钴(Ⅳ);(4)六氟合铂(Ⅳ)酸钾。
7.画出配离子[Cr(NH3)(OH)2Cl3]2-所有可能的几何异构体。
8.指出下列配合物中配位单元的空间构型并画出它们可能存在的几何异构体:(1)[Pt(NH3)2(NO2)Cl];(2)[Pt(Py)(NH3)ClBr];(3)[Co(NH3)2(OH)2Cl2];(4)K4[Co(NH3)2(NO2)4];(5)[Ni(NH3)3(OH)3];(6)[Ni(NH3)2Cl2].9.配离子[Cr(en)2Cl2]+存在几种几何异构体,哪种异构体可以表现出旋光活性,画出这些异构体。
化学竞赛题库配位化合物答案

ONOOH , ONOOH
NO2 + OH
x=x=1 2 1 3
4x + (+1) ´ 7 + ( -2) ´ 3 = -1 3y + ( -1) ´ 3 + ( +1) ´ 4 = 0
β-PdCl2
Cl Pd Cl
Cl Pd Cl
Cl Pd Cl
Cl Pd Cl
2.该反应的分步反应方程式为 (1) PdCl2 + 2Cl PdCl42PdCl42- + CH2=CH2 [Pd(C2H4)Cl3] + Cl
-
[Pd(C2H4)Cl3] + H2O [Pd(C2H4)(H2O)Cl2] + Cl ………… 总反应方程式为 PdCl2 + C2H4 + H2O (2) Pd2+采取 dsp2 杂化 (3) C2H4 与 Pd2+之间存在 σ 配键与反馈 π 键 Pd + CH3C
-
O H
+ 2HCl
+ +
2
五、1.∵配合物(C)为单核、电中性分子,其分子量为 含 H 原子个数为:
462.85 ´ 0.0523 = 24 (个) 1.008
M Mn 54.69 = = 462.85 0.1187 0.1187
形成(C)的配体是由 2 分子(A)与 1 分子(B)失去 2 分子水后形成的:
CHO
H2N
H H H B C O (A)
H Na
+
H H
B C
O O
Na+ (B)
CH3 O H3C B B O O B CH3 (C) H3C O B
(完整版)配位化合物习题及解析

《配位化合物》作业参考解析1. 下列说法正确的是A. 配合物的内界和外界之间主要以共价键相结合B. 中心原子与配体之间形成配位键C. 配合物的中心原子都是阳离子D. 螯合物中不含有离子键【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。
2. 下列配合物命名不正确的是A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ)B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ)C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾D. H2[PtCl6] 六氯合铂(Ⅳ)酸【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。
对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。
3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是A. [Co(NH3)4(CO3)]+B. [Co(NH3)5(CO3)]+C. [Pt(en)(NH3)(CO3)]D. [Pt(en)2(NH3)(CO3)]2+【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。
B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。
配位化学习题(答案参考)

配位化合物(01)1.历史上记录的第一种人工合成的配位化合物是( D )A.硫酸六氨合钴(II)B.普鲁士蓝C.硫酸四氨合铜(II)D.氯化二氨合银(I)2.配位化学的奠基人是( D)A.阿仑尼乌斯B.路易斯C.鲍林D.维尔纳3.下列说法中错误的是( C)A 配合物的形成体通常是过渡金属元素B 配键是稳定的化学键C 配键的强度可以和氢键相比较D 四面体配合物中,不存在顺反几何异构现象4.下列说法中正确的是(D )A 配位原子的孤电子对越多,其配位能力就越强B 电负性大的元素充当配位原子,其配位能力也强C CH3-C-OH配体是双齿配体D 在[Cu(en)2]2+中,Cu2+的配位数是412.下列说法中错误的是(D )A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形D.配合物中,由于存在配键,所以配合物都是弱电解质13.下列配体的本位能力的强弱次序为(B )->NH3>NCS->H2O>X-->NH3>NCS->H2O>X-C.X->H2O>CH->NH3>NCS-D.X->CN->H2O>NH3>NCS-14.在配位分子3KNO2.Co(NO3)2中,配位数为(D )A 3B 4C 5D 627.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少个共价键和配位共价键?如何对其进行区分?解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。
在NH4+离子中有四个共价键,其中有一个是配位共价键。
27.4 求下列配位化合物的中心原子的配位数分别是多少?(a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺)解(a) 8 (b) 427.7 指出下列各金属中心离子的特征配为数:(a) CuⅠ(b) CuⅡ(c)AlⅢ(d) CoⅢ(e) ZnⅡ(f) FeⅡ(g) FeⅢ(h) AgⅠ。
配位化学试题及答案

配位化学试题及答案一、选择题(每题2分,共10分)1. 下列哪项不是配位化合物的特点?A. 含有中心原子或离子B. 含有配位键C. 含有离子键D. 含有配体答案:C2. 配位化合物的几何构型通常由什么决定?A. 配体的电荷B. 配体的数目C. 配体的电子排布D. 中心原子的氧化态答案:B3. 配位化学中,路易斯碱是指什么?A. 能够提供电子的分子或离子B. 能够接受电子的分子或离子C. 能够提供空轨道的分子或离子D. 能够接受空轨道的分子或离子答案:B4. 下列哪种配体是单齿配体?A. 乙二胺(en)B. 1,3-丙二胺(pn)C. 环己二胺(cn)D. 四齿配体答案:A5. 配位化合物的命名中,配体的名称通常放在什么位置?A. 中心原子的前面B. 中心原子的后面C. 配位化合物的前面D. 配位化合物的后面答案:A二、填空题(每题2分,共10分)1. 配位化学中,中心原子或离子与配体之间形成的化学键称为______。
答案:配位键2. 一个中心原子或离子最多可以与______个配体形成配位键。
答案:63. 配位化合物的配位数是指______。
答案:中心原子或离子周围配体的数量4. 配位化合物的命名中,配体的数目通常用希腊数字表示,其中“二”表示______。
答案:二5. 配位化合物的命名中,配体的电荷通常用罗马数字表示,其中“Ⅱ”表示______。
答案:+2三、简答题(每题5分,共20分)1. 简述什么是内界和外界,并举例说明。
答案:内界是指配位化合物中中心原子或离子与配体形成的配位单元,外界是指配位单元以外的部分。
例如,在[Co(NH3)6]Cl3中,[Co(NH3)6]是内界,Cl3是外界。
2. 什么是螯合配体?请举例说明。
答案:螯合配体是指能够通过多个配位点与中心原子或离子形成配位键的配体。
例如,乙二胺(en)可以与金属离子形成螯合配位化合物。
3. 配位化合物的稳定性与哪些因素有关?答案:配位化合物的稳定性与中心原子或离子的电荷、配体的类型、配位数以及配体与中心原子或离子之间的配位键强度等因素有关。
无机化学习题-配位化合物答案

化,形成四配位平面四方配离子 5d8 的 8 个 d 电子全部配对, m = n(n + 2) B. M. = 0。
Pt(IV)应为 d2sp3 杂化,形成内轨型六配位八面体配离子。
该配合物实际化学式可能有:
65.39 y + 16 + 59.024 ´ (2 y -1)
81.39 y
= 0.516 解得 y ≈ 4
183.44 y - 102.048
∴(A)的化学式为 Zn4O(CH3COO)6
2.4ZnCO3 + 6CH3COOH
ZnO(CH3COO)6 + 4CO2 + 3H2O
3.Zn2+为 3d10,Zn2+周围有 4 个 O 原子,∴Zn2+离子采取 sp3 杂化
4.2948 + 14.476x = 3.024 + 15.12x, 0.644x = 1.2708, x = 2
∴Al 为+3 氧化态,Al3+采取 sp3 杂化。
H NEt3
NEt3 H
NEt3 H
Al
H
NEt3
H
Al
H
H
Et3N
NEt3 (非极性分子)
Al H
H
因它们都有对称面,所以都不存在对映体。
十六、1.H C
O
H + CH3OH C
O
(B) LiAlH4
(C) SiCl4
(D) (CH3)2NH (E)
6
N (E)为
H2C H3C N H3C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十九章配位化合物
1、[Pt(NH3)2Cl4]
1、配合物:K2PtCl6, Co(NH3)6Cl3, CuSO4·5H2O
螯合物:Ni(en)2Cl2, Cu(NH2CH2COO)2
复盐:(NH4)2SO4·FeSO4·6H2O KCl·MgCl2·6H2O
简单盐:Cu(OOCH3)2
3、(1)六氯合锑(III)酸铵
(2)四氢合铝(III)酸锂
(3)三氯化三(乙二胺)合钴(III)
(4)氯化二氯·四水合钴(III)
(5)二水合溴化二溴·四水合钴(III)
(6)羟·水·草酸根·乙二胺合铬(III)
(7)六硝基合钴(III)配阴离子
(8)氯·硝基·四氨合钴(III)配阳离子
(9)三氯·水·二吡啶合铬(III)
(10)二氨·草酸根合镍(II)
4、(1)[Pt(NH3)2(NO2)Cl] 平面正方形2种异构体
H3N NO2H3N NO2
Pt Pt
H3N Cl H3N Cl (2)[Pt(Py)(NH3)ClBr] 平面正方形3种异构体
Cl Py Cl NH3
Pt Pt
Br NH3 Br Py
Cl 3
Pt
Py Br
(3)[Pt(NH3)2(OH)2Cl2] 八面体5种异构体
3
NH3NH3 NH3
33
OH Cl
(4)[Co(NH3)2(NO2)4]-八面体2种异构体
23
O22O2
NH3NO2
(5)[Co(NH3)3(OH)3] 八面体2种异构体
H3H3
NH3 OH
(6)[Ni(NH3)2Cl2] 四面体无异构体
(7)[Cr(en)2(SCN)2]SCN
[Cr(en)2(SCN)2]-八面体2种异构体
en
SCN en
(8)[Co(en)3]Cl3
[Co(en)3]3+八面体2种异构体
(9)[Co(NH3)(en)Cl3] 八面体2种异构体
(10)[Co(en)2(NO2)2]Cl2
[Co(en)2(NO2)2]2+八面体2种异构体
5、该中心金属离子可能是Fe2+
)2
n
n= 4.90 n = 4
(
即在八面体场中有四个成单电子
八面体强场中磁矩为零,即无成单电子
故Fe2+符合题意
6、高自旋的有:(1),(2),(5),(7)
低自旋的有:(3),(4),(6),(8)
内轨型的有:(3),(4),(6),(8)
外轨型的有:(1),(2),(5),(7)
7、dsp2
8、由软硬酸碱规则:“硬亲硬,软亲软,软硬交界就不管”
9、(1)Al3+与F-的配合物更加稳定,Al3+为硬酸;而碱F-的硬度比Cl-大
(2)Pd2+与RSH配合后更加稳定,Pd2+为软酸,而RSH为软碱,ROH为硬碱。
(3)Cu2+与NH3结合更加稳定。
(4)Cu2+与NH2CH2COOH结合更加稳定,因为前者的配体中有N,后者仅有O,N的配位能力比O强。
10、 解:设[Ag +]为x mol•dm -3
Ag + + 2CN - =Ag(CN)2-
x 2x 0.1-x
2121025.1)2(1.0⨯=-x x x 得:x = 2.7×10-8mol•dm -3 Q = [Ag +][Cl -] = 2.7×10-8×0.10 = 2.7×10-9
Q > Ksp H (AgCl ),因而会有AgCl 沉淀析出
11、解: 设生成 Cu(NH 3)42+后Cu 2+的浓度为xmol•L -1
++⇔+24332)(4NH Cu NH Cu
x 6-4(0.01-x) 0.01-x
4)]
01.0(46[01.0x x x --- = 2.09 × 1013 得: x = 3.79 × 10-19 mol•dm -3
Q = [Cu 2+] – [OH -]2 = 3.79 × 10-19×0.012
= 3.79 × 10-23
Q 小于Ksp H 故铜氨配合物不能被破坏
12、解: K 稳,Fe(SCN)3 = 333]
][[])([-+SCN Fe SCN Fe 633636]
][[][][-+-
-=F Fe FeF FeF K 稳 又 [SCN -] = [F-] = 1 mol•dm -3
3
33636][][][)()(稳稳SCN Fe K SCN Fe FeF K FeF =∴-- [FeF 6]3-/[Fe(SCN)] = 1×1016/2.0×103 = 5×1012
13、解:Ksp H AgI = [Ag +][I -]
3317
75
533
5233523232323232331031.0103.91012.1101101][101])([101][][)(])([]/[]][[][-------+---+++++
∙=∙=⨯⨯⨯⨯⨯⨯=∙⨯=∙⨯=∙=-=cm m ol cm m ol NH cm m ol NH Ag cm m ol I NH NH Ag K NH Ag I AgI Ksp NH Ag NH Ag NH Ag K 稳稳得:)()(θ
14、解:
]lg[059.0/]/[][1]][[][][0.1][][2)(22223
22++-+-+--
----
--+===∙==+⇔+Au Au Au E Au CN Au E Au CN Au CN Au CN Au K dm mol CN CN Au CN Au e CN Au )
()()()()(标准状态时:稳θθθ =1.691 + 0.059lg1/K 稳H
=1.691+0.059lg1/2×1038
=-0.57V
15、解:E H = E H (H+/H 2)- E H [Cu (NH3)42+/Cu] = 0.0300V 即 E H [Cu (NH 3)42+/Cu] = -0.0300V
由 E H [Cu (NH 3)42+/Cu] = E H (Cu 2+/Cu ) + 0.059/2lg[Cu 2+]
12
24
32224
3321049.3lg 2059.034.00300.0/1lg 2/059.034.0]/[/1][]
[14⨯=-
=-+===⇔++++++θθθθθ稳稳稳稳稳得:)(即得:)(K K K Cu NH Cu E K Cu Cu K NH Cu NH Cu 16、解:在水溶液中,
)2/3(++Co Co E θ>)/(22O H O E θ
故Co3+能氧化水
4Co 3++2H 2O=4Co 2+O 2↑+4H +
V OH p O p OH O E OH O E OH e O H O dm m ol OH dm m ol NH V NH Co K NH Co K Co Co E Co Co Co Co
E NH Co NH Co E 45.0)1024.4(1lg 4059.0401.0][/)(lg 4059.0)/()/(4441024.4108.10.1][0.1][04.01058.11038.1lg 059.081.1]
)([])([lg 059.0)2/3(][][lg 059.0)/(])(/)([434222223353335
5
2632632323263363=⨯+=+==++∙⨯=⨯⨯=∙==⨯⨯+==++=+=---
--
------++++++++θθθθ
θθθ则:
设稳稳
])(/)([263363+
+NH Co NH Co E θ<)/(2-OH O E
故 Co (NH 3)63+不能氧化水
17、解:因各级稳定常数都比较小,Cl -过量很多故可以认为:
[Cl -] = 1.0 mol•L -1
[Cl -] + [FeCl 2+] + 2[FeCl 2+] + 3[FeCl 3] + 4[FeCl 4-] =1.0 mol•L -1
[Fe 3+] + [FeCl 2+] + [FeCl 2+] + [FeCl 3] + [FeCl 4-]=0.010 mol•L -1 2.4]
][[][321==-++Cl Fe FeCl k [FeCl 2+] = 4.2[Fe 3+] 3.1]
][[][222==-++Cl FeCl FeCl k [FeCl 2+] = 1.3×4.2[Fe 3+] =5.5[Fe 3+] 040.0]][[]
[233==-+Cl FeCl FeCl k [FeCl 3] = 0.040[FeCl 2+]
= 0.04×1.3×4.2[Fe 3+]
=0.22[Fe 3+]
012.0]
][[][344==--Cl FeCl FeCl k [FeCl 4-]=0.012[FeCl 3] =0.012×0.04×1.3×4.2[Fe 3+]
=0.0026[Fe 3+]
则:[Fe 3+] + 4.2[Fe 3+] + 5.5[Fe 3+] +0.22[Fe 3+] + 0.0026[Fe 3+]=0.010mol•L -1 可得:[Fe 3+]=9.2×10-4 mol•L -1
由此可以得到:FeCl 2+的浓度最大。
