化学实验报告-一定溶质质量分数溶液的配制
《一定溶质质量分数的氯化钠溶液的配制》

图3
(1)完成此实验正确的操作顺序是(填序号) ④③①② ;
①溶解;②把配好的溶液装入试剂瓶;③称量;④计算
(2)按实验要求,图1中还缺少的玻璃仪器是 玻璃棒
;
(3)小红按图2的操作称取氯化钠,小亮发现小红的操作有错
误.你认为小红操作中的错误是 砝码和氯化钠放反了
;
他们原计划配制溶液的溶质质量分数是 18%
液溶质的质量分数时( B )
A.等于10% B.大于10% C.小于10% D.无法确定
3.小红在实验室欲配制一定质量分数的食盐溶液。
(1)B仪器的名称是 烧杯
,上面的仪器
中除B、E外,她必须选用的仪器还有(填字母编
号) D.G ;
(2)E的作用是 搅拌,加速溶解
。
4.配制溶质质量分数一定的氯化钠溶液常按以下操作顺序 进行。
小 结:
1、配制一定溶质质量分数的溶液 的主要步骤:
计算、称量、量取、溶解、装瓶
2、用到的主要仪器和用品有:
托盘天平、药匙、白纸、量筒、胶头滴管、 烧杯、玻璃棒
如果没有食盐,手边只有刚刚配 好的6%的溶液,而我们需要50g质 量分数为3%的氯化钠溶液,那怎 么办呢?
(水的密度是1.0g/ml 、6%的氯化钠溶液的密度为1.04g/ml)
请同学们讨论分析:配制的溶液溶质质量分数比 理论值偏大,会有哪些原因?
(1)溶质的质量偏大:称取固体溶质质量 偏大或量取浓溶液时仰视读数。
(2)溶剂的质量偏小:用量筒量取水时, 俯视读数;水量好后,向烧杯中倾倒时有 液体洒落。
请同学们讨论分析:配制的溶液溶质质量分数比 理论值偏小,会有哪些原因?
(1)溶质的质量偏小:称量固体溶质的质 量偏小;所用固体不纯、不干燥或已潮解; 称量时“左码右物”并使用了游码;量取浓 溶液时俯视读数
9.4 实验活动5 一定溶质质量分数的氯化钠溶液的配制(考点解读)(解析版)九年级化学 下册

实验活动5一定溶质质量分数的氯化钠溶液的配制(考点解读)(解析版)一、配置一定溶质质量分数的溶液注意事项一定溶质质量分数的溶液的配制是这样的,所用仪器有托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒;操作步骤是:计算→称量→溶解→装瓶→贴签→入柜,其注意事项有以下六条:1、计算时,溶质的质量=溶液质量×溶质的质量分数,溶液质量=溶液体积×溶液密度,溶剂的质量=溶液质量-溶质的质量;由于溶剂一般是水,且密度为1g/cm3,所以溶剂的体积和质量在数值是相等的;2、称量,称量包括称取溶质的质量和量取溶剂的体积;首先,用托盘天平(配用药匙)称量所需的溶质,倒入烧杯中;然后,用量筒(配用胶头滴管)量取所需的水,倒入盛有溶质的烧杯中;3、用玻璃棒不断搅拌,使溶质加速溶解;4、把配好的溶液装入细口瓶中,盖好瓶塞;5、标签上要注明溶液的名称和其中溶质的质量分数;6、放入试剂柜时,要注意标签向外。
二、实验配置一定溶质质量分数的溶液1、固体药品加水配制一定溶质质量分数的溶液(固体+水)用氯化钠固体配置50g质量分数为6%的氯化钠溶液所用仪器2、实验步骤:(1)计算:m(NaCl)=50g×6%=3g m(H₂O)=50g-3g=47g=47mL;(2)称量:确认试剂;瓶塞倒放;药匙取用药品托盘天平左物右码,垫纸放药品;(3)量取:量取时先倾倒到接近液面,后改用胶头滴管滴加。
视线与凹液面的最低处保持水平;(4)溶解:玻璃棒搅拌加速溶解;(5)装瓶、贴标签:标签包括溶液名称和浓度。
例.找出下列配置一定浓度氯化钠溶液的错误操作,并改正。
3、溶液加水稀释配置一定溶质质量分数的溶液(液体+水)用质量分数为6%的氯化钠溶液配置50g质量分数为3%的氯化钠溶液。
(1)计算:m(NaCl溶液)=(50g×3%)÷6%=25g V(NaCl溶液)=25g÷1.04g/cm³=24mLm(H₂O)=50g-25g=25g=25mL(2)量取:量取时先倾倒到接近液面,后改用胶头滴管滴加。
实验11 一定溶质质量分数的溶液的配制(考点精讲)-备战2021年中考化学实验专项突破
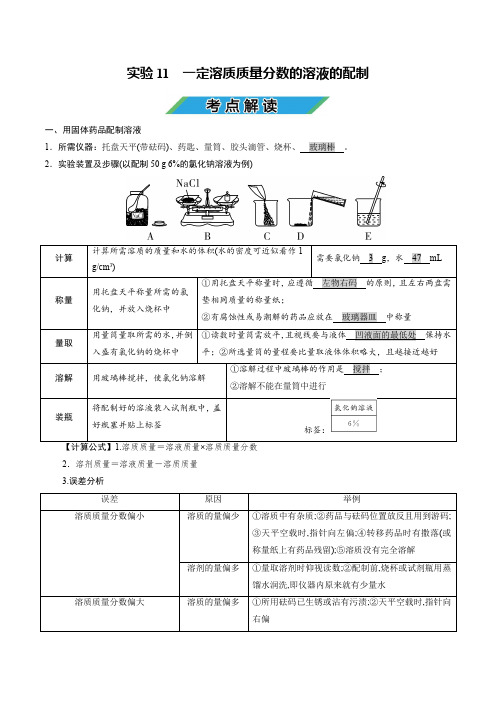
实验11 一定溶质质量分数的溶液的配制一、用固体药品配制溶液1.所需仪器:托盘天平(带砝码)2.实验装置及步骤(以配制50 g 6%的氯化钠溶液为例)标签:2.溶剂质量=溶液质量-溶质质量 3.误差分析【注意】若“左码右物”称量且使用了游码,则固体药品的实际质量=砝码质量-游码示数。
二、用浓溶液配制稀溶液1.所用仪器: 2.实验步骤计算→量取→混匀→装瓶并贴上标签 【计算公式】1.浓溶液的质量=稀溶液的质量×稀溶液的溶质质量分数浓溶液的溶质质量分数2.加入水的质量=稀溶液的质量-浓溶液的质量 3.误差分析(1)浓度偏小:量取水的体积时仰视读数;烧杯中原来有少量的水;在稀释时有部分浓溶液溅出;量取浓溶液时俯视读数。
(2)浓度偏大:量取水的体积时俯视读数;量取浓溶液时仰视读数。
【特别提醒】溶液配制完成后,转移过程中有部分液体洒出,溶液中的溶质质量分数不发生改变。
4.仪器的选用和基本实验操作(1)用硫酸钠固体配制质量分数为5%的硫酸钠溶液时,填字母序号)。
A B C D(2)欲配制质量分数为6%的NaCl 溶液,填字母序号)。
A.取固体B.称固体C.量取水D.溶解4.误差分析配制50 g 溶质质量分数为6%的氯化钠溶液时,填字母序号)。
①称量的氯化钠固体中含有不溶性杂质;②用量筒量取水时俯视读数;③将氯化钠固体放在托盘天平的右盘称量;④往烧杯中加水时有水洒出;⑤转移配好的溶液时有少量溅出。
A.②③B.①④C.②④D.③⑤一、单选题1.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是A.氯化钠固体中含有杂质B.用量筒量取水时仰视读数C.加水溶解固体时有水洒出D.配制好的溶液装瓶中时有少量洒出【答案】C【解析】A、称量的氯化钠固体中含有杂质,会造成实际所取的溶质的质量偏小,使溶质质量分数偏小,不符合题意;B、用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,使溶质质量分数偏小,不符合题意;C、加水溶解固体时有水洒出,溶剂质量减小,使溶质质量分数偏大,符合题意;D、将配制好的溶液装入试剂瓶中时有少量溅出,溶液具有均一性,溶质质量分数不变,不符合题意。
配制一定溶质质量分数的溶液化学探究实验报告

③在使用量筒量液时,先将液体倾倒入量筒,接近所需刻度时,改用__ ____逐滴滴加。读数时,量筒必须放_______,视线必须______。
3.
将NaCl倒入干燥的烧杯里,然后将蒸NaCl完全溶解,即得所需溶液。搅拌时玻璃棒不能碰也不能碰,要按照一定方向搅拌。
4.
标签上要注明药品名称和溶质质量分数
结论:所配制的溶液的溶质质量分数为。
反思:(实验中哪些因素会影响溶液的溶质质量分数)
②称量时,把称量物放在_ __盘。砝码放在盘
③称量物不能直接放在托盘上。称干燥固体药品时,必须___________;称易潮解的药品,必须放在__________里称量。
④称量质量一定的药品时,先把放在右盘,游码移至预定示数,再用药匙添加药品,直至天平平衡。
用量筒量取蒸馏水
①实验时不直接用天平称量液体的质量,而是换算成_________后用量筒量取。
化学探究实验报告
姓名:合作者:
班级:日期:
探究实验的名称:
探究实验的目的:
步骤名称
仪器
操作方法
1.
需要NaCl固体质量g;
水的体积ml(水的密度约为1g/ml)
2.
用托盘天平称量固体食盐
①用托盘天平称量前,首先应该把游码放在______处,检查天平是否左右平衡。如果天平未达到平衡,可以调节__________,使天平平衡。
做溶液配制实验报告(3篇)

第1篇实验名称:溶液配制实验目的:1. 熟悉溶液配制的基本操作方法。
2. 掌握使用量筒、容量瓶、移液管等仪器进行溶液配制的技巧。
3. 了解溶液浓度、摩尔浓度等基本概念。
实验原理:溶液配制是指将溶质按照一定比例溶解在溶剂中,形成一定浓度的溶液。
溶液的浓度可以用质量浓度、摩尔浓度等表示。
在实验中,我们通过准确称量溶质的质量、量取溶剂的体积,利用容量瓶、移液管等仪器进行溶液的配制。
实验仪器与试剂:1. 仪器:电子天平、量筒、容量瓶、移液管、烧杯、玻璃棒、滴定管、洗瓶、滤纸等。
2. 试剂:氯化钠、蒸馏水、氢氧化钠、硫酸等。
实验步骤:1. 称取一定质量的溶质。
根据实验要求,使用电子天平准确称取所需质量的溶质。
2. 量取一定体积的溶剂。
使用量筒量取所需体积的溶剂,倒入烧杯中。
3. 将溶质加入溶剂中。
将称量好的溶质小心地加入烧杯中的溶剂中,用玻璃棒搅拌至完全溶解。
4. 调整溶液体积。
将溶解后的溶液转移到容量瓶中,用蒸馏水冲洗烧杯和玻璃棒,将冲洗液一并转移到容量瓶中。
5. 定容。
向容量瓶中加入蒸馏水,至刻度线处。
用滴定管滴加蒸馏水,直至液面与刻度线相切。
6. 摇匀。
将容量瓶盖紧,倒置几次,使溶液混合均匀。
实验结果与分析:1. 实验结果:配制了一定浓度的溶液。
2. 结果分析:通过准确称量溶质的质量、量取溶剂的体积,以及使用容量瓶、移液管等仪器进行溶液的配制,成功配制了一定浓度的溶液。
实验讨论:1. 在溶液配制过程中,应注意避免溶质粘附在容器壁上,影响溶液的浓度。
2. 使用量筒、容量瓶、移液管等仪器时,要确保准确读取刻度,避免读数误差。
3. 在定容过程中,要注意液面与刻度线相切,避免液面高于刻度线。
实验总结:本次实验成功配制了一定浓度的溶液,掌握了溶液配制的基本操作方法。
通过实验,加深了对溶液浓度、摩尔浓度等基本概念的理解。
在实验过程中,需要注意操作细节,确保实验结果的准确性。
实验日期:____年__月__日实验人:____指导教师:____第2篇一、实验目的1. 熟悉溶液配制的基本操作方法。
如何配制一定溶质质量分数的溶液

综上所述,所得答案为:
24%的硝酸 钾溶液 示例 方案1 方案2 方案3 5 45 4 4 2%的硝酸钾 溶液 7 1 9 7 硝酸钾固体 水
点此播放教学视频
蒸发至有较多量 固体析出后,应 ,并用玻棒不断搅 拌,利用余热将余下溶液蒸发至干。 解析:本题主要考查了天平的使用,量筒的使用等 知识,天平称量时的读数方法是以游码左侧边缘为 标准的。量筒的取用是以量程略大于需取用的液体 体积的量筒为准。 答案: (1)10 ① B ② c (2)停止加热(或熄灭酒精灯) a
点此播放教学视频
2.考实验仪器
例4.(09东营市)以下是用8mL蒸馏水稀释浓硫 酸的实验操作过程,其中错误的环节是
解析:本题看似考查实验操作,实则考查仪器的使 用方法:量筒不能作为配制溶液的仪器。浓硫酸稀释 时应放在烧杯中。 答案:D
点此播放教学视频
例5.回答下列问题: (1)实验室配制100g 10%的氯化钠溶液时,需要 g氯化钠固体。 ①称量时如果用质量为23.1g的烧杯盛放固体,在托 盘天平上已放30g的砝码,则天平上的游码位置应是 右图的 (填字母) ②下列仪器中,量取水 时需要用到d和 仪器(填序号),溶解时需要用 到e和 仪器(填序号)。 a.烧杯、b.10mL量筒、c.100mL量筒、d.滴管、 e.玻璃棒、f.药匙、g.蒸发皿。
点此播放教学视频
3.考操作方法
例6.要配制100g溶质质量分数为10%的氯化钠溶液, 下列操作正确的是( ) A.将10g氯化钠固体直接放在天平的托盘上称量 B.量取90ml水时,俯视读数 C.为加快固体溶解,用温度计搅拌溶液 D.将配好的溶液倒入细口瓶中,盖紧瓶塞,贴上标签 解析:本题主要考查配制溶液的操作方法。使用天 平称量时不能将药品直接放在托盘上;量取液体时 要平视读数;温度计不能用来搅拌溶液。 答案:D
一定溶质质量分数的氯化钠溶液的配制实验报告单

一定溶质质量分数的氯化钠溶液的配制实验报告单实验名称:一定溶质质量分数的氯化钠溶液的配制一、实验目的:1.理解溶质的质量分数的概念;2.学习制备一定质量分数的氯化钠溶液的方法;3.掌握测量质量的准确方法。
二、实验原理:质量分数是溶液中溶质的质量与溶液总质量之比。
设氯化钠溶液的质量分数为x,则氯化钠的质量为x乘以溶液总质量。
质量分数的计算公式为:质量分数(x)=氯化钠质量/溶液总质量本实验采用蒸发法制备一定质量分数的氯化钠溶液,通过加热蒸发溶液中的水,使溶液浓缩,达到目标质量分数。
三、实验器材及试剂:1.氯化钠固体;2.蒸馏水;3.天平;4.烧杯;5.锥形瓶;6.镊子;7.加热器材;8.温度计。
四、实验步骤:1.准备工作:a.将所需器材清洗干净并晾干。
b.打开天平,将烧杯放在天平上,将天平调零。
c.使用镊子取一定质量的氯化钠固体,记录质量。
d.准备适量的蒸馏水。
2.配制溶液:a.将烧杯放在加热器上,将适量的蒸馏水倒入烧杯中。
b.将烧杯放在加热器上进行加热,同时搅拌溶液,直到观察到溶液开始沸腾。
c.一旦溶液开始沸腾,继续加热,直到溶液中的水蒸发至一定程度,使溶液浓缩。
3.测量质量:a.将烧杯从加热器上取下,放置到天平上,将天平调零。
b.将蒸发后的溶液慢慢倒入烧杯中,直到质量稳定。
c.记录溶液质量。
4.计算质量分数:a.使用质量分数公式计算氯化钠的质量分数。
b.记录计算结果。
五、实验数据记录:实验设置目标质量分数为0.2、实验过程中,取得的数据记录如下:质量分数x=氯化钠质量/溶液总质量=0.2质量分数x=0.2氯化钠质量=8g溶液总质量=40g六、实验结果与结论:通过本实验,成功地制备出了质量分数为0.2的氯化钠溶液。
七、实验讨论与思考:1.本实验使用的制备方法是蒸发法,理论上只有水分子被蒸发,而溶质的质量并不变化。
然而,实际操作中可能会有氯化钠固体溶解在水中,导致质量分数略高于理论值。
为了提高实验的准确性,可以在加热后加入少量蒸馏水,使溶液回溶,并进一步搅拌溶液以促进氯化钠的溶解。
溶液的配制实验实训报告

一、实验目的1. 掌握溶液的配制方法,熟悉常用化学试剂及仪器。
2. 熟悉容量瓶、移液管、托盘天平等仪器的使用方法。
3. 培养严谨、求实的科学作风,提高实验操作技能。
二、实验原理溶液的配制是指在一定体积的溶剂中溶解一定量的溶质,使溶液达到一定的浓度。
实验中常用的溶液配制方法有直接配制法和间接配制法。
直接配制法:将已知浓度的标准溶液稀释到所需浓度。
间接配制法:根据所需浓度和溶质的摩尔质量,计算所需溶质的质量,再进行配制。
三、实验用品1. 仪器:容量瓶、移液管、托盘天平、烧杯、玻璃棒、药匙、滤纸、胶头滴管等。
2. 试剂:氯化钠、蒸馏水、硫酸铜晶体、氢氧化钠等。
四、实验步骤1. 配制一定物质的量浓度的溶液(1)计算所需溶质的量:根据实验要求,计算所需溶质的物质的量,再根据摩尔质量计算所需溶质的质量。
(2)称量:使用托盘天平准确称取所需溶质的质量。
(3)溶解:将溶质放入烧杯中,加入少量蒸馏水,用玻璃棒搅拌使其溶解。
(4)移液:将溶解后的溶液转移到容量瓶中,用玻璃棒引流。
(5)洗涤:用少量蒸馏水洗涤烧杯和玻璃棒,将洗涤液一并转移到容量瓶中。
(6)定容:向容量瓶中注入蒸馏水至距离刻度线2~3cm处,改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线正好相切。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀溶液。
2. 配制一定质量分数的溶液(1)计算所需溶质和溶剂的质量:根据实验要求,计算所需溶质和溶剂的质量。
(2)称量:使用托盘天平准确称取所需溶质和溶剂的质量。
(3)溶解:将溶质放入烧杯中,加入适量的溶剂,用玻璃棒搅拌使其溶解。
(4)移液:将溶解后的溶液转移到容量瓶中,用玻璃棒引流。
(5)洗涤:用少量溶剂洗涤烧杯和玻璃棒,将洗涤液一并转移到容量瓶中。
(6)定容:向容量瓶中注入溶剂至距离刻度线2~3cm处,改用胶头滴管滴加溶剂至溶液凹液面与刻度线正好相切。
(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀溶液。
五、实验结果与分析1. 实验过程中,严格遵守操作规程,确保实验结果的准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学实验报告实验时间:年月日实验名称:一定溶质质量分数的氯化钠溶液的配制
九年级组长同组人姓名
实验目的:1、练习配制一定溶质质量分数的溶液
2、加深对溶质的质量分数概念的理解
实验用品:托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管;
氯化钠、蒸馏水
实验步骤:1、配制50g质量分数为6%的氯化钠溶液
(1)计算:NaCl:3 g 水:47 g
(2)称量:①用天平称量3gNaCl,倒入烧杯中
(3)量取:用量筒量取47ml 水,倒入盛有NaCl的烧杯中
(4)溶解:用玻璃棒搅拌,使NaCl 溶解。
2、配制50 g 质量分数为3%的NaCl溶液
用配好的质量分数为6%的NaCl 来配制
(1)计算:6%NaCl 溶液:25 g (体积24 ml)水:25g (体积25ml)(2)量取:用量筒量取所需的NaCl溶液和水
(3)混匀:用玻璃棒搅拌,混合均匀
3、装瓶,贴标签
4、整理卫生
实验装置图:
问题讨论:
1、用托盘天平称量NaCl时,有哪些注意事项?
答:(1)天平应放在水平桌面;
(2)天平两端各放一张规格一样的纸;
(3)称量前调节天平平衡。
2、用量筒量取液体,读数时应注意什么?
答:读数时视线要与液体凹液面最低处保持水平。
