第11章__溶出伏安法
溶出伏安法简介

1 2 3 4 5
溶出伏安法基本原理 阴极溶出伏安法 阳极溶出伏安法 影响溶出峰电流的因素 操作条件的选择
1 溶出伏安法基本原理
溶出伏安法又称反向溶出极谱法,被测的物质 在待测离子极谱分析产生极限电流的电位下电 解一定的时间,然后改变电极的电位,使富集 在该电极上的物质重新溶出,根据溶出过程中 所得到的伏安曲线来进行定量分析。
原理
3.1 阳极溶出伏安法应用
多壁碳纳米管修饰电极阳极溶出伏安法测定痕量银
图5 MWCNT修饰玻碳电极在pH4.0的NaAcHAc缓冲液中的线性扫描溶出伏安曲线
银阳极溶出峰
a.空白; b.a+1.5×10-5 mol/L Ag+. 扫描速率:100 mV/s 检测限:1 ×10-8mol/L
3.1 阳极溶出伏安法应用
检测限为3.46pg/mL
原理
图1 20ng/mlSe的溶出伏安图
(在酸性介质中富集) (在碱性介质中溶出)
———徐晖,张必成等.微分脉冲阴极溶出伏安法测定环境水样中的 痕量硒.环境化学[J],2001,20(4):387-391.
2.1 阴极溶出伏安法应用
峰电位-0.804V
在CuCI 底液中,As ( Ⅲ )与Cu (Ⅱ)在悬汞电极上形成配合物, 在0. 804 V 产生稳定而重现性好的 溶出峰
5 操作条件的选择
1) 底液 一定浓度的电解质溶液(盐浓度增加,峰电流降低); 2) 预电解电位 比半波电位负0.2~0.5 V,或由实验确定; 3) 预电解时间 预电解时间长可增加灵敏度, 但线性关系差; 4) 除氧 通N2或加入Na2SO3
3 阳极溶出伏安法
富集时工作电极为阴极,溶出时工作电极为阳 极的伏安法称为阳极溶出伏安法,多用于测定 金属离子。
利用阳极溶出伏安法测定水体钴元素

利用阳极溶出伏安法测定水体钴元素阳极溶出伏安法(ADSV)是一种常见的电化学技术,通常用于计量水体中微量金属元素的含量。
本文将介绍如何利用ADSV测定水体中的钴元素含量。
1. 实验原理ADSV是一种交流伏安法,在该方法中,阳极表面会形成一层氧化产物,并生成电流。
随着电势的增加,阳极表面产生更多的氧化产物,导致电流增加。
这个过程被称为“阳极溶出”,它的速率与阳极表面的光电活性物质的浓度成正比。
钴元素属于光电活性物质之一,使用ADSFA 可以将其转化成阳极溶出的电流信号。
通过测量反应的电流和电位,可以通过标准添加法确定钴元素的浓度。
2. 实验步骤a. 准备电极将参比电极、工作电极和对电极分别插入每个电极开孔中(工作电极应为钴材料)。
b. 准备测试溶液准备一系列浓度不同的钴离子溶液,浓度应为0.01mg / L至1.00mg / L。
c. 实验操作① 确定初始电位将电势稳定在-0.50 V。
② 进行扫描逐步增加反应电流,进行线性扫描,保持扫描速率不变。
③ 记录数据在达到峰值电流时,记录反应电流和电位数据。
④ 数据分析将数据插入标准添加法的公式中,计算出钴离子的浓度。
3. 实验注意事项a. 实验过程中需要保证操作环境无污染,选用无氧水或去离子水进行稀释和清洗。
b. 应用标准添加法时,要进行多次测量并取平均值。
c. 注意保护好电极,避免硬物与电解质溶液接触,防止电极损坏。
4. 总结ADSV法是一种利用阳极溶出法测定水体钴元素含量的常见技术。
本文介绍了该方法的实验步骤并提醒了需要注意的事项,希望读者可以通过学习本文掌握此测量方法,为精密检测水体含钴量提供可靠的数据支持。
溶出伏安法

一、阳极溶出伏安法(用于金属离子的测量)
溶出伏法包含电解富集和电解溶出两个过程。
1、电解富集
在选定的恒定电位下,对待测溶液进行电解,将溶液中的痕
量待测物富集到电极表面的过程。
待测金属离子通过电解还原成金属,与汞电极形成
汞齐(或者直接将金属沉积在惰性电极表面)富集过程表示
富集
为
Mn+ + ne + Hg
溶出伏安法(stripping voltammetry)是先将待测物质 预电解富集在电极表面,然后施加反向电压使富集的物质
重新溶出,根据溶出过程的伏安曲线进行分析的方法。
分类: 1.一般溶出伏安法 阴极溶出伏安法:阳极富集,阴极溶出 阳极溶出伏安法:阴极富集,阳极溶出 2.吸附溶出伏安法:吸附作用富集
记录所得的电流-电位曲线,称为溶出曲线。
11:15:34
溶出伏安曲线呈峰状,如下图所示。曲线中峰尖对应的电流
称峰电流(ip—定量分析依据)、对应的电位称峰电位(φP— 定性分析依据)。
11:15:34
3、溶出峰电流公式
溶出峰电流与电极类型和被测物质
浓度的关系(对汞膜电极):
ip = K’n2AD2/3ω1/2 u-1/6 tvc
2. 阴极溶出伏安法(CSV): 工作电极上还原 反应
例:S2-+Hg-2e = HgS (-0.4V阳极富集)
阴极溶出(-0.4V→-1.0V,阴极线性扫描,HgS 还原)
应用:测阴离子S2-、Cl-、Br-、I-等
3. 吸附溶出法:吸附富集→溶出 溶出:正向或负向扫描→对称峰形波 ip=Kc
M(Hg)溶出11:5:34为了提高富集效果,可同时使电极旋转或搅拌溶液,以加快 被测物质输送到电极表面,富集物质的量则与电极电位、电 极面积、电解时间和搅拌速度等因素有关。
阳极溶出伏安法
阳极溶出 是以一定的方式使微电极的电位由负向正的方向 移动,使电极内的金属重新氧化而产生氧化电流的过程。 如果在单扫描极谱仪上进行阳极溶出,则在悬汞电极上得 到的溶出峰电流为: 式中 A为电极面积;DHg为金属在汞中的扩散系数;v为溶 出时电极电位改变的速率。 由以上公式可知,最后得到的溶出峰电流不但决定于 被测金属的浓度,也决定于预电解的时间、搅拌速度、悬 汞的半径和溶出时电极电位改变的速率。因此,要使实验 结果的重现性好,必须严格控制实验条件。
预电解是一个富集过程,预电解的时间愈长,溶出的时间愈短,则灵敏度 愈高,能把已有的极谱法的灵敏度提高2~4个数量级。如果预电解的时间 为τ,预电解电流为I,溶出时间为t,溶出的峰电流为ip,则得: 如果τ》t,则ip》I。在单扫描极谱仪和脉冲极谱仪上进行阳极溶出,则溶 出的时间很短,灵敏度很高,示差脉冲极谱阳极溶出伏安法能测定的浓度可 低到10-12摩/升。
Hale Waihona Puke 出伏安法中的工作电极• 机械挤压式悬汞电极 • 挂吊式悬汞电极 • 汞膜电极 • 金属电极
溶出伏安法的实际应用
• Sn^2+的溶出峰电流与其浓度在2×10^-7 1×10^-4mol/L范围内呈良好的线性关系,
溶出伏安法: 溶出伏安法:是一种灵敏度高的电化学分析方法10-7-10-11,有时可达10-12 , 因此在 痕量成分分析中相当重要。可连续测定一定浓度范围的重金属Cd,Pb,Cu;而且方 法灵敏度高,精密度好,线性相关系数可达0,9990,回收率达85-115%, 获得了良好的分析效果
• 阳极溶出伏安法(ASV)首先发明于19世纪二 十年代,并于1959年为其发明者 Jaroslav Heyrovsky 赢得了诺贝尔化学奖。
而且方法灵敏度高精密度好线性相关系数可达回收率达获得了良好的分析效果?定义预先在恒定的电位相当于该离子的阴极上产生极限电流的电位下将被测物富集在电极上然后使微电极的电位由负向正的方向移动富集的物质反向溶出阳极溶出并通过伏安曲线进行测定的方法
阳极溶出伏安法测定水中微量汞

阳极溶出伏安法测定水中微量汞(1)摘要:介绍了阳极溶出伏安法测定地表水和工业废水中微量汞及总汞的方法。
该法操作简单、快速、可靠,使用仪器成本低廉、检测灵敏度高。
关键词:伏安法地表水微量汞地表水体中汞主要来源于贵金属冶炼、机电制造、氯碱化工、制药等工业企业排放的工业废水。
国家制定的工业废水排放标准中对汞的要求最为严格:汞的含量≤0.05 mg/L,而农业灌溉、Ⅳ—Ⅴ类地表水体及饮用水中汞的最高允许浓度≤0.001 mg/L,因此检测地表水体中的微量汞很有必要。
伏安法测定地表水体中微量汞技术,具有抗干扰能力强、灵敏度高、快速、成本低等特点,其相对标准误差为5%~7%,适用于地表水体、工业废水中微量汞的检测。
1 测定原理伏安法测定汞分为两个过程:①电沉积过程。
在一定的外加电压下,电解质溶液中的金离子首先被还原沉积在电极表面,随后被测金属离子被还原并沉积在金膜上,这是一个富集过程;②溶出过程。
电沉积过程结束后,工作电极电位从负向正的方向扫描,这时沉积的金属就从电极上溶出,这是一个很快的过程,从而获得很大的溶出电流。
根据溶出电流峰的出峰电位和峰高作定性、定量分析。
2 试验方法2.1 仪器试剂SVA—1型示波伏安仪,XWT—264型记录仪,饱和KCl—AgCl电极为参比电极,玻碳电极为工作电极。
汞标准溶液:称取1.354 0 g氯化汞固体,用水溶解后移入1 000 mL容量瓶,稀释至1 L,浓度为1 mg/L。
三氯化金:2×10-3 mol/L,盐酸:2.0 mol/L,用石英亚沸蒸馏水配溶液,高纯氮气除氧。
2.2 底液选择底液对金属离子的峰电位和峰电流有较大影响,选择最佳底液能提高方法的灵敏度。
试验表明,在盐酸溶液中汞的溶出峰值比在硫酸、硝酸溶液中高,而盐酸溶液浓度为2.0 mol/L时较理想,由此选择2.0 mol/L盐酸溶液及2.0×10-3 mol/L三氯化金为最佳底液。
在此底液下-0.4 V电位处通氮气除氧60 s、富集60 s、静置30 s后,以100 MV/s的速度扫描至 1.0 V,记录峰形。
溶出伏安法

一、实验目的1.熟悉溶出伏安法的基本原理。
2.掌握汞膜电极的使用方法。
3.了解一些新技术在溶出伏安法中的应用。
二、方法原理溶出伏安法的测定包含两个基本过程。
即首先将工作电极控制在某一条件下,使被测物质在电极上富集,然后施加线性变化电压于工作电极上,使被富集的物质溶出,同时记录电流(或者电流的某个关系函数)与电极电位的关系曲线,根据溶出峰电流(或者电流函数)的大小来确定被测物质的含量。
溶出伏安法主要分为阳极溶出伏安法,阴极溶出伏安法和吸附溶出伏安法。
本实验采用溶出伏安法测定水中的Pb(Ⅱ)、Cd(Ⅱ),其两个过程可表示为:M2+(Pb2+、Cd2+)+2e-+Hg M(Hg)本法使用玻碳电极为工作电极,采用同位镀汞膜测定技术。
这种方法是将分析溶液中加入一定量的汞盐(通常是10-5~10-4mol·L-1Hg(NO3)2),在被测物质所加电压下富集时,汞与被测定物质同时在玻碳电极的表面上析出形成汞膜(汞齐)。
然后在反向电位扫描时,被测物质从汞中“溶出”,而产生“溶出”电流峰。
在酸性介质中,当电极电位控制位-1.0V(sv.SCE)时,Pb2+、Cd2+与Hg2+离子同时富集在玻碳工作电极上形成汞齐膜。
然后当阳极化扫描至-0.1V时,可得到两个清晰的溶出电流峰。
铅的波峰电位约为-0.4V左右,而镉的为-0.6V左右(sv.SCE)。
如图11—11所示。
本法可分别测定低至10-11 mol·L-1的铅、镉离子。
三、仪器和试剂a) 伏安仪(最好选择具有导数电流方式,或半微分电流方式的新型伏安仪)。
b) x—y函数记录仪。
c) 玻碳工作电极、甘汞参比电极及铂辅助电极组成测量电极系统。
d) 磁力搅拌器;秒表。
e) 1.0×10-2 mol·L-1铅离子标准储备溶液。
f) 1.0×10-2 mol·L-1镉离子标准储备溶液。
g) 5×10-3mol·L-1硝酸汞溶液。
第11章-溶出伏安法

1)阳极溶出伏安法
待测离子在阴极上预电解富集,溶出时发生氧化反应
而重新溶出,产生
电解
M n++ne-+Hg
溶出
M(Hg)
溶出时,工作电极上发生的是氧化反应称为阳极溶出 伏安法
在测定条件一定时,峰电流与待测物浓度成正比
i c p 0
i Kc p 0
溶出过程中电极发生的反应为: M(Hg) - ne-= M n+ +Hg (氧化反应)
富集完毕后, 再使悬汞电极的电位由负向正均匀地变 化, 形成了峰形伏安曲线.
i
+
0
-
/V
Cu
2+Pb2+Cd2+
1. 基本原理
溶出安伏法包含电解富集和电解溶出两个过程.首先 是电解富集过程.它是将工作电极固定在产生极限电流电
位进行电解,使被测物质富集在电极上.为了提高富集效
果,可同时使电极旋转或搅拌溶液,以加快被测物质输送 到电极表面.富集物质的量则与电极电位、电极面积、电 解时间和搅拌速度等因素有关。
例:
测定盐酸溶液中微量Cu2+(5×10-7 mol· L-1) Pb2+ (1×10-5 mol· L-1)和 Cd2+(5×10-7 mol· L-1) 先在-0.8 V的外加电压下进行恒电压电解, 3min后,溶 液中一部分Cu2+、 Pb2+ 、 Cd2+在悬汞电极上还原, 生成汞齐,富集在汞滴上
②休止期-目的是使电极上的电解沉积物均匀分布。减小电 解电流或停止搅拌一定时间。一般为3-4分钟。
③溶出-目的是产生溶出伏安曲线。溶出过程的电位变化方 向与预电解过程相反;对于阳极溶出来说,工作电极电位逐 渐变正;对于阴极溶出来说,工作电极电位逐渐变负。
阴极溶出伏安法简介

阴极溶出伏安法简介
目录
•1拼音
•2英文参考
•3注解
•4参考资料
1拼音
yīn jí róng chū fú ān fǎ
2英文参考
cathodic stripping voltammetry[WS/T 455—2014 卫生监测与评价名词术语]
3注解
阴极溶出伏安法是指工作电极在富集过程中作为阳极,在溶出过程中作为阴极的伏安法。
用于测定不能生成汞齐的金属离子、阴离子和有机生物分子的方法,通过待测离子在一定条件下与其他已知配体(或离子)生成难溶化合物而在电极表面进行富集,然后电向反方向扫描,难溶化合物溶脱产生电流的方式进行测量的[1]。
4参考资料
1.^ [1] 中华人民共和国国家卫生和计划生育委员会.WS/T 455—2014 卫生监测与评价名词术语[Z].20141115.
免责声明:本文内容来源于网络,不保证100%正确,涉及到药方及用法用量的问题,不保证正确,仅供参考。
由此造成的问题,本站概不负责。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
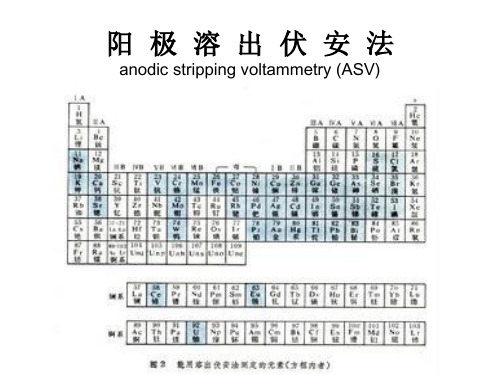
周期表中已有:31种元素能进行阳极溶出
15种元素能进行阴极溶出 7种元素能进行阳极和阴极溶出
1)阳极溶出伏安法
待测离子在阴极上预电解富集,溶出时发生氧化反应
而重新溶出,产生
电解
M n++ne-+Hg
溶出
M(Hg)
溶出时,工作电极上发生的是氧化反应称为阳极溶出 伏安法
在测定条件一定时,峰电流与待测物浓度成正比
i pc0
i p Kc0
溶出过程中电极发生的反应为: M(Hg) - ne-= M n+ +Hg (氧化反应)
hS c S VS cS K (VS VX )hS hX VX
7. 溶出伏安法的工作电极
汞电极:挤压式悬汞电极、挂吊式悬汞电极、 汞膜电极(以石墨电极为基质,在其表面上镀 上一层汞得到)。 其它固体电极:玻碳电极、铂电极和金电极等。 汞电极不适合在较正电位下工作,而固体电极 则可以。
溶出伏安法的优点、测定范围,检测限
溶出伏安法有很高的灵敏度,主要是由于经过长时间的
预电解,将被测物质富集浓缩的缘故。
阳极溶出法的测定范围在10-6~10-11 mol/L,同时有较好 的精度,检出限可达10-12 mol/L,它能同时测定几种含量在 ppb甚至ppt级范围内的元素,而不需要特别贵重的仪器。
i (-)
富集
E (+) h 溶出
阳极溶出伏安法电流电压曲线
2)阴极溶出伏安法
溶出时工作电极上发生的是还原反应,称为阴极溶出伏安法 例如:用阴极溶出伏安法测溶液中痕量S2-
以0.1 mol· -1NaOH溶液为底液,于-0.4V电解一定时间,悬汞 L 电极上便形成难溶性的HgS
Hg+S2-=HgS+2e 溶出时,悬汞电极的电位由正向负方向扫描,当达到HgS的还 原电位时,由于 下列还原反应,得到阴极溶出峰 HgS+2e- = Hg+S2- (还原反应) 阴极溶出伏安法可用于测定一些阴离子Cl-, Br-, I-, S2-, C2O42-
富集完毕后, 再使悬汞电极的电位由负向正均匀地变 化, 形成了峰形伏安曲线.
i
+
0
-
/V
Cu
2+
Pb
2+
Cd
2+
1. 基本原理
溶出安伏法包含电解富集和电解溶出两个过程.首先 是电解富集过程.它是将工作电极固定在产生极限电流电
位进行电解,使被测物质富集在电极上.为了提高富集效
果,可同时使电极旋转或搅拌溶液,以加快被测物质输送 到电极表面.富集物质的量则与电极电位、电极面积、电 解时间和搅拌速度等因素有关。
2. 基本过程:
①预电解-目的是富集。在一定底液和搅拌条件下,进行恒 电位电解,将被分析物富集于工作电极上。富集物质的量与 电解的电极电位、电极面积、电解时间和搅拌速度等因素有 关。 其预电解电位,在理论上应比该条件下的半波电位负0.2/n伏; 在实际上应比该条件下的半波电位负0.2-0.5伏。 电解时间,因电极的种类和被分析物的浓度不同而不同。一 般说来,对一定的电极而言,被分析物的浓度愈低预电解时 间愈长。对悬汞电极,当浓度为10-6mol/L时,需要5分钟; 10-9mol/L时,需要60分钟。
4. 影响溶出峰电流的因素
1).富集过程
化学计量: 被测物完全电积在阴极上。 精确性好,时间长; 非化学计量(常用方法): 约 2%~3%电积在阴极上; 在搅拌下,电解富集一定时间。
2).溶出过程
扫描电压变化速率保持恒定。
5.操作条件的选择
1). 底液
一定浓度的电解质溶液(盐浓度增加,峰电流降低);
②休止期-目的是使电极上的电解沉积物均匀分布。减小电 解电流或停止搅拌一定时间。一般为3-4分钟。
③溶出-目的是产生溶出伏安曲线。溶出过程的电位变化方 向与预电解过程相反;对于阳极溶出来说,工作电极电位逐 渐变正;对于阴极溶出程中,电极性质的变化分为: 阳极溶出伏安法:富集时工作电极为阴极,溶出时工作电极 为阳极的伏安法称为阳极溶出伏安法(多用于测定金属离 子)。 阴极溶出伏安法:富集时工作电极为阳极,溶出时工作电极 为阴极的伏安法称为阴极溶出伏安法(一般用于卤素、硫等 阴离子测定)。 计时电位溶出伏安法-记录恒电流电解条件下的电位-时间 曲线的伏安法。
例:
测定盐酸溶液中微量Cu2+(5×10-7 mol· -1) Pb2+ L (1×10-5 mol· -1)和 Cd2+(5×10-7 mol· -1) L L 先在-0.8 V的外加电压下进行恒电压电解, 3min后,溶 液中一部分Cu2+、 Pb2+ 、 Cd2+在悬汞电极上还原, 生成汞齐,富集在汞滴上
2). 预电解电位
比半波电位负0.2~0.5 伏;或实验确定;
3). 预电解时间
预电解时间长可增加灵敏度, 但线性关系差;
4). 除氧
通N2或加入Na2SO3 。
6.定量方法
测量峰高:略 标准曲线法:略 标准加入法:
hX K c X c S VS c X V X hS K VS V X
