溶出伏安法与电位溶出法
合集下载
第十二章伏安法与电位溶出法(45)

28
29
30
(二)溶出 静止0.5min~1min,施加反向扫描电压,记录曲线。
(三)定量分析依据
峰尖对应电位称为峰电位 p ,电流i p 是定量依据。
31
悬汞电极: 汞膜电极:
条件一定时:
32
(四)溶出峰电流影响的因素 1. 富集电位 控制在比待测离子峰电位负0.2V~0.4V
2. 搅拌速度: i p v ,常用的有电磁搅拌、旋转电极、
恒电流溶出或加入Hg2+为氧化剂时,待测溶液应作通氮 处理,并保持溶液上方为氮气氛围,以防止溶解氧的干扰。
40
二、电位溶出曲线 包括常规电位溶出、微分电位溶出(differential
potentiometri stripping analysis),前者是记录 t 曲线,后者是记录 dt d 或 d dt t 曲线。 (一)常规电位溶出
mh
t 1 h
22
2
2
ic m 3 t 3 h 3 h 3 h0
23
二、氢催化波 某些物质在酸性或缓冲溶液中能降低氢的超电位,比正
常氢波更正的电位下还原,形成氢催化波(hydrogen catalytic wave)。氢催化波高随催化剂的加入量的增加而增 加,形成比催化剂本身的扩散电流大的多的催化电流。
34
汞膜电极(mercury film electrode):汞膜薄,比表面积 大,汞膜牢固,可快速搅拌,富集效率高,灵敏度比悬汞电 极提高3个数量级。缺点: 形成互化物,汞膜均匀性难控制。
2. 固体电极: 碳质电极与贵金属电极如:Ag、Au、 Hg、Pt、As的测定
3. 化学修饰电极:电极表面具有特殊的化学基团,选择 性的富集分子,提高选择性和灵敏度。
29
30
(二)溶出 静止0.5min~1min,施加反向扫描电压,记录曲线。
(三)定量分析依据
峰尖对应电位称为峰电位 p ,电流i p 是定量依据。
31
悬汞电极: 汞膜电极:
条件一定时:
32
(四)溶出峰电流影响的因素 1. 富集电位 控制在比待测离子峰电位负0.2V~0.4V
2. 搅拌速度: i p v ,常用的有电磁搅拌、旋转电极、
恒电流溶出或加入Hg2+为氧化剂时,待测溶液应作通氮 处理,并保持溶液上方为氮气氛围,以防止溶解氧的干扰。
40
二、电位溶出曲线 包括常规电位溶出、微分电位溶出(differential
potentiometri stripping analysis),前者是记录 t 曲线,后者是记录 dt d 或 d dt t 曲线。 (一)常规电位溶出
mh
t 1 h
22
2
2
ic m 3 t 3 h 3 h 3 h0
23
二、氢催化波 某些物质在酸性或缓冲溶液中能降低氢的超电位,比正
常氢波更正的电位下还原,形成氢催化波(hydrogen catalytic wave)。氢催化波高随催化剂的加入量的增加而增 加,形成比催化剂本身的扩散电流大的多的催化电流。
34
汞膜电极(mercury film electrode):汞膜薄,比表面积 大,汞膜牢固,可快速搅拌,富集效率高,灵敏度比悬汞电 极提高3个数量级。缺点: 形成互化物,汞膜均匀性难控制。
2. 固体电极: 碳质电极与贵金属电极如:Ag、Au、 Hg、Pt、As的测定
3. 化学修饰电极:电极表面具有特殊的化学基团,选择 性的富集分子,提高选择性和灵敏度。
溶出伏安法

电位溶出分析法是在一定的电位下将被 测定的物质预先富集在工作电极上,例 如在汞电极上形成汞齐。然后断开电路, 同时利用溶液中特定的化学物质与工作 电极上已被富集的组分通过化学反应而 被溶出,记录溶出过程电位随时间变化 的曲线,从而获得被测定物质的浓度。 电位溶出伏安法也主要测定金属离子。 比阳极溶出伏安法有更高的灵敏度。
电极过程动力学研究n,D,C,E0,ks
研究吸附现象
复杂电极反应的过程
研究药物分析
化学生物学
阴极溶出伏安法可用于卤素、硫、 钨酸根等阴离子的测定。测定许多 能够与汞形成不溶性盐的有机和无 机化合物,能用该法测定的离子有 CN-,SCN-,C2O42-,S2-,VO3-, 卤素离子等,例如用Nafion/粘土 修饰电极在流动体系中测定S2- 。
极 谱 还 原 电 流 溶 出 氧 化 电 流
电 解 过 程
溶 出 过 程
阴极溶出分析法,有人将其 称之为阳极溶出伏安法的镜 像技术,其富集是氧化过程, 溶出是还原过程,它包括被 分析物的阳极沉积,伴随着 负向电位扫描溶出。Ag + 和 Hg 2+ 可以与很多阴离子生成 难溶盐,所以阴极溶出分析 法所用的电极常选用汞电极 和 银 电 极 。
利用被测定物质在一定电位下的 吸附性,经一定时间后被吸附物 质在电极表面被浓集,然后选择 合适的电化学分析方法测定吸附 物质的量,称为吸附溶出分析法。 包括吸附物的形成、吸附性积聚 浓缩和金属的表面活性络合物的 还原。
定量分析——广泛用于无机和有机化合物的测定, 可进行40多种元素的定量测定
阳极
阴极
溶出伏 安法
电位 吸附
溶出伏安法的操作主要分为两步:第一步是 预电解,第二步是溶出。预电解在恒电位 和搅拌溶液的条件下进行的,搅拌溶液是 为了保证去极剂不断地从溶液向电极输送。 预电解是为了富集,富集之后停止搅拌, 让溶液静止30-60秒,这段时间称为休止期, 休止期后再进行溶出
溶出伏安法

11:15:34
一、阳极溶出伏安法(用于金属离子的测量)
溶出伏法包含电解富集和电解溶出两个过程。
1、电解富集
在选定的恒定电位下,对待测溶液进行电解,将溶液中的痕
量待测物富集到电极表面的过程。
待测金属离子通过电解还原成金属,与汞电极形成
汞齐(或者直接将金属沉积在惰性电极表面)富集过程表示
富集
为
Mn+ + ne + Hg
溶出伏安法(stripping voltammetry)是先将待测物质 预电解富集在电极表面,然后施加反向电压使富集的物质
重新溶出,根据溶出过程的伏安曲线进行分析的方法。
分类: 1.一般溶出伏安法 阴极溶出伏安法:阳极富集,阴极溶出 阳极溶出伏安法:阴极富集,阳极溶出 2.吸附溶出伏安法:吸附作用富集
记录所得的电流-电位曲线,称为溶出曲线。
11:15:34
溶出伏安曲线呈峰状,如下图所示。曲线中峰尖对应的电流
称峰电流(ip—定量分析依据)、对应的电位称峰电位(φP— 定性分析依据)。
11:15:34
3、溶出峰电流公式
溶出峰电流与电极类型和被测物质
浓度的关系(对汞膜电极):
ip = K’n2AD2/3ω1/2 u-1/6 tvc
2. 阴极溶出伏安法(CSV): 工作电极上还原 反应
例:S2-+Hg-2e = HgS (-0.4V阳极富集)
阴极溶出(-0.4V→-1.0V,阴极线性扫描,HgS 还原)
应用:测阴离子S2-、Cl-、Br-、I-等
3. 吸附溶出法:吸附富集→溶出 溶出:正向或负向扫描→对称峰形波 ip=Kc
M(Hg)溶出11:5:34为了提高富集效果,可同时使电极旋转或搅拌溶液,以加快 被测物质输送到电极表面,富集物质的量则与电极电位、电 极面积、电解时间和搅拌速度等因素有关。
一、阳极溶出伏安法(用于金属离子的测量)
溶出伏法包含电解富集和电解溶出两个过程。
1、电解富集
在选定的恒定电位下,对待测溶液进行电解,将溶液中的痕
量待测物富集到电极表面的过程。
待测金属离子通过电解还原成金属,与汞电极形成
汞齐(或者直接将金属沉积在惰性电极表面)富集过程表示
富集
为
Mn+ + ne + Hg
溶出伏安法(stripping voltammetry)是先将待测物质 预电解富集在电极表面,然后施加反向电压使富集的物质
重新溶出,根据溶出过程的伏安曲线进行分析的方法。
分类: 1.一般溶出伏安法 阴极溶出伏安法:阳极富集,阴极溶出 阳极溶出伏安法:阴极富集,阳极溶出 2.吸附溶出伏安法:吸附作用富集
记录所得的电流-电位曲线,称为溶出曲线。
11:15:34
溶出伏安曲线呈峰状,如下图所示。曲线中峰尖对应的电流
称峰电流(ip—定量分析依据)、对应的电位称峰电位(φP— 定性分析依据)。
11:15:34
3、溶出峰电流公式
溶出峰电流与电极类型和被测物质
浓度的关系(对汞膜电极):
ip = K’n2AD2/3ω1/2 u-1/6 tvc
2. 阴极溶出伏安法(CSV): 工作电极上还原 反应
例:S2-+Hg-2e = HgS (-0.4V阳极富集)
阴极溶出(-0.4V→-1.0V,阴极线性扫描,HgS 还原)
应用:测阴离子S2-、Cl-、Br-、I-等
3. 吸附溶出法:吸附富集→溶出 溶出:正向或负向扫描→对称峰形波 ip=Kc
M(Hg)溶出11:5:34为了提高富集效果,可同时使电极旋转或搅拌溶液,以加快 被测物质输送到电极表面,富集物质的量则与电极电位、电 极面积、电解时间和搅拌速度等因素有关。
第十章 溶出伏安法和电位溶出法

边,用盐桥与电解池连接。
去极化电极的必要条件:电极表面积要大,通过的电流 (密度)要小,可逆性要好。
09:08:41
二、基本原理
1、极谱分析过程(极谱的形成)
d e
以测定0.001 mol·L-1的Cd2+为例
电解池中还含有0.1 mol·L-1的
c
KCl(支持介质)、1%动物胶(极大 抑制剂)说明极谱波的形成。 被测溶液中溶解氧,也能在DME 上还原产生电流,因此,需预先 通入惰性气体除去。记录i-V曲线
定性分析依据)。
3、溶出峰电流公式 溶出峰电流与电极类型和被测物质 浓度的关系(对汞膜电极): ip = K’n2AD2/3ω 1/2 u-1/6 tvc n—电极反应电子转移数 A—电极面积 D—金属在汞齐中扩散系数 t—富集时间 μ —溶液黏度 ω —电极旋转速度 v—电位扫描速度 c —待测物质浓度
1、电极材料自身电化学氧化后与被测阴离子形成难溶膜 Ag Ag+ + e 电极反应
Ag+ + X-
AgX↓
化学反应
Ag + X-
AgX ↓ + e
电解富集总反应
AgX + e
09:08:41
Ag + X-
溶出反应
2、被测变价金属离子与试剂在电极上形成难溶膜
富集过程:
Fe2+
Fe3++3OH- 溶出过程:
一、阳极溶出伏安法
二、阴极溶出伏安法
三、溶出伏安法装置
四、定量分析方法
溶出伏安法(stripping voltammetry)是先将待测物质 预电解富集在电极表面,然后施加反向电压使富集的物质重 新溶出,根据溶出过程的伏安曲线进行分析的方法。
伏安法和电位溶出法

在某一时刻,滴汞电极表面的情况可用
波的形成过程可
分为三个部分。
1.残余电流部分
图中AB段。这时,阴极 电位尚未达到Cd2+的析出 电位,电解还没有发生, 溶液中只有微小的电流 流过电解池,此电流称 为残余电流。
图6-4 镉的极谱图
2.电流上升部分
BD段。当外加电压继续 增加,使阴极电位达到 Cd2+的析出电位时,Cd2+ 开始在滴汞电极上还原 析出金属镉,并与汞生 成汞齐。电极反应如下:
平衡时的电极电位,两者之间出现偏 差,产生极化。这种由浓度差别所引 起的极化,称为浓差极化。
例如,把两个铜电极插入浓度为c 的硫酸铜酸性溶液中进行电解。电解 开始后,阴极附近的Cu2+离子将被还 原析出到电极上,使阴极表面附近溶 液中的Cu2+离子浓度不断降低。结果 使本体溶液中和阴极表面附近溶液中 的Cu2+离子浓度有了浓差。
在阳极,Cu将被氧化而溶解到溶液中。 同样,如果溶解速度大于扩散速度, 将会使电极表面附近溶液中Cu2+离子浓 度大于本体溶液中的Cu2+离子浓度,结 果电极电位变得更正。
降低电流密度、增高溶液温度或进行 搅拌可减小浓差极化。
(二)电化学极化 电化学极化是由于电极反应迟缓引
起的。整个电极过程非常复杂,通常有 几个步骤组成,有气体产生的电极反应 尤其如此。整个电极过程的速度决定于 速度最慢的一步。许多情况下,电极反 应是最慢的一步,为限速步骤。当外加
(二)极谱分析过程和极谱波
现以测定溶液中的微量Cd2+为例,说明极谱 分析过程。在电解池中加入1×103 mol/L的 CdCl2溶液,加入比待测离子含量高50~ 100倍的另一电解质(如KCl),此电解质 称为支持电解质;再加入1%的动物胶(称 为极大抑制剂)几滴;插入两支电极,按 上图所示的装置连接。
电分析化学技术测试食品中的重金属元素

女 ,汉族 ,博 士后 ,教授 ,硕 士生导师 。重庆大学食品科学硕士 点学科 带头人,曾
在美 国密歇根大学 化学 系作 访问学者 ,《 t ra n o ra o o d S n e& I e n t a Ju n f F o c c n i I o I i e
Tc n Ig > U )评 审专 家 、 《 品 与生 物技 术 学 报 》 评 审 专 家 和 《 品 研 究 与 开 发 》 e h o o y>( K 食 食 杂 志 ( 心 期 刊 )编 委 。 核 教 学 与 科 研 工 作 :主 要 从 事 应 用 化学 和 食 品科 学 等 领 域 的 教 学 与 科 学 研 究工 作 。近
年获得教育部科技进步二等奖一次 ;主持重庆 市科 委课题 “栀子天蓝色色素稳定机理的
离子 的电分析检测 ;苏丹红 的电分析检 测的研究 ;食品天然抗氧剂如 姜酚抗 氧电化 学动力
学 研 究 ;微 量 元 素 ( 、 Cr Mn )对 植 物 营 养效 应 的研 究 。 我 们 将 继 续 致 力于 研 究 学 术 。切 合
社会需求 ,积极开拓食品科学研 究的新 发展。
刘成伦
电分析化学技术测试食品中的重金属元素
刘成伦 ( 重庆大学 化学化工学院 ,重庆 4 0 3 ) 0 0 0
食品中重 金属元素的检测方法很 多,常见 的有分光光度 法、原子吸收光谱法 、电感耦
合法 、离子体原子发射光谱法等 。电化 学分析法是建立在物质在溶液 中的电化学性质基础 上的一类仪器分析方法 ,因具有 设备简单、分析速度快 、灵敏度高 、选择性 好等优点 而在
极 ,通 过 测 定 电解 过程 中 的 电 流 一 电压 曲线 来 进 行 定 量 分 析 , 目前 应 用 比较 广 泛 的 有 极 谱 催
在美 国密歇根大学 化学 系作 访问学者 ,《 t ra n o ra o o d S n e& I e n t a Ju n f F o c c n i I o I i e
Tc n Ig > U )评 审专 家 、 《 品 与生 物技 术 学 报 》 评 审 专 家 和 《 品 研 究 与 开 发 》 e h o o y>( K 食 食 杂 志 ( 心 期 刊 )编 委 。 核 教 学 与 科 研 工 作 :主 要 从 事 应 用 化学 和 食 品科 学 等 领 域 的 教 学 与 科 学 研 究工 作 。近
年获得教育部科技进步二等奖一次 ;主持重庆 市科 委课题 “栀子天蓝色色素稳定机理的
离子 的电分析检测 ;苏丹红 的电分析检 测的研究 ;食品天然抗氧剂如 姜酚抗 氧电化 学动力
学 研 究 ;微 量 元 素 ( 、 Cr Mn )对 植 物 营 养效 应 的研 究 。 我 们 将 继 续 致 力于 研 究 学 术 。切 合
社会需求 ,积极开拓食品科学研 究的新 发展。
刘成伦
电分析化学技术测试食品中的重金属元素
刘成伦 ( 重庆大学 化学化工学院 ,重庆 4 0 3 ) 0 0 0
食品中重 金属元素的检测方法很 多,常见 的有分光光度 法、原子吸收光谱法 、电感耦
合法 、离子体原子发射光谱法等 。电化 学分析法是建立在物质在溶液 中的电化学性质基础 上的一类仪器分析方法 ,因具有 设备简单、分析速度快 、灵敏度高 、选择性 好等优点 而在
极 ,通 过 测 定 电解 过程 中 的 电 流 一 电压 曲线 来 进 行 定 量 分 析 , 目前 应 用 比较 广 泛 的 有 极 谱 催
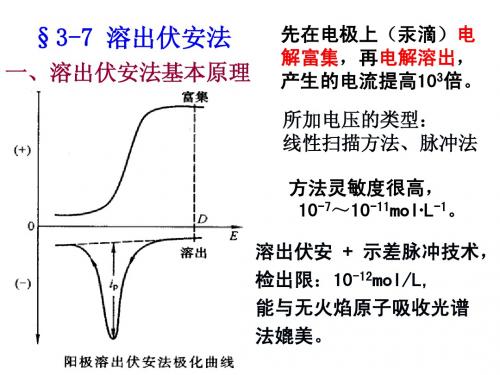
第9节 溶出伏安法

录电流-电位曲线。
四、溶出伏安图
上图为电解富集时 的i-E曲线,C点为
产生极限电流的电
位。
下图为电解溶出时
的i- E曲线,呈峰状。
图9-1
五、溶出峰电流的性质
采用不同的工作电极时,溶出峰电流的表达 式各不相同。
1. 悬汞电极
i p K1 z D 2. 汞膜电极
3/ 2 2/ 3 0 1/ 2 1 / 6
在环境监测、食品、生物试样中
微量或痕量元素的测定中有广泛应用。
主要意义是灵敏度很高。
第九节
溶出伏安法
(Stripping Voltammetry)
一、溶出伏安法
是以恒电位电解法进行富集,然后 改变电极的电位,使富集在该电极上的 被测物质重新溶出,根据溶出过程所得
的伏安曲线来进行定量分析的方法称为~。
二、分类
溶出伏安法根据工作电极上发生的反应不同分两类:
1. 阳极溶出法
(二) 缺点
主要是悬汞电极的缺点。
1.在富集阶段和溶出阶段之间必须有一个静置
阶段,一般约为30s,以便使汞滴中被测物质
的浓度均一化,并使溶液中对流作用减缓。
2.由于沉积金属在汞中的扩散,降低了富集在
表面的金属浓度,降低了悬汞电极的灵敏度。
七、应用
1. 在超纯物质分析中有实用价值。
2. 微量或痕量样品的分析。
三、工作原理
溶出伏安法的工作原理包含两个过程
1. 电解富集
2. 电解溶出
1. 电解富集
首先将被测物质在适当的电位 下(工作电极固定在产生极限电流电
第3章极谱4-溶出
例如:用汞电极测定溶液中痕量S2-: 在0.1mol/L的NaOH底液,在0.4V电解富集一 定的时间,使电极上的汞被氧化为 Hg2+,与溶液 中的S2-生成 HgS 附着在电极表面: Hg+ S2- -2e = HgS↓ 然后使工作电极的电位由正向负变化,到达 HgS 的 还原电位时,得到阴极溶出峰: HgS↓ +2e = Hg + S2可测定一些能与汞生成难溶化合物的阴离子,如
2.阴极溶出伏安法——CSV 富集过程为氧化过程,被测物的氧化沉积; 溶出过程为还原过程,沉积物的溶解还原。
阴极溶出伏安法常用银电极和汞电极。 在正电位下,电极本身氧化溶解生成Ag+、 Hg2+,它们与溶液中的微量阴离子如Cl-、Br-、l等生成难溶化合物薄膜聚附于电极表面,使阴离 子得到富集。 然后将电极电位向负方向移动,进行负电位 扫描溶出,得到阴极溶出极化曲线。溶出峰对不 同阴离子的难溶盐是特征的,峰电流正比于难溶 盐的沉积量。
3) 汞滴表面积 A 及体积 V 与峰电流关系:
ip =n K’ A / V
式中:n 为试液中被测物质总量, K 为常数,A为 汞滴的表面积,V为汞滴的体积。 汞膜电极的 A / V 比值较悬汞电极大得多。 同样的汞量做成的汞膜,其电极表面积比悬汞大得 多,电积效率高。所以灵敏度高,可达10-11mol· -1, L 电解富集的时间也大为缩短。
2)悬汞电极
悬汞电极
(a) 机械挤压式; (b) 挂吊式
机械挤压式悬汞电极:玻璃毛细管的 上端连接于密封的金属储汞器中,放 置顶端的螺旋将汞挤出,使之悬挂于 毛细管口. 汞滴的体积可用螺旋的圈数调节。 能控制汞滴的大小,所得汞滴纯净。 当电解富集的时间较长时,汞滴中的 金属原子会向毛细管深入扩散,影响 灵敏度和准确度。 吊挂式悬汞电极:直径为0.1mm 的 铂丝露出约 0.1 mm长,浸入硝酸亚 汞溶液中,作为阴极进行电解,汞 将沉积在铂丝上,得直径为 1.0 ~ 1.5mm 的悬汞滴。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
极谱分析原理
影响i 的主要因素: 影响id的主要因素:
• 待测物质浓度:在其它条件一定时,id与C成正 待测物质浓度:在其它条件一定时, 此为极谱定量分析的依据。同样, 比,此为极谱定量分析的依据。同样,此关系式 是在一定浓度范围内成立。(一般C 。(一般 是在一定浓度范围内成立。(一般C为10-5~102mol/L)。 mol/L)。 • 毛细管特性:m2/3t1/6称为毛细管常数 毛细管特性: • 温度:式中除n外,其它各项均受温度的影响, 温度:式中除n 其它各项均受温度的影响, 其中D受温度影响最大。 其中D受温度影响最大。 • 溶液组分:极谱测定中必须选用一定的底液。底 溶液组分:极谱测定中必须选用一定的底液。 液中含有相关试剂,组分不同, 液中含有相关试剂,组分不同,底液的粘度也不 若粘度大,则使D变小, 减小。 同,若粘度大,则使D变小,id减小。
溶出伏安法和电位溶出法
陈文军
经典极谱法
又称为直流极谱法,捷克学者Heyrovsky Heyrovsky于 又称为直流极谱法,捷克学者Heyrovsky于 1920年首次提出 并于1925 年首次提出, 1925年创造了第一 1920年首次提出,并于1925年创造了第一 台手工式极谱仪。 台手工式极谱仪。 1934年Ikovic提出扩散电流理论 提出扩散电流理论, 1934年Ikovic提出扩散电流理论,推导出 扩散电流方程式。 扩散电流方程式。 1935年Heyrovsky提出半波电位 提出半波电位, 1935年Heyrovsky提出半波电位,推导出极 谱波方程。 谱波方程。 1959年Heyrovsky获得诺贝尔化学奖 获得诺贝尔化学奖。 1959年Heyrovsky获得诺贝尔化学奖。
阳极溶出伏安法
电积过程: 电积过程:电积是在选定的恒电位和搅拌溶 液的条件下进行电解的过程, 液的条件下进行电解的过程,其实质是将待 测物质从溶液中富集到电极上。 测物质从溶液中富集到电极上。预电解按照 被测物质的富集是否完全可分为化学计量 化学计量和 被测物质的富集是否完全可分为化学计量和 非化学计量(定时富集)两种。 非化学计量(定时富集)两种。
极谱分析装置
电压装置: 电压装置:借电位器可连续改变加在电解池 两极上的外加电压。伏特计V 两极上的外加电压。伏特计V可以指示所加 的电压值。 的电压值。 检流计G用来测量流经电解池的电流。 检流计G用来测量流经电解池的电流。 电解池: 电解池:
• 一支是表面固定不变的大面积甘汞电极作参比 电极 • 一支是表面不断变化、面积很小的滴汞电极作 工作电极。
阳极溶出伏安法
溶出伏安曲线中峰尖对应的电位叫峰电位( 溶出伏安曲线中峰尖对应的电位叫峰电位(Ep), 峰电位 是定性依据;峰尖对应的电流称为峰电流 峰电流( 是定性依据;峰尖对应的电流称为峰电流(ip)。 由于溶出伏安法一般使用固体电极, 由于溶出伏安法一般使用固体电极,且固体电极多 种多样,性能不一,以致i 与待测离子原始C 种多样,性能不一,以致ip与待测离子原始C之间 定量关系公式亦不同。例如: 定量关系公式亦不同。例如: 悬汞电极: =3.97× 悬汞电极:ip=3.97×105n3/2D2/3ω1/2μ1/5D 1/2rυ1/2t·C R 汞膜电极: =6.94× Aυt· 汞膜电极:ip=6.94×105n2D2/3ω1/2μ-1/6Aυt·C 但对某一具体测定而言,条件一定时, =K· 但对某一具体测定而言,条件一定时,ip=K·C,这 是溶出伏安法定量的理论依据 定量的理论依据。 是溶出伏安法定量的理论依据。
• 电解质溶液中微量的杂质和未除净的微量氧在 电解电流。 滴汞电极上还原产生的电解电流 滴汞电极上还原产生的电解电流。 • 滴汞电极充放电引起的充电电流。 滴汞电极充放电引起的充电电流 充电电流。
极谱分析原理
电流上升部分 :图中bd段。当外加电压增 图中bd bd段 大到Cd 的析出电位时, 大到Cd2+的析出电位时, 阴极反应: 阴极反应:Cd2+ + 2e Cd Cd + Hg Cd(Hg) 2 Hg 2 + + 2e 阳极反应: 阳极反应:2Hg 2 Hg 2 + + 2 Cl − Hg2Cl2
极谱分析原理
电解液中CdCl 浓度为5mmol/L 电解液中CdCl2浓度为5mmol/L,同时电解液 5mmol/L, 中还含有大量的支持电解质KCl(0.1mol/L) 中还含有大量的支持电解质KCl(0.1mol/L) 和动物胶(0.005%) 并在电解前通N (0.005%), 和动物胶(0.005%),并在电解前通N2除去溶 液中的溶解氧。以滴汞电极为阴极, 液中的溶解氧。以滴汞电极为阴极,饱和甘 汞电极为阳极, 汞电极为阳极,在电解液保持静止的条件下 进行电解。控制汞滴流速为每10 10秒 进行电解。控制汞滴流速为每10秒2~3滴, 逐渐由0V增加加在两个电极上的电压, 0V增加加在两个电极上的电压 逐渐由0V增加加在两个电极上的电压,每改 变一次电压,记录一次电流值, 变一次电压,记录一次电流值,将所测得的 电流( 和电压( 值绘制成i 曲线, 电流(i)和电压(E)值绘制成i-E曲线, 极谱图或极谱波。 称为极谱图或极谱波 称为极谱图或极谱波。
阳极溶出伏安法
阳极溶出伏安法是被测物质先在工作电极上 预电解还原沉积在电极表面, 预电解还原沉积在电极表面,然后电压从负 电位逆向扫描到较正电位, 电位逆向扫描到较正电位,使富集在电极上 的物质发生氧化反应溶出, 的物质发生氧化反应溶出,主要测定金属离 子。 富集过程还原,溶出过程氧化。 富集过程还原,溶出过程氧化。
极谱分析原理
id = KC 其中K= K=607nD 其中K=607nD1/2m2/3t1/6 ,称 为尤考维奇常数 称为扩散电流方程式 扩散电流方程式, id=607nD1/2m2/3t1/6C 称为扩散电流方程式, 又称尤考维奇方程式 尤考维奇方程式。 又称尤考维奇方程式。 id为平均极限扩散电流(uA),代表每滴汞 为平均极限扩散电流(uA),代表每滴汞 ), 从形成到滴落过程中的平均电流; 从形成到滴落过程中的平均电流;n为电极 反应中电子转移数; 反应中电子转移数;D为待测物在溶液中的 扩散系数( /s); );m 扩散系数(cm2/s);m为汞在毛细管中的流 mg/s); 为汞滴滴下所需时间( );t 速(mg/s);t为汞滴滴下所需时间(s); 为待测物浓度(mmol/L)。 C为待测物浓度(mmol/L)。
凡使用滴汞电极或者使用其表面周期性更 新的液体电极的分析方法称为极谱法 极谱法。 新的液体电极的分析方法称为极谱法。 凡使用固体电极或使用其表面静止的电极 的方法称为伏安法 伏安法。 的方法称为伏安法。
——1976 IUPAC倡议 ——1976年IUPAC倡议 1976年
极谱分析装置
主要分电压装置、电流计和电解池三部分。 主要分电压装置、电流计和电解池三部分。
极谱分析原理
极谱分析原理
残余电流:当外加电压小于Cd 残余电流:当外加电压小于Cd2+的析出电位 电极表面还没有Cd 还原, 时,电极表面还没有Cd2+还原,电极表面 的浓度等于主体溶液中Cd 浓度, Cd2+的浓度等于主体溶液中Cd2+浓度,这时 应该没有电流。但实际上, 应该没有电流。但实际上,仍有微小的电流 通过电解池,这种电流称为残余电流 残余电流。 通过电解池,这种电流称为残余电流。如图 中的ab ab段 中的ab段。它包括
溶出伏安法
溶出伏安法是一种将富集和测定 溶出伏安法是一种将富集和测定结合在一起 富集和测定结合在一起 的电化学分析方法。 的电化学分析方法。 操作主要分电富集 电溶出两步 电富集和 两步。 操作主要分电富集和电溶出两步。 溶出伏安法按照溶出时工作电极发生的是氧 化反应还是还原反应,分为阳极溶出伏安法 化反应还是还原反应,分为阳极溶出伏安法 ASV) 阴极溶出伏安法(CSV)两种。 (ASV)和阴极溶出伏安法(CSV)两种。
[
]
极谱分析原理
电解电流的大小完全决定于电极表面Cd 电解电流的大小完全决定于电极表面Cd2+的 扩散速度, 扩散速度,即在单位时间内有多少离子扩 散到电极表面就有多少离子起反应, 散到电极表面就有多少离子起反应,从而 产生相应大小的电流, 产生相应大小的电流,这种电流称为扩散 电流。 电流。
∆C [Cd 2+ ] −[Cd2+ ]0ห้องสมุดไป่ตู้i扩散 ∝ 扩散速度∝ = ∆X δ
极谱分析原理
V=ESCE – Ede + ir
0
V= – Ede ( VS.SCE ) VS.SCE)
2+ 0
RT Cd Ede = E + ln 2F [Cd(Hg)]0
由于在静止条件下进行电解, 由于在静止条件下进行电解,待测离子浓度很 电极反应使得电极表面Cd 浓度迅速下降, 小,电极反应使得电极表面Cd2+浓度迅速下降,其值 小于主体溶液中Cd 浓度,产生浓差极化, 小于主体溶液中Cd2+浓度,产生浓差极化,在滴汞电 极周围形成一个很薄的扩散层。在扩散层内, 极周围形成一个很薄的扩散层。在扩散层内,电极 表面上的Cd 浓度取决于滴汞电极电位;在扩散层外, 表面上的Cd2+浓度取决于滴汞电极电位;在扩散层外, 溶液中Cd 浓度和溶液本体Cd 浓度相等; 溶液中Cd2+浓度和溶液本体Cd2+浓度相等;在扩散层 从内到外Cd 浓度由小到大。 中,从内到外Cd2+浓度由小到大。
阳极溶出伏安法
溶出过程:电积后停止搅拌,静止0.5 1min, 溶出过程:电积后停止搅拌,静止0.5~1min,以 0.5~ 使电极上富集产物扩散均匀。溶出时, 使电极上富集产物扩散均匀。溶出时,改变电极极 向电极施加一个反向线性扫描电压, 性,向电极施加一个反向线性扫描电压,使电极电 位按一定速率向电位更正的方向线性变化。 位按一定速率向电位更正的方向线性变化。当电极 电位达到比其平衡电位稍正时, 电位达到比其平衡电位稍正时,沉积在电极上的金 属开始氧化溶出。随着电位正向继续增加, 属开始氧化溶出。随着电位正向继续增加,溶出电 氧化电流)也不断的增大, 流(氧化电流)也不断的增大,在极谱波半波电位 附近,溶出电流最大。电位更正时, 附近,溶出电流最大。电位更正时,由于汞齐中金 属浓度逐渐降低,溶出电流也逐渐变小, 属浓度逐渐降低,溶出电流也逐渐变小,直至金属 完全溶出。这样,得到一峰形的 峰形的i 曲线。 完全溶出。这样,得到一峰形的i-E曲线。习惯上 以还原电流为正,氧化电流为负。 以还原电流为正,氧化电流为负。
