乙烯和烯烃
乙烯烯烃二烯烃

7
10、书写丙烯和苯乙烯的加聚反应 nCH2=CHCH3→ [CH2-CH]n CH3
8
11、关于实验室制备乙烯的下列说法正确的是(
D
)
A.反应物是乙醇和过量的3mol/L H2SO4的混和液;
B.温度计插入反应溶液液面下,以便控制温度在140℃;
C.反应完毕先灭火再从水中取出导管;
D.反应容器(烧瓶)中应加入少量瓷片。
1,4-加成
+
CH3
CH
CH
CH2 Cl
催化剂
CH
CH
CH2 H
练习3: 下列物质不能使酸性高锰酸钾溶液褪色的是( C ) A .SO2 B.CH2=CH2 C.CH3CH2CH3 D.乙苯
练习4. 不能够用于鉴别甲烷和乙烯的是( D ) A.将混合气体分别点燃,观察火焰颜色 B.将混合气体通入酸性高锰酸钾酸性溶液中,观察高锰酸钾溶液是否褪色
(2).碳链异构:碳链骨架不同而形成的碳链异构。
CH2=CHCH2CH3 与 CH3 C=CH2
CH3
丁烯的同分异构体
CH3 CH2
1-丁烯
CH
CH2
CH3
CH
2-丁烯
CH
CH3
CH3
C CH3
ห้องสมุดไป่ตู้
CH2
异丁烯
H3C C H C H CH3
H3C C H C
H CH3
顺-2-丁烯
反-2-丁烯
以C5H10为例,练习烯烃的同分异构体的写法和命 名。 (1)CH3CH2CH2CH=CH2 (2)CH3CH2CH=CHCH3 (3) CH3CH2C=CH2 CH3 (4)CH3CH=C-CH3 CH3 (5) CH2=CH-CH-CH3 1-戊烯 2-戊烯 2-甲基-1-丁烯 2-甲基-2-丁烯 3-甲基-1-丁烯
《乙烯-烯烃》课件

4. 加热时温度要迅速升到170℃以防副反应发生,度 计的水银球应插到液面下,但不接触烧瓶底部
CH3CH2-OH+H-O-CH2CH3
浓H2SO4 140 ℃
CH3CH2-O-CH2CH3+H2O
5.用排水法收集乙烯,不能用排空气法收集 6.加热较长时间,液体会逐渐变黑,乙醇被浓硫酸碳
2、关于实验室制备乙烯的下列说法正确的是
(D )
A.反应物是乙醇和过量的3mol/L H2SO4的 混和液;
B.温度计插入反应溶液液面下,以便控制温 度在140℃;
C.反应完毕 先灭火再从水中取出导管;
D.反应容器(烧瓶)中应加入少量瓷片。
3、除去乙烷中混有的少量乙烯的方法,正确
的是( B )
A.通入氯气后进行光照 B.通入溴水 C.通入澄清的石灰水 D.点燃
(2)从最靠近双键的这一端开始编号; (3)其它命名同烷烃。
5、烯烃同系物的物理性质
(1)常温下,C2—C4为气体,C5—C18为液体, C18以上为固体;
(2)烯烃的熔沸点随碳原子数增多,分子量 增大,熔沸点逐渐升高;
(3)烯烃的密度随着学性质与乙烯类似
(1)加成反应 (2)氧化反应
①燃烧: ②与酸性KMnO4溶液反应:能使酸性 KMnO4溶液褪色。 (3) 加聚反应
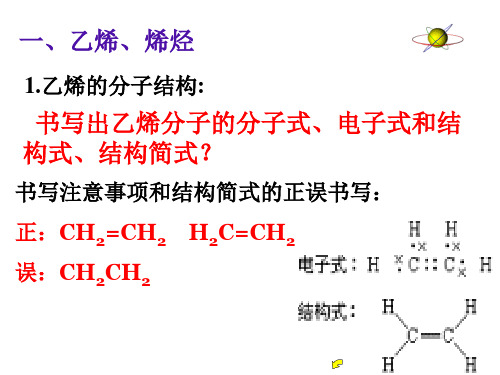
练习: 1、填空题 (1)乙烯的分子式为_______,电子式为______ 结构式为___________。 (2)乙烯与氯气的反应是_____反应,甲烷与氯 气的反应是______反应。 2、实验题
CH2=CH2+3O2 点燃 2CO2+2H20
②使紫色的KMnO4(H+)溶液褪色
乙烯_烯烃知识点汇总(全)精编版

乙烯 烯烃知识点总结一、乙烯的组成和结构乙烯分子的结构简式:CH 2 〓 CH 2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置① 浓H 2SO 4的作用:催化剂、脱水剂。
② 浓硫酸与无水乙醇的体积比:3∶1。
配制该混合液时,应先加5 mL 酒精,再将15 mL 浓硫酸缓缓地加入,并不断搅拌。
③ 由于反应温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,可以在反应混合液中加一些碎瓷片加以防止。
(防暴沸)④ 点燃酒精灯,使温度迅速升至170℃左右,是因为在该温度下副反应少,产物较纯。
⑤ 用排水法收集满之后先将导气管从水槽里取出,再熄酒精灯,停止加热。
〖讨论〗此反应中的副反应,以及NaOH 溶液的作用①乙醇与浓硫酸混合液加热会出现炭化现象,使生成的乙烯中含有CO 2、SO 2等杂质。
SO 2也能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色,因此,检验乙烯气体之前,应该使气体先通过NaOH 溶液,除去CO 2和SO 2。
②乙醇与浓硫酸共热到140℃,乙醇发生分子间脱水,生成乙醚(C 2H 5-O-C 2H 5)三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
(溴的四氯化碳溶液的红棕色褪去)乙烯除了与溴之外还可以与H2O、H2、卤化氢、Cl2等在一定条件下发生加成反应,如工业制酒精的原理就是利用乙烯与H2O的加成反应而生成乙醇。
(见《自主学习能力测评》P633)聚合反应nCH2==CH2EMBED\*MERGEFORMAT−−−→−催化剂—其中 CH2=CH2 为单体—CH2—CH2—为链节 n为聚合度聚乙烯的分子很大,相对分子质量可达到几万到几十万。
乙烯 烯烃

§12-4乙烯烯烃教学目的1.使学生了解乙烯的物理性质和主要用途,掌握乙烯的化学性质和实验室制法。
2.使学生了解加成反应和聚合反应以及不饱和烃的概念。
3.使学生了解烯烃在组成、结构、重要化学性质上的共同点,以及物理性质随分子中的碳原子数目的增加而变化的规律性。
重点和难点:乙烯分子中C=C双键结构特点及制乙烯的有关知识。
教学方法:直观教学法对比法实验引导探索法课时教案1教学过程[提问]1.饱和链烃在分子结构上有什么特点? (碳原子之间C-C单键结合; 碳原子剩余价键与氢原子结合而饱和. )2.试写出乙烷的化学式、电子式、结构式、结构简式。
(副板书)[引言]有些烃分子中碳原子之间存在碳碳双键或碳碳叁键,因此结合的氢原子数目少于烷烃分子里氢原子数目,这样的烃叫不饱和烃,如果这些烃跟某些物质起反应,它们分子里的碳原子还可以结合其它的原子或原子团. 如今天我们将要学习的乙烯——第四节乙烯一、乙烯的分子组成与结构[展示]乙烯和乙烷的球棍模型.[设问]乙烯分子与乙烷分子的碳原子所结合的氢原子数目和碳碳之间共用电子对的数目有什么异同?1.化学式: C2H42.电子式:3.结构式:结构简式:CH2=CH2(注意:不能写成:CH2CH2!)[讲解]由此可见: 乙烯分子中碳原子之间共用两对电子结合成碳碳双键,用C=C 表示.[展示]乙烯分子的球棍模型,并引导学生总结--4.结构特点: (1) C=C双键; (2键角: 120度;(3)六原子共面;(4)非极性分子.二、乙烯的实验室制法[边演示边讲解]A.展示装置并检查气密性;B.向烧瓶中加入酒精和浓硫酸的混和液20mL(强调:酒精与浓硫酸的体积比为1:3);C.再加入少量碎瓷片(其作用是: 防止暴沸);D.检查温度计的水银球是否已插入混和液中,但不与瓶底接触( 其作用是控制反应物的温度,使其迅速升温到170℃. 原因是在140℃时产生的是乙醚, 170℃时才产生乙烯. );E.迅速加热到170℃时产生乙烯气体;F.依次将产生的气体通入溴水、酸性高锰酸钾溶液;G.点燃气体; (提醒注意: 点燃前应验纯. )H.收集气体;I.先移出导管,再撤酒精灯.[小结]1. 药品: 酒精和浓硫酸(体积比1:3)[注意] 浓硫酸的作用: 脱水,催化2. 反应原理:CH3CH2OH CH2=CH2↑ + H2O3. 仪器安装:蒸馏烧瓶及温度计[注意](1)碎瓷片的作用: 防止暴沸.(2)温度计水银球的位置: 插入液面以下,但不能接触瓶底.(3)迅速加热至170℃,并保持.(140℃时生成乙醚副产物. )2CH3CH2OH CH3CH2OCH2CH3+ H2O[讲述]无色略有气味的气体,难溶于水,密度比空气略小.,因此——4.收集:排水法[讨论]加热过程中烧杯中液体的颜色为什么会逐渐变黑,且收集到的气体有刺激性气味?课时教案2:乙烯的化学性质三、乙烯的化学性质及用途[讲述]C=C比C-C键长短,键能大,但不等同,其中有一个相当于一个C-C,有一个比C-C弱,因此在反应中易断裂.1.氧化反应[回顾]乙烯在空气中燃烧,火焰明亮,略有黑烟(追问:为什么?)[注意]点燃前应验纯(因不纯时也能爆炸)。
乙烯乙炔
(2)乙炔能使酸性KMnO4溶液褪色。
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
褪色 b 、催化加氢 c 、与HX等的反应
CH≡CH+HCl催化剂 △
CH2=CHCl(制氯乙烯)
3、炔烃的通性: (1)物理性质:随着碳原子数的增多, 沸点逐渐升高,液态时的密度逐渐增加。
C小于等于4时为气态
(2)化学性质:
1)氧化反应: 氧化燃烧 试剂氧化(酸性高锰酸钾溶液) 2)加成反应:与H2、HX、H2O、X2等的加成,注意量。 3)加聚反应:
三、脂肪烃的来源及其应用
脂肪烃的来源有石油、天然气和煤等。
石油通过常压分馏可以得到石油气、汽油、 煤油、柴油等;而减压分馏可以得到润滑油、 石蜡等分子量较大的烷烃;通过石油和气态烯 烃,气态烯烃是最基本的化工原料;而催化重 整是获得芳香烃的主要途径。
天然气是高效清洁燃料,主要是烃类气体, 以甲烷为主。
煤也是获得有机化合物的源泉。通过煤焦 油的分馏可以获得各种芳香烃;通过煤矿直接 或间接液化,可以获得燃料油及多种化工原料。
(2)烯烃的熔沸点随碳原子数增多,分子量 增大,熔沸点逐渐升高;
(3)烯烃的密度随着碳原子数增多,逐渐增 大。
4、烯烃的化学性质 (1)氧化反应: ①燃烧: 火焰明亮,冒黑烟。
②催化氧化:
催化剂
2CH2==CH2 +O2加热加压2CH3CHO
③与酸性KMnO4的作用:使KMnO4溶液褪色
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
乙烯_烯烃知识点汇总(全)

乙烯_烯烃知识点汇总(全) -标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII乙烯 烯烃知识点总结一、乙烯的组成和结构乙烯分子的结构简式:CH 2 〓 CH 2乙烯分子的结构:键角约120°,分子中所有原子在同一平面,属平面四边形分子。
二、乙烯的制法工业上所用的大量乙烯主要是从石油炼制厂和石油化工厂所生产的气体中分离出来的。
实验室制备原理及装置① 浓H 2SO 4的作用:催化剂、脱水剂。
② 浓硫酸与无水乙醇的体积比:3∶1。
配制该混合液时,应先加5 mL 酒精,再将15 mL 浓硫酸缓缓地加入,并不断搅拌。
③ 由于反应温度较高,被加热的又是两种液体,所以加热时容易产生暴沸而造成危险,可以在反应混合液中加一些碎瓷片加以防止。
(防暴沸)④ 点燃酒精灯,使温度迅速升至170℃左右,是因为在该温度下副反应少,产物较纯。
⑤ 用排水法收集满之后先将导气管从水槽里取出,再熄酒精灯,停止加热。
〖讨论〗此反应中的副反应,以及NaOH 溶液的作用①乙醇与浓硫酸混合液加热会出现炭化现象,使生成的乙烯中含有CO 2、SO 2等杂质。
SO 2也能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色,因此,检验乙烯气体之前,应该使气体先通过NaOH 溶液,除去CO 2和SO 2。
②乙醇与浓硫酸共热到140℃,乙醇发生分子间脱水,生成乙醚(C 2H 5-O-C 2H 5)三、乙烯的性质1.物理性质:无色、稍有气味、难溶于水、密度小于空气的密度。
2.化学性质(1)氧化反应a.燃烧 CH 2=CH 2+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,并伴有黑烟)b.使酸性KMnO 4溶液褪色(2)加成反应:有机物分子中双键(或叁键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。
(溴的四氯化碳溶液的红棕色褪去)乙烯除了与溴之外还可以与H 2O 、H 2、卤化氢、Cl 2等在一定条件下发生加成反应,如工业制酒精的原理就是利用乙烯与H 2O 的加成反应而生成乙醇。
乙烯和烯烃

乙烯和烯烃一、乙烯的分子结构乙烯是一个平面型分子,即“六点共面”:二个C原子和四个H原子均在同一平面内,有一个C=C双键和四个C-H单键,它们彼此之间的键角约为120º。
乙烯乙烷键长(m) 1.33×10-10 1.54×10-10键角约120º109º28'键能(kJ/mol)615 348)键长小于碳碳单键(C-C);键能大于单键键能,但小于单键键能的两倍,结合乙烯的性质可认为双键中,两个键并不等同,其中一个键较稳定,另一个键较不稳定。
从而说明乙烯的双键中有一个键容易断裂,这是乙烯化学性质比乙烷活泼的理论根据,这就在本质上加深了烯烃重要性质—加成反应和加聚反应的认识,进一步理解分子结构与性质的辩证关系。
另外由于乙烯中存在碳碳双键结构,双键不能扭曲、旋转,这一点与乙烷有很大差异。
二、乙烯的重要化学性质1.乙烯能使溴水和酸性KMnO4溶液褪色,这是检验饱和烃与不饱和烃的方法。
但两者的反应类型是不同的,前者是加成反应,后者是氧化反应。
加成反应有二个特点:①反应发生在不饱和的C=C 键上,双键中的不稳定的共价键断裂,不饱和的C原子与其它原子或原子团以共价键结合。
乙烯可以与多种物质发生加成反应,例如卤素单质、卤化氢、水、氢气等。
②加成反应后生成物只有一种(不同于烷烃的取代反应)。
乙烯通过溴水,现象:溴水褪色1,2-二溴乙烷(液态)乙烯与氢气加成2.可燃性:C2H4+3O22CO2+2H2O现象:火焰较明亮,略带黑烟(与甲烷燃烧相比较)3.加聚反应,C=C双键里的一个键断裂,然后,分子里的C原子互相结合成为高分子长链。
这种聚合反应是通过加成而聚合,所以习惯上也称为加聚反应,其实质是加成反应,断的是C=C 双键中的一个键。
三、实验室制乙烯的原理、装置及注意事项: 1.药品:乙醇和浓硫酸(体积比:1∶3)2.装置:根据反应特点属于液、液加热制备气体,所以选用反应容器圆底烧瓶。
乙烯、烯烃PPT课件1 人教版

•
15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。
•
16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。
•
17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。
催化剂
CH2=CH2+H2 △ CH3CH3
CH2=CH2+Cl2
CH2ClCH2Cl
1,2-二氯乙烷
CH2=CH2+HCl
CH3CH2Cl 氯乙烷
催化剂
CH2=CH2+H2O加压加热 CH3CH2OH
3. 聚合反应
催化剂
nCH2=CH2
[ CH2- CH2 ]n
定义:由相对分子质量小的化合物分子互 相结合成相对分子质量大的高分子的反应 叫做聚合反应
•
18、努力也许不等于成功,可是那段追逐梦想的努力,会让你找到一个更好的自己,一个沉默努力充实安静的自己。
•
19、你相信梦想,梦想才会相信你。有一种落差是,你配不上自己的野心,也辜负了所受的苦难。
•
20、生活不会按你想要的方式进行,它会给你一段时间,让你孤独、迷茫又沉默忧郁。但如果靠这段时间跟自己独处,多看一本书,去做可以做的事,放下过去的人,等你度过低潮,那些独处的时光必定能照亮你的路,也是这些不堪陪你成熟。所以,现在没那么糟,看似生活对你的亏欠 ,其实都是祝愿。
第三节 乙 烯 烯烃
第二课时
三. 乙烯的物理性质
通常情况下,乙烯是一种无色.稍有气味的气体. 密度比空气略小,难溶于水
四.乙烯的化学性质
乙烯分子的结构特点:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6、混合液颜色如何变化?为什么? 烧瓶中的液体逐渐变黑。因为浓硫酸有多种特性。 在加热的条件下,无水酒精和浓硫酸混合物的反 应除可生成乙烯等物质以外,浓硫酸还能将无水 酒精氧化生成碳的单质等多种物质,碳的单质使 烧瓶内的液体带上了黑色。
7、有何杂质气体?如何除去? 由于无水酒精和浓硫酸发生的氧化还原反应,反 应制得的乙烯中往往混有 H2O、CO 2、SO2等气 体。可将气体通过碱石灰。
衡量一个国家化工产业发展 水平的标志是什么?
——乙烯的产量
一、饱和烃和不饱和烃
(1)饱和烃
碳原子间以 单键 结合,碳原子的其余价键全部与 氢 结
合。 (2)不饱和烃
分子中含有碳碳双键( C=C )或碳碳三键 —( C=– C—),碳原子所结合的氢原子数 少于饱和链烃
里的氢原子数,这样的烃叫做不饱和烃。
8、为何可用排水集气法收集?
因为乙烯难溶于水,密度比空气密度略小。
五、乙烯的用途
1.乙烯是石油化学工业最重要的基础原料,它主要用于制 造塑料、合成纤维、有机溶剂等。 乙烯的产品涵盖了工农业生产和日常生活的许多方面,所 以,一个国家的乙烯工业发展水平,已成为衡量这个国家 石油化工水平的重要标志。
2.乙烯还是一种植物生长调节剂,可作为果实催熟剂等。
实验结论 乙烯易燃烧,但在空气中燃烧不完全
b 与酸性高锰酸钾溶液反应
实验现象 通入乙烯后,溶液紫色很快褪去 实验结论
乙烯能被酸性 KMnO 4氧化,它的 化学性质比烷烃活泼
此性质可以鉴别烷烃和烯烃
(2)加成反应
现象:溴水褪色 (说明1,2-二溴乙烷无色 ) 应用 :1、区别烷烃和烯烃
2、除去乙烯中混有的甲烷
② 特点: 不饱和碳变为饱和碳 (加成)
小分子生成大分子 (聚合)
反应物与生成物最简式同 (式同)
五、乙烯的实验室制法
反应原理:
消去反应:有机化合物在一定条件下,从一个分子中脱去一个 或几个小分子(如 H2O 、HX),而生成含不饱和键化合物的 反应
断键位置: 脱去—OH 和与—OH 相邻的碳原子上的 1个H
3、化学性质:
(1)加成反应(与H2、Br 2、HX、H2O等):
催化剂
CH3-CH=CH2 + H2
CH3CH2CH3
CH 2==CH 2+Br 2
CH 2BrCH 2Br
使溴水褪色
(2)氧化反应:
①燃烧:
火焰明亮,冒黑烟。
(含碳量的大小) ②催化氧化:
催化剂
2CH 2==CH 2 +O2加热加压 2CH 3ห้องสมุดไป่ตู้HO
210*
三、乙烯的物理性质
在通常状况下,乙烯是一种 无色、稍有气味 的气体。难溶 于水,在标准状况下密度为 1.25g/L ,比空气的密度略小。
四、乙烯的化学性质
(1) 氧化反应
点燃
a 燃烧: CH 2=CH 2 + 3O 2
2CO 2+2H2O
实验现象 乙烯在空气中可以燃烧,火焰明亮伴有 少许黑烟
六、烯烃
1、烯烃的结构特点
写出 乙烷、丙烷和乙烯、丙烯的结构简式 ① 从分子组成上两种烃有何区别?推出它们的通式; ② 从分子结构上两种烃有何区别?
① 烯烃的通式: CnH2n
② 烷烃为饱和链烃,烯烃为不饱和链烃,它 的分子中有一个碳碳双键( C = C )
2、物理性质:
随着分子中碳原子数的增多,烯烃同系物 的物理性质呈现规律性变化,即熔沸点逐渐 升高,密度逐渐增大。
官能团:决定物质主要化学性质的原子或原子 团,如碳碳双键、碳碳三键、羧基、羟基
二、乙烯的结构
分子式
高温
C 2H 6(乙烷 )
电子式 结构式
HH H ?? ??C?????? C???? H
HH
HH HCCH
结构简式
HH
CH 3 CH 3
空间构型 空间立体构型
C 2H4 (乙烯) + H2
HH
H ??
3、酒精与浓硫酸体积比为何要为 1∶3? 因为浓硫酸是催化剂和脱水剂,为了保证有足够 的脱水性,硫酸要用 98% 的浓硫酸,酒精要用无 水酒精,酒精与浓硫酸体积比以 1∶3为宜。
4、温度计的位置? 温度计感温泡要置于反应物的
中央位置因为需要测量的是反应物的温度。
5、为何使液体温度迅速升到 170℃? 因为无水酒精和浓硫酸混合物在 170℃的温度下 主要生成乙烯和水,而在 140℃时乙醇将以另一 种方式脱水,即分子间脱水,生成乙醚。
③与酸性KMnO4的作用:
5CH 2=CH 2 + 12KMnO 4 +18H2SO4
10CO 2 ↑ + 12MnSO 4 + 6K2SO4 + 28H2O
使KMnO 4溶液褪色
(3)加聚反应:
由相对分子质量小的化合物分子互相结合 成相对分子质量大的高分子的反应叫做 聚合反 应。
由不饱和的相对分子质量小的化合物分子 结合成相对分子质量大的化合物分子,这样的 聚合反应同时也是加成反应,所以这样聚合反 应又叫做 加聚反应。
浓硫酸的作用:催化剂和脱水剂
制乙烯实验装置
为何使液体温度迅 速升到170℃?
酒精与浓硫酸 体积比为何 要
为1∶3?
浓硫酸的作 用是什么?
放入几片碎 瓷片作用是
什么?
温度计的 位置?
有何杂质气体? 如何除去?
用排水集 气法收集
混合液颜色如何 变化?为什么?
1、放入几片碎瓷片作用是什么? 防止暴沸
2、浓硫酸的作用是什么? 催化剂和脱水剂
nCH 2==CH 2 催化剂
[ CH 2 CH 2 ] n
烃的类别 分子结构 代表物质 主要化学性质 特点
烷烃
全部单键、 饱和
CH 4
燃烧、取代、热 分解
烯烃
有碳碳双 键、不饱 和
?
C???
? ?
?
C???
H
HH HC CH
CH 2=CH 2 平面结构
乙烯与乙烷结构的对比
分子式 结构式
C2H6
C2H4 这就是 乙烯的 官能团
键的类别
C—C
C==C
键角
109o28ˊ 120o
键长( 10-10米)
1.54
1.33
键能(KJ/mol )
348
615
空间各原子 的位置
2C和6H不在 2C和4H在同 同一平面上 一平面上
化学反应方程式: CH 2=CH 2 + Br 2
CH 2Br-CH 2Br
加成反应
① 概念:有机物分子里不饱和的碳原子跟其它原子或
原子团直接结合,生成新的化合物的反应
② 特点:不饱和碳变为饱和碳
(3)加聚反应
HH
HH 催化剂
nH C C H
CC
n
HH
① 概念: n CH 2=CH 2 催化剂
—[ CH 2—CH 2—] n
