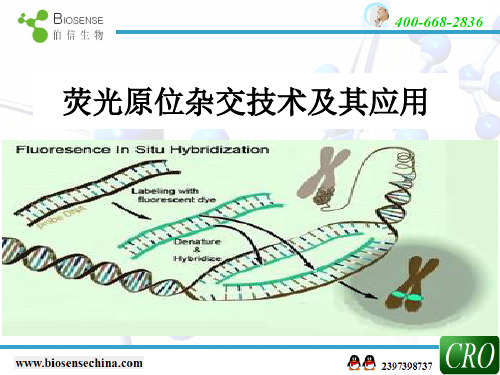
荧光原位杂交技术FISH
FISH实验
现今越来越多的学者趋向于FISH与IF的结合实验,通 俗一点讲,就是在同一个样本上既进行FISH实验,又同时
进行IF实验检测。这方面实验一般适用于检测一个目的基
因以及该目的基因所相对应的蛋白,我们公司在这方面实 验上条件已非常成熟。另外公司也提供其他方面的实验服 务,有Southern blot 、Northern blot、CHIP、COIP, QPCR等等;蛋白类实验有IHC、IF、WB等。
2、实验操作及注意事项
实验操作过程中的注意事项
a、石蜡切片脱蜡过程要脱蜡完全。
b、需预热的洗液和变性液应该提前放于达到预热温度的 水浴锅内,预热至少30min。 c、操作过程中应该尽量减少探针接触白光时间,减少荧 光的损耗。
d、实验过程中最好设立一个阴性对照组,不加探针,直接 用洗液代替探针进行孵育,排除组织本身的非特异性表 达。
FISH与IF的结合实验实例
小鼠血管
人病变血管
常见问题解答
石蜡组织切片FISH检测结果受其他诸多因
素的影响,如组织标本的解剖位置、标本厚度、
固定条件、实验室环境、操作人员的差异、蛋白 酶效价的差异、探针的质量等,都可能影响实验 结果。我们实验室已进行过多种标本的FISH检 测,会根据不同的样本在一定范围内对实验条件
进行适当调整优化,从而获得理想的实验结果。
石蜡常见样本图释
荧光原位杂交应用最成功的是基因定位。基因定位研 究是构建基因图谱的基本要素, 基因位置的确定有助于了 解基因的功能, 利用FISH 技术, 可以直接确定某一DNA 序
列在染色体上的位置。
二、FISH实验及图例展示
• 1、样本的准备与处理
• 2、实验操作及注意事项
• 3、实验结果的检测 • 4、实验图例的展示
FISH技术

FISH技术:荧光标记的原位杂交技术 1974年Evans首次将染色体显带技术和染色体原位杂交联合应用,提高了定位的准确性。20世纪70年代后期人们开始探讨荧光标记的原位杂交,即FISH技术。1981年Harper成功地将单拷贝的DNA序列定位到G显带标本上,标志着染色体定位技术取得了重要进展。20世纪90年代,随着人类基因组计划的进行,由于绘制高分辨人类基因组图谱的需要,FISH技术得到了迅速的发展和广泛应用。 1.原理 将核酸探针的某一种核苷酸标记上报告分子如生物素、地高辛,可利用该报告分子与荧光素标记的特异亲和素之间的免疫化学反应,经荧光检测体系在镜下对待测DNA进行定性、定量或相对定位分析。 肺肿瘤细胞FISH
荧光原示核酸是在同位素标记探针的基础上改进而来的。早期的同位素标记没有专门的标记方法,如将随机同位素标记的碱基添加到生长的细胞中之后再进行放射自显影。同位素杂交的诸多缺点必然要求用更好的技术来取而代之。首先,放射性材料决定了探针的不稳定性,特别是半衰期较短的同位素随着时间推移不断衰退而造成探针的活性不能持久。其次,虽然放射显影的灵敏度极高,但是分辨率(清晰度)有限。第三,为了在放射显影底片上获得可检测到的信号往往需要延长曝光时间,使检测周期变长。第四,放射性标记探针相对比较昂贵,并且必须按照严格的程序转运、贮存、处理带有放射性的材料。而FISH 技术在分辨率、检测周期、安全性等方面明显得到了改进,并为以后的多位点检测、高质量分析、活细胞绘图等打下了基础。 1980 年,Bauman 首次将荧光原位杂交用于核酸检测,直接将RNA-3’端用荧光素标记作为特异DNA 序列的探针 。嵌入整个探针的酶结合荧光素标记碱基方法已经广泛用于荧光探针的制备;一次可以标记一种颜色。氨基-烯丙基标记碱基技术可以与任何半抗原或者荧光素结合,这对于原位杂交是至关重要的,因为氨基-烯丙基标记的碱基技术可以仅通过简单的化学反应就可以获得一系列的低背景信号探针,通过杂交探针的二级检测系统使得杂交信号被放大。早在19 世纪80 年代,缺口平移法检测、生物素标记探针,二级荧光标记抗体检测等方法已经用于DNA 和mRNA检测。约十年后,单链DNA 探针的合成、标记方法的不断改进可以使合成的杂交探针携带大量的荧光素分子用于直接检测。在这些方法基础上,有许多关于不同的检测范围、特异性,灵敏度以及分辨率等直接的或间接的改进技术方面的报道。 1 FISH 技术检测位点数目及检测目标的发展 在FISH 技术基本确立之后,FISH 不仅用于单基因或核酸检测,FISH 技术的进一步发展扩展到多色FISH 多基因位点同时检测,从基因检测发展到基因组、染色体、活细胞中转录产物mRNAs 原位检测以及组织水平的核酸检测,并且在今后的研究中还有可能应用到整个生物体的检测。早期的探针较大,是通过载体的增殖、缺口平移法、体外转录法和随机引物DNA 合成法来制备以获得特异性杂交克隆。然而大片断的探针通常带有重复序列造成高荧光背景,采用未标记的核酸进行预处理使其与非特异性位点结合用于抑制非特异性杂交可以克服上述问题,同时也使得研究者扩大了检测目标,实现了整条染色体染色。在细胞遗传学上FISH 技术在染色体分析方面也因此得到了显著的提高。如通过比较基因组杂交(Comparativegenomic hybridization)用于检测染色体区域的缺失和重复。大片段探针一旦和样品非特异性结合就会形成一个信号,混淆染色体上基因的检测,就需要剪切成小片段<200核苷酸。现在检测手段的提高以及检测软件的不断发展使得FISH技术的检测要求越来越低,灵敏度越来越高。精确的计算机图片处理算法的不断改进形成了亚显微水平的探针高分辨技术。随着检测目标越来越小,FISH技术已用于隐蔽的亚端粒核型基因重排和精确的染色体作图及单拷贝mRNA的检测。 FISH 检测范围的扩大,使得FISH 技术的应用在20 世纪90 年代急速增长。由FISH 技术应用而形成的分支技术实现了越来越多的不同类型位点同时检测。首先是采用不同的荧光素来检测多位点,如双色荧光用于检测特异的核酸序列,每一条染色体、基因或者转录产物分别由一种可以分辨的荧光信号来表示。之后是采用两种色彩译码方案进一步扩大了FISH 应用范围。译码方案主要是针对色彩比例,即每一种颜色在总颜色中所占的比例来描绘多位点。前述的每一种方法,或是两种方法的结合都已经将可检测位点多达12 个。采用计算机翻译的五色方案可同时检测出人类所有染色体代表着FISH 技术多位点检测的里程碑。尽管可以采用多种方法观测到mRNAs,但是FISH 对整个转录产物的原位分析似乎更有应用前景。色彩译码技术已经实现了对整个组织的检测。 2 FISH 技术的定量分析阶段[1] Pinkel 等(1986)首次将荧光图像定量分析用于基本细胞遗传检测,采用双色激发块装置照相机检测荧光信号,而且定量分析技术很快用于了mRNA 检测。荧光检测的关键是信号的重现性、无规律性及背景的自发荧光。不仅不同的样品之间荧光不同,而且同一载玻片上的材料或者同样的细胞都有可能显示出不均衡的荧光。目前已有多种方法用于消除一些组织中的自发荧光:如样品制备过程中,采用的消除自发荧光试剂包括硼氢化钠或者采用光照辐射进行预处理以消除非特异性背景信号。这些消除自发荧光的方法并不完全有效,通常在进行图像分析时通过计算机算术除去自发荧光信号。荧光图像的光谱数据包括真正的信号和许多杂噪,分别进行分析并且通过单独的光谱组分分析除掉杂噪数据。多色FISH 有自身的限制,包括不同的荧光强度和颜色重叠。但是通过计算机算法分析平衡了多色图像,包括强度变化和自动纠正信号重叠。 FISH图像自身的限制并没有影响到自动破译算法的发展。采用序列较大探针进行DNA 位点检测和多色荧光计数算法辅助病理学家实现了自动化分析。此外,检测探针试剂盒和点计数方法的应用为便捷的检测结果提供了一个平台。尽管多种方法已经用于分析或优化自动细胞检测系统,人工的细胞病理检测仍是可信度高的组织分析方法。然而,细胞制备、鉴别、固定介质上细胞样品计算机化检测在未来的医学诊断中的高效益性不容忽视,快速检测细胞内的分子信号只有通过计算机辅助方法进行检测。现在,自动化检测程序已经扩展到采用多基因转录模型检测特异的DNA 簇和转录位点以确定功能细胞的状态。 鉴于FISH 起始阶段的发展主要是探针类型和检测位点的扩展,荧光检测技术将来的发展可能包括检测领域的扩展。荧光图像临床诊断应用需要在检测体系上进一步提高,如探针的结合,照相和分析的自动化,因此避免了不同操作间的误差。样品厚度是荧光显微镜检测样品类型的一个限制因素。近来的激光共聚焦显微镜和光学X射线断层摄影技术要求样品厚度达到1~2mm。一种改进的光学投射X 显微断层摄影技术可以获取到15mm 厚样品的图像扩大了生物学和诊断样品的检测范围。活细胞的RNAs FISH 技术检测也有报道。既可以采用体内释放的荧光集团也可以采用杂交后探针的荧光素进行检测。这两种新方法都可以降低非特异性标记探针存在时的高背景(如活细胞),可以用于追踪mRNA 的合成和转移途径。这些方法较绿色荧光蛋白(Green fluorescence protein, GFP)更易于检测不同靶分子。相对于GFP 活细胞原位杂交检测,FISH 易受到细胞内合成探针的影响。FISH 需要进一步的改进以降低活体基因表达检测时的干扰背景,避免细胞内自身杂交物的干扰。其实完全可以不必考虑FISH 检测和荧光检测蛋白技术的差异,将FISH 技术和荧光蛋白技术结合起来可以同时检测目的核酸和蛋白。 多光子显微技术的应用进一步扩大了荧光图像的应用范围。采用多光子显微镜,激光块可以发射光子聚焦于显微镜两到三次激发目的荧光素。采用近红外激发光可以更深层次穿透生物样品,比可见光对活体样品造成的毒性低。这种新方法的应用已将荧光图像用于活体系统的检测,甚至整个动物体。由于还不能合成生物体标记探针,因此目前生物体内荧光图像的应用只限于检测荧光分子或生物体自发荧光。生物组织在正常的生理或者病理生理过程中产生的自发荧光信号可以作为一种重要的诊断信号。一旦生物体探针成为可能,将会成为鉴别特异核酸序列,进行非入侵诊断,获取诊断图像的一种有力辅助手段。
荧光原位杂交技术(FISH)的基本原理及应用

荧光原位杂交技术(FISH)的基本原理及应⽤我接触“FISH”也是刚刚两年多的时间,作为⼀个“初学者”刚开始接触“FISH”可能跟⼤多数⼈⼀样满脑⼦的疑惑:“FISH”是做什么的?有什么临床作⽤呢?那些红红绿绿的点都是些什么意思?……今天让我们慢慢的去揭开FISH的不太神秘的⾯纱。
1.FISH的前世今⽣在FISH技术问世之前,基于20世纪60年代,放射性核素探针的原位杂交⽅法,检测间期染⾊体和分裂期染⾊体上特定DNA和RNA序列的⽅法,该⽅法存在操做⽐较⿇烦、分辨率有限、探针不稳定、放射性同位素的危害较⾼等问题,故⽬前弃之不⽤。
20世纪80年代⽤⾮放射性半抗原如⽣物素进⾏核酸标记的技术逐渐开展后,探针也开始使⽤这种⾮放射性标记⽅法。
随后FISH技术逐渐开展起来,1986年以后该技术被应⽤于分析细胞分裂期染⾊体铺⽚的DNA序列。
相对于放射性来说,FISH具有稳定性好、操作安全、结果迅速、空间定位准确、⼲扰信号少、⼀张玻⽚可以标记多种颜⾊探针等优点。
这些优点逐渐使FISH成为⼀种研究分⼦细胞遗传学很好的⽅法。
FISH即染⾊体荧光原位杂交(Flourescence in situ hybridization,FISH)是通过荧光素标记的DNA探针与样本细胞核内的DNA靶序列杂交,从⽽获得细胞核内染⾊体或基因状态的信息。
FISH是将传统的细胞遗传学同DNA技术相结合,开创了⼀门新的学科——分⼦细胞遗传学。
(如下图所⽰)2.FISH信号解读-红红绿绿是什么⽬前临床上⽤于FISH检测的探针的荧光素⼤都是绿⾊的和橙红⾊标记,可⼤致分为:染⾊体计数(着丝粒)探针(centromere-enumerationprobes,CEP),位点特异性识别探针(locus-specific identifier probes,LSI),染⾊体涂染(paint,WCP)探针。
其中CEP和LSI探针中的计数探针、融合探针及分离重排探针,在⾎液病诊断与预后分型中最为常⽤。
荧光原位杂交(fish)

荧光原位杂交技术荧光原位杂交技术(fluorescence in situ hybridization),简称FISH。
是利用荧光标记的特异核酸探针与细胞内相应的靶DNA分子或RNA分子杂交,通过在荧光显微镜或共聚焦激光扫描仪下观察荧光信号,来确定与特异探针杂交后被染色的细胞或细胞器的形态和分布,或者是结合了荧光探针的DNA区域或RNA分子在染色体或其他细胞器中的定位。
中文名fish外文名fluorescent in situ hybridization建立时间1986年发展历程1969年,Pardue和John等两个研究小组开始采用放射性标记DNA或28S RNA发明了原位杂交技术(ISH)。
尽管当时原位杂交技术已经具有较高的特异性和灵敏度,但鉴于放射性同位素自身特性的局限,如安全性、空间分辨率低、不稳定性等问题,这项技术仅限于实验室研究方面的应用。
1986年科研工作者开始利用异硫氰酸盐荧光素来标记探针,并在荧光显微镜下进行观察分析,建立了荧光原位杂交技术(FISH)。
1989年,Delong首次使用荧光标记寡核苷酸探针检测单个微生物细胞。
由于FISH技术具有敏感度高、信号强、背景低、快速等优点,该方法在环境微生物的检测中得到了广泛的应用。
随着科技的迅速发展,FISH探针标记物越来越多,不仅从单一荧光发展到多色荧光检测,而且应用范围也进一步扩大,不仅可以用于分裂相细胞而且可以用于间期细胞检测,为FISH技术的临床应用打下了坚实的基础。
操作步骤编辑播报(1)样品的固定;(2)样品的制备和预处理;(3)预杂交;(4)探针和样品变性;(5)用不同的探针杂交以检测不同的靶序列;(6)漂洗去除未结合的探针;(7)检测杂交信号,进行结果分析·荧光信号观察:将处理好的样品置于荧光显微镜下,选择分散较好的区域来观察。
三色(或者更多)荧光激发下,观察到不同颜色的荧光图像。
通常选用20X物镜来扫描样品杂交区域,40X或100X物镜下观察样品,从一定的方向进行计数,并对计数情况进行分析。
免疫荧光原位杂交技术FISH

EGFR基因扩增检测试剂盒 (FISH)
无荧光信号
没有用酶进行处理, 用了不恰当的滤光镜
镜下观察可能出现的问题 没有加入探针(或探针没有经过适当变 性),杂交条件不够恰当 探针不合格(或探针没有适当保存),荧光 显微镜没有适当地起作用
荧光信号微弱
杂交条件不够充分
探针过分稀释造成浓度太低, 没有适当变性,探针和杂交液没有充分 混合,洗涤条件不够恰当(或洗涤太过), 滤光镜不对
37ºC 蛋白酶k
5-30min
洗片
DAPI染色
阅片
脱蜡
石蜡切片浸于二甲苯中3次,每次10分钟 浸入100%的乙醇中5分钟.然后梯度复水
各2分钟 浸入去离子水3分钟
(脱蜡不足会导致探针杂交强度和杂交率降低,荧光背景高等)
预处理
I. 100 ºC沸水处理组织切片30分钟
II. 100ug/mL的蛋白酶K溶液,37 ºC孵育5-30 分钟
有背景荧光 荧光信号计数问题
杂交后洗涤不够充分 洗涤缓冲液盐的浓度过高 洗涤时温度过低
选择分散较好不重叠的细胞计数
IGH/C
HER-2扩增
C-MYC
CBFB基因断裂重组检测试剂盒
探针:GLP CBFB CBFB基因(Core binding factor β,CBFB):核心结合因子 ,位于 16号染色体上。
III. 2*SSC漂洗,梯度脱水各2分钟,干燥玻片.
• 探针变性 • 玻片变性
变性
83 ºC
5min
DAPI复染
杂交
42ºC 湿盒
孵育过夜
洗涤
• 50%甲酰胺 • 2XSSC • 0.1%NP-40 • 75%乙醇
(完整版)Fish实验

FISH-荧光原位杂交实验(原位杂交)实验目的通过实验了解荧光原位杂交技术的基本原理和在生物学、医学领域的应用。
掌握原位杂交技术的操作方法,熟练掌握荧光显微镜的使用方法。
2. 实验原理荧光原位杂交(Fluorescence in situ hybridization FISH)是一门新兴的分子细胞遗传学技术,是20世纪80年代末期在原有放射性原位杂交技术的基础上发展起来的一种非放射性原位杂交技术。
目前这项技术已经广泛应用于动植物基因组结构研究、染色体精细结构变异分析、病毒感染分析、人类产前诊断、肿瘤遗传学和基因组进化研究等许多领域。
FISH的基本原理是用已知的标记单链核酸为探针,按照碱基互补的原则,与待检材料中未知的单链核酸进行特异性结合,形成可被检测的杂交双链核酸。
由于DNA分子在染色体上是沿着染色体纵轴呈线性排列,因而可以将探针直接与染色体进行杂交从而将特定的基因在染色体上定位。
与传统的放射性标记原位杂交相比,荧光原位杂交具有快速、检测信号强、杂交特性高和可以多重染色等特点,因此在分子细胞遗传学领域受到普遍关注。
杂交所用的探针大致可以分为三类:1)染色体特异重复序列探针,例如a卫星、卫星III类的探针,其杂交靶位常大于1Mb,不含散在重复序列,与靶位结合紧密,杂交信号强,易于检测;2)全染色体或染色体区域特异性探针,其由一条染色体或染色体上某一区段上极端不同的核苷酸片段所组成,可由克隆到噬菌体和质粒中的染色体特异大片段获得;3)特异性位置探针,由一个或几个克隆序列组成。
探针的荧光素标记可以采用直接和间接标记的方法。
间接标记是采用生物系标记的dUTP(biotin-dUTP)经过缺口平移法进行标记,杂交之后用藕联的荧光素的抗生物系的抗体进行检测,同时还可以利用几轮抗生物素蛋白—荧光素、生物素化的抗—抗生物素蛋白、抗生物素蛋白—荧光素的处理,将荧光信号进行放大,从而可以检测500bp的片段。
而直接标记法是将荧光素直接与探针核苷酸蔌磷酸戊糖骨架共价结合,或在缺口平移法标记探针时将荧光素核苷三磷酸掺入。
2024荧光原位杂交技术在血液肿瘤中的应用规范(全文)

2024荧光原位杂交技术在血液肿瘤中的应用规范(全文)荧光原位杂交(FISH)技术是基于碱基互补配对原则,利用荧光标记的核酸探针,对待测标本DNA序列进行定位、定性和定量分析的技术,是遗传学异常的主要检测手段之一。
相较于核型分析,FISH技术具有快速、灵敏度高及特异性强的优势,是血液肿瘤诊断和预后判定的重要手段。
为进一步规范FISH技术在血液肿瘤中的应用,中国抗癌协会血液病转化医学专业委员会、中国老年医学学会病理学分会及中华医学会血液学分会组织国内血液学、病理学和检验学专家,制定了FISH 在血液肿瘤中的应用规范。
1 FISH在血液肿瘤诊疗中的应用价值1.1 诊断分型遗传学改变是血液肿瘤诊断分型的主要依据。
急性白血病(AL)、慢性粒细胞白血病(CML)、伴嗜酸粒细胞增多和酪氨酸激酶基因融合的髓系/淋系肿瘤(MLN-TK)、骨髓增生异常综合征(MDS)、大B 细胞淋巴瘤、滤泡淋巴瘤(FL)、套细胞淋巴瘤(MCL)、伯基特淋巴瘤(BL)、边缘区淋巴瘤(MZL)、间变大细胞淋巴瘤(ALCL)、T幼淋巴细胞白血病(T-PLL)等均需要借助FISH检测关键的遗传学异常才能精准分型。
1.2 预后分层目前针对急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)、MDS、慢性淋巴细胞白血病(CLL)、原发性骨髓纤维化(PMF)、多发性骨髓瘤(MM)等血液肿瘤,世界卫生组织(WHO)、美国国立综合癌症网络(NCCN)指南已提出了基于遗传学异常的预后分层/评分体系。
FISH检测在血液肿瘤的预后评估中发挥着不可替代的作用。
1.3 指导治疗CML患者中费城染色体(Ph染色体)或BCR::ABL1融合基因的发现开启了酪氨酸激酶抑制剂(TKI)靶向治疗的新时代。
此外,针对PML::RARA融合基因或其他RARA重排的全反式维甲酸和砷剂、ABL信号通路(ABL1、ABL2、PDGFRA、PDGFRB重排)的TKI药物、JAK-STAT信号通路(CRLF2、JAK1/2/3重排)的JAK抑制剂、FLT3重排的FLT3抑制剂、ALK重排的ALK抑制剂等均已正式应用于临床治疗或处于临床试验阶段。
荧光原位杂交技术(FISH)常见问答

荧光原位杂交技术(FISH)常见问答1.对于FISH操作来说,那些因素比较重要?在FISH中最重要的因素是温度、光照、湿度和各种试剂的PH值。
温度和湿度直接影响着探针和目标DNA的杂交效率;光照影响了荧光染料的强度;各种试剂pH是否符合要求直接关系到FISH的稳定性。
2.在夏季成功检测的同一探针和样本为什么在冬季就得不到理想的效果?发生上述现象最大的可能是FISH操作的环境温度发生了变化导致的。
在我国,冬季普遍比夏季寒冷,低的环境温度使FISH得不到良好的杂交效率。
此外,探针的保存不当也容易引起荧光素的萃灭而导致效果不佳。
因此保证FISH操作中的温度非常重要。
3.该如何保证FISH 操作中的温度?最佳的措施是使用一些FISH的专用仪器进行操作。
如果是手工操作,首先要对FISH操作过程中可能使用的一些仪器进行温控能力的检查,诸如水浴锅、孵箱,对其中不符合要求的要进行更换(疾病诊断中的探针要求温控精度在1度以内)。
其次,要尽可能地保持操作环境温度在20度以上,对于在冬季进行的FISH操作尤为重要。
此外对于需要预热以达到要求温度的试剂,在使用前必须使用温度计对其进行测温。
同时检测的样本最好不能超过4块。
操作中的行动一定要迅速。
操作者还往往忽视一些小部件的温度,诸如载玻片和盖玻片。
特别是在冬季,盖玻片本身温度就低,加之探针的量本就不多(10ul),因此事先没有预热的盖玻片会使得杂交液的温度急剧下降严重地影响了探针和目标DNA的杂交效率。
因此对上述小部件的预热也能有效地提高FISH的杂交效果。
4.使用荧光显微镜观察结果时,最初有清晰而明亮的信号。
但随后信号急剧衰减。
几分钟后信号就消失了。
这是探针本身的质量问题吗?在正常情况下,目前的商业化探针即使是杂交后,如果保存适当,荧光信号能保持半年以上。
出现上述情况主要的原因是操作观察的过程中或是探针的保存过程中没有采取严格的避光措施。
阳光或是强的灯光都会使荧光染料发生急剧的淬灭,从而造成了观察结果的不稳定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
荧光原位杂交技术FISH
1 目的
通过FISH实验检测两条Brd2基因cRNA探针的效价。
2材料与仪器
2.1材料
件为:95℃预变性3 min;95℃变性30 s;50℃退火45 s;72℃延伸45 s;循环30次;
72℃再延伸8 min。
2) 将所有PCR产物经1%琼脂糖凝胶电泳检测,采用凝胶回收试剂盒回收并纯化PCR产
物,并用微量分光光度计测定其浓度。
3) 进行体外转录反应合成Brd2 cRNA探针,20 μL体外转录反应体系如下:RNase
inhibitor 1μL,10×NTP dig labeling mixture 2μL,10×transcription buffer 2μL,Template DNA 13μL,RNA polymerase 2μL。
4) 37℃水浴孵育2 h,取0.5μL于1%琼脂糖凝胶电泳检测。
5) 加入2μL无RNase污染的Dnase I 37℃水浴孵育15 min来消化模板DNA。
6) 加入EDTA 0.8μL,加入5.6μL NH4Oac终止反应,再加入56μL无水乙醇并混匀,于
-80℃放置20 min。
7) 15000 r/min,4℃离心15 min,弃上清,加入700μL 80%的无水乙醇混匀,15000 r/min,4℃
离心10 min沉淀RNA。
8) 干燥后用DEPC处理的水50μL溶解RNA。
合成的两条探针经1%琼脂糖凝胶电泳鉴
定并用微量分光光度计测定探针浓度,于-80℃保存备用。
3.2荧光原位杂交实验检测探针的效果
1) 正常C57BL/6小鼠用1%戊巴比妥钠深麻后,依次以30 mL 0.01 mol/L DEPC-PBS和
100 mL含4%多聚甲醛的磷酸缓冲液(PB)行左心室灌注,小心剥离脑组织,于4℃环境下用上述相同固定液进行后固定过夜,后将组织转移浸没于含30%蔗糖的PB溶液中脱水至沉底。
2) 最后取出组织用OTC包埋,冰冻切片机连续切片至需要的层面,切片厚度30 μm。
3) 选取上述脑组织切片于室温条件下经含有2%H2O2的0.1 mol/L DEPC-PB处理10 min
以阻断内源性过氧化物酶,再用0.1mol/L DEPC-PB室温漂洗10 min,接着用含
0.3%Triton X-100的0.1 mol/L DEPC-PB处理20 min,在用乙酰化液处理10 min,后
于0.1mol/L DEPC-PB中清洗2次,每次10 min,后加入预杂交液,60℃预杂交1 h 以封闭非特异结合位点。
4) 分别于两组切片中加入探针并使探针终浓度为1 μg/mL。
于60℃杂交炉中恒温孵育
16-20 h,同时设立省略探针的空白对照,以上操作严格在无RNA酶环境下进行。
5) 杂交后组织切片置于wash buffer中60℃浸洗2次,每次20 min,接着切片在RNase
buffer中室温孵育5 min,后加入终浓度为20 μg/mL的RNase,37℃作用30 min以消化未结合的cRNA探针。
6) 接下来恒温37℃条件下依次用2×SSC,0. 2×SSC溶液各浸洗切片2次,每次20 min,
再在TS7.5溶液中室温孵育5 min,后置于TBS溶液中室温封闭1 h,加入地高辛抗体(POD-anti-DIG,1:100)室温孵育过夜。
7) 次日于TNT中洗涤3次,每次10 min,在用0.1mol/L PB浸洗10 min,接着进行
TSA-Biotin(1:3000)信号放大反应,后在0.1mol/L PB浸洗10 min,TNT溶液中室温浸洗2次后加入FITC-avidin(1:1000)的TBS溶液避光孵育3 h,后将组织切片于室温条件下TNT溶液中洗涤3次,每次10 min。
8) 在原位杂交完成后,用细胞核标志物DAPI进行衬染。
9) 然后进行裱片、封片,激光共聚焦显微镜下观察,拍照。
4结果分析
图1为荧光原位杂交实验检测两条Brd2基因cRNA探针的效价。
运用标记的两条Brd2 cRNA反义探针,在小鼠脑组织切片进行荧光原位杂交反应,用DAPI进行衬染。
同时设立省略探针的阴性对照。
同样实验条件下,两条反义探针得到杂交结果相一致,在小鼠大脑皮质中可见清晰的绿色的Brd2杂交信号,而省略探针的切片无任何杂交信号。
以上结果表明,所制备的探针具有较好的特异性。
图1荧光原位杂交实验检测两条Brd2基因cRNA探针的效价;A.D为设计的第一条探针;B.E为设计的第
二条探针;C.F组为设立省略探针阴性对照。
