人教版版高中化学选修弱电解质的电离-优质课
合集下载
弱电解质的电离电离方程式的书写课件人教版-高中化学选修四

体中,溶液的导电性变化不大的是(BD)
A.自来水
B.0.5mol/LNH4Cl溶液 C.0.5mol/L 醋酸
D.0.5mol/L盐酸
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
〖课堂练习〗
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
加
正向
CH3COOH
加 水 正向
增大 增大 减小 减小
增大 减小
减小 增大
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
〖课堂练习〗
1、把0.05molNaOH固体分别加入100mL下列液
练习:写出下列电解质电离的方程式: CH3COOH、H2S、Cu(OH)2 、Al(OH)3 CH3COONH4、K2CO3、KHCO3、KHSO4、
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
• 下列电离方程式书写正确的是( )
C
A. BaSO4
Ba2++SO42-
B. H3PO4
3H++PO43-
C. Al(OH)3
H++AlO2-+H2O
D. NaHS=Na++H++S2-
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
A.自来水
B.0.5mol/LNH4Cl溶液 C.0.5mol/L 醋酸
D.0.5mol/L盐酸
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
〖课堂练习〗
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
加
正向
CH3COOH
加 水 正向
增大 增大 减小 减小
增大 减小
减小 增大
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
〖课堂练习〗
1、把0.05molNaOH固体分别加入100mL下列液
练习:写出下列电解质电离的方程式: CH3COOH、H2S、Cu(OH)2 、Al(OH)3 CH3COONH4、K2CO3、KHCO3、KHSO4、
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
• 下列电离方程式书写正确的是( )
C
A. BaSO4
Ba2++SO42-
B. H3PO4
3H++PO43-
C. Al(OH)3
H++AlO2-+H2O
D. NaHS=Na++H++S2-
弱电解质的电离电离方程式的书写课 件人教 版-高中 化学选 修四( 优秀课 件)
高中化学 人教版选修4 课件:第三章 第一节 第2课时 弱电解质的电离(36张PPT)

栏 目 链 接
五、设计实验验证时注意等物质的量浓度和等pH的两种 酸的性质差异。
实验设计思路:以证明某酸(HA) 是弱酸为例
栏 目 链 接
尝试
应用 2.常温下,下列有关酸HA的叙述中,不能说明HA是弱 酸的是( ) ②测0.01 mol/L
栏 目 链 接
①取0.1 mol/L HA溶液,其溶液pH为2 NaA溶液,其溶液pH大于7 泡发光很暗 HA酸加水量多
第三章
水溶液中的离子平衡第一节
第一节 弱电解质的电离
第2课时 弱电解质的电离
栏 目 链 接
1.掌握弱电解质的电离平衡。
2.了解影响电离平衡的因素。
3.了解电离常数的意义。
栏 目 链 接
栏 目 链 接
要点一
1.概念
弱电解质的电离平衡
在一定条件(如温度、浓度一定)下,弱电解质在溶液中 电离成离子 __________的速率和 离子结合成分子 __________ 的速率相等,电离过程 就达到了平衡状态。 2.电离平衡的建立过程(用vt图象描述)
栏 目 链 接
多元弱酸各步电离常数大小的比较为K1≫K2≫K3,因此
多元弱酸的酸性主要由第一步电离所决定 (八字诀:分步进 行,一步定性)。
栏 目 链 接
四、一元强酸与一元弱酸的比较
♨ 特别提示:判断一种酸是强酸还是弱酸时,实质是 看它在水溶液中的电离程度,完全电离即为强酸,不完全电 离即为弱酸。
mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱
酸盐,所以能说明HA是弱酸,故不选;③用HA溶液做导电 性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,
栏 目 不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选; 链 ④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多, 接
五、设计实验验证时注意等物质的量浓度和等pH的两种 酸的性质差异。
实验设计思路:以证明某酸(HA) 是弱酸为例
栏 目 链 接
尝试
应用 2.常温下,下列有关酸HA的叙述中,不能说明HA是弱 酸的是( ) ②测0.01 mol/L
栏 目 链 接
①取0.1 mol/L HA溶液,其溶液pH为2 NaA溶液,其溶液pH大于7 泡发光很暗 HA酸加水量多
第三章
水溶液中的离子平衡第一节
第一节 弱电解质的电离
第2课时 弱电解质的电离
栏 目 链 接
1.掌握弱电解质的电离平衡。
2.了解影响电离平衡的因素。
3.了解电离常数的意义。
栏 目 链 接
栏 目 链 接
要点一
1.概念
弱电解质的电离平衡
在一定条件(如温度、浓度一定)下,弱电解质在溶液中 电离成离子 __________的速率和 离子结合成分子 __________ 的速率相等,电离过程 就达到了平衡状态。 2.电离平衡的建立过程(用vt图象描述)
栏 目 链 接
多元弱酸各步电离常数大小的比较为K1≫K2≫K3,因此
多元弱酸的酸性主要由第一步电离所决定 (八字诀:分步进 行,一步定性)。
栏 目 链 接
四、一元强酸与一元弱酸的比较
♨ 特别提示:判断一种酸是强酸还是弱酸时,实质是 看它在水溶液中的电离程度,完全电离即为强酸,不完全电 离即为弱酸。
mol/L的NaA溶液,其溶液的pH大于7,说明NaA是强碱弱
酸盐,所以能说明HA是弱酸,故不选;③用HA溶液做导电 性实验,灯泡发光很暗,只能说明溶液中氢离子浓度较小,
栏 目 不能说明该酸的电离程度,所以不能说明该酸是弱酸,故选; 链 ④等体积pH=4的盐酸和HA稀释到pH=5,HA加水量多, 接
人教版新课程高中化学选修4《化学反应原理》第三章第一节《弱电解质的电离》说课稿

23科 学设 计 多元化 的评 价 体 系.促使 学生素 质 的全 面发展 。 教 学 评 价 分 为 前 置 评 价 、过程 评 价 和后 置 评 价 ,是 以 教 学 目标 为 依 据 ,对 教 学 过 程 及 结 果 进 行 评 测 的 过 程 ,具 有 反 馈 、 诊 断 、激励 、调 控 和 纠正 等功 能 。在 教学 设 计 的复 杂 系 统 中 ,特 别 是 针 对 非 线 性 的 教 学 过 程 ,评 价 不 能 简 单 地 考 查 对 某 些 书 本 知 识 的 掌握 情况 .而 更应 考 虑 学 生 在 这 一 问 题 上 的认 知 和 学 习 能 力 ,客 观 评 估 学 生 的 学 习方 法 和 效 果 ,允 许 学 生 学 习结
于培 养 学 生 应 用 化 学 知 识 解 决 实 际 问 题 的 能 力 .发 展 学 生 自 主 获 取 知 识 的 愿 望 和 能 力 ,把 知 识 学 习 、能 力培 养 与 情 感 体 验 有 机 结 合 起 来 ,实 现 自我 、社 会 与 自然 的 和 谐 有 着 广 泛 的 意 义 。
墨
Байду номын сангаас
人 教 版 新 课 程 高 中 化 学 选 修 4《化 学 反 应 原 理 》 第 三 章 第 一 节 《弱 电 解 质 的 电 离 》说 课 稿
郭 俊 辉
(通 钢 一 中 ,吉 林 通 化 134003)
一 、 解 读 课 程 标 准 .分 析 教 材 地 位 本 章 内 容 理 论 性 强 ,知 识 点 之 间 环 环 相 扣 、循 序 渐 进 ,理 论 与 实 际 、知 识 与 技 能 并 举 ,而 本 节 内 容 义 是 化 学 平 衡 理 论 的 延 伸 和 拓 展 .是 化 学 平 衡 与 溶 解 平 衡 的桥 梁 和 纽 带 ,是 学 生 学 好 本 章 的前 提 和 基 础 ,有 利 于 引 导 学 生 根 据 已有 的 知 识 和 生 活 经 验 去 探 究 和 认 识 化 学 , 激 发 学 生 探 究 和 学 习 的 兴 趣 对 于 促 进 学 生 学 习 方 式 的 多 样 化 ,建 构 自然 界 物 质 问 相 互 依 存 、相 互 制 约 的 思 想 有 着 重 要 的 作 用 。 电 离 平 衡 知 识 在 生 产 和 生 活 巾有 着 非 常 广 泛 的 应用 ,能 充 分 体 现 化 学 理 沦 对 实 际 的 指 导 作 用 .可 以让 学 生 了 解 化 学 知识 的 社 会 价 值 .对
于培 养 学 生 应 用 化 学 知 识 解 决 实 际 问 题 的 能 力 .发 展 学 生 自 主 获 取 知 识 的 愿 望 和 能 力 ,把 知 识 学 习 、能 力培 养 与 情 感 体 验 有 机 结 合 起 来 ,实 现 自我 、社 会 与 自然 的 和 谐 有 着 广 泛 的 意 义 。
墨
Байду номын сангаас
人 教 版 新 课 程 高 中 化 学 选 修 4《化 学 反 应 原 理 》 第 三 章 第 一 节 《弱 电 解 质 的 电 离 》说 课 稿
郭 俊 辉
(通 钢 一 中 ,吉 林 通 化 134003)
一 、 解 读 课 程 标 准 .分 析 教 材 地 位 本 章 内 容 理 论 性 强 ,知 识 点 之 间 环 环 相 扣 、循 序 渐 进 ,理 论 与 实 际 、知 识 与 技 能 并 举 ,而 本 节 内 容 义 是 化 学 平 衡 理 论 的 延 伸 和 拓 展 .是 化 学 平 衡 与 溶 解 平 衡 的桥 梁 和 纽 带 ,是 学 生 学 好 本 章 的前 提 和 基 础 ,有 利 于 引 导 学 生 根 据 已有 的 知 识 和 生 活 经 验 去 探 究 和 认 识 化 学 , 激 发 学 生 探 究 和 学 习 的 兴 趣 对 于 促 进 学 生 学 习 方 式 的 多 样 化 ,建 构 自然 界 物 质 问 相 互 依 存 、相 互 制 约 的 思 想 有 着 重 要 的 作 用 。 电 离 平 衡 知 识 在 生 产 和 生 活 巾有 着 非 常 广 泛 的 应用 ,能 充 分 体 现 化 学 理 沦 对 实 际 的 指 导 作 用 .可 以让 学 生 了 解 化 学 知识 的 社 会 价 值 .对
高中化学 《弱电解质的电离》(第二课时)课件 新人教版选修4

9
(高考题)0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+ 对于该平衡,下列叙述正确的是( B )
A.加水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1mol/L盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向 移动 10
0.1
1.77×10-5
1.80×10-5
0.421%
1.34%
3
3.量度弱电解质电离程度的化学量:
(1)电离平衡常数: 对于一元弱酸:HA c ( H+) .c( A-) Ka= c(HA) 对于一元弱碱:MOH c ( M+).c( OH- ) Kb= c(MOH) H++A-,平衡时
M++OH-,平衡时
(4)请设计一个实验方案,促使氯气与水反应 的化学平衡向正反应方向移动。
13
三、电离方程式的书写
NaCl = Na++Cl- CH3COOH+H2O H3O++CH3COO-
即CH3COOH
H++CH3COO-
强电解质在溶液中完全电离,用“=” 弱电解质在溶液中部分电离,用“ ” 多元弱酸的电离 应分步完成电离方程式, 多元弱碱则一步完成电离方程式。
如何用平衡移动原理来解释?
19
电离难的原因:
H2CO3 HCO3- H+ + HCO3- H+ + CO32-
a、一级电离出H+后,剩下的酸根阴离子带负电 荷,增加了对H+的吸引力,使第二个H+离子 电离困难的多;
b、一级电离出的H+抑制了二级的电离。 结论:多元弱酸的酸性由第一步电离决定。
(高考题)0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+ 对于该平衡,下列叙述正确的是( B )
A.加水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1mol/L盐酸,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向 移动 10
0.1
1.77×10-5
1.80×10-5
0.421%
1.34%
3
3.量度弱电解质电离程度的化学量:
(1)电离平衡常数: 对于一元弱酸:HA c ( H+) .c( A-) Ka= c(HA) 对于一元弱碱:MOH c ( M+).c( OH- ) Kb= c(MOH) H++A-,平衡时
M++OH-,平衡时
(4)请设计一个实验方案,促使氯气与水反应 的化学平衡向正反应方向移动。
13
三、电离方程式的书写
NaCl = Na++Cl- CH3COOH+H2O H3O++CH3COO-
即CH3COOH
H++CH3COO-
强电解质在溶液中完全电离,用“=” 弱电解质在溶液中部分电离,用“ ” 多元弱酸的电离 应分步完成电离方程式, 多元弱碱则一步完成电离方程式。
如何用平衡移动原理来解释?
19
电离难的原因:
H2CO3 HCO3- H+ + HCO3- H+ + CO32-
a、一级电离出H+后,剩下的酸根阴离子带负电 荷,增加了对H+的吸引力,使第二个H+离子 电离困难的多;
b、一级电离出的H+抑制了二级的电离。 结论:多元弱酸的酸性由第一步电离决定。
化学弱电解质的电离新人教版选修省名师优质课赛课获奖课件市赛课一等奖课件

①加碱②加碳酸钠③加镁或锌
2、有两瓶pH=2旳酸溶液,一瓶是 强酸,一瓶是弱酸.现只有石蕊试液、 酚酞试液、pH试纸和蒸馏水,而没有 其他试剂.简述怎样用最简便旳试验 措施来鉴别哪瓶是强酸:
各取等体积酸液,用蒸馏水稀释相同 倍数,然后用PH试纸分别测其PH值,PH 值变化大旳那瓶是强酸.
hoq827egk
前者方程式后边是阴阳离子,后者是酸碱
④多元弱酸盐电离:
NaHS=Na++HS- HS- ⇌ S2-+H+
例1、〔99MCE〕用水稀释0.1mol/L氨 水时,溶液中伴随水量旳增长而减小旳是( B)
例2、下列溶液中,A、向0.1mol/L氨水中 加入同体积旳水;B、向0.1mol/LKOH溶液中 入同体积旳水;C、向0.2mol/L氨水中加入同 体积旳0.1mol/LHCl;D、向0.1mol/LKOH溶 液中加入同体积旳0.1mol/LHCl。这四种溶液 中,[OH-]由大到小旳正确顺序是:B>A>C>D
A A=B,④反应过程旳平均速率B > A,⑤盐酸里有
锌剩余,⑥醋酸里有锌剩余。 A、③④⑤ B、③④⑥ C、②③⑤ D、②③⑤⑥
⑵ห้องสมุดไป่ตู้离平衡常数 1、概念:
在一定条件下,弱电解质旳电离到达平 衡时,弱电解质电离生成旳多种离子浓度乘 积,跟溶液中未电离旳分子浓度旳比是一种 常数。叫电离平衡常数,简称电离常数,用 K表达。 2、计算式:
二、弱电解 质旳电离平衡
25℃时将0·1mol·L-1HAc溶液中变化某种条件 后各量旳变化情况填入下表:
加入物质 平衡移动方向 H+数 [Ac–] [H+] PH Ka
加水稀释
向右移动
2、有两瓶pH=2旳酸溶液,一瓶是 强酸,一瓶是弱酸.现只有石蕊试液、 酚酞试液、pH试纸和蒸馏水,而没有 其他试剂.简述怎样用最简便旳试验 措施来鉴别哪瓶是强酸:
各取等体积酸液,用蒸馏水稀释相同 倍数,然后用PH试纸分别测其PH值,PH 值变化大旳那瓶是强酸.
hoq827egk
前者方程式后边是阴阳离子,后者是酸碱
④多元弱酸盐电离:
NaHS=Na++HS- HS- ⇌ S2-+H+
例1、〔99MCE〕用水稀释0.1mol/L氨 水时,溶液中伴随水量旳增长而减小旳是( B)
例2、下列溶液中,A、向0.1mol/L氨水中 加入同体积旳水;B、向0.1mol/LKOH溶液中 入同体积旳水;C、向0.2mol/L氨水中加入同 体积旳0.1mol/LHCl;D、向0.1mol/LKOH溶 液中加入同体积旳0.1mol/LHCl。这四种溶液 中,[OH-]由大到小旳正确顺序是:B>A>C>D
A A=B,④反应过程旳平均速率B > A,⑤盐酸里有
锌剩余,⑥醋酸里有锌剩余。 A、③④⑤ B、③④⑥ C、②③⑤ D、②③⑤⑥
⑵ห้องสมุดไป่ตู้离平衡常数 1、概念:
在一定条件下,弱电解质旳电离到达平 衡时,弱电解质电离生成旳多种离子浓度乘 积,跟溶液中未电离旳分子浓度旳比是一种 常数。叫电离平衡常数,简称电离常数,用 K表达。 2、计算式:
二、弱电解 质旳电离平衡
25℃时将0·1mol·L-1HAc溶液中变化某种条件 后各量旳变化情况填入下表:
加入物质 平衡移动方向 H+数 [Ac–] [H+] PH Ka
加水稀释
向右移动
新课程高中化学选修4《化学反应原理》第三章第一节《弱电解质的电离》说课稿

三、教学准备
1、实验材料:醋酸溶液、盐酸溶液、电导率计、PH试纸等。 2、课件制作:PPT课件、教学视频等。
四、教学过程
1、导入:提问导入,询问学生酸和醋酸有什么区别,引出弱电解质的概念 和本节课题。
2、知识讲解:通过PPT展示弱电解质的概念,重点讲解弱电解质的电离平衡 及其影响因素。利用醋酸溶液的实验,引导学生观察现象,了解弱电解质的电离 过程和平衡移动。
4、及时反馈矫正,巩固深化认识。设计的练习有层次、有坡度、容量大, 既符合学生的认知规律,又适合各层面的学生,做到面向全体,使基础差的学生 有所收获,优等生也有用武之地,使全体学生在“成功体验”中有所感悟、有所 发现、有所创新。
三、说教学程序
1、展示目标(2分钟)
目的是让学生明确本节课的学习目标,做到心中有数,有的放矢。
的情境下进行学习,极大的调动了学生的学习积极性、主动性,有效的培养 了学生的创新精神和实践能力。
3、重视实验与媒体辅助,提高教学效率。通过实验和媒体资料可以丰富学 生的感性认识,帮助学生突破难点。如:通过测定醋酸溶液的导电性实验和酸碱 中和滴定实验及醋酸溶液稀释时溶液PH的变化规律实验等来增强学生对弱电解质 电离平衡的理解和掌握。
2、过程与方法:通过实验探究和理论分析,培养学生的观察、分析和推理 能力。
3、情感态度与价值观:培养学生对化学的好奇心和探究欲,认识化学与生 活的密切关系,培养科学态度和社会责任感。
二、教学重难点
1、重点:弱电解质的电离平衡及影响因素。 2、难点:理解电离平衡的建立和移动,以及影响因素的分析。
5、教学关键
关键是抓住弱电解质在水溶液中存在电离平衡,其平衡也和化学平衡一样, 具有“动等、定、变”的特点。
二、说教法与学法
优质课公开课说课稿高中化学选修四第三章第一课弱电解质的电离说课稿
3.问题驱动法:通过提出问题,环环相扣,发散学生的思维, 使其一直处于思考状态,紧跟教师思路。
板书并布置作业 能力训练 知识归纳
实验铺垫
回顾旧知
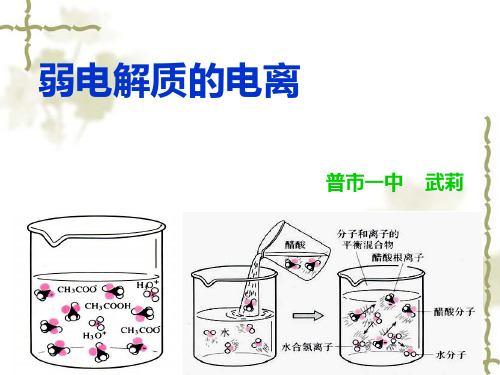
导入新课
1. 强、弱电解质
(1)实验引入
说明
盐酸和醋酸的电离程度不同
推断:在水溶液中,盐酸易电离,醋酸较难电离
(2)图片展示
结论:不同电解质在水中的电离程度是不同的
三、说学法
我们常说:“现代的文盲不是不识字的人,而是没有掌 握学习方法的人”,因而在教学中要特别重视学法的指 导。
1.实验促进法:充分发挥学生主体作用,将教材中演示实验改为学 生实验从而调动学生的积极性,促使学生主动学习。
2.多媒体辅助教学法:用先进的电脑动画将微观现象宏观化, 将瞬间变化定格化,有助于学生的学习。
1.通过小组实验探究培养学生合作精神和自主学习的能力 2.通过探究实验活动及结果分析获得正确认识,体验科学认知过程
3.教学重点、难点 重点:强弱电解质的概念和弱电解质的电离平衡
难点:弱电解质的电离平衡
二、说教法 学的主体
教师
1.教学手段
引导
☆.设置疑问 ☆.充分利用插图和表格 ☆.调动学生积极性
强、弱电解质的概念
2. 弱电解质的电离(以醋酸为例) 实验探究 电离是动态平衡的 溶于水后各粒子的浓度变化 各粒子浓度与时间关系图
(一)电离平衡的概念 及特征
υ υ υ
电离
υ
电离
=
υ ≠0
结合
电离平衡 平衡 结合
t
影响电离平衡的外在因素
化学平衡原理
[知识迁移]0.1mol/L的CH3COOH溶液中 CH3COOH CH3COO- + H+
高二《化学反应原理》第1课时 弱电解质的电离平衡 优质课示范课

HS- H++S2-
。
(1)向H2S溶液中加入NaOH固体时,电离平衡向_右___
移动,c(H+)_减__小___;
(2)向H2S溶液中加入CuSO4溶液时,电离平衡向_右___
体会课堂探究的乐趣, 汲取新知识的营养, 让我们一起 走 进 课 堂 吧!
【实验探究】
等体积、等浓度的盐酸、醋酸与镁条(用砂纸打磨)的反应。 观察、比较气球鼓起的快慢等现象。思考等浓度的盐酸、醋 酸溶液中的H+浓度的大小关系。
【复习回顾】
如何判断某电解质是弱电解质?
(1)弱电解质溶液中,电离出的离子与未电离的分子共存。 (2)某一元酸HA,当浓度为0.1 mol·L-1时,溶液的pH=3。 (3)根据物质的类别判断弱电解质。 弱酸、弱碱、水。 H2CO3、HClO、H2S、HF、CH3COOH、NH3·H2O 、Fe(OH)3等。
已电离的溶质分子数 α = 原有溶质的分子总数 ×100%
电离度表示弱电解质在水中的电离程度。不同的弱电解质 的电离度是不同的,同一弱电解质在不同浓度的水溶液中 其电离度是不同的,溶液越稀,电离度越大。
三、影响电离平衡的有哪些因素
1.内因:电解质本身的性质。 2.外界条件 (1)温度 越热越电离。
Ka1>>Ka2
主要原因:
一级电离出的H+抑制了二级的电离。
【例题分析】
【例题】25℃时醋酸的Ka=1.7×10-5 mol·L-1,求0.10 mol·L-1 的醋酸溶液中H+的浓度。 【提示】结合三段式,利用电离常数的表达式计算。
解:设生成的H+ 物质的量浓度为x。
起始 转化
CH3COOH 0.10 mol·L-1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.电解质与非电解质
• 在水溶液或熔融状态下能导电的电解质都不能导电的非 电解质化合物
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课 人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
课堂实验
实验3- 0.1
1
mol/L
HCl
0.1mol/L
CH3CO OH
与镁条 产生气 产生气
反应的 泡的速 泡的速 现象 度较快 度较慢
• H+的浓度不同。盐酸中 HCl完全电离而醋酸只 是部分发生电离
溶液的 = 1 2~3 pH值
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
课堂实验
• 醋酸的去水垢能力不如盐酸强 , 除了浓度因素外 , 是 否还有其他原因?下面的实验也许可以帮助我们求得一 个合理的解释.
• 分别试验等体积、等浓度的盐酸、醋酸溶液与等量镁条 的反应并测这两种酸的pH.
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课 人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
需注意的几点
• 电解质和非电解质的前提均是化合物 • 电解质和非电解质可溶于水,也可不溶于水 • 电解质为离子化合物和部分共价化合物,而非电解质全
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
•强电解质
•弱电解质
• 一般有:强酸、强碱,活 • 一般有:弱酸、弱碱,少
泼金属氧化物和大多数盐, 部分盐,如:醋酸、一水
如:硫酸、盐酸、碳酸钙、 合氨(NH3·H2O)、醋
硫酸铜等
酸铅、氯化汞。另外,水
其中分别加入:
①适量的盐酸 ② NaOH溶液
③ NH4Cl溶液 ④大量的水
⑤加热
⑥氨气 ⑦CuCl2溶液
对上述电离平衡有什么影响?
加入 盐 物质 酸
NaOH NH4Cl 加大 加热 氨气 溶 液 溶 液 量水
平衡 移动
右
方向
左
左 右右 ?
右?
3.影响电离平衡的因素
(1)温度
升温平衡向电离方向移动。(电离吸热)
• (2)此平衡也是有条件的平衡:当条件改变,平衡被破坏,在新的条件 下建立新的平衡,即平衡发生移动。
• (3)影响电离平衡的因素 • A.内因的主导因素。 • B.外因有: • ①温度:电离过程是一个吸热过程,所以,升高温度,平衡向电离方
向移动。 • ②浓度:
逆 等 动
特点: 定
变
(1)与化学平衡一样,电离平衡也是动态平衡。 (2)化学平衡原理也适用于电离平衡,当浓度等条 件改变时,弱电解质的电离平衡也会发生移动。
是共价化合物 • SO2、CO2、NH3均为非电解质,但它们分别溶于水生
成的H2SO3、H2CO3、NH3.H2O是电解质
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
单击此处添加文本具体内容
什么是电离
• 电解质溶于水或者受热熔化,解离成自由移 动的离子的过程称为电离
• 电解质溶于水时是由于水分子的作用而电离;熔融时是由于热能破坏化学键而电离成自由移动的 离子,都不是因通电而电离的。
四、弱电解质的电离
电离
CH3COOH 结合 思考与讨论:
CH3COO - + H+
1)开始时,V电离 和 V分子化怎样变化?
2)当V电离 = V结合时,可逆过程达到一种什么样的 状态?
画出弱电解质电离的V-t图像
弱电解质电离的V-t图像
V
V电离
V电离= V结合
V结合
电离平衡状态
0
t1
t2
t
1.定义: 在一定条件(如温度、浓度)下, 当电解
是极弱电解质
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
课堂实验
• 盐酸和醋酸是生活中经常 用到的酸. 盐酸常用于卫 生洁具的清洁或去除水 垢. 我们知道醋酸的腐蚀 性比盐酸小 , 比较安全 , 为什么不用醋酸代替盐酸 呢?
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
《弱电解质的电离》
高二一班
褚文静
课标要求
•1.能描述弱电解质在水溶液中的电离 平衡。 •2.了解酸碱电离理论。
课标解读
•1.了解电解质、非电解质及强、弱电 解质的概念。 •2.理解电解质的电离平衡及影响因素。 •3.了解酸、碱电离的特点
单击此处添加文本具体内容
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
单击此处添加文本具体内容
为什么醋酸溶于水时只有部 分分子电离成H+和CH3COO-呢?
CH3COOH H++CH3COO- H++CH3COO- CH3COOH
所以,实际上在醋酸的水溶液中存 在下面的可逆过程:
CH3COOH H++CH3COO-
与化学平衡比较
• (1)电离平衡是动态平衡:即弱电解质分子电离成离子过程和离子结合 成弱电解质分子过程仍在进行,只是其速率相等。
2.强电解质和弱电解质
• 强电解质:在水溶液中,完全电离的电解质 • 弱电解质:在水溶液中,部分电离的电解质 • 通常所说的电解质强弱是按其电离度大小划分的,能够在水
中全部电离的电解质叫强电解质,相反,能够在水中部分电 离的电解质叫弱电解质。所以,已溶解于水的电解质是否完 全电离是区别强电解质和弱电解质的唯一依据。
质分子电离成离子的速率和离子重新结合成分子的速
率相等时,电离过程就达到了平衡状态 —— 电离平衡
逆 弱电解质的电离 动 动定 溶液中各分子、离子的浓度不变 变 条件改变时,电离平衡发生移动。
思考与讨论:
NH3·H2O
NH4 + + OH -
例:在氨水中存在怎样的电离平衡?若向
(2)浓度 弱电解质浓度越大,电离程度越小。
(3)同离子效应 在弱电解质溶液中加入同弱电解质具有相同离 子的强电解质,使电离平衡向左移动
(4)化学反应: 电离平衡向右移动
C例H:3C0O.1OmHol/L的电结C离合H3CCOHO3CHO溶O液- +中H+
• 在水溶液或熔融状态下能导电的电解质都不能导电的非 电解质化合物
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课 人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
课堂实验
实验3- 0.1
1
mol/L
HCl
0.1mol/L
CH3CO OH
与镁条 产生气 产生气
反应的 泡的速 泡的速 现象 度较快 度较慢
• H+的浓度不同。盐酸中 HCl完全电离而醋酸只 是部分发生电离
溶液的 = 1 2~3 pH值
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
课堂实验
• 醋酸的去水垢能力不如盐酸强 , 除了浓度因素外 , 是 否还有其他原因?下面的实验也许可以帮助我们求得一 个合理的解释.
• 分别试验等体积、等浓度的盐酸、醋酸溶液与等量镁条 的反应并测这两种酸的pH.
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课 人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
需注意的几点
• 电解质和非电解质的前提均是化合物 • 电解质和非电解质可溶于水,也可不溶于水 • 电解质为离子化合物和部分共价化合物,而非电解质全
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
•强电解质
•弱电解质
• 一般有:强酸、强碱,活 • 一般有:弱酸、弱碱,少
泼金属氧化物和大多数盐, 部分盐,如:醋酸、一水
如:硫酸、盐酸、碳酸钙、 合氨(NH3·H2O)、醋
硫酸铜等
酸铅、氯化汞。另外,水
其中分别加入:
①适量的盐酸 ② NaOH溶液
③ NH4Cl溶液 ④大量的水
⑤加热
⑥氨气 ⑦CuCl2溶液
对上述电离平衡有什么影响?
加入 盐 物质 酸
NaOH NH4Cl 加大 加热 氨气 溶 液 溶 液 量水
平衡 移动
右
方向
左
左 右右 ?
右?
3.影响电离平衡的因素
(1)温度
升温平衡向电离方向移动。(电离吸热)
• (2)此平衡也是有条件的平衡:当条件改变,平衡被破坏,在新的条件 下建立新的平衡,即平衡发生移动。
• (3)影响电离平衡的因素 • A.内因的主导因素。 • B.外因有: • ①温度:电离过程是一个吸热过程,所以,升高温度,平衡向电离方
向移动。 • ②浓度:
逆 等 动
特点: 定
变
(1)与化学平衡一样,电离平衡也是动态平衡。 (2)化学平衡原理也适用于电离平衡,当浓度等条 件改变时,弱电解质的电离平衡也会发生移动。
是共价化合物 • SO2、CO2、NH3均为非电解质,但它们分别溶于水生
成的H2SO3、H2CO3、NH3.H2O是电解质
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
单击此处添加文本具体内容
什么是电离
• 电解质溶于水或者受热熔化,解离成自由移 动的离子的过程称为电离
• 电解质溶于水时是由于水分子的作用而电离;熔融时是由于热能破坏化学键而电离成自由移动的 离子,都不是因通电而电离的。
四、弱电解质的电离
电离
CH3COOH 结合 思考与讨论:
CH3COO - + H+
1)开始时,V电离 和 V分子化怎样变化?
2)当V电离 = V结合时,可逆过程达到一种什么样的 状态?
画出弱电解质电离的V-t图像
弱电解质电离的V-t图像
V
V电离
V电离= V结合
V结合
电离平衡状态
0
t1
t2
t
1.定义: 在一定条件(如温度、浓度)下, 当电解
是极弱电解质
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
课堂实验
• 盐酸和醋酸是生活中经常 用到的酸. 盐酸常用于卫 生洁具的清洁或去除水 垢. 我们知道醋酸的腐蚀 性比盐酸小 , 比较安全 , 为什么不用醋酸代替盐酸 呢?
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
《弱电解质的电离》
高二一班
褚文静
课标要求
•1.能描述弱电解质在水溶液中的电离 平衡。 •2.了解酸碱电离理论。
课标解读
•1.了解电解质、非电解质及强、弱电 解质的概念。 •2.理解电解质的电离平衡及影响因素。 •3.了解酸、碱电离的特点
单击此处添加文本具体内容
人教版版 高中化 学选修 弱电解 质的电 离-优质 课
单击此处添加文本具体内容
为什么醋酸溶于水时只有部 分分子电离成H+和CH3COO-呢?
CH3COOH H++CH3COO- H++CH3COO- CH3COOH
所以,实际上在醋酸的水溶液中存 在下面的可逆过程:
CH3COOH H++CH3COO-
与化学平衡比较
• (1)电离平衡是动态平衡:即弱电解质分子电离成离子过程和离子结合 成弱电解质分子过程仍在进行,只是其速率相等。
2.强电解质和弱电解质
• 强电解质:在水溶液中,完全电离的电解质 • 弱电解质:在水溶液中,部分电离的电解质 • 通常所说的电解质强弱是按其电离度大小划分的,能够在水
中全部电离的电解质叫强电解质,相反,能够在水中部分电 离的电解质叫弱电解质。所以,已溶解于水的电解质是否完 全电离是区别强电解质和弱电解质的唯一依据。
质分子电离成离子的速率和离子重新结合成分子的速
率相等时,电离过程就达到了平衡状态 —— 电离平衡
逆 弱电解质的电离 动 动定 溶液中各分子、离子的浓度不变 变 条件改变时,电离平衡发生移动。
思考与讨论:
NH3·H2O
NH4 + + OH -
例:在氨水中存在怎样的电离平衡?若向
(2)浓度 弱电解质浓度越大,电离程度越小。
(3)同离子效应 在弱电解质溶液中加入同弱电解质具有相同离 子的强电解质,使电离平衡向左移动
(4)化学反应: 电离平衡向右移动
C例H:3C0O.1OmHol/L的电结C离合H3CCOHO3CHO溶O液- +中H+
