物质在空气和氧气中反应的现象
书写红磷、镁条在空气中燃烧反应方程式及现象

红磷和镁条是我们生活中常见的两种物质,它们在空气中燃烧的反应方程式及现象是化学领域中的一大经典问题。
本文将为大家介绍关于红磷和镁条在空气中燃烧的反应方程式及现象。
一、红磷在空气中燃烧的反应方程式及现象红磷是一种无机化合物,外观呈暗红色或橘黄色。
在空气中燃烧时,红磷会发生化学反应,生成氧化物和氧化物蒸气,并放出大量热能。
1. 反应方程式:红磷(P) + 氧气(O2)→ 三氧化二磷(P4O6)2. 燃烧现象:当红磷与空气中的氧气发生化学反应时,会产生熊熊燃烧的火焰,并伴随着明亮的白色光芒。
红磷燃烧的过程中会产生大量的烟雾,散发出刺鼻的味道。
二、镁条在空气中燃烧的反应方程式及现象镁是一种常见的金属元素,其在空气中燃烧时同样会产生化学反应,并伴随着特有的燃烧现象。
1. 反应方程式:镁(Mg) + 氧气(O2)→ 氧化镁(MgO)2. 燃烧现象:当镁条与空气中的氧气发生化学反应时,会产生明亮灼热的火焰,火焰呈白色,并散发出耀眼的光芒。
在镁燃烧的过程中,还会有爆炸声和炽热的火星飞溅。
镁条燃烧产生的火焰呈蓝白色,光芒十分刺眼。
三、红磷和镁条的燃烧现象对比红磷和镁条在空气中燃烧的过程中,均会和氧气发生化学反应,但其燃烧现象有所不同。
红磷燃烧时所产生的火焰呈现黄色,而镁条燃烧的火焰呈现白色或蓝白色。
镁条燃烧时产生的光芒更为刺眼,燃烧过程也更为激烈。
相较之下,红磷燃烧时所产生的烟雾和味道更加明显。
红磷和镁条在空气中燃烧的反应方程式及现象均为化学领域中的研究重点。
通过对红磷和镁条的燃烧现象进行观察和研究,不仅可以增进对化学反应的理解,还能为工业生产、科研实验提供便利。
对于广大化学工作者和爱好者来说,掌握红磷和镁条在空气中燃烧的反应方程式及现象,对于开拓视野、深化理解化学知识具有重要意义。
四、红磷和镁条燃烧的物理和化学性质1. 温度和能量释放红磷和镁条在空气中燃烧时,释放出的能量和产生的热量都是相当可观的。
这是因为燃烧是一种放热反应,当红磷和镁条与氧气反应时,会释放出大量的热能。
各种常见物质反应现象

各种常见物质反应现象1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。
7.氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
9.用木炭粉还原氧化铜粉末,使生成气体通入澄清石灰水,黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊。
10.一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量。
11. 向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有C1-的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
16.向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成。
17.一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成。
18.在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成。
19.将Cl2通入无色KI溶液中,溶液中有褐色的物质产生。
20.在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
25.细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后生成绿色的溶液。
铁丝在空气和氧气中燃烧的实验现象

铁丝在空气和氧气中燃烧的实验现象以铁丝在空气和氧气中燃烧的实验现象为标题,我们将探讨铁丝在两种气体环境下的燃烧行为,并分析其原因。
1. 实验背景铁是一种常见的金属元素,其具有较高的熔点和燃点。
在正常情况下,铁丝并不会自燃,但当铁丝接触到氧气时,会发生燃烧反应。
为了进一步研究铁丝在空气和氧气中燃烧的实验现象,我们进行了以下实验。
2. 实验设备和方法我们准备了一段铁丝和两个实验室瓶子,一个用于放置空气,另一个用于放置氧气。
首先,我们将一小段铁丝放入空气瓶中,并点燃铁丝的一端。
我们观察到铁丝在空气中燃烧,并产生明亮的火焰。
然后,我们使用同样的方法在氧气瓶中进行实验。
在氧气中,铁丝燃烧得更加剧烈,并产生了更亮的火焰。
3. 实验现象和观察结果在空气中,铁丝燃烧时产生明亮的火焰,火焰呈现出橙色。
然而,在氧气中,铁丝燃烧得更加剧烈,火焰呈现出明亮的白色。
4. 实验结果分析铁丝在空气和氧气中燃烧的实验现象可以通过以下反应方程式来描述:2Fe + 3O2 -> 2Fe2O3在空气中,铁丝与氧气发生反应生成氧化铁(III),即铁丝燃烧的产物为三氧化二铁(Fe2O3)。
这种物质是一种常见的红色粉末,也被称为铁锈。
因此,我们观察到的橙色火焰是由铁丝燃烧产生的氧化铁颗粒所发出的光线。
而在氧气中,由于氧气的浓度更高,铁丝燃烧的速度更快,火焰更加明亮。
这是因为氧气提供了更多的氧供给燃烧反应,使得铁丝燃烧更加充分。
5. 实验结论通过本次实验,我们可以得出以下结论:- 铁丝在空气中燃烧产生的火焰颜色为橙色,燃烧产物为三氧化二铁(Fe2O3),即铁锈。
- 铁丝在氧气中燃烧产生的火焰颜色更亮,燃烧更剧烈,燃烧产物仍为三氧化二铁(Fe2O3)。
6. 实验意义和应用铁丝在空气和氧气中燃烧的实验现象具有重要的科学意义和应用价值。
首先,通过研究铁丝燃烧的机制,我们可以更好地理解金属燃烧的过程和规律。
其次,对于工业中的燃烧过程,如铁制品的焊接、切割等,我们可以利用氧气的高浓度来提高燃烧的效率和速度。
硫在空气中和氧气中燃烧的现象不同的原因

硫在空气中和氧气中燃烧的现象不同的原因硫是一种常见的化学元素,它在自然界中存在于矿石、火山岩等地方。
在空气中和氧气中,硫的燃烧现象是有一些不同的。
我们来看空气中硫的燃烧现象。
当硫与空气中的氧气发生反应时,会产生硫的氧化物,即二氧化硫(SO2)。
这个反应过程可以简单表示为:S + O2 -> SO2在这个反应中,硫原子与氧气分子结合,形成了硫的氧化物。
这个反应是放热反应,也就是产生了热量。
所以,当硫在空气中燃烧时,会产生火焰,并伴随着明亮的火光和热量释放。
而在氧气中,硫的燃烧现象有一些不同。
当硫与纯氧气反应时,同样会产生硫的氧化物二氧化硫。
这个反应过程可以表示为:S + O2 -> SO2与空气中的反应相比,这个反应也是放热反应,产生了火焰和热量。
但是与空气中的燃烧相比,氧气中的燃烧更为剧烈,火焰更明亮,热量释放更大。
这种差异的原因主要是因为空气中的主要成分是氮气,而氧气中则只有氧气分子。
氮气是一种稳定的分子,不容易参与化学反应。
当硫燃烧时,氮气的存在会稀释氧气,减缓反应速度,降低燃烧的剧烈程度。
相反,纯氧气中没有氮气的稀释作用,反应速度更快,燃烧更为剧烈。
空气中还含有其他成分,如水蒸气、二氧化碳等。
这些成分也会对燃烧过程产生影响。
例如,水蒸气可以与硫的氧化物反应,形成硫酸:SO2 + H2O -> H2SO4这个反应会产生酸性物质,对环境产生污染。
而二氧化碳则可以减缓燃烧反应的速度,使燃烧过程相对缓慢。
总结起来,硫在空气中和氧气中的燃烧现象有一些不同。
在空气中燃烧时,硫的燃烧相对较慢,火焰相对较暗,热量释放相对较少。
而在纯氧气中燃烧时,燃烧过程更为剧烈,火焰更明亮,热量释放更大。
这种差异主要是由于空气中的氮气的稀释作用以及其他成分的存在所致。
硫的燃烧现象不仅是化学反应的基本过程,也是我们生活中许多燃烧现象的重要组成部分。
对于了解硫的性质和燃烧过程的差异,具有一定的科学意义和实际应用价值。
物质与氧气反应实验现象的总结
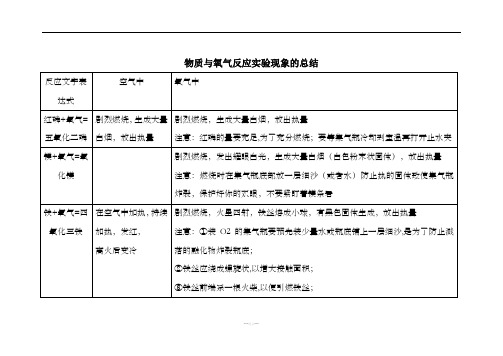
在空气中加热,持续加热ห้องสมุดไป่ตู้发红,
离火后变冷
剧烈燃烧,火星四射,铁丝熔成小球,有黑色固体生成,放出热量
注意:①装O2的集气瓶要预先装少量水或瓶底铺上一层细沙,是为了防止溅落的融化物炸裂瓶底;
②铁丝应绕成螺旋状,以增大接触面积;
③铁丝前端系一根火柴,以便引燃铁丝;
④待火柴将要燃尽时,才能将铁丝由上向下缓慢伸入瓶中;
物质与氧气反应实验现象的总结
反应文字表达式
空气中
氧气中
红磷+氧气=五氧化二磷
剧烈燃烧,生成大量白烟,放出热量
剧烈燃烧,生成大量白烟,放出热量
注意:红磷的量要充足,为了充分燃烧;要等集气瓶冷却到室温再打开止水夹
镁+氧气=氧化镁
剧烈燃烧,发出耀眼白光,生成大量白烟(白色粉末状固体),放出热量
注意:燃烧时在集气瓶底部放一层细沙(或者水)防止热的固体致使集气瓶炸裂,保护好你的双眼,不要紧盯着镁条看
⑤铁丝上不能有漆或有锈,使用前先用砂纸打磨干净.
铁锈是Fe2O3,不会跟O2反应,所以,要除去铁丝表面的锈
碳+氧气=二氧化碳
木炭红热,无烟无焰,生成无色无味的能使澄清石灰水变浑浊的气体,放出热量
剧烈燃烧,发出白光,生成无色无味的,能使澄清石灰水变浑浊的气体,放出热量
注意事项:先将木炭在空气中烧至红热,然后由上到下缓缓伸入充满氧气的集气瓶.这是为了防止因受热膨胀的氧气溢出集气瓶,也可以使木炭充分与氧气接触.
硫+氧气 =二氧化硫
剧烈燃烧,发出淡蓝色火焰,生成有刺激性气味的气体,放出热量
剧烈燃烧,发出蓝紫色火焰,生成有刺激性气味的气体,放出热量
注意:需要给集气瓶内装上少量水,因为硫在氧气中点燃生成二氧化硫,是有毒气体,它溶于水.
(完整版)物质在氧气中燃烧现象归纳
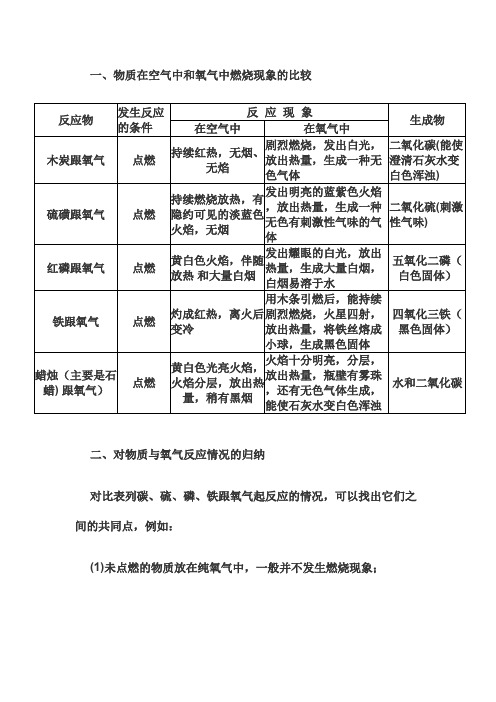
一、物质在空气中和氧气中燃烧现象的比较
二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
反 应 现 象
反应物发生反应的条件在空气中在氧气中
生成物木炭跟氧气
点燃
持续红热,无烟、
无焰
剧烈燃烧,发出白光,
放出热量,生成一种无
色气体
二氧化碳(能使澄清石灰水变白色浑浊)硫磺跟氧气点燃
持续燃烧放热,有
隐约可见的淡蓝色
火焰,无烟
发出明亮的蓝紫色火焰
,放出热量,生成一种
无色有刺激性气味的气
体
二氧化硫(刺激性气味)红磷跟氧气点燃
黄白色火焰,伴随
放热 和大量白烟
发出耀眼的白光,放出
热量,生成大量白烟,
白烟易溶于水
五氧化二磷(白色固体)铁跟氧气点燃
灼成红热,离火后变冷用木条引燃后,能持续
剧烈燃烧,火星四射,放出热量,将铁丝熔成
小球,生成黑色固体四氧化三铁(黑色固体)
蜡烛(主要是石蜡) 跟氧气)
点燃黄白色光亮火焰,
火焰分层,放出热
量,稍有黑烟
火焰十分明亮,分层,
放出热量,瓶壁有雾珠
,还有无色气体生成,
能使石灰水变白色浑浊
水和二氧化碳
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
缓慢的氧化反应例子

缓慢的氧化反应例子
缓慢的氧化反应是指在一定条件下,物质与氧气反应的过程中释放能量的速率较慢。
以下是10个缓慢的氧化反应的例子:
1. 铁的生锈:当铁与空气中的氧气发生反应时,会形成铁的氧化物,即生锈。
这是一个缓慢的氧化反应过程。
2. 苹果变黄:当切开的苹果暴露在空气中时,其中的维生素C会与氧气反应,导致苹果表面逐渐变黄。
3. 木材燃烧:木材在空气中与氧气反应,产生二氧化碳和水蒸气,释放出热能。
这是一个缓慢的氧化反应过程。
4. 铜器氧化:铜器长时间暴露在空气中,会与氧气反应生成铜氧化物,使铜器表面逐渐变绿。
5. 银饰品氧化:银饰品长时间不使用或暴露在空气中,会与氧气反应生成银氧化物,使银饰品表面出现黑斑。
6. 橡胶老化:橡胶制品长时间暴露在空气中,会与氧气发生反应,导致橡胶变硬、变脆。
7. 酒精氧化:酒精暴露在空气中,会与氧气反应生成醋酸,使酒精逐渐失去香味。
8. 油漆氧化:油漆长时间暴露在空气中,会与氧气反应变干,使油
漆表面变得坚硬。
9. 纸张变黄:纸张长时间暴露在空气中,会与氧气反应,导致纸张逐渐变黄。
10. 食物变质:食物长时间暴露在空气中,会与氧气反应导致细菌繁殖,导致食物变质。
以上是10个缓慢的氧化反应的例子,这些反应都是在一定条件下,物质与氧气发生缓慢的氧化反应,释放能量的速率较慢。
这些反应的发生会对物质造成一定的变化,如颜色的改变、质地的变化或物质性质的改变等。
磷在空气和氧气中燃烧的现象不同的原因

磷是一种化学元素,它在空气和氧气中燃烧时表现出不同的现象。
在这篇文章中,我们将探讨磷在空气和氧气中燃烧的原因,以及背后的化学科学原理。
1. 磷在空气中燃烧的原因当磷与空气发生反应时,它在高温下会生成氧化磷(P2O5),这是因为空气中含有氧气和氮气,而氧气是支持燃烧的必要条件之一。
氧气与磷反应生成氧化磷的化学方程式如下:4P + 5O2 -> 2P2O52. 磷在氧气中燃烧的原因与在空气中燃烧不同,磷在纯氧气中燃烧时会产生更明显的火焰和强烈的光。
这是因为氧气是燃烧的氧化剂,它能够更快速、更强烈地促进燃烧反应。
磷在氧气中燃烧生成氧化磷的化学方程式如下:4P + 3O2 -> 2P2O33. 化学反应机理磷在空气和氧气中燃烧的差异主要源于化学反应的机理。
在空气中,氮气的存在会影响燃烧过程,使燃烧反应变得不够充分和高效。
而在纯氧气中,燃烧反应能够更加迅速和充分地进行,因此产生的火焰更加强烈。
这是导致磷在不同条件下燃烧现象不同的关键原因之一。
4. 温度影响除了氧气的影响之外,温度也是影响磷燃烧的重要因素。
在更高的温度下,磷与空气或氧气发生的化学反应会更为剧烈和迅速。
这也解释了为什么磷在高温条件下更容易燃烧,并且产生更加显著的火焰和光亮。
5. 结论磷在空气和氧气中燃烧的现象不同的原因主要包括化学反应机理和温度的影响。
在空气中,氮气的存在影响了燃烧反应的充分进行;在氧气中,燃烧反应更为迅速和强烈。
而温度的变化也会对燃烧过程产生显著影响。
通过对磷燃烧现象的深入理解,我们可以更好地控制和利用这一化学元素,为人类社会的进步和发展做出贡献。
6. 应用领域磷是一种重要的化工原料,广泛应用于农业、医药、军事、化工等领域。
磷化工产业在世界各国的国民经济中占有重要地位。
在农业上,磷是植物的重要营养元素,对于植物的生长发育起着至关重要的作用。
在农业生产中,对于磷的利用和控制也显得尤为重要。
磷化工产品还广泛应用于磷酸盐、磷酸肥料和农药等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
点燃
黄白色光亮火焰,火焰分层,放出热量,稍有黑烟
火焰十分明亮,分层,放出热量,瓶壁有雾珠,还有无色气体生成,能使石灰水变白色浑浊
水和二氧化碳
铁跟氧气
点燃
灼成红热,离火后变冷
用木条引燃后,能持续剧烈燃烧,火星四射,放出热量,将铁丝熔成小球,生成黑色固体
四氧化三铁(黑色固体)
红磷跟氧气
点燃
黄白色火焰,伴随放热和大量白烟
发出耀眼的白光,放出热量,生成大量白烟,白烟易溶于水
五氧化二磷(白色固体)
镁跟氧气
点燃
燃烧、放出大量的热、同时放出耀眼的白光
氧化镁(白色固体)
氢气跟氧气
点燃
淡蓝色的火焰
水(无色液体)
反应物
发生反应的条件氧气中
木炭跟氧气
点燃
持续红热,无烟、无焰
剧烈燃烧,发出白光,放出热量,生成一种无色气体
二氧化碳(能使澄清石灰水变白色浑浊)
硫磺跟氧气
点燃
持续燃烧放热,有隐约可见的淡蓝色火焰,无烟
发出明亮的蓝紫色火焰,放出热量,生成一种无色有刺激性气味的气体
二氧化硫(刺激性气味)
蜡烛(主要是石蜡)跟氧气)
点燃
黄白色光亮火焰,火焰分层,放出热量,稍有黑烟
火焰十分明亮,分层,放出热量,瓶壁有雾珠,还有无色气体生成,能使石灰水变白色浑浊
氧化镁(白色固体)
氢气跟氧气
点燃
淡蓝色的火焰
水(无色液体)
水和二氧化碳
铁跟氧气
点燃
灼成红热,离火后变冷
用木条引燃后,能持续剧烈燃烧,火星四射,放出热量,将铁丝熔成小球,生成黑色固体
四氧化三铁(黑色固体)
红磷跟氧气
点燃
黄白色火焰,伴随放热和大量白烟
发出耀眼的白光,放出热量,生成大量白烟,白烟易溶于水
五氧化二磷(白色固体)
镁跟氧气
点燃
燃烧、放出大量的热、同时放出耀眼的白光
反应物
发生反应的条件
反应现象
生成物
在空气中
在氧气中
木炭跟氧气
点燃
持续红热,无烟、无焰
剧烈燃烧,发出白光,放出热量,生成一种无色气体
二氧化碳(能使澄清石灰水变白色浑浊)
硫磺跟氧气
点燃
持续燃烧放热,有隐约可见的淡蓝色火焰,无烟
发出明亮的蓝紫色火焰,放出热量,生成一种无色有刺激性气味的气体
二氧化硫(刺激性气味)
