(完整版)常见晶胞
(完整版)常见晶胞模型

氯化钠晶体离子晶体(1)NaCI晶胞中每个Na+等距离且最近的Cl-(即Na+配位数)为6个(2)(3)NaCI晶胞中每个CI-等距离且最近的Na+(即CI-配位数)一个晶胞内由均摊法计算出一个晶胞内占有的Na+4个; 占有的CI-4个。
在该晶体中每个Na+周围与之最接近且距离相等的Na+ 与每个Na+等距离且最近的CI-所围成的空间几何构型为CsCI晶体(注意:右侧小立方体为CsCI晶胞;左侧为8个晶胞)(1)CsCI晶胞中每个Cs+等距离且最近的C「(即Cs+配位数)为8个CsCI晶胞中每个CI-等距离且最近的Cs+(即CI-配位数)为8个,这几个Cs+在空间构成的几何构型为正方体。
(2)在每个Cs+周围与它最近的且距离相等的Cs+有6个这几个Cs+在空间构成的几何构型为正八面体。
• Cs* OCI- (3)一个晶胞内由均摊法计算出一个晶胞内占有的Cs+ 1个;占有的CI- 1个CaF2晶体(1))Ca2+立方最密堆积,F-填充在全部四面体空隙中。
(2)CaF2晶胞中每个Ca2+等距离且最近的F-(即Ca2+配位数)为8个CaF2晶胞中每个F-等距离且最近的Ca2+(即F-配位数)为4个(3)一个晶胞内由均摊法计算出一个晶胞内占有的Ca2+4个;占有的F-8个。
ZnS晶体:(1)1个ZnS晶胞中,有4 个S2「,有4个Zn2+(2)Zn2+的配位数为4个, S2_的配位数为4个O£n?,•原子晶体(1) 金刚石晶体a 每个金刚石晶胞中含有 8个碳原子,最小的碳环为 6元环,并且不在同一平面(实际为椅 式结构),碳原子为sp 3杂化,每个C 以共价键跟相邻的_4_个 C 结合,形成正四面体。
键角109° 28'b 、 每个碳原子被12个六元环共用,每个共价键被6个六元环共用c 、 12g 金刚石中有2mol 共价键,碳原子与共价键之比为 (2) Si 晶体由于Si 与碳同主族,晶体Si 的结构同金刚石的结构。
常见的晶体结构及其原胞晶胞

§1-2 常见的晶体结构及其原胞、晶胞1) 简单晶体的简单立方(simple cubic, sc) 它所构成的晶格为布喇菲格子。
例如氧、硫固体。
基元为单一原子结构的晶体叫简单晶体。
其特点有: 三个基矢互相垂直(),重复间距相等,为a,亦称晶格常数。
其晶胞=原胞;体积= ;配位数(第一近邻数) =6。
(见图1-7)图1-7简单立方堆积与简单立方结构单元2) 简单晶体的体心立方( body-centered cubic, bcc ) , 例如,Li,K,Na,Rb,Cs,αFe,Cr,Mo,W,Ta,Ba等。
其特点有:晶胞基矢, 并且,其惯用原胞基矢由从一顶点指向另外三个体心点的矢量构成:(见图1-9 b)(1-2)其体积为;配位数=8;(见图1-8)图1-8体心立方堆积与体心立方结构单元图1-9简单立方晶胞(a)与体心立方晶胞、惯用原胞(b)3) 简单晶体的面心立方( face-centered cubic, fcc ) , 例如,Cu,Ag,Au,Ni,Pd,Pt,Ne, Ar, Xe, Rn, Ca, Sr, Al等。
晶胞基矢,并且每面中心有一格点, 其原胞基矢由从一顶点指向另外三个面心点的矢量构成(见图1-10 b):(1-3)其体积=;配位数=12。
,(见图1-10)图1-10面心立方结构(晶胞)(a)与面心立方惯用原胞(b)4) NaCl结构(Sodium Chloride structure),复式面心立方(互为fcc),配位数=6(图1-11 a)。
表1-1 NaCl结构晶体的常数5) CsCl结构(Cesuim Chloride structure),复式简单立方(互为sc),配位数=8(图1-11 b)。
表1-2 CsCl结构晶体的常数图1-11 NaCl结构和CsCl结构6) 金刚石结构(Diamond structure), 两套fcc格子相互沿对角线位移1/4处套合。
《常见晶胞类型》PPT课件

12
6
3
54
12
6354,源自AB关键是第三层,对第一、二层来说,第三层可以有两种最紧
密的堆积方式。
.
17
第一种是将球对准第一层的球。 下图是此种六方 紧密堆积的前视图
12
A
6
3
54
B
A
于是每两层形成一个周期,
B
即 AB AB 堆积方式,形成六
A
方紧密堆积。
配位数 12 。 ( 同层 6,上下层. 各 3 )
Cu 8×(1/8) + 8×(1/4) = 3
.
Y1
1/8
Cu铜 Ba钡 Y钇 O氧
38
CsCl晶体
在氯化铯晶体中,每个Cl-(或Cs+)周围与之最接近
且距离相等的Cs+(或Cl-)共有 8个 ;这几个Cs+(或 Cl-)在空间构成的几何构型为 立方体 ;在每个Cs+
周围距离相等且最近的Cs+共有 6 个 ;这几个
Cs+(或Cl-)在空间构成的几. 何构型为
正八面体; 39
每个CO2分子周围有多 少个与之最近且等距离
C
B
12
6
3
54
配位数 12 。 ( 同层 6, 上下层各 3 )
A C B A
此. 种立方紧密堆积的前视图 22
A B A
镁型
C B A
铜型
金属晶体的两种最密堆积方式
.
23
金属晶体的原子空间堆积模型4
• 面心立方 (铜型)
.
24
简 单 立 方
(
六
方 密 堆
镁 型
积
)
《常见晶胞类型》课件

晶胞与晶体结构的关系
01
晶胞的形状和内部结构决定了晶 体结构的对称性和空间排列规律 。
02
通过研究晶胞的结构特点,可以 了解晶体的物理性质和化学性质 ,如熔点、导电性、光学性质等 。
常见晶胞类型的特性
01
02
03
简单立方
具有八个顶点,每个顶点 上都有一个原子或分子。
面心立方
具有六个面,每个面上都 有一个原子或分子。
个稳定的四面体结构。
每个原子的配位数为4,即每个 原子与四个相邻原子形成共价键
。
原子间的距离和键角是固定的, 保证了晶胞的稳定性和对称性。
闪锌矿型晶胞的几何特征
闪锌矿型晶胞具有立方晶系结构,其 晶格常数为a=b=c,α=β=γ=90°。
原子间的距离和键角是固定的,保证 了晶胞的稳定性和对称性。
每个面心有一个原子,每个顶点被四 个原子所共享。
是晶胞的角度。
空间群
密排六方晶胞属于P63/mmc空间 群,具有高度的对称性。
原子间距
在密排六方晶胞中,原子间距相等 ,且与晶胞的边长成比例。
05
CATALOGUE
氯化钠型晶胞
定义与特性
定义
氯化钠型晶胞是一种离子晶体结构,由阳离子和阴离子按一定的规律排列而成,具有较高的离子电导 率和热稳定性。
特性
闪锌矿型晶胞是一种立方晶系 结构,其特点是每个顶点被四 个原子所共享,每个面心有一 个原子。
闪锌矿型晶胞具有较高的对称 性,其晶格常数为a=b=c, α=β=γ=90°。
闪锌矿型晶胞的原子排列紧密 ,具有较高的密度和稳定性。
原子排列与配位数
在闪锌矿型晶胞中,每个原子被 其他四个原子所包围,形成了一
《常见晶胞类型》 ppt课件
常见晶体结构彩图

常见晶体结构彩图1.己烷C6H12:碳原子以s骨架,与2个H成C-H键。
2.二茂铁Fe(C5H5)2:上下环戊烯阴离子各以六个π电子参与成键,与Fe对称性匹配的d3p3轨道形成六个分子轨道,Fe其余的三个价轨道为非键的孤对电子占据。
3.B12H122-:12个B形成封闭的三角二十面体,每个B还与1个H形成B-H键。
4.C20H20:每个C以sp3杂化与相邻的3个C、1个H形成s键,整个碳笼为正十二面体。
5.C60:每个C以sp2杂化与相邻的3个C形成球形多面体s骨架(12个五边形与20个六边形),还有1个垂直于曲面的p轨道与其他p轨道形成1个离域的大p键。
6.石墨层内C以共价键与相邻的3个C形成平面骨架,层之间为范德华力。
7.金剛石:为A4结构,每个C以sp3杂化与相邻4个C成四面体配位,晶胞中有8个C原子。
8.NaCl晶体属面心立方点阵,Na+与Cl-的配位数均为6。
Cl-作立方最密堆积,Na+填在Cl-形成的八面体空隙中。
每个晶胞含有4个Cl-和4个Na+,Cl-位于晶胞顶点与面心位置,Na+位于体心与棱心位置。
9.立方ZnS晶体中,S原子作立方最密堆积,Zn原子填在一半的四面体空隙中,形成立方面心点阵,晶胞中含个S原子4个Zn原子;10.六方ZnS晶体中,S原子作六方最密堆积,Zn原子填在一半的四面体空隙中,形成六方点阵,晶胞中含个S原子4个Zn原子。
11.CaF2晶体属立方面心点阵,F-作简单立方堆积,Ca2+数目比F-少一半,填了一半的立方体空隙,每一个Ca2+由八个F-配位,而每个F-有4个Ca2+配位,每个CaF2晶胞有4个Ca2+和8个F-原子。
12.金红石(TiO2)为简单四方结构,Ti4+处在略为变形的氧八面体中,即氧离子作假六方堆积,Ti4+填在它的准八面体空隙中,Ti4+配位数为6,O2-与3个Ti4+配位(3个Ti4+几乎形成等边三角形)。
13.方石英(立方SiO2)构型中的Si,与金刚石结构中C原子一样,形成A4堆积;O原子位于Si-Si连线的中心位置附近,形成三维网络状低密度结构,离子晶体已过渡到共价晶体。
晶胞结构
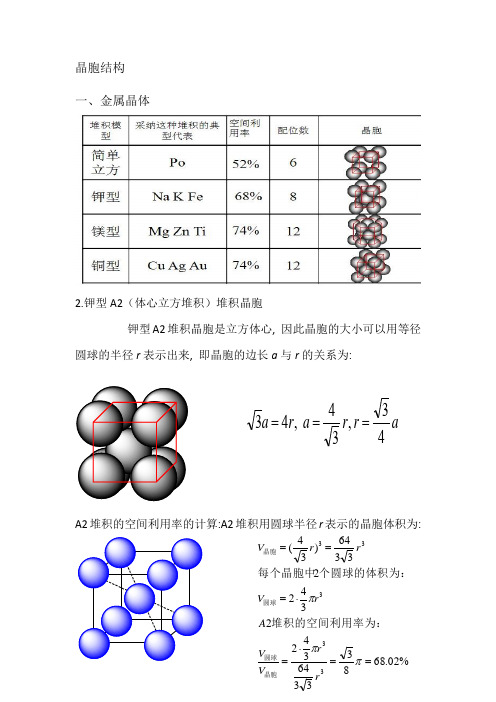
晶胞结构一、金属晶体2.钾型A2(体心立方堆积)堆积晶胞钾型A2堆积晶胞是立方体心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A2堆积的空间利用率的计算:A2堆积用圆球半径r 表示的晶胞体积为:ar r a r a 43,34 ,43===%02.68833364342234223364)34(33333==⋅=⋅===πππr r V V A rV rr V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中3.六方最密堆积(4)A1(面心立方最密堆积)A1是ABCABCABC······型式的堆积,从这种堆积中可以抽出一个立方面心点阵,因此这种堆积型式的最小单位是一个立方面心晶胞。
A1堆积晶胞是立方面心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A1堆积空间利用率的计算:A1堆积用圆球半径r 表示的晶胞体积为:(5)A4堆积形成晶胞A4堆积晶胞是立方面心点阵结构, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A4堆积的空间利用率的计算:A4堆积用圆球半径r 表示的晶胞体积为: ra r a 22 ,42==%05.742312163441344 4216)22(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中ar r a r r a 83,38 ,8243===⨯=%01.34163335123484348 833512)38(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中二、原子晶体1.金刚石立体网状结构,每个碳原子形成4个共价键,任意抽出2个共价键,每两个单键归两个六元环所有,而不是只归一个六元环所有(如图所示,红色的两个碳碳单键,可以构成蓝色和紫红色的两个六元环)。
(完整版)七大晶系详细图解

七大晶系详细图解已知晶体的形态已经超过了四万种,但是万物都会有规律,晶体自然也是有的。
它们都是按七种结晶方式模式发育的,即七大晶系。
晶体即是一种以三维方向发育的的几何体,为了表示三维空间,分别用三、四跟人为添加的轴来表示晶体的长宽高以及中心。
三条轴分别用X、Y 、Z(U)(Z 轴也可叫做“主轴”)来表示,而为了更好表示轴之间的度数,我们用α、β、γ来表示轴角。
就这样出现了七种不同的晶系模式:立方晶系(也称等轴晶系)、四方晶系、三方晶系、六方晶系、正交晶系(也称斜方晶系)、单斜晶系、三斜晶系。
其中又按照对称程度又分为高级晶族、中级晶族、低级晶族。
高级晶族中只有一个立方晶系;中级晶族有六方、四方、三方三个晶系;低级晶族有正交、单斜、三斜三个晶系。
立方晶系立方晶系的三个轴的长度是一样的,即X=Y=Z ,且互相垂直,即α=β=γ=9,0° 对称性最强。
具有4 个立方体对角线方向三重轴特征对称元素的晶体归属立方晶系。
属于立方晶系的有:面心立方晶胞、体心立方晶胞、简单立方晶胞。
这个晶系的晶体并不是只有狭义的正方体一种形状,四面体、八面体、十二面体形状的晶体都属于立方晶系。
它们从不同角度看高低宽窄都差不太多,相对晶面和相邻晶面都相似,横截面和竖截面一样。
最典型立方晶系的晶体为:氯化钠。
常见立方晶系晶体模型图:二、四方晶系四方晶系四方晶系的三条晶轴互相垂直,即α=β=γ=9。
0其°中两个水平轴(X 轴、Y 轴)长度一样,Z 轴的长度可长可短,通俗的说:四方晶系的晶体大多是四棱的柱状体,有的是长柱体,有的是短柱体,即其晶胞必具有四方柱的形状。
横截面为正方形,四个柱面是对称的,即相邻和相对的柱面都是一样的,但和顶端不对称。
所有主晶面交角都是90。
特征对称元素为四重轴。
如果Z 轴发育,它就是长柱状甚至针状;如果两个横轴(X 轴、Y 轴)发育大于Z 轴,那么晶体就会呈现四方板状,最有代表的就是磷酸二氢钠和硫酸镍β了。
常见晶胞类型4解析

金
最活泼的金属是---------- 铯
最稳定的金属是---------- 金
5、决定离子晶体结构的因素
(1)几何因素
晶体中正负离子的半径比. 一般决定配位数的多少:正负离子的半 径比越大,配位数越多. 晶体中正负离子的电荷比. 正负离子电荷比=正负离子的配位数比 =正负离子的数目反比 离子键的纯粹因素
(2)电荷因素
(3)键性因素
晶体中微粒的排列、个数及密度的计算 在氯化钠晶体中, 每个Na+周围与 之最接近且距离 相等的Cl-共有 6 个;这几个 Cl-在 空间构成的几何 构型 为 正八面体 。
白磷的键角为多少?Wg白磷中磷磷单键的数 目为多少? 60° (W/124) ×6 ×NA
CaF2 晶体中正离子的配位数8,负离子的配位 4 数为 。 TiO2晶体中正离子的配位数为6,负离子的配 位数为多少? 3 ZnS晶体中负离子的配位数是4,正离子的配位 数为多少? 4
石墨是层状结构的混合型晶体
( 六 方镁 密型 堆 积 )
金属晶体的四种堆积模型对比
4、几种常见的离子晶体的晶胞结构:
(1)氯化钠型晶胞
Na+ Cl-
钠离子和氯离子在晶胞中的位置: 氯离子:体心和棱中点; 或者反之;交错排列 钠离子:面心和顶点.
每个NaCl晶胞含Na+、Cl-的个数?
Na+ Cl-
计算方法:均摊法 顶点占1/8;棱占1/4;面心占1/2;体心占1 Na+:
单质硼有无定形和晶体两种,参考下列数据回答:
金刚石 晶体硅 晶体硼
熔点(K) 沸点(K) 硬度(moh)
>3823 5100 10
1683 2628 7 .0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见晶胞
类
型
实例
结构
要点
原子晶体
金刚石
1、每一个碳原子采用 杂化与其他 个碳原子等距离紧邻,由非极性键结合成的最小环的结构中有 个碳原子。
平均每个碳原子被 个六元环共用,每根C-C 键被 个六元环共用。
2、1mol 金刚石中,碳碳键为 mol 。
二氧 化硅
1、每一个硅原子紧邻 个氧原子,每一个氧原子紧邻 个硅原子,形成了由Si-O 键(极性或非极性)键构成的 元环的最小环状结构。
一个环上有 个硅原子, 个氧原子。
2、1molSiO 2中,硅氧键为
mol 。
分子晶体
干冰
1、一个二氧化碳晶胞中含有 个二氧化碳分子
2、二氧化碳晶胞中与二氧化碳最近的二氧化碳分子有 个
C 60
1、一个C 60分子中含有____根双键,____根单键。
2、C 60晶胞中与一个C 60最近的C 60分子有___个
冰
1、一个水分子形成
________
个氢
键,平均1mol冰中含有mol 氢键。
ZnS 1、每个锌离子紧邻个硫离子,每一个硫离子又紧邻个锌离子,这些锌离子或硫离子构成了体。
2、锌离子的配位数为
离子晶体NaCl
1、每个钠离子紧邻个Cl-,每
个Cl-又紧邻个Na+,这些氯离
子或Na+构成的空间几何构型
是;2、与每一个Na+等距离的
围绕且又最近的Na+为
个;同理Cl-也然。
CsCl
1、每一个Cl-紧邻个Cs+,
每一个Cs+紧邻个Cl-,这
些Cs+或Cl-构成了体。
2、与每一个Cs+(或Cl-)等距离
的围绕且又最近的Cs+(或Cl-)
为个,这些Cs+(或Cl-)构
成的空间构型是体。
CaF2
1、1个晶胞中含有个Ca2+,
个F-,Ca2+的配位数为个,
F-配位数为个
2、设CaF2晶胞边长为a pm,
求晶体密度为g/cm3
金属晶体
简单立方堆积
1、代表物质: Po
2、空间利用率:
3、配位数:
体心立方堆积
1、代表物质: Na 、K 、Fe 、W
2、空间利用率:
3、配位数:
六方密堆积
ABABAB
1、代表物质: Mg 、Zn 、Ti
2、空间利用率:
3、配位数:
面心立方密堆积
ABCABC
1、代表物质: Cu 、Ag 、Au
2、空间利用率:
3、配位数:
混合晶体
石墨
1、碳原子的杂化方式为 ,键角为 。
2、在石墨晶体的片层结构中,每个六元碳环占有的碳原子数为 个,每个六元碳环所含有的共价健数是 个。
