第一章 化学基本概念和定律习题
初三化学第一章练习题答案

初三化学第一章练习题答案题目一:物质与能量1. 定志志说,物质无法被创建或销毁,只能通过化学反应进行转化。
这个说法对吗?答案:正确。
根据物质守恒定律,物质无法被创建或销毁,只能转化成其他形式。
2. 搅拌均匀的盐水属于什么类型的混合物?答案:搅拌均匀的盐水属于均匀混合物。
3. 是否能量可以被创建或销毁?答案:能量也符合守恒定律,无法被创建或销毁,只能从一种形式转化为另一种形式。
题目二:物质纯净度和粒子模型1. 化学中的纯净物指的是什么?答案:化学中的纯净物指的是只包含一种物质的物质。
2. 水可以通过加热变成水蒸气,这个过程属于物质的什么形式转化?答案:水加热变成水蒸气属于物质的相变。
3. 描述一下固体的粒子模型。
答案:固体的粒子模型是指粒子排列紧密,无规则运动,既不能自由流动也不能互相脱离的物态。
题目三:纯净水的制备和净化1. 纯净水的制备方法有哪些?答案:纯净水的制备方法包括蒸馏法、离子交换法和反渗透法等。
2. 纯净水的用途有哪些?答案:纯净水可用于实验室的化学实验、医疗设备的洗涤、饮用水的生产等多个领域。
3. 描述一下纯净水的特点。
答案:纯净水不含有任何溶质,呈无色、无味、无臭的状态,并且具有良好的导热性和电导性。
题目四:化学反应与能量变化1. 化学反应中释放出的热量被称为什么?答案:化学反应中释放出的热量被称为反应热。
2. 写出常见的放热反应的例子。
答案:常见的放热反应包括燃烧反应、酸碱中和反应等。
3. 化学反应与能量变化之间的关系是什么?答案:化学反应常常伴随着能量的变化,可以是吸热反应(吸收热量)或放热反应(释放热量)。
题目五:化学方程式1. 化学方程式的作用是什么?答案:化学方程式用于描述化学反应中物质的种类、相对分子数以及反应前后的状态变化等。
2. 化学方程式中,"->"代表什么?答案:化学方程式中,"->"表示反应产物的生成方向。
初中化学中考总复习 基础篇第1章 化学基本概念和原理
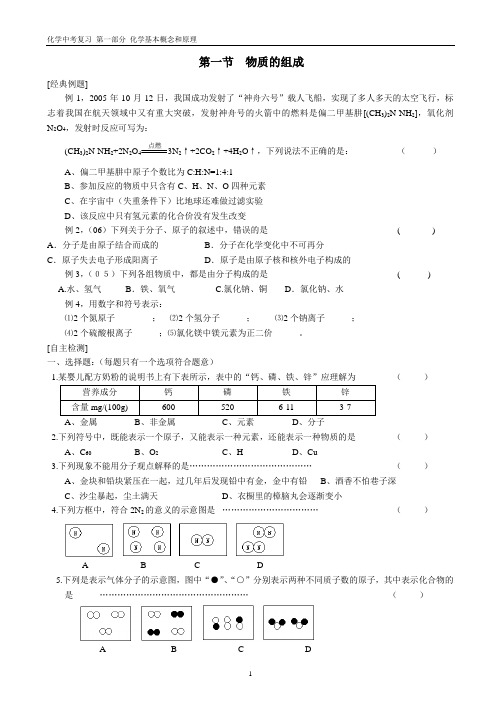
化学中考复习第一部分化学基本概念和原理第一节物质的组成[经典例题]例1,2005年10月12日,我国成功发射了“神舟六号”载人飞船,实现了多人多天的太空飞行,标志着我国在航天领域中又有重大突破,发射神舟号的火箭中的燃料是偏二甲基肼[(CH3)2N-NH2],氧化剂N2O4,发射时反应可写为:(CH3)2N-NH2+2N2O4点燃3N2↑+2CO2↑+4H2O↑,下列说法不正确的是:()A、偏二甲基肼中原子个数比为C:H:N=1:4:1B、参加反应的物质中只含有C、H、N、O四种元素C、在宇宙中(失重条件下)比地球还难做过滤实验D、该反应中只有氢元素的化合价没有发生改变例2,(06)下列关于分子、原子的叙述中,错误的是( ) A.分子是由原子结合而成的B.分子在化学变化中不可再分C.原子失去电子形成阳离子D.原子是由原子核和核外电子构成的例3,(05)下列各组物质中,都是由分子构成的是( )A.水、氢气B.铁、氧气 C.氯化钠、铜 D.氯化钠、水例4,用数字和符号表示:⑴2个氮原子______ ;⑵2个氢分子______;⑶2个钠离子______;⑷2个硫酸根离子______;⑸氯化镁中镁元素为正二价______。
[自主检测]一、选择题:(每题只有一个选项符合题意)1.某婴儿配方奶粉的说明书上有下表所示,表中的“钙、磷、铁、锌”应理解为()A、金属B、非金属C、元素D、分子2.下列符号中,既能表示一个原子,又能表示一种元素,还能表示一种物质的是()A、C60B、O2C、HD、Cu3.下列现象不能用分子观点解释的是……………………………………()A、金块和铅块紧压在一起,过几年后发现铅中有金,金中有铅B、酒香不怕巷子深C、沙尘暴起,尘土满天D、衣橱里的樟脑丸会逐渐变小4.下列方框中,符合2N2的意义的示意图是……………………………()A B C D5.下列是表示气体分子的示意图,图中“●”、“○”分别表示两种不同质子数的原子,其中表示化合物的是……………………………………………()A B C D化学中考复习 第一部分 化学基本概念和原理6.纽约大学的科学家最近研制出有“双腿”、能在盘子里“散步”的分子机器人,它是由26个氨基酸结合而成的多肽分子,下列说法正确的是……( )A 、这种分子机器人是一种新型分子B 、我们可以用肉眼直接看到这个分子“散步”C 、分子本身是不会运动的,其“散步”是在人的推动下进行的D 、这种分子组成物质是一种单质 7.维生素C (化学式为C 6H 8O 6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,下列说法不正确的是……………………( )A 、维生素C 不属于氧化物B 、维生素C 中碳、氢、氧三种元素质量比为6:1:12C 、每个维生素C 分子中由6个碳原子、8个氢原子、6个氧原子构成D 、青少年要多吃蔬菜和水果补维生素C ,切忌偏食8.20世纪20年代,就有人预言可能存在由4个氧原子构成的氧分子(O 4),但一直没有得到证实。
九年级化学上册第一章知识点+习题

1-1物质的变化和性质思维导图重点知识点细讲1、化学则是研究物质的组成、结构、性质以及变化规律的科学。
化学研究物质及其变化,它不仅要研究自然界中已经存在的物质及其变化,还要根据需要研究和创造自然界中不存在的新物质。
2、化学的发展史:古代化学→近代化学→现代化学(冶金、火药、造纸)(原子一分子论)(元素周期律、物质结构理论)3、1869年俄国化学家门捷列夫发现了元素周期律并编制出元素周期表。
4、初中阶段要求了解的科学家人名:道尔顿:提出原子论阿伏伽德罗:提出分子学说门捷列夫:发现了元素周期律并编制了元素周期表屠呦呦:青蒿素侯德榜:侯氏制碱法张青莲:测定相对原子质量拉瓦锡:测定空气中氧气的含量5、物理变化(如挥发、熔化、融化)与化学变化(如燃烧、生锈、变质、酿酒):有无新物质生成6、物理性质(颜色、气味、状态、硬度、密度、熔点、沸点、溶解性、挥发性、导电性、吸附性等)与化学性质(可燃性、氧化性、还原性、稳定性、酸性、碱性等)。
常考考点考点一化学变化和物理变化【例1】《中国诗词大会》弘扬了中国传统文化。
下列诗句反映的物质变化主要为化学变化的是( )A.千淘万漉虽辛苦,吹尽狂沙始到金B.千锤万凿出深山,烈火焚烧若等闲C.花气袭人知骤暖,鹊声穿树喜新晴D.无边落木萧萧下,不尽长江滚滚来【一隅三反】1.下列变化中,属于物理变化的是()A.酿造酸奶B.水果榨汁C.蜡烛燃烧D.葡萄酿酒2.下列是常见仪器在实验室的对话,其中发生了化学变化的是()A. 试管:“同学们不爱惜我,我被摔碎了。
”B. 铁架台:“好难受啊!我在潮湿的空气中生锈了。
”C. 烧杯:“热死了,我装的冰块不见了。
”D. 漏斗:“滤液好浑浊呀!我嘴里的滤纸破了。
”3.下列变化属于化学变化的是()A.干冰升华 B.海水晒盐C.蔗糖溶解于水D.葡萄酿酒考点二化学性质和物理性质【例2】学习科学知识可以用来辨别“真”“伪”。
下列叙述属于“真”的是( ) A.氮气的化学性质不活泼,可用作粮食瓜果保护气 B.氧气具有助燃性,常作火箭推进燃料C.氢氧化钠具有碱性,可用于治疗胃酸过多 D.活性炭具有吸附性,可使硬水软化【一隅三反】1.下列判断错误的是( )A.NaOH固体有吸水性——物理性质B.NaOH固体为白色片状——物理性质C.NaOH固体溶于水得到的溶液显碱性——物理性质D.NaOH固体放在空气中易变质——化学性质2.下列性质中,属于化学性质的是()A.可燃性B.密度C.熔点D.硬度3.下列一些物质的自我介绍,其中介绍自己化学性质的是()A. B. C. D.考点三物质的性质和用途【例2】下列物质的用途,主要利用其化学性质的是()A.氮气可用作焊接金属的保护气 B.干冰用作人工降雨C.汽油可用于擦拭衣物上的油污 D.活性炭可除去冰箱中的异味【一隅三反】1.下列各图中物质用途与相应性质关系的叙述不相符的是()选项A:用氧气切割金属B:石墨做电池电极C:N2用于超导实验车D:CO2做气体肥料性质氧气有可燃性石墨能导电液氮沸点低CO2参与光合作用2.下列物质的用途与性质对应不正确的是()物质用途性质A 二氧化碳作气体肥料二氧化碳既不燃烧也不支持燃烧B 熟石灰改良酸性土壤熟石灰能与酸发生中和反应C 小苏打治疗胃酸过多小苏打能与盐酸反应D 氮气焊接金属时做保护气氮气的化学性质不活泼3.物质常见的性质包括:①颜色;②气味;③水溶性;④导电性;⑤可燃性;⑥助燃性;⑦毒性等.请选择以上序号填空。
化学基本概念和定律习题

第一章 化学基本概念和定律习题一.选择题1. 下列有关同位素的说明中,正确的是( ) A. 质量数相等,原子序数不同,化学性质相似 B. 质量数和原子序数都相等,化学性质不同 C. 质量数不相等,原子序数相等,化学性质相似 D. 质量数不相等,原子序数相等,化学性质不同2. 原子的摩尔质量,正确的描述是指( )A. 任何一摩尔原子的质量B. 标况下,一摩尔原子的质量C. 含有阿佛加德罗数目个原子的质量D. 数值上等于原子量,单位为g·mol -1的质量3. 一种未知气体,在一台扩散仪内以15.0mL·s -1的速度扩散,而此仪器内甲烷气体以30.0mL·s -1的速度扩散,则未知气体的分子量为( ) A. 64 B. 32 C. 144 D. 72 4. 完全中和10升0.01mol·L -1 H 2SO 4需NaOH 的物质的量为( ) A. 0.2mol B. 2mol C. 0.5mol D. 0.4mol 5. 与20克SO 3所含氧原子个数相同的CO 2的质量为( ) A. 33克 B. 44克 C. 16.5克 D. 22克6. 3.1克磷与氯气反应,生成PCl m 和PCl n 混合物,已知PCl m 和PCl n 的物质的量之比为3:2,则PCl m 和PCl n 的物质的量分别为( )A. 3B. 2C. 0.06D. 0.04E. 0.057. 一种未知气体,在一台扩散仪内以15.0mL·s -1的速度扩散,而此仪器内甲烷气体以30.0mL·s -1的速度扩散,则未知气体的分子量为( ) A. 64 B. 32 C. 144 D. 728. 将等体积的氧气和氢气放入钢瓶中,此时的温度为423K ,压力为20.26kPa ,经点燃爆炸并恢复到原来的温度,则P 总, P2O分别为( )kPaA. 10.133B. 15.199C. 5.066D. 0.1E. 0.05 9. 将100kPa 压力下的氢气150mL 和45kPa 压力的氧气75mL 装入250mL 的真空瓶,则氢气和氧气的分压分别为( )A. 13.5B. 27C. 60D. 72.5E. 14510.实际气体接近理想气体的条件是( )A. 低压高温B. 高压低温C. 低温低温D. 高温高压11.下列关于分子论的论点,正确的是( )A. 一切物质都是由分子组成的B. 分子是保持原物质性质的最小微粒C. 分子是保持原物质化学性质的微粒D. 以上论述都不正确12.分子和原子的本质区别是( )A. 原子比分子的体积小B. 原子比分子的质量小C. 分子能不断地运动,原子则不能D. 分子在化学反应中,可以变成另一种分子,而原子则不能13.下列叙述错误的是( )A. 由同种元素的原子构成的纯净物称单质B. 由不同种元素的原子构成的纯净物称化合物C. 纯净的石墨晶体由C-12,C-13,C-14构成碳单质D. 纯净的氧中含少量的臭氧构成氧单质14.某元素的原子序数为83,该元素的一个原子必然含有( )A. 42个质子和41个中子B. 1个中子,41个质子和41个电子C. 83个电子D. 42个中子和41个质子15.多核素元素的几种核素,在其原子核中具有( )A. 相同的质子数,但中子数不同B. 相同的质量数,但原子序数不同C. 相同的质子数,电子数不同D. 相同的中子数,但质子数不同16.H-1,H-2,H-3与O-16,O-17,O-18六种核素,组成水的分子类型总数是( )A. 9种B. 8种C. 18种D. 27种17.核素C-12的原子质量为12.0000u,丰度为98.89%,核素C-13的原子质量为13.0033u,丰度为1.109%,则碳的平均原子量为( )A. 13.0008,B. 12.011C. 13.0045D. 12.05018.分子量为58的化合物,含5/29(质量)的氢,其余为碳,这个化合物的一个分子中氢原子的数目为( )A. 5B. 4C. 8D. 1019.有一元素X,它与氧化合形成分子式为X4O 的化合物,如果8.40千克的X与6.50千克的氧恰好完全化合,则元素X的原子量是( )A. 24.0B. 31.0C. 54.4D. 70.320.一定温度和压力下,2.00克CO2体积为1.12升,同温同压下,2.00克某气体体积为0.77升,已知CO2分子量为44,则该气体的分子量为( )A. 64B. 34C. 18.8D. 8021.氯的平均原子量为35.453,自然界存在的氯的同位素仅有Cl-35,Cl-37则Cl-35,Cl-37在自然界的丰度比近似为( )A. 1:4B. 3:1C. 4:3D. 3:222.标状下,25升气体的质量是0.050kg,则与气体的分子量最接近的数值是( )A. 22:B. 34:C. 45:D. 56.23.下列叙述正确的是( )A. "物质的量"就是某物质的摩尔质量B. "物质的量"的单位是摩尔C. 标况下,1摩尔物质的质量才是摩尔质量D. "物质的量"与物质的质量的关系是通过摩尔质量联系起来的24.下列说法正确的是( )A.1mol任何气体的体积都是22.4LB.1mol任何气体的体积都约是22.4LC. 标准状态下,1mol任何气体的体积都约是22.4LD. 标准状态下,1mol任何气体的体积都是22.425.一定量的某气体,压力增为原来的4倍,绝对温度是原来得2倍,那么气体体积变化的倍数是( )A. 8B. 2C. 12D.1826.下列叙述错误的是( )A. 一种气体产生的压力,与其它气体的存在有关B. 一种气体产生的压力,与其它气体的存在无关C. 混合气体的总压力为各气体的分压力之和D. 各组分气体的分压力等于总压与该组分的摩尔分数之积27.初始压力为101.3kPa的N2(g) 1升和CO2(g) 1升装入一个单向抽空的0.5升容器中,如温度保持不变,N2(g)的分压为( )A. 101.3kPaB. 202.6kPaC. 303.9kPaD. 405.2kPa28.一敞开烧瓶在280K时充满气体,要使13气体逸出,则应将温度升高到( )A. 400KB. 300KC. 420KD. 450K29.合成氨原料气中,H2,N2比为3:1(体积比),除此二种气体外,还含有杂质气体4%,原料气总压为15198.75kPa,则N2,H2的分压分别为( )A. 4217.0kPaB. 3647.7kpaC. 3500kpaD. 11399.1kPaE. 10943.1kPa30.可使气体扩散速度增大的因素为( )A. 增加气体的质量B. 加入催化剂C. 升高气体的温度D. 恒温恒压下加入其它气体31.标况下某气体1.12升,质量为1.25克,则H2的扩散速度是同条件下该气体扩散速度的( )倍A. 12.50B. 0.08C. 3.54D. 0.3532.一未知气体在一台扩散仪器内以10米/秒的速度扩散,在此仪器内,CH4气体以30米/秒的速度扩散,此未知气体的分子量为( )33.银有质量为106.902u和108.900u两种同位素,以知银元素的原子量为107.870,求质量为106.902u的同位素的丰度为( )A. 51.35%B. 48.65%C. 60.25%D. 39.75%34.用氢还原某n价金属氧化物时,1克氢气能还原m克氧化物,则该氧化物中金属的原子量是( )A. (m-8)nB. (8-m)nC. mn+8nD. (m-16)n35.某主族元素最高价含氧酸的化学式为HRO3,该元素R能与氢生成氢化物,其中氢的含量为17.76%,那R的原子量为( )A. 7B. 14C. 31D. 7536.用足量的金属还原m克某金属氧化物R2O3 ,得n克金属R,则R的原子量为( )A.48n(m-n)B.24n(m-n)C. (m-n)24nD.(m-n)48n37.欲配制1升含NH310%的氨水,(d=0.96g·mL-1),标准状况下,需NH3的体积为( )A. 253升B. 126.5升C. 63.25升D. 0.1265升38.373K与98658.6Pa压力下,一物质蒸气密度d=0.5977克/升,该物质的分子量( )A. 64B. 34C. 144D. 18.839.关于摩尔的概念,下列说法正确的是( )A. 摩尔是计量一系统物质中所含基本单元数量多少的数量单位B. 摩尔既是计量一系统物质中所含基本单元数量多少的数量单位,又是表示它们质量大小的质量单位C. 摩尔是"物质的量"的单位,它是一系统的物质的量,该系统中所含的基本单元数与0.012kg C-12的原子数目相等D. 摩尔是一个质量单位40.在相同条件下,2.00L某气体质量为3.04克,8L的N2的质量为10克,则该气体的分子量为( )A. 17B. 34C. 68D. 13641.一个20升的氧气钢瓶,未使用前其压力为1.52×107Pa,(室温293K时) 使用一段时间后,钢瓶内压力降为2.03×105Pa,则用掉的氧气的质量为( )A. 3.461B. 1.825C. 1.731D. 0.913二.计算题1.将含有硝酸铜和铜粉的混合物若干克在空气中加热,使其充分反应,结果反应前后质量未变,求原混合物中铜和硝酸铜的摩尔百分组成. (原子量: N:14 O:16 Cu: 64)2.300K,101.325kPa下,一烧瓶充满氮气的质量为0.050426kg,在相同条件下,充满氢气为0.049888kg,则烧瓶的体积为多少升?3.将含等摩尔氮气和氢气的混合气体通入一反应器,在30397.5kPa下反应,若氢气反应掉20%,这时反应器内的压力为多少?4.将等体积混合的SO2(g),O2(g)的混合气体,通过接触器,有90%的SO2变为SO3,求混合气体中各气体的体积分数。
期末复习第一部分 基本概念和原理答案

初三化学期末复习第一部分基本概念和原理成煤气、煤焦油、焦炭、7石油蒸馏、8干冰升华。
A氢气能在空气中燃烧、B铁在潮湿的空气中易生锈、C碳酸不稳定、D古字画不易退色、E二氧化碳能溶于水、F活性炭具有较强的吸附性、G碳在氧气中燃烧。
6.氧化反应和还原反应——碳还原氧化铜:化学方程式C + CuO高温2Cu + CO2↑C: 得氧、发生氧化反应、具有还原性、是还原剂CuO: 失氧、发生还原反应、具有氧化性、是氧化剂7.质量守恒定律:(1)内容:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
(2)微观解释:在任何化学反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变。
(3)应用:①A+B=2C, 10克A跟4克B 完全反应生成14克C。
②A+B=C+2D,10克A跟6克B完全反应生成8克C和8克D。
8.燃烧是可燃物与氧气发生的一种发光、放热的剧烈的氧化反应。
9.燃烧必须同时具备三个条件:(1)可燃物;(2)与氧气(或空气)接触;(3)达到燃烧所需要的最低温度(着火点)。
10.破坏燃烧的任何一个条件,燃烧反应就可停止,从而达到灭火的目的,所以,灭火的原理有:(1)清除可燃物或是可燃物与火源隔离(2)隔绝氧气或空气(3)使温度降到着火点以下。
11.爆炸是:可燃物在有限的空间内急剧地燃烧,在短时间内聚集大量的热,使气体体积迅速膨胀而引起的现象;日常生活中有哪些气体与空气混合点燃会爆炸?氢气,甲烷,一氧化碳二、物质构成:1.构成物质的基本粒子有分子、原子、离子;水由水分子构成,铁由铁原子构成,氯化钠由钠离子和氯离子构成。
.原子的构成:原子是由居于原子中心,带正电荷的原子核和核外带负电荷的电子构成。
原子核质子:每个质子带1个单位正电荷.(1) 原子中子:不带电电子: 分层排布,每个电子带1个单位的负电荷.(2)为什么原子成电中性?因为在原子中质子和电子所带的电量相等,电性相反,所以原子不显电性。
大学无机化学试题及答案完整版

大学无机化学试题及答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】第一章 一些基本概念和定律本章总目标:1:学习物质的聚集状态分气态、固态、液态三种,以及用来表示这三种聚集态的相关概念。
2;重点掌握理想气体状态方程、道尔顿分压定律以及拉乌尔定律。
各小节目标 第一节:气体1:了解理想气体的概念,学习理想气体的状态方程推导实际气体状态方程的方法。
2:掌握理想气体状态方程的各个物理量的单位及相关的计算。
理想气体:忽略气体分子的自身体积,将分子看成是有质量的几何点;假设分子间没有相互吸引,分子之间及分子与器璧之间发生的碰撞时完全弹性的,不造成动能损失。
3:掌握Dalton 分压定律的内容及计算。
第二节:液体和溶液1:掌握溶液浓度的四种表示方法及计算 ○1物质的量浓度(符号:Bc 单位1mol L -•):溶液中所含溶质B 的物质的量除以溶液的体积。
○2质量摩尔浓度(BB An b m =,单位:1mol kg -•):溶液中溶质B 的物质的量除以溶剂的质量。
○3质量分数(BB m m ω=):B 的质量与混合物的质量之比。
○4摩尔分数(B B nn χ=):溶液中溶质的物质的量与溶液的总物质的量之比。
2:了解非电解质稀溶液的依数性及其应用。
第三节:固体1:了解常见的四种晶体类型2:掌握四类晶体的结构特征及对物质性质的影响,比较其熔沸点差异。
Ⅱ习题一选择题:1.如果某水合盐的蒸汽压低于相同温度下的蒸汽压,则这种盐可能发生的现象是() (《无机化学例题与习题》吉大版)A.气泡B.分化C.潮解D.不受大气组成影响2.严格的讲,只有在一定的条件下,气体状态方程式才是正确的,这时的气体称为理想气体。
这条件是()A.气体为分子见的化学反应忽略不计B.各气体的分压和气体分子本身的体积忽略不计C.各气体分子的“物质的量”和气体分子间的引力忽略不计D.各气体分子间的引力,气体分子的体积忽略不计3.在300K,把电解水得到的并经干燥的H2和O2的混合气体40.0克,通入60.0L的真空容器中,H2和O2的分压比为():1 :1 C.1:1 :14.在下述条件中,能使实际气体接近理想的是()A.低温、高压B.高温、低压C.低温、低压D.高温、高压5.某未知气体样品为5.0克,在温度为1000C时,压力为291KPa时体积是0.86L,该气体的摩尔质量是()A.42g/molB.52g/molC.62g/molD.72g/mol6.处于室温一密闭容器内有水及与水相平衡的水蒸气。
化学的一些基本概念和定律汇总

化学的一些基本概念
国际单位制和摩尔 重要气体定律
分子(molecule):保持物质化学性质的最小微粒。 •原子(atom):进行化学反应的基本微粒。 •元素(element):相同核电荷数(质子数)的一类原子 的总称。
第一节 基本概念
•核素(nuclide):一定质子数和中子数的一种原子。
=m/V
M
RT
p
pM = RT
有关气体体积的化学计算
例:为了行车的 安全,可在汽 车中装备上空 气袋,防止碰 撞时司机受到 伤害。这种空 气袋是用氮气 充胀起来 的,所用的氮气是由叠氮化钠与三氧化二铁 在火花的引发下反应生成的。总反应是:
6NaN3+Fe2O3(s) 3Na2O(s)+2Fe(s)+9N2(g)
(97.8 2.20)kPa 4.16L n(N2)= -1 -1 8.314J K mol 292K
相对分子量:组成分子的各原子相对原子量 之和。
第二节 国际单位
国际单位:m
s Kg mol A K cd 国际单位制包括基本单位、导出单位、 词头单位 • 小化词头:d c m m n p • 大化词头:da b K M G T
第三节 气 体
§3.1 理想气体状态方程式
§3.2 混合气体的分压定律
p nRT V
分压的求解:
n B RT pB V
nRT p V
pB nB xB p n nB pB p xB p n
x B B的摩尔分数
例题 某容器中含有NH3、O2 、N2等气体 的 混 合 物 。 取 样 分 析 后 , 其 中 n(NH3) =0.320mol,n(O2)=0.180mol,n(N2) =0.700mol。混合气体的总压 p=133.0kPa。试 计算各组分气体的分压。 解:n= n(NH3)+n(O2)+n(N2) =0.320mol+0.180mol+0.700mol =1.200mol
(完整word版)无机化学选择题及答案

第一章 化学基本概念和定律习题一。
选择题1. 实际气体接近理想气体的条件是( A )A 。
低压高温 B. 高压低温 C. 低温低温 D. 高温高压2. 下列关于分子论的论点,正确的是( C )A 。
一切物质都是由分子组成的B 。
分子是保持原物质性质的最小微粒C 。
分子是保持原物质化学性质的微粒 D. 以上论述都不正确3. 标况下某气体1.12升,质量为1.25克,则H 2的扩散速度是同条件下该气体扩散速度的( C )倍A. 12.50B. 0.08C. 3.54 D 。
0。
354. 关于摩尔的概念,下列说法正确的是( A )A. 摩尔是计量一系统物质中所含基本单元数量多少的数量单位B 。
摩尔是”物质的量”的单位,它是一系统的物质的量,该系统中所含的基本单元数与0。
012kg C —12的原子数目相等第二章 化学平衡习题一.选择题1. 合成氨反应: N 2(g)+3H 2(g)2NH 3(g)的平衡常数3N NH p 2H23p p p K =:当体系总压力增大一倍时,同温下重新建立平衡,此时: 3H N 2NH p 223'p 'p 'p 'K =, K p 与K p ’的关系为( D )A 。
K p =1/4K p ’B 。
K p =4K p 'C 。
K p =K p ’ D. K p 与K p ’没有如上关系2. 在276K 时反应: CO (g)+H 2O(g )CO 2(g)+H 2(g )的Kc=2。
6,当CO(g)与H 2O(g )的浓度(mol·L -1)以何种比例(与下列各组数据接近的)混合时,可得到90%的CO 的转化率( D )A 。
1:1 B. 1:2 C. 1:4 D 。
1:53. 下列反应处于平衡状态, 2SO 2(g)+O 2(g )2SO 3(g ) △H=-200kJ·mol —1,欲提高平衡常数Kc 的值,应采取的措施是( A ) A. 降低温度 B. 增大压力 C 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 化学基本概念和定律习题一.选择题下列有关同位素的说明中,正确的是( )A. 质量数相等,原子序数不同,化学性质相似B. 质量数和原子序数都相等,化学性质不同C. 质量数不相等,原子序数相等,化学性质相似D. 质量数不相等,原子序数相等,化学性质不同 原子的摩尔质量,正确的描述是指( )A. 任何一摩尔原子的质量B. 标况下,一摩尔原子的质量C. 含有阿佛加德罗数目个原子的质量D. 数值上等于原子量,单位为g·mol -1的质量一种未知气体,在一台扩散仪内以15.0mL·s -1的速度扩散,而此仪器内甲烷气体以30.0mL·s -1的速度扩散,则未知气体的分子量为( )A. 64B. 32C. 144D. 72 完全中和10升0.01mol·L -1 H 2SO 4需NaOH 的物质的量为( ) A. 0.2mol B. 2mol C. 0.5mol D. 0.4mol 与20克SO 3所含氧原子个数相同的CO 2的质量为( )A. 33克B. 44克C. 16.5克D. 22克3.1克磷与氯气反应,生成PCl m 和PCl n 混合物,已知PCl m 和PCl n 的物质的量之比为3:2,则PCl m 和PCl n 的物质的量分别为( )A. 3B. 2C. 0.06D. 0.04E. 0.05一定量的某气体于300K 时装入10升密闭容器中,此时压力为91.2kPa ,若温度升高为360K ,容器压缩为原来的3/4,此时压力将变为( )A. 68.4kPaB. 121.6kPaC. 146kPaD. 73kPa将等体积的氧气和氢气放入钢瓶中,此时的温度为423K ,压力为20.26kPa , 经点燃爆炸并恢复到原来的温度,则P 总, P2O 分别为( )kPaA. 10.133B. 15.199C. 5.066D. 0.1E. 0.05将100kPa 压力下的氢气150mL 和45kPa 压力的氧气75mL 装入250mL 的真空瓶,则氢气和氧气的分压分别为( )A. 13.5B. 27C. 60D. 72.5E. 145实际气体接近理想气体的条件是( )A. 低压高温B. 高压低温C. 低温低温D. 高温高压下列关于分子论的论点,正确的是( )A. 一切物质都是由分子组成的B. 分子是保持原物质性质的最小微粒C. 分子是保持原物质化学性质的微粒D. 以上论述都不正确分子和原子的本质区别是( )A. 原子比分子的体积小B. 原子比分子的质量小C. 分子能不断地运动,原子则不能D. 分子在化学反应中,可以变成另一种分子,而原子则不能下列叙述错误的是( )A. 由同种元素的原子构成的纯净物称单质B. 由不同种元素的原子构成的纯净物称化合物C. 纯净的石墨晶体由C-12,C-13,C-14构成碳单质D. 纯净的氧中含少量的臭氧构成氧单质某元素的原子序数为83,该元素的一个原子必然含有( )A. 42个质子和41个中子B. 1个中子,41个质子和41个电子C. 83个电子D. 42个中子和41个质子多核素元素的几种核素,在其原子核中具有( )A. 相同的质子数,但中子数不同B. 相同的质量数,但原子序数不同C. 相同的质子数,电子数不同D. 相同的中子数,但质子数不同H-1,H-2,H-3与O-16,O-17,O-18六种核素,组成水的分子类型总数是( )A. 9种B. 8种C. 18种D. 27种核素C-12的原子质量为12.0000u,丰度为98.89%,核素C-13的原子质量为13.0033u,丰度为1.109%,则碳的平均原子量为( )A. 13.0008,B. 12.011C. 13.0045D. 12.050分子量为58的化合物,含5/29(质量)的氢,其余为碳,这个化合物的一个分子中氢原子的数目为( )A. 5B. 4C. 8D. 10有一元素X,它与氧化合形成分子式为X4O 的化合物,如果8.40千克的X与6.50千克的氧恰好完全化合,则元素X的原子量是( )A. 24.0B. 31.0C. 54.4D. 70.3一定温度和压力下,2.00克CO2体积为1.12升,同温同压下,2.00克某气体体积为0.77升,已知CO2分子量为44,则该气体的分子量为( )A. 64B. 34C. 18.8D. 80氯的平均原子量为35.453,自然界存在的氯的同位素仅有Cl-35,Cl-37则Cl-35,Cl-37在自然界的丰度比近似为( )A. 1:4B. 3:1C. 4:3D. 3:2标状下,25升气体的质量是0.050kg,则与气体的分子量最接近的数值是( )A. 22:B. 34:C. 45:D. 56.下列叙述正确的是( )A. "物质的量"就是某物质的摩尔质量B. "物质的量"的单位是摩尔C. 标况下,1摩尔物质的质量才是摩尔质量D. "物质的量"与物质的质量的关系是通过摩尔质量联系起来的下列说法正确的是( )1mol任何气体的体积都是22.4L1mol任何气体的体积都约是22.4LC. 标准状态下,1mol任何气体的体积都约是22.4LD. 标准状态下,1mol任何气体的体积都是22.4一定量的某气体,压力增为原来的4倍,绝对温度是原来得2倍,那么气体体积变化的倍数是( )A. 8B. 2C. 12 D.18下列叙述错误的是( )A. 一种气体产生的压力,与其它气体的存在有关B. 一种气体产生的压力,与其它气体的存在无关C. 混合气体的总压力为各气体的分压力之和D. 各组分气体的分压力等于总压与该组分的摩尔分数之积初始压力为101.3kPa的N2(g) 1升和CO2(g) 1升装入一个单向抽空的0.5升容器中,如温度保持不变,N2(g)的分压为( )A. 101.3kPaB. 202.6kPaC. 303.9kPaD. 405.2kPa一敞开烧瓶在280K时充满气体,要使13 气体逸出,则应将温度升高到( )A. 400KB. 300KC. 420KD. 450K合成氨原料气中,H2,N2比为3:1(体积比),除此二种气体外,还含有杂质气体4%,原料气总压为15198.75kPa,则N2,H2的分压分别为( )A. 4217.0kPaB. 3647.7kpaC. 3500kpaD. 11399.1kPaE. 10943.1kPa可使气体扩散速度增大的因素为( )A. 增加气体的质量B. 加入催化剂C. 升高气体的温度D. 恒温恒压下加入其它气体标况下某气体1.12升,质量为1.25克,则H2的扩散速度是同条件下该气体扩散速度的( )倍A. 12.50B. 0.08C. 3.54D. 0.35一未知气体在一台扩散仪器内以10米/秒的速度扩散,在此仪器内,CH4气体以30米/秒的速度扩散,此未知气体的分子量为( )银有质量为106.902u和108.900u两种同位素,以知银元素的原子量为107.870,求质量为106.902u的同位素的丰度为( )A. 51.35%B. 48.65%C. 60.25%D. 39.75%用氢还原某n价金属氧化物时,1克氢气能还原m克氧化物,则该氧化物中金属的原子量是( )A. (m-8)nB. (8-m)nC. mn+8nD. (m-16)n某主族元素最高价含氧酸的化学式为HRO3,该元素R能与氢生成氢化物,其中氢的含量为17.76%,那R 的原子量为( )A. 7B. 14C. 31D. 75用足量的金属还原m克某金属氧化物R2O3 ,得n克金属R,则R的原子量为( )A.48n(m-n) B.24n(m-n)C. (m-n)24n D.(m-n)48n欲配制1升含NH310%的氨水,(d=0.96g·mL-1),标准状况下,需NH3的体积为( )A. 253升B. 126.5升C. 63.25升D. 0.1265升373K与98658.6Pa压力下,一物质蒸气密度d=0.5977克/升,该物质的分子量( )A. 64B. 34C. 144D. 18.8关于摩尔的概念,下列说法正确的是( )A. 摩尔是计量一系统物质中所含基本单元数量多少的数量单位B. 摩尔既是计量一系统物质中所含基本单元数量多少的数量单位,又是表示它们质量大小的质量单位C. 摩尔是"物质的量"的单位,它是一系统的物质的量,该系统中所含的基本单元数与0.012kg C-12的原子数目相等D. 摩尔是一个质量单位在相同条件下,2.00L某气体质量为3.04克,8L的N2的质量为10克,则该气体的分子量为( )A. 17B. 34C. 68D. 136一个20升的氧气钢瓶,未使用前其压力为1.52×107Pa,(室温293K时) 使用一段时间后,钢瓶内压力降为2.03×105Pa,则用掉的氧气的质量为( )A. 3.461B. 1.825C. 1.731D. 0.913二.计算题将含有硝酸铜和铜粉的混合物若干克在空气中加热,使其充分反应,结果反应前后质量未变,求原混合物中铜和硝酸铜的摩尔百分组成. (原子量: N:14 O:16 Cu: 64)300K,101.325kPa下,一烧瓶充满氮气的质量为0.050426kg,在相同条件下,充满氢气为0.049888kg,则烧瓶的体积为多少升?将含等摩尔氮气和氢气的混合气体通入一反应器,在30397.5kPa下反应,若氢气反应掉20%,这时反应器内的压力为多少?将等体积混合的SO2(g),O2(g)的混合气体,通过接触器,有90%的SO2变为SO3,求混合气体中各气体的体积分数。
将两团棉花塞子,一个用浓氨水湿润,另一个用浓盐酸湿润,同时塞入一根长0.97M的玻璃管两端,在氨气和氯化氢气体首先接触的地方,生成一个NH4Cl环,问这一环在距氨棉塞一端多远处出现?若V(NH3) =30ml·s-1则V(HCl)是多少?0.3263克某金属的氢化物MH2与水作用,MH2 + H2O →M(OH)2 +H2↑,在294K,101.3kPa条件下得干燥H20.345升,求此金属的原子量。
在300K和101kPa时,一块0.136克的Al-Zn合金与盐酸完全反应,得到干燥的氢气为0.129升,试计算合金中铝的百分含量。
原子量: Al:27 Zn: 65 Cl: 35.5第一章 化学基本概念和定律习题答案一.选择题二.计算题解: 设铜为Xmol , 硝酸铜为Ymol 2Cu + O 2→ 2 CuO 2mol 增加32克 X Z Z=32X 2=16X2Cu(NO 3)22→2CuO+4NO 2+O 2 2mol 减量: 4×46+32=216 Y W W=216Y2=108Y ∵Z=W ∴16X=108Y令:X+Y=1 则: X=0.87=87% Y=0.13=13% 2. 解: W=PVMRTW(N 2)=101.325×1×288.314×300=1.14(g)W(H 2) =101.325×1×28.314×300=0.08(g)(1.14-0.08)1 = (0.050426-0.049888)×10 V V=0.51(L) 3. 解:N 2 + 3H 2 = 2NH 3 反应前: n n 0 反应后:n-0.23n n-0.2n 0.43nn 总=n-0.23n + n-0.2n + 0.43n =1.867n21.867 = 30397.5P P=28376kPa4. 解: 设反应前混合气体的总体积为1升.2SO 2 + O 2 →2SO 3始: 0.5 0.5 0 平: 0.05 0.275 0.45 总体积=0.775 升 V SO2=0.050.775 =0.065V O2 =0.2750.775 =0.355V SO3 =0.45/0.775=0.58 5. 解: V(HCl)/ V(NH 3) =3NH HCl M M =1.465白环距氨端为:1.465(1.465+1)×0.97=0.576(m)V(HCl) =V(NH 3)/1.465=20.5mL·s -1 6. 解: 求在标况下,H 2的体积压力不变时:V 1 T 1 = V 2T 2V =0.375×273294设: 金属的原子量为XMH2 + 2H2O = M(OH)2 +2H2↑ X+2 22.4×20.3263 0.375×273294 = 0.3480.348X + 0.696 = 22.4 × 2 ×0.3263X = 407. 解: 生成氢气的物质的量为n=PV/RT=(101×0.129)/(8.314×300) = 0.00522mol2Al + 6HCl=2AlCl3+ 3H254g 3molX mm =3X/5.4Zn + 2HCl=ZnCl2+ H265 1mol0.136-x nn = (0.136-X)65有: (0.136-X)65+3X54= n + m = 0.00522(mol)解得: X=0.078Al%=0.0780.136×100%=57.35%。
