冻干粉针生产工艺规程通则
阿奇霉素冻干粉针剂工艺

阿奇霉素冻干粉针剂试制的实用工艺本品系采用阿奇霉素无菌冻干粉针剂,按干品计算每mg效价必须>600阿奇霉素。
其操作过程为:单位原料—称量—配剂—除菌过滤—灌装—半加塞—冷冻干燥—轧盖—灯检。
本产品从西林瓶的清洗、灭菌到灌装,配剂在局部百级的洁净室中进行,胶塞和铝塑盖的消毒在灭菌柜中进行,使用时在万级洁净区的局部百级环境中进行操作。
灌装后进行半加塞,装满一托盘后立即加套圈送入博医康Pilot10-15T干燥机冻干,待冻干结束后压塞、出柜送入轧盖、灯检、贴签。
我们将试制的三批产品按药典进行全面检测,完全符合药典要求并作为GMP 产品认证产品上报。
试制工艺过程如下:1.在配制好的阿奇霉素粉针剂溶液要除菌过滤时,取消了常规的粗滤、精滤几道复杂工艺,而几种不同的孔径的滤膜重叠在一起,全过程一次完成,达到了除菌效果,比分几次过滤造成损失要少得多,且药液澄清透明无毛点,符合GMP要求。
2.使用不锈钢限位器。
产品冻干后,在干燥箱内进行真空压塞封口时,为了不受产品的数量限制,各层搁板上可放置不锈钢限位器,使不同规格的产品都可同样进行压塞封口,保证产品小瓶不被压坏。
3.在容器小,冻干产品装量多的情况下,再无法用双倍水样法和真空压力回升法来确定冻干何时结束时,可采用注射用水与产品一起冻干,根据注射用水升华完毕就可确定产品冻干的结束时间。
4.在冻干过程中利用博医康Pilot10-15T冻干机自身系统调节真空度,并控制在8-13Pa,而大部分时间真空泵不运转,全程时间可缩短6-8小时。
在冻干最初阶段,真空泵一般停止30分钟起动一次,每次运转5-7分钟,但冻干后期真空泵每隔2-3小时才运转一次,时间约5分钟,节约了能源(水电)和机器的磨损,提高了产品的质量,降低了成本。
5.当某些产品溶液冻结后,由于蒸发面积大,瓶口小,无法使用半加塞冻干时,只好直接敞开瓶口冻干,待冻干结束后取出产品瓶,用手工无菌操作将丁基胶塞盖在瓶口上,任其自然摆放,再送入能自动压塞的冻干机干箱内抽真空2小时,真空度控制在40Pa左右时,再进行自动压塞封口,出箱后经高频火花真空检测仪,逐瓶检测,其真空率高达99.5%左右。
冻干粉针生产工艺规程通则
1.目的:建立冻干粉针生产工艺规程,确保冻干粉针的生产过程按规定程序进行。
2.范围:适用于冻干粉针生产的全过程。
3.责任者:生产管理部技术员、质量管理部QA 监督员、车间工艺员、各工段长、操作工。
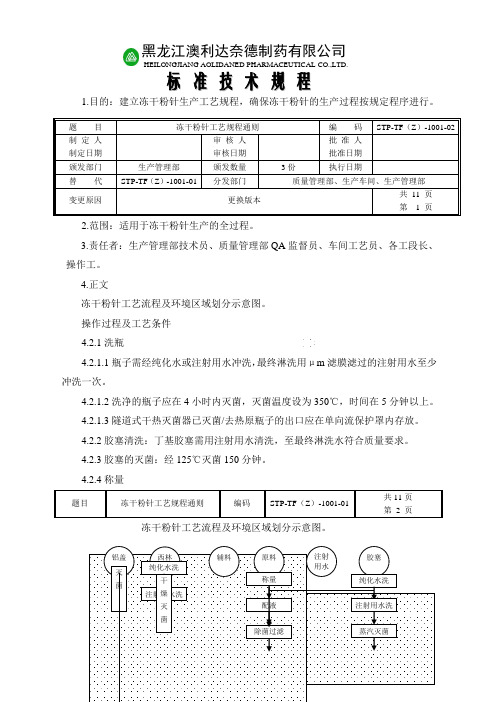
4.正文冻干粉针工艺流程及环境区域划分示意图。
操作过程及工艺条件 4.2.1洗瓶4.2.1.1瓶子需经纯化水或注射用水冲洗,最终淋洗用μm 滤膜滤过的注射用水至少冲洗一次。
4.2.1.2洗净的瓶子应在4小时内灭菌,灭菌温度设为350℃,时间在5分钟以上。
4.2.1.3隧道式干热灭菌器已灭菌/去热原瓶子的出口应在单向流保护罩内存放。
4.2.2胶塞清洗:丁基胶塞需用注射用水清洗,至最终淋洗水符合质量要求。
4.2.3胶塞的灭菌:经125℃灭菌150分钟。
4.2.4称量冻干粉针工艺流程及环境区域划分示意图。
题 目 冻干粉针工艺规程通则编 码 STP-TF (Z )-1001-02 制 定 人 制定日期审 核 人 审核日期批 准 人 批准日期 颁发部门 生产管理部 颁发数量 3份执行日期替 代 STP-TF (Z )-1001-01分发部门质量管理部、生产车间、生产管理部变更原因更换版本共 11 页 第 1 页题目冻干粉针工艺规程通则编码STP-TF (Z )-1001-01共11页 第 2 页黑龙江澳利达奈德制药有限公司HEILONGJIANG AOLIDANED PHARMACEUTICAL CO.,LTD .标 准 技 术 规 程注射用水洗蒸汽灭菌图例﹡4.2.4.1按处方及SOP 要求配料,记录原辅料代号、品名、批号并做好称量记录。
4.2.4.2称量及计算必须复核,操作人、复核人应在记录上签名。
4.2.4.3剩余的原辅料应封口贮存。
4.2.4.4天平及其他称重设备每次使用前应校正,并定期由计量部门专人校验,校验结果应予记录。
4.2.5配液4.2.5.1配制药液用的注射用水必须符合要求。
4.2.5.2按品种进行在线控制。
冻干粉针剂工艺规程详解

皖西学院化学与生命科学系(制药设备与工程设计)课程设计班级姓名学号指导教师二○一○年六月二十一日制药设备与工程设计课程设计任务书皖西学院化学与生命科学系课程设计说明书题目:课程:系(部):专业:班级:学生姓名:学号:指导教师:完成日期:目录1.工艺流程图及环境区域划分2.生产处方及其依据3.生产工艺及操作程序4.设备一览表及主要设备生产能力5.技经指标与消耗定额6.劳动定员7.技术安全、劳动保护和工艺卫生8.物料平衡1.粉针剂工艺流程图及环境区域划分图例:100 000级区 10 000级区 * 局部百级2.产品介绍注射用青霉素钠,英文名:Benzylpenicillin Sodium for Injection 。
主要成份为青霉素钠,其化学名为(2S,5R,6R)-3,3-二甲基-6-(2-苯乙酰氨基)-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐。
性状本品为白色结晶性粉末。
药理作用为β-内酰胺类抗生素,系通过干扰细菌细胞壁粘肽的合成, 于细菌繁殖期起杀菌作用。
主要作用于革兰氏阳性菌、革兰氏阴性球菌、嗜血杆菌属及螺旋体、放线菌等。
青霉素内服后在胃酸中大部分灭活,一般剂量达不到有效血浓度。
其钠盐肌肉注射后吸收迅速,约0.5h达血药浓度,对多数敏感菌的有效血浓度可维持6~8h。
青霉素在血中约有50%以上(马为52~54%)与血浆蛋白结合。
在血中未结合的和游离的青霉素能通过被动扩散分布于组织、体液中,但不易透入眼、骨组织、脑脊液和浓肿腔中,易透入有炎症的组织。
青霉素约50~75%自肾脏排出,尿中浓度也很高。
丙磺舒、磺胺药、阿司匹林等可提高其血药浓度,延长其半衰期。
本品为抗生素类药。
主用于革兰氏阳性菌感染,亦可用于放线菌及钩端螺旋体等的感染。
2.1产品规格注射青霉素钠(0.3、0.5g、0.6g、)2.2产品剂型、规格和批量3.生产工艺及操作程序3.1生产场所和设备3.1.1主要操作间的位置和要求3.1.2主工生产设备型号和编号3.2关键生产设备操作规程和清洁规程3.3生产步骤3.3.1原料的准备工作:在无菌分装操作前一天,xxxx无菌原料经物料员凭批生产指令从仓库领取后,在缓冲间擦拭干净,由物料员和QA检查员依据领料核料单审核原料名称,规格,批号、重量,是否有检验合格证等,审核合格后,由车间生产人员用消毒液揩擦桶外壁后,放到物料传递间原料经净化后传入万级B区,第二天方可经传递窗紫外灯照射30分钟后传入万级A区。
冻干粉针剂工艺流程

冻干粉针剂工艺流程Freeze-drying Powder Injection Process。
Freeze-drying technology is widely used in the pharmaceutical industry to produce powder injection drugs. The process involves several steps, including pre-treatment, freezing, primary drying, secondary drying, and packaging. Each step is crucial to ensure the quality and stability of the final product.Pre-treatment:Before the freeze-drying process, the drug solution needs to be pre-treated to remove impurities and adjust the pH value. The solution is filtered through a sterile filter to remove any bacteria or particles. Then, the pH value is adjusted to ensure the drug's stability during the freeze-drying process.Freezing:After pre-treatment, the drug solution is filled into vials or ampoules and then quickly frozen at a low temperature. The freezing process is critical to ensure the formation of a uniform ice crystal structure. The uniform ice crystal structure can prevent damage to the drug molecules during the drying process.Primary Drying:The primary drying process involves sublimation, where the frozen water in the drug solution changes from a solid to a gas without going through the liquid phase. The process is conducted under a low-pressure environment and a low-temperature condition. The primary drying process can take several hours to several days, depending on the drug's characteristics and the equipment used.Secondary Drying:After the primary drying process, the drug productstill contains some residual moisture. The secondary dryingprocess is designed to remove the remaining moisture and improve the drug's stability. The temperature and pressure conditions are adjusted to ensure the complete removal of moisture without damaging the drug molecules. The secondary drying process can take several hours to several days, depending on the drug's characteristics and the equipment used.Packaging:After the secondary drying process, the drug product is sealed in vials or ampoules under sterile conditions. The packaging process is critical to ensure the drug's quality and stability during storage and transportation.In conclusion, the freeze-drying powder injection process is a complex and delicate process that requires strict control of temperature, pressure, and time. The process can produce high-quality and stable powderinjection drugs with a long shelf life. The quality and stability of the final product depend on each step of the process, from pre-treatment to packaging. Therefore, it isessential to follow the standard operating procedures and conduct rigorous quality control throughout the process.。
冻干粉针剂(化学制剂)生产质量技术指导原则

冻干粉针剂(化学制剂)药品质量安全专项工作生产质量技术指导原则为了提高冻干粉针剂(化学制剂)生产质量风险评估、管理的有效性,指导企业在严格执行GMP的基础上,有序开展药品生产质量风险排查和生产质量研究,进一步完善企业内部质量管理制度。
在新版GMP实施前,我们在相关企业质量风险管理经验的基础上,针对关键工序和岗位,制定了本指导原则。
冻干粉针剂(化学制剂)的生产必须严格按精心设计并经验证的方案及规程进行,产品的无菌或其它质量特性绝不能只依赖与任何形式的最终处理或成品检验。
1.人员培训管理1.1称量、配制、灌封、过滤、冻干、无菌和内毒素项目检验等关键岗位新进人员经GMP知识、岗位操作等专业培训、考核合格后,经质量管理部门确认后才能上岗。
无菌区操作人员的培训、考核,应重点关注进、出无菌区的更衣和无菌操作要求(包括生产操作和安装时的姿势、动作幅度及速率等)。
1.2企业应定期对上述关键岗位操作人员,组织岗位操作SOP及相关管理制度再培训、再考核。
1.3冻干粉针剂灌装生产线的员工,应定期参加培养基模拟灌装试验。
灌装生产线的新员工经岗位培训后,在正式上岗生产的第一年,至少有一次参加成功的培养基模拟灌装试验。
2. 厂房、设备与设施2.1厂房、设备与设施管理2.1.1厂房和设备设施应采用经过验证的工艺和规程进行生产操作,并应保持持续的验证状态。
2.1.2设备管理部门应切实履行维护和维修职责,制定厂房和设备设施的预防维护计划, 相应的维护和维修应有记录。
生产管理部门应及时向设备管理部门上报设备运行的重要情况。
2.1.3厂房和设备设施维护和维修不得影响产品质量。
经改造、重大维修或停产一定时间以上的关键设备(如灭菌、灌装等设备)应进行再确认或评估,符合要求后方可用于生产。
2.2HVAC系统2.2.1洁净区的洁净要求应在2013年12月31前,符合《药品生产质量管理规范(2010年修订)》中相应洁净度的要求。
应开展HVAC系统验证,验证结果符合规定,并与实际生产相适应。
冻干粉针剂生产质量技术指导原则-征求意见稿

冻干粉针剂(化学制剂)生产质量技术指导原则(征求意见稿)为提高冻干粉针剂(化学制剂)风险排查的有效性和针对性,在严格执行GMP的基础上,指导企业排查生产质量风险和开展生产质量研究,建立完善企业内部质量管理制度,制定本指导原则。
冻干粉针剂(化学制剂)的生产必须严格按精心设计并经验证的方案及规程进行,产品的无菌或其它质量特性绝不能只依赖与任何形式的最终处理或成品检验。
1.人员培训管理1.1称量、配制、洗灌封、过滤、冻干、无菌和内毒素检验等关键岗位新进人员经GMP知识、岗位操作(特别是进、出无菌区的更衣、无菌操作技术)等专业培训,并经考核合格和质量管理部门确认后才能上岗。
1.2企业应定期对上述关键岗位操作人员,组织岗位操作SOP及相关管理制度再培训、再考核。
1.3冻干粉针剂灌装生产线的员工,应定期参加培养基模拟灌装试验。
灌装生产线的新员工经岗位培训后正式生产第一年,至少有一次参加成功的培养基模拟灌装试验。
2. 厂房、设备与设施2.1厂房、设备与设施管理2.1.1厂房和设备设施应在采用经过验证的工艺和规程进行生产操作时,保持持续的验证状态。
2.1.2设备管理部门应切实履行维护和维修职责,制定厂房和设备设施的预防维护计划, 相应的维护和维修应有记录。
生产管理部门应及时向设备管理部门上报设备运行的重要情况。
2.1.3厂房和设备设施维护和维修不得影响产品质量。
经改造、重大维修或停产一定时间以上的关键设备(如灭菌、灌装等设备)应进行再确认,符合要求后方可用于生产。
2.2HVAC系统2.2.4应建立适当压差控制。
在压差十分重要的相邻级别区之间应安装压差表,记录压差数据,并在结果超标时有明确的纠偏措施。
推荐在灌装间等核心区域建立压差超标的报警系统。
2.2.5生产时,洁净区空气净化系统应当保持连续运行,维持相应的洁净度级别。
推荐设送风机组故障的报警系统。
生产过程中因故停机再次开启空气净化系统,时限应在验证范围内,并应经评估和确认此次偏差不影响产品质量的,才能放行产品。
冻干粉针剂工艺

冻干粉针剂的工艺流程图及环境要求生产工艺流程及环境区域划分示意图入 库冻干粉针剂认证检查的要点冻干粉针剂指在低温真空的环境下先将配制好的药液预冻然后升华干燥成粉末状态的一种制剂。
根据药品新版GMP原则要求,结合冻干粉针剂生产影响药品质量的关键环节,提出冻干粉针剂GMP检查要点,旨在督查药品生产企业质量保证体系和实际运行状态。
检查组须对如下内容按照药品GMP要求,逐一核实。
1、机构与人员a)主管生产和质量管理的企业负责人、生产管理和质量管理部门负责人均应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验,并履行其职责。
b)企业负责人和各级管理人员应定期接受药品管理法律法规培训。
c)质量检验、生产、维修保养、清洁人员应定期进行卫生和微生物学基础知识、洁净作业等方面的培训和考核,并具有实际操作技能。
2、厂房设施的管理要点及检查重点a)洁净区:我国《药品生产质量管理规范》对最终灭菌的无菌药品生产厂房洁净度级别的要求是:浓配或采用密闭系统的稀配应在100000级洁净区内进行;稀配、滤过、灌封、直接接触药品的包装材料的最终处理等操作应在10000级洁净区内进行;物料、中间品应经过物流缓冲间或传递柜进、出洁净区。
称量配料间如产尘应与洁净走廊呈相对负压,必要时设捕尘设施。
中国药典规定:微生物限度检查、无菌检查应在100级或10000级背景下的局部100级区内进行,并与生产区分开。
微生物限度检查与无菌检查用的实验室和空气净化系统最好彼此分开,以尽可能减少对无菌检查的干扰。
b)空气净化系统应能确保洁净区的洁净度级别、温湿度、压差等符合生产工艺要求并经过验证。
初效、中效过滤器应明确清洗/更换周期,高效过滤器应定期检测其完整性,如有泄漏或阻塞应及时更换。
空气净化系统应每天24小时运行,停用后再次运行应进行清洁、消毒并经过再验证,符合要求的方可开始生产。
c)与产品直接接触的压缩空气、氮气、二氧化碳等辅助设施这些气体因与产品直接接触,不得对产品带来污染。
冻干粉针剂工艺

冻干粉针剂的工艺流程图及环境要求生产工艺流程及环境区域划分示意图入 库冻干粉针剂认证检查的要点冻干粉针剂指在低温真空的环境下先将配制好的药液预冻然后升华干燥成粉末状态的一种制剂。
根据药品新版GMP原则要求,结合冻干粉针剂生产影响药品质量的关键环节,提出冻干粉针剂GMP检查要点,旨在督查药品生产企业质量保证体系和实际运行状态。
检查组须对如下内容按照药品GMP要求,逐一核实。
1、机构与人员a)主管生产和质量管理的企业负责人、生产管理和质量管理部门负责人均应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验,并履行其职责。
b)企业负责人和各级管理人员应定期接受药品管理法律法规培训。
c)质量检验、生产、维修保养、清洁人员应定期进行卫生和微生物学基础知识、洁净作业等方面的培训和考核,并具有实际操作技能。
2、厂房设施的管理要点及检查重点a)洁净区:我国《药品生产质量管理规范》对最终灭菌的无菌药品生产厂房洁净度级别的要求是:浓配或采用密闭系统的稀配应在100000级洁净区内进行;稀配、滤过、灌封、直接接触药品的包装材料的最终处理等操作应在10000级洁净区内进行;物料、中间品应经过物流缓冲间或传递柜进、出洁净区。
称量配料间如产尘应与洁净走廊呈相对负压,必要时设捕尘设施。
中国药典规定:微生物限度检查、无菌检查应在100级或10000级背景下的局部100级区内进行,并与生产区分开。
微生物限度检查与无菌检查用的实验室和空气净化系统最好彼此分开,以尽可能减少对无菌检查的干扰。
b)空气净化系统应能确保洁净区的洁净度级别、温湿度、压差等符合生产工艺要求并经过验证。
初效、中效过滤器应明确清洗/更换周期,高效过滤器应定期检测其完整性,如有泄漏或阻塞应及时更换。
空气净化系统应每天24小时运行,停用后再次运行应进行清洁、消毒并经过再验证,符合要求的方可开始生产。
c)与产品直接接触的压缩空气、氮气、二氧化碳等辅助设施这些气体因与产品直接接触,不得对产品带来污染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.目的:建立冻干粉针生产工艺规程,确保冻干粉针的生产过程按规定程序进行。
2.范围:适用于冻干粉针生产的全过程。
3.责任者:生产管理部技术员、质量管理部QA 监督员、车间工艺员、各工段长、操作工。
4.正文4.1冻干粉针工艺流程及环境区域划分示意图。
4.2操作过程及工艺条件 4.2.1洗瓶4.2.1.1瓶子需经纯化水或注射用水冲洗,最终淋洗用0.22μm 滤膜滤过的注射用水至少冲洗一次。
4.2.1.2洗净的瓶子应在4小时内灭菌,灭菌温度设为350℃,时间在5分钟以上。
4.2.1.3隧道式干热灭菌器已灭菌/去热原瓶子的出口应在单向流保护罩内存放。
4.2.2胶塞清洗:丁基胶塞需用注射用水清洗,至最终淋洗水符合质量要求。
4.2.3胶塞的灭菌:经125℃灭菌150分钟。
4.2.4称量 冻干粉针工艺流程及环境区域划分示意图。
黑龙江澳利达奈德制药有限公司HEILONGJIANG AOLIDANED PHARMACEUTICAL CO.,LTD .标 准 技 术 规 程图例﹡4.2.4.1按处方及SOP 要求配料,记录原辅料代号、品名、批号并做好称量记录。
4.2.4.2称量及计算必须复核,操作人、复核人应在记录上签名。
4.2.4.3剩余的原辅料应封口贮存。
4.2.4.4天平及其他称重设备每次使用前应校正,并定期由计量部门专人校验,校验结果应予记录。
4.2.5配液4.2.5.1配制药液用的注射用水必须符合要求。
4.2.5.2按品种进行在线控制。
如测定PH 值等。
4.2.5.3凡接触药液的设备、管道和容器具,应根据SOP 进行清洁,必要时进行灭菌处理。
4.2.5.4在线控制用计量器具应按SOP 要求校验后方可使用。
4.2.5.5按批生产记录及SOP 的要求做好各种记录。
4.2.6过滤4.2.6.1在除菌滤器前采用适当的预过滤器,使用0.22μm 的滤器做除菌过滤。
使用时,所有过滤器需用注射用水淋洗,并在灭菌后做完好性检查。
4.2.6.2药液过滤后,除菌过滤器须再次检查其完好性。
4.2.6.3应取少量除菌过滤前的药液,进行菌检,监控微生物污染状况。
4.2.6.4除菌过滤器不得隔天使用,除非通过验证。
4.2.7灌装4.2.7.1灌装管道、针头、灌装用具等使用前用注射用水洗净并经灭菌,应选用不落微粒的软管,特殊品种的设备及器具应当专用。
4.2.7.2直接与药液接触的惰性气体或压缩空气,使用前应经净化处理,其所含微生物微粒、无油项目应符合规定要求,所有惰性气体的纯度应达到规定标准。
4.2.7.3单向流保护罩发生故障时,应采取应急措施,灌装过程中发生污染,并应适当抽样,将发生故障的产品分开,做好标记,只有调查的结果证明故障对产品质量未造成影响时,方可将出现故障的产品并入同一批内。
4.2.7.4单向流出现暂时故障重新开始灌装前,微粒监测的结果应符合标准。
4.2.7.5灌装过程中应定时进行装量检查,每半小时一次,装量出现偏差时,应及时进行调整。
4.2.7.6已灌装的半成品在放入冻干腔室前,应在单向流保护下存放,以防止污染。
4.2.8冻干4.2.8.1冻干腔室应使用除菌过滤器,冻干结束后,以除菌过滤器的氮气或空气平衡腔室的真空。
小瓶应在略有真空条件下,如-20KPa条件下压塞,以保证封口的完整性。
4.2.8.2冻干腔室应定期进行在线清洁。
4.2.9压盖4.2.9.1压盖作业的级别不低于100000级。
4.2.9.2如在同一无菌操作区内进行压盖与灌装,铝盖应予以灭菌,并有防止微粒污染的措施。
4.2.9.3小瓶的封口完好性应予验证。
4.2.9.4应严格控制好压盖压力的上下限,确保产品的密封性。
4.2.10包装4.2.10.1外包装作业中应进行目检,剔除外观异常的产品及铝盖松动等疵品。
4.2.10.2贴签、包装及装箱过程中应经常检查包装材料上的品名、规格、批号、有效期、数量是否正确,内外箱标识及内容是否一致。
4.2.10.3包装结束后应及时清场,并填好清场记录,并将包装品交待验库,检验后入库。
4.2.11无菌区清洁与消毒4.2.11.1无菌操作区内消毒用的乙醇应除菌过滤。
4.2.11.2应使用不易脱落微粒经灭菌的清洁工具,地面清洁所用拖把等应予灭菌,不可灭菌时,则应消毒处理。
4.2.11.3无菌操作区不得存放潮湿的清洁工具。
4.2.11.4无菌室应有专用的清洁规程及环境监控计划。
4.2.11.5按清场管理的有关规定进行清场。
4.3工艺卫生和环境卫生4.3.1物流程序:原辅料→半成品(中间体)→成品(单向顺流、无往复运动)4.3.2物净程序:物品→前处理→消毒、清洁区4.3.3人净程序:人→门厅→更鞋(一)→更衣(一)→洗手、脸、腕→更鞋(二)→更衣(二)→洗手、手消毒→更衣(三)→手消毒→洁净区4.3.4人净标准:4.3.5工作服标准:洁净服选用防静电、无尘、耐酸碱、耐蒸汽灭菌、不剥落纤维、不断线等四连体无菌衣,必须包盖全部头发、胡须及脚部,并能阻留人体脱落物。
4.3.6洁净区利用臭氧熏蒸法对空间消毒,75%乙醇等消毒剂对地面物品和接触药品的机械表面进行消毒,用强碱液对容器具进行处理。
厕所利用清洁剂进行清洗除垢,甲酚皂除臭消毒,一般区采用常规法进行处理。
4.3.7本产品工艺过程中所需的SOP名称及要求4.3.8原辅料、中间产品和成品的质量标准和技术参数贮存注意事项4.3.8.1原辅材料、中间产品和成品的质量标准:见各品种质量标准4.3.8.2一切原辅料、半成品、成品必须在清洁环境下存放,严防异物污染药品。
4.3.8.3 中间体、半成品的贮存,应有明显的标记,放置有序,分批号整齐摆放。
4.3.8.4贮存室必须清洁、干燥,合格、不合格与待验品种应分别码放,有明显的标志。
4.3.8.5出入库要按规定的程序办理,需要在车间存放的原辅料包装材料,不超过两天使用量,用量较少的原辅料可以结合其特殊性,允许车间暂存,待该品种结束后集中办理退库手续。
4.3.8.6注意安全,生产前后应随时进行安全检查4.3.9中间产品的检查方法与控制4.3.10需要进行验证的关键工序及基工艺验证的具体要求4.3.11包装要求,标签、说明书(附样本与产品贮存方法及有效期)4.3.11.1认真搞好环境卫生,生产中废料应及时清理,保持室内整洁畅通。
4.3.11.2与生产无关的物品不得带入操作室,严禁吸烟和随地吐痰。
4.3.12说明书贮存方法4.3.12.1标签、说明书、小盒、中盒等应有专人负责,实行专库上锁管理,对印有批号标签的处理,应按有关标签管理制度执行。
4.2.12.2质检员及各工段兼职质量监督员应随时检查标签、说明书的贮存情况,防止事故发生。
4.3.13辅料的消耗定额,技术经济指标、物料平衡以及各项指标的计算方法。
4.3.13.1成品率=成品量×100% 理论量4.3.13.2合格品率=合格的成品量×100% 总成品量4.3.13.3《物料平衡计算标准操作规程》4.3.14原料的消耗定额:见分则。
4.3.15辅料的消耗定额:见分则。
4.3.16设备一览表及主要设备生产能力4.3.17技术安全及劳动保护4.3.17.1技术安全4.3.17.1.1操作人员必须穿戴好洁净的工作服、帽、鞋,并不得穿工作服离开车间,直接接触药品生产的操作人员要戴好口罩、手套,头发不得外漏、不得化妆、不得戴耳环、戒指,操作人员外出回岗位,必须洗手消毒。
4.3.17.1.2患有传染病、皮肤病、体表有伤口者,严禁接触药品生产。
4.3.17.1.3经常保持生产场所的清洁卫生,操作间必须地面整洁,无积水,窗明案净,有五防(防尘、防虫、防鼠、防蚊、防蝇)措施,室内墙壁无脱落物,工具用具定点放置。
4.3.17.1.4操作人员对设备、容器、管道应经常保持清洁,符合清洁标准,方可投入生产。
4.3.17.1.5一切原辅料、半成品、成品必须在清洁环境下,严防异物污染药品。
4.3.17.1.6包装材料必须保持清洁整齐,不得乱放,未彻底清洁前不得进入生产区。
4.3.17.1.7每次生产结束后,必须进行清场,经检验合格后,方可投入下批生产。
4.3.17.1.8中间体、半成品必须装在规定的洁净容器内,防止污染。
4.3.17.1.9工作服按规定及时清洗,一般生产区每周清洗二次,洁净区每班洗一次,手套、口罩随时清洗。
4.3.17.2劳动保护.2.1操作人员应穿戴规定的劳动保护用品,这既是洁净生产的需要,也是劳动保护的需要。
.2.2 机器设备的传动装置要安装好保护罩或盖板。
.2.3 无菌室臭氧熏蒸消毒时,操作员应离开无菌室,消毒结束后,应开启风机通风,置换后,方可进行操作。
.2.4 本公司对职工定期进行体检。
4.3.18劳动组织与岗位定员 工艺卫生.1生产区域保持地面整洁,门窗玻璃、墙面、顶棚洁净完好。
设备、管道、管线排列整齐并且包扎光洁、无跑、冒、滴、漏。
容器、工具按规定定点放置,并保持清洁。
.2 应定期进行清洁,生产区的清洁应按洁净区的清洗、消毒的标准操作程序和一般生产区清洁规程规定执行。
.3 质量部要按洁净室检测办法,定期对各区的工艺卫生及洁净度、菌落数进行检查,并记录,生产部门根据检测结果对空调系统进行必要的处理及对室内进行臭氧熏蒸消毒。
生产车间管理人员,各岗位负责人、生产部均应按各自的职责对生产区的工艺卫生进行检查和抽查。
.4 操作人员进入操作间必须按人员进出无菌区净化的标准操作程序、人员进出十万级洁净区标准操作程序规定执行。
4.3.20成品容器、包装材料的要求:直接接触药品的内包装容器、包装材料必须达到药用要求,有药用包装材料和容器注册证。
外包装材料按质量标准要求的尺寸材质和内容设计、印刷。
4.3.21偏差及不合格品处理:生产过程中出现偏差和不合格品分别按《生产过程偏差处理管理制度》和《不合格品管理制度》处理。
4.3.22附录(常用理化常数、计算公式及换算表等)4.3.22.1度量衡使用公制用下列符号表示度m:米量l :升ml:毫升(千分之一)ul:微升(百万分之一升)衡kg:公斤(1千克)g:克(一千毫克)mg:毫克(千分之一克)ug:微克(百分之一克)4.3.22.2百分比浓度用“%”表示。
4.3.23附页(供修改时登记、批准日期、文号和内容)。
