烷烃自由基取代反应37页PPT
合集下载
有机化学第02章烷烃PPT课件

B r
B r
C
H
I
C l
与
I
C H
C l
构型异构体
• 不可转换 • 理论上可分离
H HH
H H H H
与
HH H
H H
构象异构体
•可通过单键旋转转换
•一般无法分离
28
化合物性质的两个方面 物理性质 物态:气体? 液体 ? 固体? 沸点(b.p.) 熔点(m.p.) 密度(比重) 溶解度: 水中溶解度? 有机溶剂中? 折光率 化学性质:有机化学反应(本课程的重点)
5
2
4
1
3
6
7
8
这样选取主链及 编号是否合适?
20
三.构象 (comformation) 和构象异构体
➢ C—C单键是可以旋转的 ➢ 单键的旋转使分子中的原子或基团在空间产生不同的排列
(构象) ➢ 不同的构象之间为构象异构关系(一类立体异构现象)
乙烷的两种构象
21
描述立体结构的几种方式
H
H
1
H
potential energy (KJ/mol)
H H 1 12H旋 转 6 0 oH H
12H H旋 转 6 0 o
1
H2 HH
1 1
HH
HH
H
H H
H
……
HH 1 HH HH
1 2 .1
旋转中须克服能垒——扭转张力 • 电子云排斥 • 相邻两H间的von der waals排 斥力
H HH 1
CH3 C H 3C C H 3
CH3
异戊烷 新戊烷
isopentane neopentane
➢ 异构词头用词头“正”、“异”和“新”等区分 ➢ 相应的英文词头为 n- (normal)、iso和neo(注意不加“-”)
第4章烷烃自由基取代反应ppt课件

例如: 正丁烷的沸点:- 0.5℃ 异丁烷的沸点:- 11.7℃
二 熔点
取决于分子间的作用力和晶格堆积的密集度。
烷烃熔点的特点
(1) 随相对分子质量增大 而增大。
(2) 偶数碳烷烃比奇数碳 烷烃的熔点升高值 大 (如右图)。
(3)相对分子质量相同的烷 烃,支链增多,熔点下降。
高度对称的烷烃分子熔点比同分子量的直链烷烃高。
伯,仲,叔氢原子的反应活性
2.溴化
C H 3 C H 2 C H 3 + B r 2
B r
1 2 7 o CC H 3 C H C H 2 B r+C H 3 C H C H 3 h v
3 %
9 7 %
Br
C H 3C H C H 3 +Br2
127oC C H 3C H C H 2Br+C H 3CC H 3 hv
第 四 章 烷烃 自由基取代反应
Chapter 2 Alkanes and free radical substitution reaction
4.1 烷烃的分类
4.2 烷烃的物理性质
外
观: 状态, 颜色, 气味
1-4 气态 5-16 液态 17- 固态 t
物理常数: 沸点(b.p.) 熔点(m.p.)
C HC H 2+B r2
C H 2 C H 2 C HC HC H 2 B r B r B r B r
4.12 烷烃的来源
(1) 石油(分馏产物); (2) 天然气
干天然气--甲烷86%~99%(体积) 湿天然气--甲烷60%~70%,还含有一定的乙烷,
丙烷,丁烷等气体. (3) 油田气--低级烷烃,如甲烷,乙烷,丙烷,丁烷和戊烷等; (4) 煤层气,沼气--甲烷等; (5) 甲烷冰.
二 熔点
取决于分子间的作用力和晶格堆积的密集度。
烷烃熔点的特点
(1) 随相对分子质量增大 而增大。
(2) 偶数碳烷烃比奇数碳 烷烃的熔点升高值 大 (如右图)。
(3)相对分子质量相同的烷 烃,支链增多,熔点下降。
高度对称的烷烃分子熔点比同分子量的直链烷烃高。
伯,仲,叔氢原子的反应活性
2.溴化
C H 3 C H 2 C H 3 + B r 2
B r
1 2 7 o CC H 3 C H C H 2 B r+C H 3 C H C H 3 h v
3 %
9 7 %
Br
C H 3C H C H 3 +Br2
127oC C H 3C H C H 2Br+C H 3CC H 3 hv
第 四 章 烷烃 自由基取代反应
Chapter 2 Alkanes and free radical substitution reaction
4.1 烷烃的分类
4.2 烷烃的物理性质
外
观: 状态, 颜色, 气味
1-4 气态 5-16 液态 17- 固态 t
物理常数: 沸点(b.p.) 熔点(m.p.)
C HC H 2+B r2
C H 2 C H 2 C HC HC H 2 B r B r B r B r
4.12 烷烃的来源
(1) 石油(分馏产物); (2) 天然气
干天然气--甲烷86%~99%(体积) 湿天然气--甲烷60%~70%,还含有一定的乙烷,
丙烷,丁烷等气体. (3) 油田气--低级烷烃,如甲烷,乙烷,丙烷,丁烷和戊烷等; (4) 煤层气,沼气--甲烷等; (5) 甲烷冰.
第4章 烷烃 自由基取代

=
A + BC
A
........
B
...........
C
AB + C
过渡态的特点: (1)能量高。 (2)极不稳定,不能分离得到。 (3)旧键未完全断开,新键未完全形成。
反应势能图
反应势能曲线:图中表示势能高低的曲线。
势 能
A......B ....C
反应坐标:由反应物到生成物所经过的能 量要求最低的途径。 过渡态:在反应物互相接近的反应进程中, 与势能最高点相对应的结构称为过渡态。
Cl2 光
57/43=2x/6
x=4
(3)烷烃与其它卤素的取代反应 CH3 CH3-CH CH3 + Br2
光 127℃
CH3 CH3 CH3-C-Br + CH3-CHCH2Br CH3 痕量 99%
•仲,叔氢原子的反应活性:1:82:1600.溴更具有选择性.
• 与氟反应剧烈,不易控制,会引起爆炸.
CH2 > CH2
苯甲基自由基
CHCH2 > (CH3)3C > (CH3)2CH
三级丁基自由基 异丙基自由基
稀丙基自由基
> CH3CH2 > CH3
乙基自由基
>
苯基自由基
甲基自由基
两点说明
•影响自由基稳定 性的因素是很多 的,如: 电子离 域,空间阻碍, 螯合作用和邻位 原子的性质等;
•碳自由基的最外层 为七个电子,反应 时总要寻找另外的 电子来达到八隅体 结构,所以是亲电 的。
CH3 例如: CH3-CH-CH3 Br 2, 光 127 ℃ CH3 CH3-C-CH3 Br >99% CH3 CH3-CH-CH2 Br <1%
A + BC
A
........
B
...........
C
AB + C
过渡态的特点: (1)能量高。 (2)极不稳定,不能分离得到。 (3)旧键未完全断开,新键未完全形成。
反应势能图
反应势能曲线:图中表示势能高低的曲线。
势 能
A......B ....C
反应坐标:由反应物到生成物所经过的能 量要求最低的途径。 过渡态:在反应物互相接近的反应进程中, 与势能最高点相对应的结构称为过渡态。
Cl2 光
57/43=2x/6
x=4
(3)烷烃与其它卤素的取代反应 CH3 CH3-CH CH3 + Br2
光 127℃
CH3 CH3 CH3-C-Br + CH3-CHCH2Br CH3 痕量 99%
•仲,叔氢原子的反应活性:1:82:1600.溴更具有选择性.
• 与氟反应剧烈,不易控制,会引起爆炸.
CH2 > CH2
苯甲基自由基
CHCH2 > (CH3)3C > (CH3)2CH
三级丁基自由基 异丙基自由基
稀丙基自由基
> CH3CH2 > CH3
乙基自由基
>
苯基自由基
甲基自由基
两点说明
•影响自由基稳定 性的因素是很多 的,如: 电子离 域,空间阻碍, 螯合作用和邻位 原子的性质等;
•碳自由基的最外层 为七个电子,反应 时总要寻找另外的 电子来达到八隅体 结构,所以是亲电 的。
CH3 例如: CH3-CH-CH3 Br 2, 光 127 ℃ CH3 CH3-C-CH3 Br >99% CH3 CH3-CH-CH2 Br <1%
第二章 烷烃和环烷烃 自由基取代

二、小环烷烃的结构
小环环烷烃不稳定,而环戊烷、环己烷以 及大环环烷烃却比较稳定,为什么呢? 1、拜尔(Baeyer)张力学说: 为解释三、四元环不稳定,而五、六元环稳 定的原因,提出了张力学说,基本点是: (1)、假设碳原子成环后,原子都处于一个 平面上 (2)、按照碳原子的正四面体模型,碳碳键 之间的夹角为109°28’。
CH3 H H CH3 H H
H CH3 CH3
对位交叉式 63%
H 3C H
四 H H 种 H 典 邻位交叉式 37% 型 构 H3C CH 3 象
H H H H
H H
H H 3C
部分重叠式
全重叠式
稳定性次序: 对位交叉式>邻位交叉式>部分重式>全重叠式
在化学反应中,分子不一定以优势构象参与 反应。 影响构象稳定性的因素除了扭转张力和范德 华斥力外,有时还有偶极-偶极相互作用以及 氢键的影响,在这些情况下,分子优势构象 不一定都是对位交叉式。
环烷烃的分类
根据环烷烃分子中所含的碳环数目,可分为单环、 多环环烷烃。 分子中只有一个碳环结构的烷烃,称为单环环烷 烃 ,其分子通式为CnH2n 。
பைடு நூலகம்
单环环烷烃分类:小环(三元环、四元环) 常见环(五元环、六元环) 中环(七元环~十二元环) 大环(十二元环以上)环烷烃
1. 双环或多环环烷烃中,两环共用1个碳原子 称螺环烷烃,共用碳原子称螺原子。含一个螺 原子的称单螺环烷烃。 2. 两环间共用2个或2个以上的碳原子称桥环 烷烃,共用碳原子称桥头碳原子(简称桥原子) 螺原子 桥原子
H H H 锯架式 H H H
H H H H H H
Newman投影式
第四章 烷烃 自由基取代反应
键解离能 平均键能和自由基
1、键解离能 和自由基稳定性
键的解离能: 某一键断裂所吸收的热量, 是键解离反应的焓( ΔHο反应热),用 DHο 表示,如: CH3-H → CH3 ·+ H · ΔHο= DHο= + 439.3 kJmol-1
1
CH3CH2- H → CH3CH2 ·+ H · CH3CH2CH2-H → CH3CH2CH2 ·+ H · ( CH3 )2CH-H → ( CH3 )2CH · + H ·
甲烷氯化的反应热如下所示:
(1) Cl2 (+242.7 ) (2)Cl · CH4 + (+439.3 ) (3)CH3· Cl2 + CH3· HCl + (- 431.8) CH3Cl + Cl · ΔHο= (+439.3 )+(-431.8) = + 7.5 kJmol-1 ΔHο = (+ 242.7)+ (-355.6) 2Cl · ΔHο= + 242.7 kJmol-1
第四章 烷烃 自由基取代反应
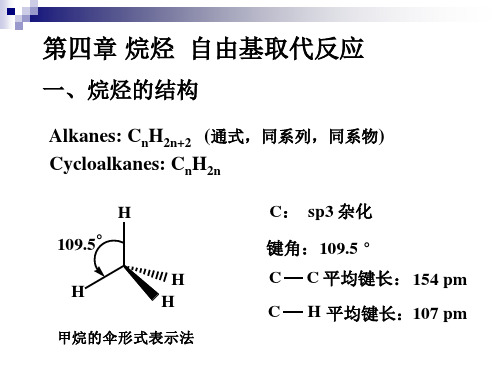
一、烷烃的结构
Alkanes: CnH2n+2 (通式,同系列,同系物) Cycloalkanes: CnH2n
H 109.5° H H H C: sp3 杂化 键角:109.5 ° C C C 平均键长: 154 pm H 平均键长:107 pm
甲烷的伞形式表示法
二、烷烃的结构特点 1、非极性分子,偶极矩为0 2、在运动中可以产生瞬时偶极矩 3、分子间有色散力(瞬时偶极矩间的相互 作用)、vander waals 引力
一步反应 A + BC [A---B---C] 过渡态 AB + C
二步反应 A + B 反应物 C 中间体 D 产物
烷烃自由基取代反应37页PPT

烷烃自由基取代反应
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 9、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
END
16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 9、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
END
16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
第四章 烷烃自由基取代反应
3. 有机反应的分类
按反应时键断裂和生产的方式 :自由基型、离子型、协同 亲电反应: 决进攻而发生的反应。 协同反应: 旧键的断裂与新键的生成都相互协调地在同一步骤中完成。 按反应物和生成物的结构关系 : 酸碱 (acid-base) 、 取代 ( substitution reaction) 、 加成 (addition reaction) 、 消除 (elimination reaction) 、 重排 ( rearrangement reaction) 、氧化还原( oxidation and reduction) 、缩合( condensation) 。
→ R3COOH + R3C·
过氧化物易产生爆炸的原因: -O-O-键是个弱键,在适当温度下很容易分解,产生自由基,自由基引发链反应,产生大量自由基,促使反应很快 进行,并放出大量热。
10. 烷烃的硝化
烷烃与硝酸或四氧化二氮进行气相(400~450℃)反应,生成硝基化合物(RNO2) 。 硝基烷烃可以转变成多种其他类型的化合物,如胺、羟胺、腈、醇、醛(Nef 反应) 、酮及羧酸等。硝基烷烃在工业上是很有用的溶剂,例如溶 解醋酸纤维、假漆、合成橡胶以及其他有机化合物。低级硝基烷烃都是可燃的,而且毒性很大。
6. 自由基反应
自由基碳呈 sp2 杂化(碳正离子 P 248 也是一样;碳负离子一般为 sp3 杂化,中的一对负电子占用的轨道会对其他 σ 轨道有排斥, 而成三角锥形,即这对负电子占有一个 sp3 杂化轨道) , p 轨道被一个孤电子占据。 在同系列中第一个化合物往往是比较特殊的。 解离能越低的碳自由基越稳定。 数据表明断裂 C-C 键所需的能量比 C-H 键小,因此 C-C 键易断同时还可以看出断裂 CH3CH2CH2CH3 中 C-C 键,形成两个 CH3CH2· 时H 最小, 说明大分子在中间断裂的机会是比较多的。 慢引发,快增长,速终止,有转移。 自由基反应的特点是没有明显的溶剂效应,酸、碱等催化剂对反应也没有明显影响当反应体系中有氧气(或有一些能捕捉自由基的杂质存在,如 下)时,反应往往有一个诱导期。所以自由基反应要做到防水防氧防铁。
理学第4章 烷烃 自由基取代

性 (4)氧气是自由基反应的抑制剂。
单自由基比双自由基稳定
C H 3 + O O
双自由基
C H 3O O
单自由基
异裂: A:B A+ + B-
(CH3)3C : Cl (CH3)3C+ + Cl-
• 共价键断裂时,两原子间的共用电子对完全转移到其 中的一个原子上的断裂方式.结果产生正 、负离子.
A : B → A• + B• 自由基
自由基反应中,分子经过均裂产生自由基,也称均裂 反应。
Cl2 (光照) Cl·+ Cl· CH4 + Cl · CH3 ·+ H : Cl
(1)反应机理包括链引发、链增长、链终止三个阶段。
共 (2)反应必须在光、热或自由基引发剂的作用下发生。
(3)溶剂的极性、酸或碱催化剂对反应无影响。
丙烷氯代反应:
Cl2 光
Cl
CH3CH2CH3 25℃,CCl4 CH3CH2CH2Cl + CH3CHCH3
正丙基氯43% 异丙基氯57%
设:伯氢原子活泼性为1,仲氢原子相对活泼性为x:
57/43=2x/6
x=4
(3)烷烃与其它卤素的取代反应
CH3
CH3
CH3
CH3-CH
CH3
+
Br2
光 127℃
CH3-C-Br
+ CH3-CHCH2Br
CH3
99%
痕量
•仲,叔氢原子的反应活性:1:82:1600.溴更具有选择性.
• 与氟反应剧烈,不易控制,会引起爆炸.
• 烷烃与碘作用得不到碘代烷.
产物单一,可用溴代 来制备卤代烃
单自由基比双自由基稳定
C H 3 + O O
双自由基
C H 3O O
单自由基
异裂: A:B A+ + B-
(CH3)3C : Cl (CH3)3C+ + Cl-
• 共价键断裂时,两原子间的共用电子对完全转移到其 中的一个原子上的断裂方式.结果产生正 、负离子.
A : B → A• + B• 自由基
自由基反应中,分子经过均裂产生自由基,也称均裂 反应。
Cl2 (光照) Cl·+ Cl· CH4 + Cl · CH3 ·+ H : Cl
(1)反应机理包括链引发、链增长、链终止三个阶段。
共 (2)反应必须在光、热或自由基引发剂的作用下发生。
(3)溶剂的极性、酸或碱催化剂对反应无影响。
丙烷氯代反应:
Cl2 光
Cl
CH3CH2CH3 25℃,CCl4 CH3CH2CH2Cl + CH3CHCH3
正丙基氯43% 异丙基氯57%
设:伯氢原子活泼性为1,仲氢原子相对活泼性为x:
57/43=2x/6
x=4
(3)烷烃与其它卤素的取代反应
CH3
CH3
CH3
CH3-CH
CH3
+
Br2
光 127℃
CH3-C-Br
+ CH3-CHCH2Br
CH3
99%
痕量
•仲,叔氢原子的反应活性:1:82:1600.溴更具有选择性.
• 与氟反应剧烈,不易控制,会引起爆炸.
• 烷烃与碘作用得不到碘代烷.
产物单一,可用溴代 来制备卤代烃
