氨基酸性质总结
氨基酸基本的理化性质

感染性疾病曾一度是人类生存所面临的最大威胁。随着抗生素的发明和广
泛使用,感染性疾病得到了一定程度的控制,但仍然是人类死亡的一个重要原
因。据WHO报告,2000年全球死亡人数5570万,其中1440万由感染性疾病引起,
占总死亡人数的15.9%。过去的几十年里,耐药性微生物的不断产生和生物耐药
性问题的日益恶化,开发新的抗感染药物已成为治疗感染疾病的必由之路。昆
一、天然活性肽
目前,由自然界已经获得了种类多样、功能各异的生物活性肽,下页 列举了一些这方面的例证。
昆虫抗菌肽 :迄今为止,已有150多种昆虫抗菌肽被分离鉴定,许多 抗菌肽的cDNA已被克隆测序并进行了初步的基因定位和表达调控机制研 究。昆虫抗菌肽已成为当前研究的热点,某些抗菌肽正在通过基因工程技 术开始工业化生产并用于农业、工业和食品卫生等多个领域。
关于抗菌肽的作用机理,现在人们比较一致的看法是,不同的抗菌肽在其 杀菌方式上可能存在一些差异。有的通过在细菌膜上形成孔道,造成细胞内物 质泄漏进而导致化学势丧失而达到杀菌的效果;有的能够干扰一定类型的外膜 蛋白基因的转录,使相应蛋白的合成量减少,从而导致细胞膜的通透性增加, 使细菌生长受到抑制。有些还可能抑制细菌细胞壁的形成,使细菌不能维持正 常的细胞形态而生长受阻,等等。
一般用水和乙醇之间自由能变化表示氨基酸侧链的疏水性,将此变化值 标作△G′。
不同氨基酸的△G′值如下表所示。
编辑课件
2
氨基酸
丙氨酸(Ala) 精氨酸(Arg) 天冬酰胺(Asn) 天冬氨酸(Asp) 半胱氨酸(Cys) 谷氨酰胺(Gln) 谷氨酸(Glu)
氨基酸侧链的疏水性(乙醇→水,kJ/mol)
△G′
10.87 1.25 1.67
各种氨基酸理化性质-20101202

各种氨基酸性质
酸的酶进行水解,再利用游离氨基酸与酰化体的溶解度差进行分离。化学合成法生产 成本高,反应复杂,步骤多,且有许多副产物。
3.发酵法:利用微生物发酵法生产L-缬氨酸具有原料成本低、反应条件温和及易实 现大规模生产等优点,是一种非常经济的生产方法。 (1)添加前体物发酵法:又称微生物转化法。这种方法使用葡萄糖作为发酵碳源 ,再添加特异的前体物质即在氨基酸生物合成途径中的一些合适中间代谢产物,以避 免氨基酸生物合成途径中的反馈调节作用,经微生物作用将其有效转化为目的氨基酸 。由于其前体物质如丙酮酸等稀少或价格昂贵,目前已少采用此法生产L-缬氨酸。 (2)直接发酵法:是借助于微生物具有合成自身所需氨基酸的能力,通过对特定微 生物ide诱变处理,选育出营养缺陷型及氨基酸结构类似物抗性突变株,以解除代谢调 节中的反馈抑制和反馈阻遏作用,从而达到过量累积某种氨基酸的目的。目前,世界 上L-缬氨酸均采用直接发酵法生产。国外曾对发酵法所用L-缬氨酸优良生产菌株的诱 变育种和代谢调节作了一些研究,而国内尚处于研究与小规模生产阶段,菌株产酸水 平不高,生产水平和产量远不能满足市场需求。因此,以微生物发酵法生产L-缬氨酸 的研究具有重要的意义。
物理性质:本品为白色结晶或结晶性粉末;无臭,味微甜而后苦 ;在水中
溶解,在乙醇中几乎不溶;等电点6.00。
化学性质:具有氨基酸的通性。 生产工艺: 目前,L-缬氨酸的生产方法有提取法、合成法、发酵法等。
1.提取法:动物血粉、蚕蛹及毛发水解液中L-缬氨酸的含量较高,从动物血粉 和蚕蛹水解液中,应用离子交换技术从混合氨基酸中分离L-缬氨酸,分离的效率高 ,提取操作简单,生产周期短,但成本高,不适合现代化大工业生产猪血粉中提 取L-缬氨酸的回收率为14.7%;蚕蛹水解液中分离L-缬氨酸,回收率为23.68%
有机化学基础知识点氨基酸的结构和性质

有机化学基础知识点氨基酸的结构和性质氨基酸是有机化合物中的一类重要分子,它具有特殊的分子结构和多种性质。
本文将围绕氨基酸的结构和性质展开相关探讨。
一、氨基酸的结构氨基酸的基本结构由一个氨基(NH2)、一个羧基(COOH)、一个带有特定侧链的碳原子组成。
其中,碳原子与氨基和羧基相连,形成一个称为α-碳的中心原子。
氨基酸的侧链(R基团)可以是疏水性的烃基、亲水性的羟基或带电离子的酸基等,这些不同的侧链决定了氨基酸的特性和功能。
二、氨基酸的分类根据氨基酸的侧链特征,可以将其分为以下几类:1. 脂溶性氨基酸:侧链为非极性的疏水性基团,如甲基(Alanine),苯基(Phenylalanine)等;2. 极性氨基酸:侧链含有氢键形成原子,具有一定的亲水性,如羟基(Serine),酸基(Aspartic acid)等;3. 硫氨基酸:侧链含有硫原子,具有特殊的性质,如半胱氨酸(Cysteine);4. 离子型氨基酸:侧链带有正电荷或负电荷,如精氨酸(Arginine),谷氨酸(Glutamic acid)等。
三、氨基酸的性质氨基酸具有以下几种重要的性质:1. 生理性质:氨基酸是构成生物体内蛋白质的基本组成单元,参与细胞代谢和生命活动的调控。
其中人体无法自行合成的氨基酸称为必需氨基酸,必须从外部食物中摄入。
2. 光学性质:氨基酸的α-碳上存在手性中心,可以分为D-型和L-型两种异构体。
天然氨基酸大部分为L-型,而工业合成的氨基酸多为D-型。
3. 缔合性质:氨基酸能够通过脱羧和脱氨反应与其他分子发生缔合,形成肽键和蛋白质。
这个过程称为蛋白质的合成。
4. 缓冲性质:氨基酸中的羧基和氨基可以接受或释放质子,并能维持生物体内pH的稳定。
5. 亲水性和疏水性:由于氨基酸的不同侧链,其溶解度和溶液中的行为也会不同,包括溶解度、水合作用等。
四、应用举例1. 蛋白质合成:氨基酸是构成蛋白质的基本单元,了解氨基酸的结构和性质对研究蛋白质的合成机制和调控具有重要意义。
各种氨基酸理化性质-20101202综述

分子式:C2H5NO2 化学式:NH2CH2COOH 结构式
分子量:75.07
物化性质:甘氨酸是20个氨基酸中最简单的一个,是一个非极性的氨基酸。白
色单斜晶系 或六方晶系晶体,或白色结晶粉末,无臭,有特殊甜味; 相对密度1.16,熔点 248℃(分解),易溶于水;在水中的溶解度: 25℃ 时为 25g/100ml,50℃时为 39.1g/100ml,75℃时为 54.4g/100ml,100℃时为67.2g /100ml;极 难溶于乙醇,在100g无水 乙醇中约溶解 0.06 g,几乎不溶于丙酮 和乙醚;等电点6.06。
2.合成法:合成法很多,一种是由异丁酸与氨生成氨基异丁醇,再与氰化氢合 成氨基异丁腈,然后水解而成。一种是由异丁醛与氰化氢合成羟基异丁腈,水解 得DL-缬氨酸,经化学法或酶法拆分得L-缬氨酸。也可由异丁醛与氰化钠和氯化铵 直接合成氨基异丁腈,再水解而成。上述三种方法的得率为36%~40%。合成法 所得为外消旋体,须经外消旋拆开。旋光拆开的方法很多,如用酰基-DL-氨基
各种氨基酸性质
酸的酶进行水解,再利用游离氨基酸与酰化体的溶解度差进行分离。化学合成法生产 成本高,反应复杂,步骤多,且有许多副产物。
3.发酵法:利用微生物发酵法生产L-缬氨酸具有原料成本低、反应条件温和及易实 现大规模生产等优点,是一种非常经济的生产方法。 (1)添加前体物发酵法:又称微生物转化法。这种方法使用葡萄糖作为发酵碳源 ,再添加特异的前体物质即在氨基酸生物合成途径中的一些合适中间代谢产物,以避 免氨基酸生物合成途径中的反馈调节作用,经微生物作用将其有效转化为目的氨基酸 。由于其前体物质如丙酮酸等稀少或价格昂贵,目前已少采用此法生产L-缬氨酸。 (2)直接发酵法:是借助于微生物具有合成自身所需氨基酸的能力,通过对特定微 生物ide诱变处理,选育出营养缺陷型及氨基酸结构类似物抗性突变株,以解除代谢调 节中的反馈抑制和反馈阻遏作用,从而达到过量累积某种氨基酸的目的。目前,世界 上L-缬氨酸均采用直接发酵法生产。国外曾对发酵法所用L-缬氨酸优良生产菌株的诱 变育种和代谢调节作了一些研究,而国内尚处于研究与小规模生产阶段,菌株产酸水 平不高,生产水平和产量远不能满足市场需求。因此,以微生物发酵法生产L-缬氨酸 的研究具有重要的意义。
氨基酸的结构与性质

四、核酸
1、核酸是一类含磷的生物高分子化合物,相对分 子量可达十几万至几百万。
2、核酸在生物体的生长、繁殖、遗传、变异等 生命现象中起着决定性的作用。
3、具有酸性
4、分类:(1)脱氧核糖核酸(DNA):生物遗 传信息的载体;还指挥着蛋白质的合成、细胞的分 裂和制造新的细胞,大量存在于细胞核中。 (2)核糖核酸(RNA):根据DNA提供的信息 控制体内蛋白质的合成,主要存在于细胞质中。
化而分解。它们能溶于强酸或强碱溶液中,除少数外一般 都能溶于水,而难溶于酒精和乙醚。
谷
甘
氨
氨
酸
酸
不同的氨基酸形成内盐的pH值各不相同
名称 甘氨酸 丙氨酸 缬氨酸 亮氨酸 异亮氨酸 苯丙氨酸 半胱氨酸
内盐pH 6.06 6.11 6.00 6.01 6.05 5.49 5.05
名称 苏氨酸 谷氨酸 天冬氨酸 赖氨酸 组氨酸 精氨酸 酪氨酸
A.蛋白质的盐析 B.酯的水解 C.蛋白质白变性 D.氯化铁的水解
2、欲将蛋白质从水中析出而又不改变它的性
质应加入( C)
A.甲醛溶液
B.CuSO4溶液
C.饱和Na2SO4溶液 D.浓硫酸
3.关于蛋白质的叙述错误的是( B )
A.浓HNO3溅在皮肤上,使皮肤呈黄色, 是由于浓HNO3和蛋白质发生了颜色反应
A. 2种 C. 4种
B. 3种 D. 5种
氨基酸可以与同碳数的硝基化合物为同分异构体
第四章 生命中的基础有机化学物质 第二课时蛋白质 酶 核酸
蛋白质的结构与性质 1. 组成: 蛋白质构成元素有:C、H、O、N、S 等 官能团为:肽键(酰胺键) 相对分子质量可达几万到几千万,为有机高分 子化合物。 人体内所具有的蛋白质种类达到了10万种以上。
初中化学知识点归纳氨基酸和蛋白质的性质与应用

初中化学知识点归纳氨基酸和蛋白质的性质与应用氨基酸和蛋白质是化学领域中重要的概念和研究对象。
本文将对初中化学中与氨基酸和蛋白质相关的知识点进行归纳和总结,并探讨其性质与应用。
一、氨基酸的概念与分类氨基酸是构成蛋白质的基本单元,由一种或多种氨基酸残基组成。
根据氨基酸的结构和特性,可以将其分为脂肪族氨基酸和芳香族氨基酸两大类。
脂肪族氨基酸是指在分子结构中含有脂肪族侧链的氨基酸,如甘氨酸、丙氨酸等。
芳香族氨基酸则是指包含芳香族环结构的氨基酸,比如苯丙氨酸、酪氨酸等。
二、氨基酸的性质与应用1. 氨基酸的酸碱性氨基酸是同时具有酸性和碱性的物质,其分子中含有一个或多个氨基(-NH2)和一个羧基(-COOH)。
因此,氨基酸可以通过释放或接受质子而表现出酸性或碱性。
2. 氨基酸的缔合作用氨基酸可以通过缔合反应,将两个或多个氨基酸结合到一起形成肽键。
多个氨基酸通过缔合作用形成的化合物被称为肽,而其中氨基酸数目较多的化合物被称为多肽。
3. 氨基酸的生理功能氨基酸在生物体内具有多种重要的生理功能。
例如,氨基酸是蛋白质的组成单元,参与构建和修复生物体的组织结构;氨基酸还可以作为能量的来源,提供细胞代谢所需的能量。
4. 蛋白质的性质与应用蛋白质是由氨基酸长链缔合而成的生物大分子,在生物体内具有多种重要功能。
根据其复杂的结构和功能,蛋白质可以分为结构蛋白、酶、激素等多种类型。
结构蛋白是生物体内构成组织和细胞的重要组成部分,如肌肉纤维中的肌动蛋白;酶是生物体内催化化学反应的催化剂,如消化道中的胃蛋白酶;激素则是调节生物体生理功能的信号分子,如胰岛素。
除了在生物体内发挥重要作用外,蛋白质还具有广泛的应用价值。
在食品工业中,蛋白质常被用作乳化剂、稳定剂和增稠剂等;在医药领域,蛋白质也被用于制造药物和疫苗。
三、氨基酸和蛋白质的实验室检测方法在实验室中,常用的检测氨基酸和蛋白质的方法包括纸层析法、光谱分析法和生物化学分析法等。
纸层析法是一种简单、快速的方法,可用于检测氨基酸和短肽。
氨基酸的性质
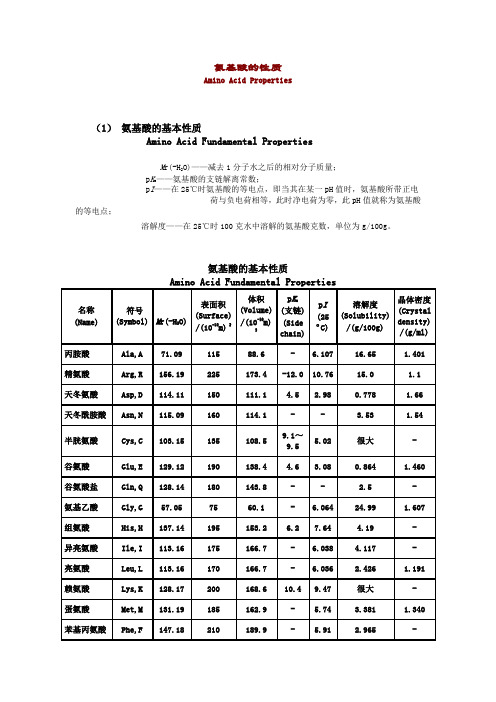
氨基酸的性质
Amino Acid Properties
(1)氨基酸的基本性质
Amino Acid Fundamental Properties
M r(-H2O)——减去1分子水之后的相对分子质量;
p K a——氨基酸的支链解离常数;
p I——在25℃时氨基酸的等电点,即当其在某一pH值时,氨基酸所带正电
荷与负电荷相等,此时净电荷为零,此pH值就称为氨基酸的等电点;
溶解度——在25℃时100克水中溶解的氨基酸克数,单位为g/100g。
氨基酸的基本性质
(2)氨基酸的系统名称、出现频率与分子式
Systematic Names、Occurrences and Formulae of Amino Acids
氨基酸的系统名称、出现率与分子式
(3) 氨基酸的标准热力学数据
Standard Thermodynamic Data of Amino Acids
下表中的标准热力学数据是以温度25.0℃(298.15K)处于标准状态的1摩尔纯物质为基准的。
物质状态表示符号为:g——气态,l——液态,cr——晶体。
△H fΘ——物质的标准生成焓(298.15K),单位为kJ/mol;
△G fΘ——物质的标准生成Gibbs自由能(298.15K),单位为kJ/mol;
SΘ——物质的标准熵(298.15K),单位为J/(mol•K);
C pΘ——物质的常压热容(298.15K),单位为J/(mol•K)。
氨基酸的标准热力学数据。
氨基酸的结构与性质

氨基酸的结构是由一个氨基、一个羧基、一个氢和一个R基连在同一个中心C 原子上组成。
这样分子式就为C2H4O2R。
性质:氨基酸为无色晶体,熔点超过200℃,比一般有机化合物的熔点高很多。
α一氨基酸有酸、甜、苦、鲜4种不同味感。
谷氨酸单钠盐和甘氨酸是用量最大的鲜味调味料。
氨基酸一般易溶于水、酸溶液和碱溶液中,不溶或微溶于乙醇或乙醚等有机溶剂。
氨基酸在水中的溶解度差别很大,例如酪氨酸的溶解度最小,25℃时,100 g 水中酪氨酸仅溶解0.045 g,但在热水巾酪氨酸的溶解度较大。
赖氨酸和精氨酸常以盐酸盐的形式存在,因为它们极易溶于水,因潮解而难以制得结晶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D或Asp
133.089
HOOC-CH2-
酸性氨基酸类
半胱氨酸
Cysteine
C或Cys
121.145
HS-CH2-
含硫类
谷氨酰胺
Glutamine
Q或Gln
146.131
H2N-CO-(CH2)2-
酰胺类
谷氨酸
Glutamic acid
E或Glu
147.116
HOOC-(CH2)2-
Proline
P或Pro
115.117
-N-(CH2)3-CH-Βιβλιοθήκη |_________|亚氨基酸
丝氨酸
Serine
S或Ser
105.078
HO-CH2-
羟基类
苏氨酸
Threonine
T或Thr
119.105
CH3-CH(OH)-
羟基类
色氨酸
Tryptophan
W或Trp
204.213
Phenyl-NH-CH=C-CH2-
|___________|
芳香族类
酪氨酸
Tyrosine
Y或Tyr
181.176
4-OH-Phenyl-CH2-
芳香族类
缬氨酸
Valine
V或Val
117.133
CH3-CH(CH2)-
脂肪族类
20种氨基酸密码子表
第一个
核苷酸5′
第二个核苷酸
第三个
核苷酸3′
U
C
A
G
U
苯丙氨酸
丝氨酸
酪氨酸
半胱氨酸
U
苯丙氨酸
这类氨基酸分子中只含有一个氨基和一个羧基
酸性氨基酸
谷氨酸、天门冬氨酸
这类氨基酸分子中含有一个氨基和二个羧基
碱性氨基酸
赖氨酸、精氨酸、组氨酸
这类氨基酸的分子中含二氨基一羧基;组氨酸具氮环,呈弱碱性,也属碱性氨基酸。
2.根据氨基酸的极性分类:
类别
氨基酸
非极性氨基酸
甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸
131.160
(CH3)2-CH-CH2-
脂肪族类
赖氨酸
Lysine
K或Lys
146.17
H2N-(CH2)4-
碱性氨基酸类
蛋氨酸
Methionine
M或Met
149.199
CH3-S-(CH2)2-
含硫类
苯丙氨酸
Phenylalanine
F或Phe
165.177
Phenyl-CH2-
芳香族类
脯氨酸
精氨酸
G
G
缬氨酸
丙氨酸
天冬氨酸
甘氨酸
U
缬氨酸
丙氨酸
天冬氨酸
甘氨酸
C
缬氨酸
丙氨酸
谷氨酸
甘氨酸
A
缬氨酸
丙氨酸
谷氨酸
甘氨酸
G
二、分类
1.根据氨基酸分子中所含氨基和羧基数目的不同,将氨基酸分为中性氨基酸、酸性氨基酸和碱性氨基酸:
类别
氨基酸
特点
中性氨基酸
甘氨酸、丙氨酸、亮氨酸、异亮氨酸、缬氨酸、胱氨酸、半胱氨酸、甲硫氨酸、苏氨酸、丝氨酸、苯丙氨酸、酪氨酸、色氨酸、脯氨酸、蛋氨酸和羟脯氨酸
氨基酸分类
一、总表
中文名称
英文名称
符号与缩写
分子量
侧链结构
类型
丙氨酸
Alanine
A或Ala
89.079
CH3-
脂肪族类
精氨酸
Arginine
R或Arg
174.188
HN=C(NH2)-NH-(CH2)3-
碱性氨基酸类
天冬酰胺
Asparagine
N或Asn
132.104
H2N-CO-CH2-
酰胺类
天冬氨酸
极性氨基酸
极性中性氨基酸
色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸
酸性氨基酸
天冬氨酸、谷氨酸
碱性氨基酸
赖氨酸、精氨酸、组氨酸
其中,属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸
属于亚氨基酸的是:脯氨酸
含硫氨基酸包括:半胱氨酸、蛋氨酸
3.按其亲水性、疏水性可分为:
类别
氨基酸
亲水性氨基酸
酸性氨基酸类
甘氨酸
Glycine
G或Gly
75.052
H-
脂肪族类
组氨酸
Histidine
H或His
155.141
N=CH-NH-CH=C-CH2-
|__________|
碱性氨基酸类
异亮氨酸
Isoleucine
I或Ile
131.160
CH3-CH2-CH(CH3)-
脂肪族类
亮氨酸
Leucine
L或Leu
氨基酸分类一总表中文名称丙氨酸精氨酸英文名称alaninearginine符号与缩写分子量侧链结构ch3hncnh2nhch23h2ncoch2hoocch2hsch2h2ncoch22hoocch22hnchnhchcch2ch3ch2chch3ch32chch2h2nch24ch3sch22phenylch2nch23chhoch2ch3chohphenylnhchcch24ohphenylch2ch3chch2类型脂肪族类碱性氨基酸类酰胺类酸性氨基酸类含硫类酰胺类酸性氨基酸类脂肪族类碱性氨基酸类脂肪族类脂肪族类碱性氨基酸类含硫类芳香族类亚氨基酸羟基类羟基类芳香族类芳香族类脂肪族类a或ala89079r或arg174188天冬酰胺asparaginen或asn132104天冬氨酸asparticacidd或asp133089半胱氨酸cysteinec或cys121145谷氨酰胺glutamineq或gln146131谷氨酸甘氨酸组氨酸glutamice或glu147116acidglycineg或gly75052histidineh或his155141异亮氨酸isoleucinei或ile131160亮氨酸赖氨酸蛋氨酸leucinelysinel或leu131160k或lys14617methioninem或met149199苯丙氨phenylalaninef或phe165177酸脯氨酸丝氨酸苏氨酸色氨酸酪氨酸缬氨酸prolineserinep或pro115117s或ser105078threoninet或thr119105tryptophanw或trp204213tyrosinevaliney或tyr181176v或val11713320种氨基酸密码子表第一个第二个核苷酸第三个核苷酸5核苷酸3ucag苯丙氨酸丝氨酸酪氨酸半胱氨酸u苯丙氨酸丝氨酸酪氨酸半胱氨酸cu亮氨酸丝氨酸终止密码子终止密码子a亮氨酸丝氨酸终止密码子色氨酸g亮氨酸脯氨酸组氨酸精氨酸u亮氨酸脯氨酸组氨酸精氨酸cc亮氨酸脯氨酸谷氨酰胺精氨酸a亮氨酸脯氨酸谷氨酰胺精氨酸g异亮氨酸苏氨酸天冬酰胺丝氨酸u异亮氨酸苏氨酸天冬酰胺丝氨酸ca异亮氨酸苏氨酸赖氨酸精氨酸a蛋氨酸苏氨酸赖氨酸精氨酸g缬氨酸丙氨酸天冬氨酸甘氨酸u缬氨酸丙氨酸天冬氨酸甘氨酸cg缬氨酸丙氨酸谷氨酸甘氨酸a缬氨酸丙氨酸谷氨酸甘氨酸g二分类1
D, E, H, K, Q, R, S, T,羟脯氨酸,焦谷氨酸
疏水性氨基酸
A, F, I, L, M, P, V, W, Y,α-氨基丁酸,β-氨基丙氨酸,正亮氨酸
未定类
C和G
丝氨酸
酪氨酸
半胱氨酸
C
亮氨酸
丝氨酸
终止密码子
终止密码子
A
亮氨酸
丝氨酸
终止密码子
色氨酸
G
C
亮氨酸
脯氨酸
组氨酸
精氨酸
U
亮氨酸
脯氨酸
组氨酸
精氨酸
C
亮氨酸
脯氨酸
谷氨酰胺
精氨酸
A
亮氨酸
脯氨酸
谷氨酰胺
精氨酸
G
A
异亮氨酸
苏氨酸
天冬酰胺
丝氨酸
U
异亮氨酸
苏氨酸
天冬酰胺
丝氨酸
C
异亮氨酸
苏氨酸
赖氨酸
精氨酸
A
蛋氨酸
苏氨酸
赖氨酸
