溶液复习学案
九年级下册化学《溶液》单元复习课 学案
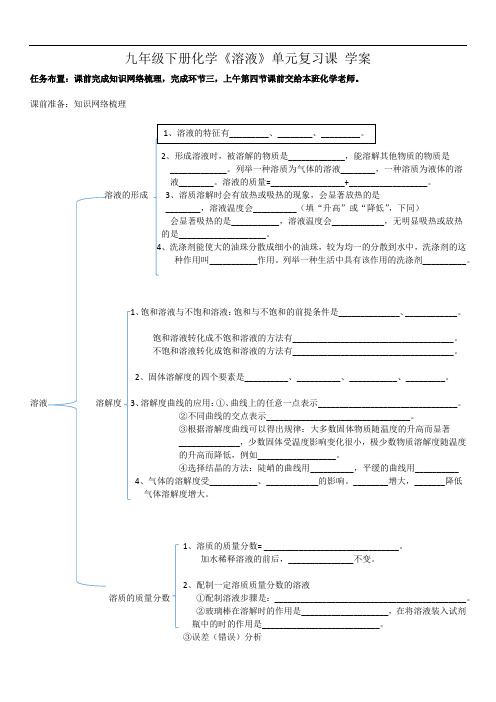
九年级下册化学《溶液》单元复习课学案任务布置:课前完成知识网络梳理,完成环节三,上午第四节课前交给本班化学老师。
课前准备:知识网络梳理。
溶液的形成,下同),无明显吸热或放热__________。
1、饱和溶液与不饱和溶液:饱和与不饱和的前提条件是______________、____________。
饱和溶液转化成不饱和溶液的方法有_____________________________________。
不饱和溶液转化成饱和溶液的方法有_____________________________________。
2、固体溶解度的四个要素是__________、__________、___________、_________。
溶液溶解度3、溶解度曲线的应用:①、曲线上的任意一点表示________________________________。
②不同曲线的交点表示_________________________________。
③根据溶解度曲线可以得出规律:大多数固体物质随温度的升高而显著______________,少数固体受温度影响变化很小,极少数物质溶解度随温度的升高而降低,例如__________________。
④选择结晶的方法:陡峭的曲线用__________,平缓的曲线用__________4、气体的溶解度受___________、____________的影响。
________增大,_______降低气体溶解度增大。
1、溶质的质量分数= _______________________________。
加水稀释溶液的前后,_______________不变。
2、配制一定溶质质量分数的溶液溶质的质量分数①配制溶液步骤是:____________________________________________。
②玻璃棒在溶解时的作用是____________________,在将溶液装入试剂瓶中的时的作用是___________________________。
《溶液》复习学案

第九单元《溶液》复习学案编写人:王诗龙审核人:郝乃中【学习目标:】1、建立溶液的概念并认识溶液、溶质、溶剂三者之间的关系。
2、如何引导学生从微观角度分析溶解过程中的放热和吸热现象。
3、建立饱和溶液和溶解度的概念4、溶液的溶质质量分数的概念和简单的计算以及配制一定溶质质量分数的溶液。
5、溶液的溶质质量分数简单的计算以及溶质质量分数和化学方程式混合的综合计算。
【课内探究】一、自主学习:知识点1:溶液的概念和特征,溶质,溶剂的概念和三者的关系(1)、溶液是指:其基本特征是:、、和。
(2)、溶液一定是无色透明的吗?无色透明的液体一定是溶液吗?理由是:(举例说明)。
(3)、溶质是指: ,溶剂是指:。
(4)、溶液的质量等于与质量之和。
(思考溶液的体积怎样?)知识点2:饱和溶液,不饱和溶液的概念及相互转化的措施(1)、饱和溶液是指:,不饱和溶液是指。
(2)、饱和溶液变为不饱和溶液的措施有:或;不饱和溶液变为饱和溶液的措施有:、或。
(注意适用条件)知识点3:物质溶解度的概念及含义的理解(四要素)(1)、固体溶解度是指:。
其四要素是:、、、。
气体溶解度是指:,其影响因素与和有关。
(如何影响?)知识点4:固体物质溶解度曲线的变化规律(三条特殊曲线)溶解度曲线可以相交,其交点的涵义是:。
变化规律:三条:;;。
知识点5:溶质质量分数的概念及计算公式和变形公式的应用溶质质量分数是指与的比,其数学表达式是:,变形公式是:或。
知识点6:配制一定质量分数的溶液所需的实验仪器和实验步骤。
配制一定质量分数的溶液实验所需实验仪器是:。
实验步骤是:三步:、、。
三、精讲点拨:1、溶液从广义上来讲,不一定都是液体,只要是一种或几种物质分散到另一种物质里形成的均一,稳定的混合物就是溶液。
例如:空气就是一种溶液,前面学习的合金也是一种溶液。
所以,溶液,溶质和溶剂都可以是固体,液体和气体三种状态,不一定都是液体。
关于溶质和溶剂的区分有三种情况:1、固体和液体混合:一般把固体看作溶质,液体看作溶剂;2、气体和液体混合:一般把气体看作是溶质,液体看作溶剂;3、液体和液体混合:一般把量少的看作是溶质,量多的看作是溶剂(当与水混合时,不论量多量少,水都作溶剂,水是一种最常用的溶剂,但并不是唯一的溶剂。
初中化学溶液复习教案

初中化学溶液复习教案
一、概念复习
1. 什么是溶液?
2. 什么是溶质和溶剂?
3. 说说溶解度和饱和溶解度的概念。
4. 什么是浓度?如何计算溶液的浓度?
二、性质复习
1. 说说溶解度与温度的关系。
2. 什么是稀释?如何计算稀释后的溶液浓度?
3. 说说饱和溶液中溶质和溶剂的动态平衡。
4. 溶液的导电性与离子的关系是什么?
5. 溶解过程中吸热与放热的原因是什么?
三、实验复习
1. 怎样实验测定溶液浓度?
2. 怎样用导电性实验判断溶液中是否含有离子?
3. 怎样用溶解度实验确定溶质在不同温度下的溶解度?
四、应用复习
1. 溶解度对生产和生活有哪些重要影响?
2. 如何在实际生活中调配和制备需要的溶液?
3. 为什么说溶液是化学中的重要概念?
五、习题训练
1. 计算25g氯化钠溶解在100g水中的溶解度。
2. 已知一溶液浓度为0.5mol/L,若稀释后溶液浓度变为0.2mol/L,求稀释倍数。
3. 一实验室发现有一瓶溶液具有较好的导电性,另一瓶溶液导电性较弱,解释原因。
4. 白糖在水中的溶解过程吸热,用化学式表示这一化学反应。
六、总结提高
1. 回顾本节课的知识点,总结溶液的基本概念和性质。
2. 思考溶液在生活和科学研究中的应用,能否举例说明?
3. 如何进一步提高对溶液的理解和掌握?
以上内容仅供参考,具体教案内容可根据教学实际情况进行调整。
愿学生们通过复习提高对溶液知识的理解和掌握,取得更好的学习成绩。
九年级化学《溶液》复习教案(20200912045708)

九年级化学《溶液》复习教课设计教课要点1、溶液的特点及溶质、溶剂的判断;2、饱和溶液与不饱和溶液的含义及互相转变;3、溶解度的含义及应用;4、从溶解度曲线图中获得有关信息。
教课难点1、溶解时的吸放热现象;2、饱和溶液与不饱和溶液之间的转变;3、溶解度曲线的综合应用。
教课过程:一、溶液:一种或几种物质分别到另一种物质里,形成的均一、稳固的混淆物。
1、溶液构成:溶质:被溶解的物质溶剂:能溶解其余物质的物质2、溶液中溶质和溶剂的判断体系溶质溶剂气 + 液气体液体固 + 液固体液体液+液有水量少量多无水非水物水二、溶解时的吸热或放热现象1、溶解过程的两种变化 : 扩散过程 : 汲取热量水合过程 : 放出热量2、几种表现 :(1)扩散过程汲取的热量小于水合过程放出的热量 :表现为放热 , 温度高升 .(2)扩散过程汲取的热量大于水合过程放出的热量 :表现为吸热 , 温度降低 .(3)扩散过程汲取的热量等于水合过程放出的热量 : 表现为温度不变。
【小结】(1)浓硫酸、 NaOH固体等溶于水温度高升;(2)NaCl 等溶于水温度不变;(3)NH4NO3等溶于水温度降低。
【练习】如图向试管里的水中加入某种物质后,本来 U型管内两臂在同一水平上的红墨水,右侧液面降低了些,左侧的液面上涨了些,则加入的物质是()A、活性炭B、生石灰C、硝酸铵D、氢氧化钠假如液面左低右高了呢?则加入的物质是()三、乳浊液:小液滴分别到液体里形成的混淆物。
特点:乳状污浊液体,不稳固,液体分层乳化现象乳化剂能使植物油分别成无数渺小的液滴,而不聚成大油珠。
小液滴能随水流走。
特点:乳状污浊液体,能稳固存在四、饱和溶液不饱和溶液1、观点(1) 饱和溶液和不饱和溶液在必定温度下,在必定量溶剂里,不可以再溶解某种溶质的溶液,叫做这类溶质的饱和溶液,还可以持续溶解某种溶质的溶液,叫做这类溶质的不饱和溶液.讲溶液饱和或不饱和,必定要指明温度和溶剂质量.和溶液或不和溶液必定要溶(2)溶液和稀溶液 --- 大略地表示溶液里溶含量的多少2、和溶液和不和溶液的互相化关系一般律:降温、蒸发溶剂、加溶质不和溶液和溶液升温、加溶剂【稳固】:(1)、在必定 _________下, 必定量的 _________ 里 ________ 再溶解某种溶的溶液叫和溶液 .(2)、要使和硝酸溶液成不和溶液 , 可采纳的举措有(1)________________________ (2)________________________ (3)、 30 C 和硝酸溶液高升温度至100oc, 杯底 _______( 有或无 ) 晶体 ,100oc 的硝酸溶液是 ________溶液 ( 填和 . 不和)(4)、以下法能否正确 ?不正确的予更正 .(a)和溶液是指不可以再溶解原溶的溶液 , 不和溶液是能溶解原溶的溶液⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯()(b)溶液必定是和溶液,稀溶液必定是不睦溶液⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯()3、物的溶解性往常把一种物溶解在另一种物里的能力叫做溶解性。
九年级化学《溶液》复习课 学案
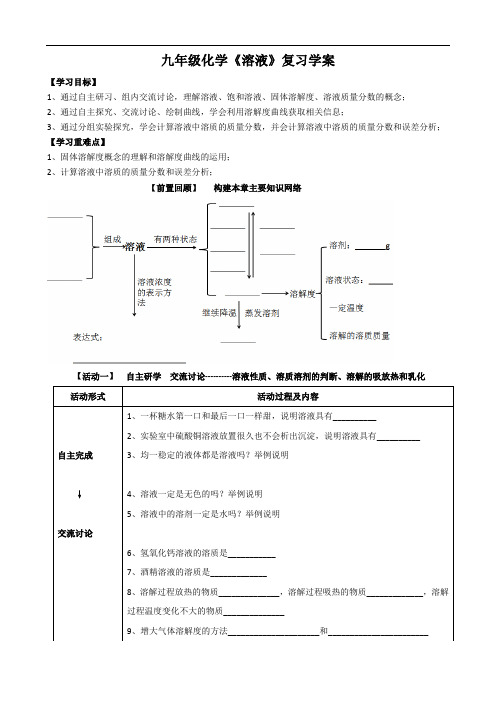
九年级化学《溶液》复习学案【学习目标】1、通过自主研习、组内交流讨论,理解溶液、饱和溶液、固体溶解度、溶液质量分数的概念;2、通过自主探究、交流讨论、绘制曲线,学会利用溶解度曲线获取相关信息;3、通过分组实验探究,学会计算溶液中溶质的质量分数,并会计算溶液中溶质的质量分数和误差分析;【学习重难点】1、固体溶解度概念的理解和溶解度曲线的运用;2、计算溶液中溶质的质量分数和误差分析;【前置回顾】构建本章主要知识网络【活动一】自主研学交流讨论----------溶液性质、溶质溶剂的判断、溶解的吸放热和乳化【活动二】自主探究交流讨论-----------溶解度及溶解度曲线独立绘制↓组内分享➢根据列表法给出的溶解度数据,描绘出硫酸铜和硝酸钾的溶解度曲线反馈练习1、右图所示,向试管里的水加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质可能是()A 氢氧化钠B 生石灰C 浓硫酸D 硝酸铵2、下列祛污操作中利用了乳化原理的是()A.用汽油除去衣服上的油污B.用洗洁精清洗餐具上的油污C.用烧碱溶液洗去餐具上的油污D.用食醋洗去水壶中的水垢活动形式活动过程及内容组内交流↓小组汇报➢寻找错误:1、20g硝酸钾溶解在100g水中恰好饱和,所以硝酸钾的溶解度是20g。
2、20℃时,50g水中加入18g食盐后溶液恰好饱和,因此,20℃时,食盐在水中的溶解度为18g。
3、10℃时,100g水里溶解了10g蔗糖,所以10℃时,蔗糖在水中的溶解度为10g。
【活动三】实验探究分享感悟---------溶质质量分数的计算、溶液的浓稀和饱和不饱和的关系【学以致用】1、下列关于溶液的说法正确的是()A、溶液一定是混合物B、均一的、稳定的液体都是溶液C、凡是无色透明的液体都是溶液D、水和酒精混合形成的溶液,酒精作溶剂2、下列溶液中,溶质为液体的()A、医用葡萄糖溶液B、20%的氢氧化钠溶液C、75%的酒精溶液D、0.9%的生理盐水3、将接近饱和的硝酸钾溶液变成饱和溶液,不易采用的方法()A、加溶质B、降温C、加溶剂D、恒温蒸发溶剂4、20℃时将36g氯化钠与100g水混合,形成溶液的质量___________(“大于”“等于”“小于”“大于等于”“小于等于”)136g;5、腌制食品、海带晾干后,常会在表面出现白色固体食盐,请解释原因:______________________________________6、认真分析溶解度曲线图,回答下列问题:①Q点的含义___________________________②P点的含义__________________________________③t1℃时甲、乙丙的溶解度由大到小的顺序是_______________________④t3℃时,甲物质的饱和溶液中,溶质质量、溶剂质量与溶液质量之比为__________________⑤t3℃时甲物质的不饱和溶液转变成饱和溶液可采取的方法有______________和____________⑥t3℃甲、乙和丙的饱和溶液各W克,降温到t1℃时析出晶体最多的是_________物质,无晶体析出的是___________物质⑦从甲溶液中获取甲晶体可采用_________________的方法,从乙溶液中获取乙晶体可采用_____________的方法7、下图所示为配制100 g质量分数为5%的硝酸钾溶液操作过程示意图:请完成下列问题:(1)B操作中应称量硝酸钾的质量为____ g,放好游码和砝码后,向托盘上加硝酸钾时,若指针偏向分度盘的左边,接下来应进行的操作是_____________________________________。
九年级化学《溶液》复习课教案

通过讨论、交流和实验探究,加深对溶液的理解,更好的领会生活中存在的大量溶液,感受化学来源于生活并服务于生活。
二、教学的重点及难点
1、固体溶解度概念的理解和溶解度曲线的运用;
2、溶液溶质质量分数的计算和配制溶液中的误差分析;
三、教学过程
教师活动
学生活动
设计意图
【引入】
展示学生前置学习
活动一
【过渡】今天,我们将已“溶液”为核心,系统复习本章知识;
【板书】溶液
【组织学生】组织学生分组,通过自主完成+交流讨论,解决溶液相关的性质、溶解的吸放热现象和乳化。
【小组展示】一个小组的代表展示答案
【反馈练习】
【反馈纠正】
活动二
【过渡】溶液有两种状态,并板书。跟饱和溶液溶液相关的一个知识点就是溶解度。
课题:人教版第九单元《溶液》(复习课)
教学对象:九年级
科目:化学
授课
一、教学目标
知识与技能:
1、通过自主研习、组内交流讨论,理解溶液、饱和溶液、固体溶解度、溶液质量分数的概念;
2、通过自主探究、交流讨论、绘制曲线,学会利用溶解度曲线获取相关信息;
3、通过分组实验探究,学会计算溶液中溶质的质量分数,并会计算溶液溶质质量分数和误差分析;
【反馈纠手描绘溶解度曲线,从描绘的曲线寻找【反馈练习】需要的信息
回忆配制溶液的步骤,并展开探究实验,记录观察现象,完成思考,讨论交流。
计算溶质质量分数,分析误差
纠正错误
描绘溶解度曲线,学会从溶解度曲线获取信息,突破难点
通过简单的探究实验,练习溶质质量分数的计算、体会溶液浓度和饱和度的关系,突破难点
【板书】饱和、不饱和、溶解度,
【组织学生】组织学生以小组为单位完成活动二
溶液的形成 复习学案

溶液的形成复习学案1复习目标:1、通过复习掌握溶液概念,区分溶解和乳化不同。
2、能判断出溶液是否饱和及相互间的转化。
【知识梳理】一、溶液1.定义:溶液是指物质分散到的物质里,生成的的物。
2.特征:溶液具有①性②性。
①是指,②是指。
3.组成:(1)溶液包括和。
最常用的溶剂是,、也可以做溶剂。
溶质可以是固体,也可以是,;溶质可以是单质,也可以是物,物;一种溶液中溶质可以是一种,也可以是种。
(2)溶液的命名:溶质的溶剂溶液白磷的二硫化碳溶液(溶质是:溶剂是);如:氯化钠的水溶液(溶质是:溶剂是);当溶剂是水时,可以省略溶剂水,称为氯化钠溶液;硫酸铜溶液等(溶质是:溶剂是)(3)从微观上看,食盐溶液实际上是和组成的均匀混合物,食盐溶液含有的粒子是(符号表示)、、。
4.溶剂的判断:当固体、气体溶于液体时,是溶剂;当两种液体互溶时,是溶剂;当液体为水时,无论水多少,习惯上把水当做。
5.溶液的质量= + ,但溶液的体积不等于溶质和溶剂的体积和,原因是(用分子观点解释)。
注意①一种溶液中只有溶剂,但可以有溶质。
(选填“一种或多种”)②溶液“透明”包括无色透明和有色透明(如______溶液为蓝色);透明液体不一定是溶液,如______。
从溶液定义上可知道溶液不一定都是液体,也可以是固体或气体,如:、的等都是溶液二、溶解现象1.在溶解过程中发生了两种变化,一种是向水中扩散,这一过程热量;另一种是和作用,生成,这一过程热量。
当,表现溶液温度升高,当,表现溶液温度降低,当,表现溶液温度不变。
2.物质的溶解通常伴随的变化。
、等物质溶解时,温度升高,等物质溶解时,温度降低,、等物质溶解时,温度不变。
三、乳化1.、和等物质可以使食用油以的形态分散在水中,形成不易分层、的混合物,这种现象较乳化现象。
2.用汽油和用加了洗涤剂的水都能除去衣服上的油污,两者原理(填“是”或“不”)相同,原理分别是,。
四、饱和溶液、不饱和溶液1.饱和溶液、不饱和溶液的概念饱和溶液:在_____下,向一定量溶剂里加入某种溶质,当溶质_____溶解时所得到的溶液,叫做这种溶质在这种溶剂里的_____溶液。
《溶液》复习教案

《溶液》复习教案学习目标:1、复习巩固溶液、饱和溶液、不饱和溶液等概念并能实际运用。
2、掌握“溶质质量分数”的含义;会进行溶质质量分数的计算,能根据溶质量分数及化学方程式进行综合性的计算;3、学会利用溶质质量分数解决生产和生活中的实际问题,培养学生善于思考、总结、归纳的精神。
重点和难点1、溶质质量分数的计算及溶液稀释问题的计算。
2、能进行有关化学方程式的溶质质量分数计算,利用溶质质量分数解决生产和生活中的实际问题;教学过程:一、导入,明确学习目标汶川大地震空投物资图片【旁白】四川汶川县发生的8.0级大地震,牵动着全国亿万人的心,十五万支破伤风注射针剂紧急运往前线、数万箱碘酒、生理盐水、葡萄糖注射液等药品火速到达灾区,那同学们能说一下用的上述物质属于我们化学上的---溶液。
今天,我们就对溶液中的重要概念和有关溶液溶质量分数的简单计算作一次复习。
明确学习目标二、构建知识网络概念、特征溶液组成(溶质在存在形式,酸碱盐溶液)吸热溶解过程:放热饱和溶液溶质是否还可以溶解(转化)不饱和溶液溶液的分类浓溶液溶质含量的多少稀溶液计算表达方式溶质质量分数溶质质量分数的计算三、知识回顾,自主复习学生完成学案:(分组完成1-6)1、溶液:由 物质或 物质分散到 物质里,形成的 、 的 。
2、溶液是由________和_________组成的。
最常见的溶剂是______,_____、_____等也可以作溶剂。
如:碘酒中_______是溶质________是溶剂3、饱和溶液:在______温度下,向_______溶剂里,加入某种溶质,当溶质不能继续______时,所得到的溶液叫做这种溶质在这种溶剂里的________________;还能__________的溶液叫做不饱和溶液。
4、溶质质量分数指 质量和 质量的比值。
溶质的质量分数计算的基本公式为 :___________________________________________________5、溶液的稀释:依据:溶液的稀释前后溶质的质量 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第九单元溶液的形成
复习目标一:溶液的形成
1、溶液
(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的
(2)溶液的基本特征:、。
注意:a、溶液不一定都是无色,
如CuSO4溶液为蓝色 FeSO4溶液为浅绿色 Fe2(SO4)3溶液为黄色
b、溶质可以是固体、液体或气体;水是最常用的溶剂
c、溶液的质量 = 溶质的质量 + 溶剂的质量
溶液的体积≠溶质的体积 + 溶剂的体积
2、溶质和溶剂的判断:
3、饱和溶液、不饱和溶液
(1)概念:
(2)判断方法:继续加入该溶质,看能否溶解
(3)饱和溶液和不饱和溶液之间的转化
注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低
②最可靠的方法是:加溶质、蒸发溶剂
(4)浓、稀溶液与饱和不饱和溶液之间的关系
①饱和溶液不一定是浓溶液
②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液
③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓
(5)溶解时放热、吸热现象
溶解吸热:如NH4NO3溶解
溶解放热:如NaOH溶解、浓H2SO4溶解
溶解没有明显热现象:如NaCl
【配套练习一】
1、下列各组物质不能形成溶液的是()
A.蔗糖和水B.硝酸钾和水C.碘和酒精D.植物油和水
2.(3分)(2013•滨州)关于溶液和乳化的下列说法这种错误的是()
A. 溶液中可以含有多种溶质
B. 溶液是均一、稳定的混合物
C.用汽油洗去衣服上的油污是乳化现象
D. 溶液不一定是无色的
3.(2013.成都)在盛有水的烧杯中加入以下某种物质,形成溶液的过程中,温度下降。
这种物质是()
A. 氢氧化钠
B.氯化钠
C.浓硫酸
D.硝酸铵
4、现有60℃的饱和NaCl溶液,与该溶液有关的量有:①水的质量;②溶液中溶质NaCl的质
量;③NaCl的质量分数;④溶液的质量。
用序号填空:
(1)将该饱和溶液稀释,不变的量有: ;
(2)将该饱和溶液降温至20℃,一定变化的量有。
5、20℃时,某饱和硝酸钾溶液中取出一部分,则剩下的溶液一定是()
A.饱和溶液 B不饱和溶液 C稀溶液 D不确定
6、含有蔗糖晶体的溶液A,从冰箱里取出放置一段时间后,晶体慢慢消失,形成溶液B。
对于溶液A和B,一定处于饱和状态的是,其中溶质质量分数较大的是。
复习目标二:理解溶解度和溶解度曲线
1、固体的溶解度
(1)定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克。
(3)溶解度曲线的意义
①溶解度曲线表示某物质在不同的温度下的溶解度或溶解度随温度变化的情况。
②溶解度曲线上的每一个点表示该溶质在某温度下的溶解度,此时的溶液必然是饱和溶液。
③两条曲线交叉点表示两种溶质在同一温度下具有相同的溶解度。
④在溶解度曲线下方的点,表示该溶液是不饱和溶液。
(4)溶解度曲线的变化规律
A、大多数固体物质的溶解度随温度升高而增大,表现在曲线“坡度”比较“陡”,如硝酸钾
B、少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl
C、极少数固体物质的溶解度随温度的升高而减小,表现在曲线“坡度”下降,如Ca(OH)2【配套练习二】
1.(2013.株洲市)(4分)右图为KNO3和NaCl两种物质的溶解度曲线。
(1)t1℃时,两种物质溶解度的大小关系:NaCl KNO3
(填“>”或“=”或“<”)。
(2)t2℃时,将25g氯化钠固体投入50g水中,充分溶解后可得到
NaCl 溶液(填“不饱和”或“饱和”或“不能确定”)。
(3)将饱和KNO3溶液变为不饱和KNO3溶液,可行的方法之一是
添加溶剂(水),还可以是。
(4)你从图中还可获得什么信息(写出一条即可):。
2、右图是甲、乙两种固体物质的溶解度曲线。
(1)t2℃时,甲物质的溶解度为;
(2)从图中你还能获得哪些信息?(任填一条)
;
(3)分析t1℃时,将10g乙物质放入100g水中,充分溶
解后所得的溶液是(填“饱和”或“不饱和”)溶液。
欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的
方法(任填一种方法)。
复习目标三:掌握溶质的质量分数的计算
1、公式:溶质质量分数=
2、在饱和溶液中:溶质质量分数=
3、配制一定溶质质量分数的溶液
用固体配制:
①步骤:计算、称量、溶解
②仪器:天平、药匙、量筒、滴管、烧杯、玻璃棒
【配套练习三】
1. 把200g质量分数为20%的食盐水稀释成质量分数为10%的溶液,需加水()
A. 50g
B. 100g
C. 200g
D. 400g
1.下列哪种方法不可能
...用于分离饱和溶液中的溶质和溶剂()
A.过滤 B.蒸发 C.蒸馏 D.结晶
2.将适量的下列物质溶解于水的过程中,会使溶液的温度显著降低的是()
A.浓硫酸B.硝酸铵 C.火碱 D.蔗糖
3.右图为A、B、C三种固体物质(不含结晶水)的溶解度曲线。
下列说法错误的是()A.t1℃时,三种物质中B的溶解度最大
B.t2℃时,取三种物质各a g分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C.将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,A溶液中析出的晶体质量最大
D.可用增加溶剂的方法使接近饱和的B溶液变为饱和溶液
4.右图是X、Y两种固态物质的溶解度曲线,下列判断正确的是()A.t1时,X物质和Y物质的溶解度相等
B.X物质和Y物质的溶解度均随温度的升高而增大
C.将Y物质的饱和溶液从t2降到t1有晶体析出
D.t2时,X溶液的溶质质量分数比Y溶液的溶质质量分数大
5.下图是甲、乙两种物质(不含结晶水)的溶解度曲线。
下列说法中正确的是()
A. 甲的溶解度大于乙的溶解度
B. t1℃时,50g甲的饱和溶液中有15g甲
C.t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液
D.当甲中含有少量乙时,可以用降温结晶的方法提纯甲
6.(2013.泸州市)配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行。
A B C D E
A B C D E
请回答下列问题:
(1)用上图所示的序号
.......表示正确配制该溶液的操作顺序为。
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应。
A.增加适量氯化钠固体 B.减少适量氯化钠固体
C.调节游码 D.添加砝码
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是。
7、用固体氯化钠配制100 g 10%的氯化钠溶液,不需要使用的仪器是
A.玻璃棒
B.石棉网
C.烧杯
D.量筒
8.(2013.娄底市)右图是A、B、C三种物质的溶解度曲线。
请回答:
(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是;
(2)当A中混有少量B时,可用方法提纯A;
(3)t2℃时,在100g水中放入克A物质恰好形成饱和溶液,
此时溶液中溶质的质量分数为。
9.(2013.福州市)(7分)图7是甲、乙两种物质的溶解度曲线,请
结合图7回答问题:
(1)℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是(填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲
溶液的溶质质量分数(填“大于”、“等于”或“小于”)乙溶
液的溶质质量分数。
(5)小明同学用甲物质进行以下实验:
①实验过程中,B、C、D对应的溶液为不饱和溶液的是。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。
你认为“全部溶解”的原因是。
