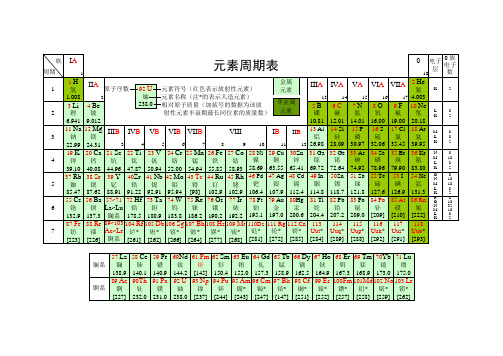
元素周期表(空表)
化学元素周期表超清可打印
[222]
P
O
N
M
L
K
8
18
32
18
8
2
7
87Fr
钫
[223]
88Rr
镭
[226]
89~103
Ac~Lr
锕系
104Rf
钅卢*
[261]
105Db
钅杜*
[262]
106Sg
钅喜*
[266]
107Bh
钅波*
[264]
108Hs
钅黑*
[277]
109Mt
钅麦*
[268]
110Ds
钅达*
[281]
111 Rg
4.003
K
2
2
3Li
锂
6.941
4Be
铍
9.012
5B
硼
10.81
6C
碳
12.01
7N
氮
14.01
8O
氧
16.00
9F
氟
19.00
10Ne
氖
20.18
L
K
8
2
3
11Na
钠
22.99
12Mg
镁
24.31
IIIB
3
IVB
4
VB
5
VIB
6
VIIB
7
VIII
89 10
IB
11
IIB
12
13Al
铝
26.98
29Cu
铜
63.55
30Zn
锌
65.41
31Ga
镓
69.72
化学元素周期表

生物医学领域的应用
环保和可持续发展
人工智能与化学的结合
感谢观看
汇报人:XX
在自然界中的存在和提取方法
元素在自然界中 的分布情况
提取元素的主要 方法和技术
元素在地球科学 、生物学等领域 的应用
ቤተ መጻሕፍቲ ባይዱ
元素在工业、农 业、医疗等领域 的应用和价值
元素的价值和用途
元素在科学研究中的应用
元素在工业生产中的应用
元素在日常生活中的应用
元素在医疗健康领域的应用
05
周期表的发展历程 和未来展望
添加 标题
同周期元素性质递变规律:同一周期元素从左到右, 随着原子序数增加,金属性逐渐减弱,非金属性逐 渐增强。
03
周期表中元素的分 类和分组
金属元素和非金属元素的分类
金属元素:按电子排布规律填充在周期表中的元素,如钠、钾、铝等 非金属元素:不遵循电子排布规律,在周期表中占据特殊位置的元素,如氢、氧、氯等
电子层数:同周 期元素具有相同 的电子层数
周期表的特点和意义
周期性排列:按 照原子序数由小 到大,元素性质 呈周期性变化
列族分布:同一 列中的元素具有 相似的性质,称 为族
周期表的意义: 帮助预测元素性 质,指导新元素 的发现和利用
周期表的应用: 在化学、材料科 学、医学等领域 有广泛应用
02
周期表中元素的性 质
周期表的发展历程
元素分类:将元素按照性质进行 分类,如金属、非金属等
电子排布:根据元素的电子排布 规律,预测元素的性质
添加标题
添加标题
添加标题
添加标题
原子序数:按照元素的原子序数 进行排列,形成周期表
元素周期律:发现元素之间的周 期性规律,为周期表的建立奠定 基础
无机化学元素周期表

总趋势:随着原子序数的增大,原子半径自左至右减小.
同周期原子半径的变化趋势 (一)
解 释: 电子层数不变的情况下,有效核电荷的增大导致核对外层电子的引力增大.
解 释: ◆ 主族元素: 电子逐个填加在最外层, 对原来最外层上的电子的屏蔽参数(σ)小, 有效 核电荷(Z*) 迅速增大。例如, 由Na(Z=11)至Cl (Z=17), 核电荷增加6, 最外层3s电子 感受到的有效核电荷则增加4.56(由2.51增加至7.07)。 ◆ 过渡元素: 电子逐个填加在次外层, 增加的次外层电子对原来最外层上电子的屏蔽 较强, 有效核电荷增加较小。 ◆ 内过渡元素: 电子逐个填加在外数第三层, 增加的电子对原来最外层上电子的屏蔽 很强, 有效核电荷增加甚小。
同周期原子半径的变化趋势 (二)
相邻元素的减小幅度:主族元素 > 过渡元素 > 内过渡元素
◆ 第3周期前7个元素平均减小: [ r(Na) - r(Cl)]/6 = [191 pm - 99 pm]/6 = 15.3 pm ◆ 第一过渡系10个元素平均减小: [ r(Sc) - r(Zn)]/9 = [164 pm - 137 pm]/9 = 3.0 pm ◆ 镧系15个元素平均减小: [ r(La) - r(Lu)]/14 = [188 pm - 173pm]/14 = 1.1 pm
原子半径变化规律的形象表示
原子半径
镧系收缩的结果
B Zr和Hf B Nb和Ta B Mo和W 每对原子的原子半径和离子半径较接近,化学性质也十分相似,造成这三对元素在分离上十分困难。
镧系收缩
镧系元素的原子半径和离子半径随着原子序数 的增加而逐渐减小的现象称为镧系收缩。
电离能 I ( ionization energy)
元素周期表读音及符号

第二周期元素:3锂(lǐ) 4铍(pí) 5硼(péng) 6碳(tàn) 7氮(dàn) 8氧(yǎng) 9氟(fú) 10氖(nǎi)
第三周期元素:11钠(nà) 12镁(měi) 13铝(lǚ) 14硅(guī) 15磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà)
28
Ni
镍
niè
有磁性和良好可塑性
29
Cu
铜
tóng
人类发现最早金属之一
30
Zn
锌
xīn
人体需要的微量元素
31
Ga
镓
jiā
燃点低沸点高
32
Ge
锗
zhě
是一种重要的半导体材料
33
As
砷
shēn
有毒
34
Se
硒
xī
可使玻璃致色为鲜红色
35
Br
溴
xiù
活泼,单质为红棕色液体
36
Kr
氪
kè
是一种无色无味无臭的惰性气体
11
Na
钠
nà
活泼
12
Mg
镁
měi
轻金属之一
13
Al
铝
lǚ
地壳里含量最多的金属
14
Si
硅
guī
地壳中含量仅次于氧
15
P
磷
lín
白磷有剧毒
16
S
硫
liú
质地柔软,轻。与氧气燃烧形成有毒的二氧化硫
17
Cl
氯
lǜ[3]
有毒活泼
18
Ar
氩
yà
化学元素周期表

化学元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列,经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米³/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
空白元素周期表

空白元素周期表空白元素周期表是一张没有任何元素信息的元素周期表,它只有原子序数、元素符号和原子量等栏目,而没有元素的特性或其它信息。
这张空白元素周期表的作用是帮助学生们记忆元素周期表的基本构造,以及理解元素周期表中包含的不同元素之间的关系。
空白元素周期表是以科学家居斯特(Dmitri Mendeleev)于1869年创立的元素周期表为基础,其中有三条主要的规则:原子序数从小到大升序排列,元素周期表中的元素需要按照其原子量从小到大升序排列,每一个周期内的元素,元素性质都有一定的变化趋势。
空白元素周期表中的原子序数是从1到118的编号,代表了每个元素在元素周期表中的位置。
它代表了元素的排序,以及它们在元素周期表中的排列顺序。
空白元素周期表还有一列元素符号,即元素的缩写,如H(氢)、He (氦)、Li(锂)等。
此外,空白元素周期表还有一列原子量,即每个元素的原子量,也就是说,每个元素所含原子的数量。
空白元素周期表是初学者们学习元素周期表的好工具,可以帮助学生们更好地记住元素周期表的构成,以及元素在元素周期表中的位置。
它还可以帮助学生们理解不同元素之间的关系,从而更好地掌握元素周期表的含义。
空白元素周期表的另一个重要用途是,当学生们遇到新的元素时,也可以使用空白元素周期表来查找该元素在元素周期表中的位置,从而更好地理解元素的特性。
它可以帮助学生们更快地找到新的元素,并且让他们更好地理解这些元素的结构和特性。
最后,空白元素周期表也可以用于教学,例如对于某些元素的相关性质的介绍,老师可以使用空白元素周期表来让学生们更好地理解元素的特性,它能够帮助学生们更好地记住元素周期表的构造,以及元素之间的关系。
总之,空白元素周期表是一种很好的帮助学生们记住元素周期表的工具,它可以帮助学生们更好地理解元素周期表,并且能够帮助他们更快地找到新的元素,从而更好地理解这些元素的特性。
化学周期表

化学周期表化学元素周期表元素周期表中的元素(每周期开头设为空4个字节)1H氢 1.00792He氦 4.00263Li 锂 6.9414Be铍9.01225B硼10.8116C碳12.0117N 氮14.0078O氧15.9999F氟18.99810Ne氖20.1711 Na钠22.989812Mg镁24.30513Al铝26.98214Si硅28.08515P磷30.97416S硫32.0617Cl氯35.45318Ar 氩39.9419K钾39.09820Ca钙40.0821Sc钪44.95622 Ti钛47.923V钒50.9424Cr铬51.99625Mn锰54.938 26Fe铁55.8427Co钴58.933228Ni镍58.6929Cu铜63.5430Zn锌65.3831Ga镓69.7232Ge锗72.533As 砷74.92234Se硒78.935Br溴79.90436Kr氪83.837 Rb铷85.46738Sr锶87.6239Y钇88.90640Zr锆91.2241Nb铌92.906442Mo钼95.9443Tc锝(99)44Ru 钌161.045Rh铑102.90646Pd钯106.4247Ag银107.86848Cd镉112.4149In铟114.8250Sn锡118.6 51Sb锑121.752Te碲127.653I碘126.90554Xe氙131.355Cs铯132.90556Ba钡137.3357-71La-Lu镧系57La镧138.958Ce铈140.159Pr镨140.960Nd钕144.261Pm钷(147)62Sm钐150.363Eu铕151.9664 Gd钆157.2565Tb铽158.966Dy镝162.567Ho钬164.968Er铒167.269Tm铥168.970Yb镱173.0471 Lu镥174.96772Hf铪178.473Ta钽180.94774W钨183.875Re铼186.20776Os锇190.277Ir铱192.278 Pt铂195.0879Au金196.96780Hg汞200.581Tl铊204.382Pb铅207.283Bi铋208.9884Po钋(209)85At 砹(201)86Rn氡(222)87Fr钫(223)88Ra镭226.03 89-103Ac-Lr锕系89Ac锕(227)90Th钍232.091Pa镤231.092U铀238.093Np镎(237)94Pu钚(239,244)95 Am镅(243)96Cm锔(247)97Bk锫(247)98Cf锎(251)99 Es锿(252)100Fm镄(257)101Md钔(258)102No锘(259) 103Lr铹(260)104Rf钅卢(257)105Db钅杜(261)106Sg钅喜(262)107Bh钅波(263)108Hs钅黑(262)109Mt钅麦(265) 110Ds钅达(266)111Rg钅仑(272)112Uub(285)113 Uut(284)114Uuq(289)115Uup(289)116Uuh(292)117 Uus(*)/*尚未被发现*/118Uuo(293)?6?7?6?7各个元素的读音氢(qīng)氦(hài)锂(lǐ)铍(pí)硼(p?0?0ng)碳(tàn)氮(dàn)氧(yǎng)氟(fú)氖(nǎi)钠(nà)镁(měi)铝(lǚ)硅(guī)磷(lín)硫(liú)氯(lǜ)氩(yà)钾(jiǎ)钙(gài)钪(kàng)钛(tài)钒(fán)铬(g?0?9)锰(měng)铁(tiě)钴(gǔ)镍(ni?0?9)铜(t?0?7ng)锌(xīn)镓(jiā)锗(zhě)砷(shēn)硒(xī)溴(xiù)氪(k?0?9)铷(rú)锶(sī)钇(yǐ)锆(gào)铌(ní)钼(mù)锝(d?0?0)钌(liǎo)铑(lǎo)钯(pá)银(yín)镉(g?0?0)铟(yīn)锡(xī)锑(tī)碲(dì)碘(diǎn)氙(xiān)铯(s?0?9)钡(b?0?9i)镧(lán)铪(hā)钽(tǎn)钨(wū)铼(lái)锇(?0?0)铱(yī)铂(b?0?7)金(jīn)汞(gǒng)铊(tā)铅(qiān)铋(bì)钋(pō)砹(ài)氡(dōng)钫(fāng)镭(l?0?0i)锕(ā)钅卢(lú)钅杜(dù)钅喜(xǐ)钅波(bō)钅黑(hēi)钅麦(mài)钅达(dá)钅仑(lún)镧(lán)铈(shì)镨(pǔ)钕(nǚ)钷(pǒ)钐(shān)铕(yǒu)钆(gá)铽(t?0?9)镝(dí)钬(huǒ)铒(ěr)铥(diū)镱(yì)镥(lǔ)锕(ā)钍(tǔ)镤(pú)铀(y?0?7u)镎(ná)钚(bù)镅(m?0?0i)锔(jū)锫(p?0?0i)锎(kāi)锿(āi)镄(f?0?9i)钔(m?0?0n)锘(nu?0?6)铹(láo)小结:其实大多数元素的读音比较好读,只要读半边就可以了。
化学周期表

