硝基化合物PPT课件
合集下载
第十三章 硝基化合物
1-碘辛烷加至冰冷的亚硝酸银及乙醚的混合物中,在0℃反应24h,即生成1-硝 基辛烷。
卤代烃与亚硝酸盐若在极性非质子溶剂DMF或DMS0中或在相转移催化条件下进 行反应,往往可以得到较好产率的硝基化合物。
氯代烃活性较差,但有时使用活泼的氯代烃还是能与亚硝酸盐顺利反应。如苄 氧基氯甲烷合成相应的硝基化合物。
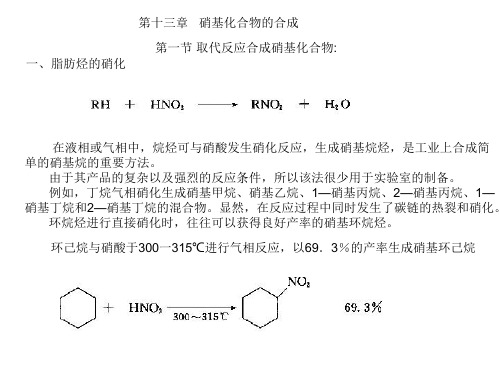
第十三章 硝基化合物的合成 第一节 取代反应合成硝基化合物: 一、脂肪烃的硝化
在液相或气相中,烷烃可与硝酸发生硝化反应,生成硝基烷烃,是工业上合成简 单的硝基烷的重要方法。 由于其产品的复杂以及强烈的反应条件,所以该法很少用于实验室的制备。 例如,丁烷气相硝化生成硝基甲烷、硝基乙烷、1—硝基丙烷、2—硝基丙烷、1— 硝基丁烷和2—硝基丁烷的混合物。显然,在反应过程中同时发生了碳链的热裂和硝化。 环烷烃进行直接硝化时,往往可以获得良好产率的硝基环烷烃。 环己烷与硝酸于300一315℃进行气相反应,以69.3%的产率生成硝基环己烷
多烷基苯进行硝化时,往往有二元硝化或支链硝化的副反应发生,但在三氟 化硼催化下,用硝酸甲酯作硝化剂,多烷基苯在硝基甲烷中可高产率地生成一元 硝化。
三、卤代烃与亚硝酸盐作用(Victor-Meyer反应)
卤代烃与亚硝酸盐的反应,乃是实验室合成伯、仲硝基化合物的重要方法。 一般而言,亚硝基锂、钠、钾盐能与伯、仲烷基溴化物或碘化物反应,生成相应 的硝基化合物。而亚硝酸银仅适合于和伯烷基溴化物或碘化物反应。 在所有的这些情况下,都有形成亚硝酸酯的副反应发生。有时,当仲、叔卤代物 与亚硝酸银反应时,亚硝酸酯成为主要的产物(通过SNl反应机理)。 2-碘辛烷与亚硝酸钠反应,生成2-硝基辛烷和部分亚硝酸酯
脂肪及芳香伯胺均可按氧化成硝基化合物。由于叔硝基化合物一般不能用相应 的叔卤代烃与亚硝酸盐反应制得,所脂肪胺的氧化法对合成叔硝基化合物特别有实 用价值。 高锰酸钾是氧化叔烃基胺成相应的叔烃基硝基化合物良好的试剂。通常氧化 反应在水溶液中,或丙酮-水、乙酸-水中进行,产率在70%一80%之间。
苯的氨基与硝基化合物幻灯片

• 对氯苯胺事故应急处理: 隔离泄漏污染区,周围设警示标志,建议应 急处理人员戴好防毒面具,穿化学防护服。不要直接接触泄漏物,用 洁净的铲子收集于干燥洁净有盖的容器中,运至废物处理场所。如大 量泄漏,收集回收或无害处理后废弃。 • 急救措施: 皮肤接触对氯苯胺应立即脱去污染的衣服,用肥皂水及清 水彻底冲洗。注意手、足和指甲等部位。眼睛接触立即提起眼险,用 大量清洁流水或生理盐水冲洗。吸入后,迅速脱离现场至空气新鲜处。 呼吸困难时给氧。呼吸停止时,立即进行人工呼吸,并立即就医。误 服者给漱口,饮水,洗胃后口服活性炭,再给以导泻,并立即就医。
主要毒作用的共同点
(四)神经系损害
• 该类化合物难溶于水,易溶于脂肪,进入人体后 易与含大量类脂质的神经细胞发生作用,引起神 经系统的损害。重度中毒患者可有神经细胞脂肪 变性,视神经区可受损害,发生视神经炎、视神 经周围炎等。
主要毒作用的共同点
(五)皮肤损害和致敏作用
• 有些苯的氨基和硝基化合物对皮肤有强烈的刺激 作用和致敏作用,一般在接触后数日至数周后发 生接触性或过敏性皮炎,脱离接触并进行适当治 疗后可痊愈。此外,个别过敏体质者,接触对苯 二胺和二硝基氯苯后,还可发生支气管哮喘,临 床表现与一般哮喘相似。
毒理
• 三.毒性作用 苯胺代谢中间产物苯基羟胺,有很 强的形成高铁血红蛋白的能力,使血红蛋白失去 携氧功能,造成机体组织缺氧,引起中枢神经系 统、心血管系统及其他脏器的一系列损害。
毒理
苯胺的急性毒性: 大鼠吸入4h LC50774.2mg/m3 小鼠吸入 LC501120mg/m3 人经口MLD估计4 g
毒作用表现
• 严重中毒者,中毒3~4天后可出现不同程 度的溶血性贫血。可有黄疸、中毒性肝病和 膀胱刺激症状等。肾脏受损时,出现少尿、 蛋白尿、血尿等,严重者可发生急性肾功能 衰竭,少数见心肌损害。
硝基化合物

O R
成环和重排
O R C CH2 R' 成环 O R + C CH2 R' 重排 R R' O R C CH2R' + N N O
+ + H2C N N C R
醛和环酮以重排产物为主,普通的酮主要生成环氧化物。酮分子中 与羰基相连的两个烃基不相同时,得到两种重排产物的混合物。
O R O R C CH2 H + + H2C N N C H + N N O R C CH3
H 重排
O + CH2N2
O CH2 + N N
O + N2
O C CH2 CH2N2 CH2
O C CH2 + N N
O C
环丙酮
3. 与酰氯反应
O R
脱去氯化氢
O R O H C CH2 Cl + -H+ N N O R C CH + N N + N N
+ + H2C N N C Cl
-Cl
R
第一节 硝基化合物
硝基化合物可分为脂肪族硝基化合物和芳香族硝基化合物。 硝基化合物的结构
CH3 + N O
Sp2杂化
O
O O
C-N 147pm , <ONO = 127
N-O
+ N
122pm
+ N O O
+ N
O O
P, π 共轭
CH3
NO2
μ= 3.5 D
硝基为强的吸电子基
厚 第十八章 止 其它含氮化合物
H2 O R'OH NH3 O O RCH2COR'
成环和重排
O R C CH2 R' 成环 O R + C CH2 R' 重排 R R' O R C CH2R' + N N O
+ + H2C N N C R
醛和环酮以重排产物为主,普通的酮主要生成环氧化物。酮分子中 与羰基相连的两个烃基不相同时,得到两种重排产物的混合物。
O R O R C CH2 H + + H2C N N C H + N N O R C CH3
H 重排
O + CH2N2
O CH2 + N N
O + N2
O C CH2 CH2N2 CH2
O C CH2 + N N
O C
环丙酮
3. 与酰氯反应
O R
脱去氯化氢
O R O H C CH2 Cl + -H+ N N O R C CH + N N + N N
+ + H2C N N C Cl
-Cl
R
第一节 硝基化合物
硝基化合物可分为脂肪族硝基化合物和芳香族硝基化合物。 硝基化合物的结构
CH3 + N O
Sp2杂化
O
O O
C-N 147pm , <ONO = 127
N-O
+ N
122pm
+ N O O
+ N
O O
P, π 共轭
CH3
NO2
μ= 3.5 D
硝基为强的吸电子基
厚 第十八章 止 其它含氮化合物
H2 O R'OH NH3 O O RCH2COR'
第十三章 硝基化合物和胺

当N原子上所连烃基各不相同时,可出现光活性的对映体,但 两者的转换能量较低(21kJ· mol-1),因此,不能分离。
15
3、命名 A. 普通命名法:适用于简单胺。胺为母体,所含烃基的名称 和数目写在前面。
B. 系统命名法:氨基作为取代基,烃为母体。
16
二、 胺的物理性质
⒈ 沸点:比相应的醇、酸低,并伯胺 〉仲胺 〉叔胺
硝基甲烷、硝基乙烷、硝基丙烷的pKa值分别为:10.2、8.5、7.8。
这是因为具有α-H的硝基化合物存在互变异构的结果:
6
2.α-H的缩合反应
由于脂肪族带有-H的硝基化合物具有酸性,因此,可
作为亲核试剂与羰基化合物发生亲核加成反应。与羟醛缩合、 Claisen缩合反应类似。
7
(二)、还原反应 硝基很容易被还原,得到苯胺。
第十章 硝基化合物和胺
1
第一节 硝基化合物
分子中含有—NO2官能团的化合物统称为硝基化合物。 一、硝基化合物的结构、分类和命名
1、结构 硝基化合物的构造式为: 电子衍射法证明:硝基中两个氮氧键的键长是完全相同 的。如:CH3NO2 分子中的两个 N-O 键的键长均为0.122 nm。 硝基中,氮原子和两个氧原子上的p轨道相互重叠,形成 包括O、N、O三个原子在内的大π键。
甲 胺 ( 31 ) 乙烷(30) 沸点(℃) -7 -88 甲醇(32) 64
正 丙 胺 ( 伯 ) 甲乙胺(仲) 三甲胺(叔) 沸点(℃) 49 35 3
⒉ 水溶性:低级易溶于水,随烃基的增大,水溶解度降低。 ⒊ 气味:有氨的刺激性气味及腥臭味。 ⒋ 毒性:芳胺的毒性很大。 ⒌ 状态:甲胺、二甲胺、三甲胺是气体。 低级胺是液体。高级胺是固体。
4
多硝基化合物受热易分解而发生爆炸,如:TNT炸药、 2,4,6-三硝基苯酚(俗称:苦味酸)。
15
3、命名 A. 普通命名法:适用于简单胺。胺为母体,所含烃基的名称 和数目写在前面。
B. 系统命名法:氨基作为取代基,烃为母体。
16
二、 胺的物理性质
⒈ 沸点:比相应的醇、酸低,并伯胺 〉仲胺 〉叔胺
硝基甲烷、硝基乙烷、硝基丙烷的pKa值分别为:10.2、8.5、7.8。
这是因为具有α-H的硝基化合物存在互变异构的结果:
6
2.α-H的缩合反应
由于脂肪族带有-H的硝基化合物具有酸性,因此,可
作为亲核试剂与羰基化合物发生亲核加成反应。与羟醛缩合、 Claisen缩合反应类似。
7
(二)、还原反应 硝基很容易被还原,得到苯胺。
第十章 硝基化合物和胺
1
第一节 硝基化合物
分子中含有—NO2官能团的化合物统称为硝基化合物。 一、硝基化合物的结构、分类和命名
1、结构 硝基化合物的构造式为: 电子衍射法证明:硝基中两个氮氧键的键长是完全相同 的。如:CH3NO2 分子中的两个 N-O 键的键长均为0.122 nm。 硝基中,氮原子和两个氧原子上的p轨道相互重叠,形成 包括O、N、O三个原子在内的大π键。
甲 胺 ( 31 ) 乙烷(30) 沸点(℃) -7 -88 甲醇(32) 64
正 丙 胺 ( 伯 ) 甲乙胺(仲) 三甲胺(叔) 沸点(℃) 49 35 3
⒉ 水溶性:低级易溶于水,随烃基的增大,水溶解度降低。 ⒊ 气味:有氨的刺激性气味及腥臭味。 ⒋ 毒性:芳胺的毒性很大。 ⒌ 状态:甲胺、二甲胺、三甲胺是气体。 低级胺是液体。高级胺是固体。
4
多硝基化合物受热易分解而发生爆炸,如:TNT炸药、 2,4,6-三硝基苯酚(俗称:苦味酸)。
第一节 硝基化合物

第一节 硝基化合物
一.硝基化合物的分类、命名和结构
1. 分类 2. 命名 3. 结构
二.硝基化合物的性质
1. 物理性质 2. 化学性质
脂肪族硝基化合物 芳香族硝基化合物
一、硝基化合物的分类、命名和结构
1. 分类 硝基化合物通式:R━NO2
官能团:硝基
伯 RCH2NO2
脂肪族硝基化合物 仲 R2CHNO2
OH
NO2 NaHCO3溶液
NO2
H+
NO2
130 ℃
Cl
ONa
NO2 NaHCO3溶液 100 ℃
NO2 H+
OH NO2
NO2
NO2
NO2
二、硝基化合物的性质
O2N
Cl
NO2 NaHCO3溶液 O2N 35 ℃
ONa NO2 H+
O2N
OH NO2
NO2
NO2
NO2
硝基是强吸电子基团,随着硝基数目的增加,苯环上电子云密度
按照烃基的结构
叔 R3CNO2
芳香族硝基化合物
一硝基化合物 按照官能团的数目
多硝基化合物
一、硝基化合物的分类、命名和结构
2. 命名
硝基化合物的命名和卤代烷类似,硝基只作取代基
NO2
CH3
COOH
(CH3)2CHNO2
2-硝基丙烷 2-nitropropane
NO2
间二硝基苯 m-dinitrobenzene
R2CHNO2 + HONO
NO2
R
NO
NaOH 溶液
C
溶解,得到蓝色溶液
R
NO2
R3CNO2 + HONO
一.硝基化合物的分类、命名和结构
1. 分类 2. 命名 3. 结构
二.硝基化合物的性质
1. 物理性质 2. 化学性质
脂肪族硝基化合物 芳香族硝基化合物
一、硝基化合物的分类、命名和结构
1. 分类 硝基化合物通式:R━NO2
官能团:硝基
伯 RCH2NO2
脂肪族硝基化合物 仲 R2CHNO2
OH
NO2 NaHCO3溶液
NO2
H+
NO2
130 ℃
Cl
ONa
NO2 NaHCO3溶液 100 ℃
NO2 H+
OH NO2
NO2
NO2
NO2
二、硝基化合物的性质
O2N
Cl
NO2 NaHCO3溶液 O2N 35 ℃
ONa NO2 H+
O2N
OH NO2
NO2
NO2
NO2
硝基是强吸电子基团,随着硝基数目的增加,苯环上电子云密度
按照烃基的结构
叔 R3CNO2
芳香族硝基化合物
一硝基化合物 按照官能团的数目
多硝基化合物
一、硝基化合物的分类、命名和结构
2. 命名
硝基化合物的命名和卤代烷类似,硝基只作取代基
NO2
CH3
COOH
(CH3)2CHNO2
2-硝基丙烷 2-nitropropane
NO2
间二硝基苯 m-dinitrobenzene
R2CHNO2 + HONO
NO2
R
NO
NaOH 溶液
C
溶解,得到蓝色溶液
R
NO2
R3CNO2 + HONO
第十四章 含氮化合物-硝基化合物

14-1-11
第一节 硝基化合物
硝基化合物的化学性质
A. a-活性H的反应
(1)与碱作用生成盐:
-NO2为强吸电子基,a-H受硝基的影响,较为活泼,可发生类似酮烯醇互变异构,从而具有一定的酸性。 O R CH2 N O R CH O H Na OH N O R CH
O N O
Na
14-1-12
3、重要的重氮化合物
4、叠氮化合物和氮烯
14-1-3
第一节 硝基化合物
硝基化合物的分类、命名
硝基化合物可以看作是烃分子中的氢原子被硝基取代的衍生物 命名时,硝基总是作为取代基,以相应烃为母体
RH
RNO2 脂肪族硝基化合物
CH3NO2 硝基甲烷
H3C NO2 C CH3 H
2-硝基丙烷
ArH
ArNO2 芳香族硝基化合物
H3C NO2
对硝基甲苯
14-1-4
第一节 硝基化合物
硝基化合物的结构
氮原子的电子结构为: s2 , 2 s2 , 2 px1 , 2 py1 , 2 pz1 1
O R N O
硝基化合物的构造式为:
0.122 nm
O R N O
O
R N
+
O R
R
N O 0.122 nm
N
+
O
O O .122nm 0
R—+N三NX- 重氮化合物(Diazo-azo-compounds) .. R—N:
R—N—N=N 叠氮化合物(Azides)
氮烯(Nitrene)
内容提要
1、硝基化合物 2、胺
(1)胺的分类和命名 (2)胺的物理性质 (3)胺的化学性质 (4)胺的制法 (5)芳胺的重氮化及重氮盐的反应
《硝基化合物的合成》课件
光线
有些硝化反应可能需 要光线的作用才能进 行,以提供能量和激 发反应。
催化剂
有时候,硝化反应需 要催化剂的存在,以 促进反应速率和提高 产率。
硝基化合物的应用
农业领域
硝基化合物在农业中被用作化学肥料,以促进 植物的生长和提高产量。
燃料领域
硝基化合物可以被用作燃料的添加剂,增加燃 烧速率和产生更高的能量。
硝化反应的条件和机理对反应的选择性和产率有着重要影响,需要仔细研究和优化。
3 硝基化合物在许多领域有着广泛的应用
硝基化合物应用广泛,不仅在农业、医药和燃料领域有应用,还在其他领域也发挥着重 要作用。
硝酸硝化是常用的硝化剂 之一,常用于硝化脂肪化 合物,如甘油三硝酸酯的 合成。
3 硝酸银
硝酸银是一种常用的有机 硝化试剂,常用于硝化烷 基化合物的合成。
硝化反应的条件
温度
硝化反应通常需要在 适当的温度下进行, 以也有一定的要求,通 常需要在适当的压力 下进行。
医药领域
硝基化合物在医药领域具有广泛应用,作为药 物和化合物的合成中间体。
炸药制造
硝基化合物是炸药的重要成分,常常被用于军 事和矿业领域的爆破工作。
结论
1 硝基化合物的合成是重要的化学反应之一
硝基化合物的合成是一个有趣且具有挑战性的化学反应,需要深入研究和探索。
2 硝化反应的条件和机理需要谨慎研究
《硝基化合物的合成》 PPT课件
一个生动且有趣的演示文稿,介绍了硝基化合物的合成过程,以及其在不同 领域的广泛应用。欢迎大家参与讨论并提出问题。
硝基化合物简介
硝基化合物的概念
硝基化合物是一类含有硝基基团的有机化合物,通常具有特殊的化学性质和应用价值。
《硝基化合物》课件
和运输
探讨硝基化合物的储存 和运输要求,以确保安 全。
3 硝基化合物的处理
和回收
讨论如何正确处理和回 收硝基化合物以减少对 环境的影响。
总结
硝基化合物的主要内容
回顾硝基化合物的核心概念和重要知识点。
硝基化合物的重要性
强调硝基化合物在科学研究和实际应用中的重要性。
硝基化合物的发展趋势
展望硝基化合物领域的未来发展趋势和前景。
探讨硝化反应发生所需的适宜条件。
硝化反应的实验方法
介绍实验室中用于合成硝基化合物的常用实验方法。
硝基化合物的性质
物理性质
探索硝基化合物的物理性质, 如熔点、沸点和溶解度等。
化学性质
介绍硝基化合物的常见化学 反应和反应特点。
硝基化合物的危害
讨论硝基化合物在人体和环 境中的危害和影响。
硝基化合物的应用
硝基化合物
欢迎来到《硝基化合物》的PPT课件!今天我们将深入探讨硝基化合物的定 义、合成、性质、应用和安全性等方面的知识。
什么是硝基化合物
• 硝基化合物的定义 • 硝基的结构和化学性质 • 硝基化合物的种类和分类
硝基化合物的合成
硝化反应的原理
详细介绍硝化反应如何实现硝基化合物的合成。
硝化反应的条件
1
医药应用
2
探索硝基化合物在医药领域的重要作
用和应用。
3
工业应用
了解硝基化合物在工业生产中的广泛 应用领域。
硝基化合物的环境影响
讨论硝基化合物对环境的影响和可持 续发展的相关措施。
硝基化合物的安全性
1 作硝基化合物所 需的安全措施。
2 硝基化合物的存储
第十三章-硝基化合物
伯硝基化合物 仲硝基化合物
叔硝基化合物
NO2
O2N
CH3
2,4-二硝基甲苯
Cl
O2N
Cl
O2N
COOH
CH3 对硝基氯苯 2-甲基-4-硝基-5-氯苯甲酸
硝基化合物的制备
脂肪烃硝化时,由于形成混合物,在合成上无制备意义。 在工业上应用较广的是芳香烃的硝化:
HNO 3-H2SO4 50℃
NO2 发烟HNO3-发烟H 2SO4 NO2
CHO
+
NH3
H2/Ni 9MPa,40-70℃
O +NH2CH3
H2/Ni P
CH2NH2 NHCH3
胺的制备
5.酰胺的还原或降级
O R C NH2
LiAlH 4 RCH 2NH2 NaOX + NaOH (X2 + NaOH) RNH 2
6.盖布瑞尔(Gabriel)反应制伯胺
C O KOH
第十三章 含氮化合物
(一)硝基化合物 (二)胺 (三)重氮和偶氮化合物 (四)腈与异腈
(一) 硝基化合物
13.1 命名与制备
硝基化合物的命名与卤代烃相似,以烃为母体,硝基看做取代基。
CH3CH2NO2 硝基乙烷
CH3CHCH3
NO2 2-硝基丙烷
CH3 CH3 C CH3
NO2 2-甲基-2-硝基丙烷
SnCl2 + HCl NO2
NH2 NH2 NO2 CHO
NH2
胺的制备
2.布赫雷尔(Bucherer)反应
OH + NH3
(NH4)2SO3 + H 2O 150℃,10MPa
NH2
3.氨的烷基化
硝基化合物和胺课件
RCONH 2 + Br 2 + 4NaOH
RNH2 + 2NaBr + Na 2CO3 + 2H2O
——霍夫曼降解反应是制备纯伯胺的一个好方法
(CH 3)3CCH 2COOH
NH3 △
(CH 3)3CCH 2CONH 2
NaOH Br2
(CH 3)3CCH 2CH2NH2 (94%)
2024/3/14
——酰氯、酸酐、酯、酰胺和腈易还原,催化加氢或氢化铝锂可使 酰氯、酸酐和酯还原为伯醇,酰胺和腈还原为胺,酯的还原应用最
广
O C N(CH 3)2 LiAlH4 , 干 醚
CH2N(CH 3)2 (88%)
CH3(CH 2)7CH=CH(CH 油酸甲酯
2)7COOCH
3
①
LiAlH4 , 干 ② H3O+
醚
CH
3(CH
2)7CH油=C醇H(CH
2)7CH2OH + CH
3OH
H2,Ni
NC CH2CH2CH2CH2 CN
H2N CH2(CH2)4CH2 NH2
2024/3/14
19
4. 霍夫曼酰胺降解反应 制备纯伯胺的方法之一(15.8.7)。
——非取代酰胺与氯或溴的碱溶液作用时,可脱去羰基生成伯胺, 使碳链减少一个碳原子,称霍夫曼降解反应
——硝基对其邻、对位上取代基的化学性质有显著的影响
•对卤原子活泼性的影响
氯苯的氯原子不活泼,很难水解,与氢氧化钠溶液共热到200℃, 也不能水解成苯酚。氯苯的邻、对位被硝基取代后,水解易进行, 邻、对位的硝基越多,氯越活泼。常压下反应便可完成
O2N
Cl
①NaHCO3(aq) ,130℃ ② H3O+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C l C H 2 C O O N a + N a N O 2H 2 O O 2 N C H 2 C O O N a 蒸 - C 馏 O 2C H 3 N O 2 C l C H 2 C H 2 C O O N a + N a N O 2H 2 O O 2 N C H 2 C H 2 C O O子结构式:
或
• 两个氮氧键长均为0.121nm
.
3
(2) 硝基的结构
• 硝基的共振结构式
.
4
二. 硝基化合物的制备 (1) 脂肪族硝基化合物的制备:烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合物;
同时发生碳键的断裂而生成 低级硝基化合物。
实验室制备:
第十二章 含氮化合物
.
ex1it
第一节 硝基化合物 (Nitro Compounds)
一. 硝基化合物的分类、结构和命名
•硝基化合物可看成烃分子中的氢原子被硝基取代后的 衍生物。
(1)一硝基化合物和多硝基化合物 (2)伯、仲、叔硝基化合物(1°,2°,3°硝基化合物)
• 命名——硝基作为取代基:
对应的是几级碳
物是液体,它们具有苦杏仁味;有毒性. • 多硝基化合物在受热时一般易分解而发生爆炸.
硝基化合物的红外光谱
• 脂肪族伯和仲硝基化合物的N-O伸缩振动在1565~1545 cm-1 和 1385~1360 cm-1,叔硝基化合物的N-O伸缩振动在1545~1530 cm-1 和1360~1340 cm-1.
[2H] Ar NH NH Ar
.
氢化偶氮苯衍生物 14
2. 氢化偶氮苯类化合物的重排反应
N H N H
H + N H 2
联苯胺
N H 2
环上有取代基时的重排
R N HN H R
H +
H 2N R
R N H 2
注意取代基在重排前后的位置
.
15
➢ 氢化偶氮苯类化合物的重排机理(分子内重排)
2H+ NH NH
X
X OH
OH 加成
X OH
X OH
NO2
慢
N
OO
实验证据:
i. 动力学证据:双分子反应 ii. NO2在间位时反应难发生 iii. X 为 Cl, Br, I 时反应的速率接近 iv. X = F 时反应速率较快 v. 邻对位硝基增加,反应更加容易
.
N OO
消除 -X 快
N OO
Meisenheimer络合物
• 硝基化合物存在硝基式和酸式互变异构:
主要
.
10
• 具有-H的伯或仲硝基化合物存在互变异构现象,所 以呈酸性:
• 叔硝基化合物没有这种氢原子,因此不能异构成酸式,也就
不能与碱作用.
.
11
2. 硝基的还原
NO2
Fe / HCl or Zn / HCl or Sn (SnCl2) /HCl
酸性还原
NaOBr
.
13
➢ 硝基的酸性还原过程(经过多个中间产物)
[ 2 H ]
[ 2 H ]
[ 2 H ]
A rN O 2 A rN O A rN H O H A rN H 2
亚硝化合物
羟基芳胺
芳胺
一般难得到
➢ 硝基的碱性还原过程
Ar N O H2N Ar
-H2O Ar N OH
HN Ar
Ar N N Ar 偶氮苯衍生物
OH NaOH
ONa
NO2
NO2
21
硝基芳香卤代烃的亲核取代举例
OCH3 NO2
NO2
NaOCH3
Cl NO2
NaSH
NHNH2 NO2
NO2
NO2 NH2NH2
NH2CH3
.
SH NO2
NO2
NHCH3 NO2
NO2
22
C l + C H 3 O N a
NH2 R
(单分子还原)
R
Zn / NaOH
R
碱性还原
NH NH
氢化偶氮苯
R
(双分子还原)
➢ 合成上的应用 —— 制备芳香族胺类化合物
(向芳环上引入氨基)
.
12
• 在中性(Zn/NH4Cl)条件下还原,很容易停留在 N-羟基苯胺 Na3AsO3
Fe + NaOH
Fe
H2O2
Zn + NaOH
Zn + NaOH
NH2 NH2
H2N
NH2
NH
NH2
NH
H
2H+
NH2
H2N
H
NH2
.
16
•芳香族多硝基化合物 用碱金属的硫化物或多硫化物,硫氢化铵、硫化铵或多硫化铵 为还原剂,可以选择性还原其中的一个硝基成为氨基:
选择性还原其中 的一个硝基成为 氨基.
(2) 脂肪族硝基化合物的还原
R -N O 2 H 2 /P to rN i . R -N H 2
C H 3 ( C H 2 ) 5 C H C H 3 + N a N O 2
I
C H 3 ( C H 2 ) 5 C H C H 3 + C H 3 ( C H 2 ) 5 C H C H 3
N O 2
O N O
58%
30%
.
5
如何制备: C H 3 N O 2 C H 3 C H 2 N O 2
.
19
含硝基芳香卤代物的亲核取代
X NaOH 135~160oC
NO2
X NO2 Na2CO3
100oC NO2
X
O 2N
NO2
H 2O
OH H+
NO2
➢邻或对位
OH
硝基可促进
H+
N O 2 取代进行
NO2
➢硝基数目
OH
多,取代更
H+
O 2N
N O 2 加容易
NO2
NO2
.
20
取代反应的机理 —— 加成-消除机理
C H 3 C H C O O N a + N a N O 2
C l
C H 3 C H C O O N a- C O 2 C H 3 C H 2 N O 2
N O 2
(2) 芳香族硝基化合物的制备
. 淡黄色液体
6
三. 硝基化合物的物理性质
• 脂肪族硝基化合物是无色而具有香味的液体,难溶于水,而易
溶于醇和醚; • 大部分芳香族硝基化合物都是淡黄色固体,有些一硝基化合
17
3. 苯环上的亲电取代反应 • 硝基是间位定位基,它使苯环钝化:
• 由于硝基的钝化影响,硝基苯不能发生傅-克反应。
.
18
4. 芳环上的亲核取代反应I 加成-消除机理
➢一般条件下芳环上的亲核取代较难发生
例:
Cl
NaOH
H+
高温,高压
OH
为什么?
SN2过程
Cl
OH
无法翻转
SN1过程
Cl
+ Cl
C(sp2)-Cl不易断裂
•芳香族硝基化合物的N-O伸缩振动在1550~1510 cm-1 和 1365~1335 cm-1.
.
7
硝基乙烷的红外光谱
.
8
硝基苯的红外光谱
.
9
四. 硝基化合物的化学性质
1. α氢的酸性及与碱作用
• 脂肪族硝基化合物中,含有-H的伯或仲硝基化合物能逐渐溶解于氢氧化
钠(生成稳定的负离子):
• 共振结构式:
或
• 两个氮氧键长均为0.121nm
.
3
(2) 硝基的结构
• 硝基的共振结构式
.
4
二. 硝基化合物的制备 (1) 脂肪族硝基化合物的制备:烷烃和硝酸——硝化反应(得混合物作溶剂)
• 主要产物为一硝基化合物;
同时发生碳键的断裂而生成 低级硝基化合物。
实验室制备:
第十二章 含氮化合物
.
ex1it
第一节 硝基化合物 (Nitro Compounds)
一. 硝基化合物的分类、结构和命名
•硝基化合物可看成烃分子中的氢原子被硝基取代后的 衍生物。
(1)一硝基化合物和多硝基化合物 (2)伯、仲、叔硝基化合物(1°,2°,3°硝基化合物)
• 命名——硝基作为取代基:
对应的是几级碳
物是液体,它们具有苦杏仁味;有毒性. • 多硝基化合物在受热时一般易分解而发生爆炸.
硝基化合物的红外光谱
• 脂肪族伯和仲硝基化合物的N-O伸缩振动在1565~1545 cm-1 和 1385~1360 cm-1,叔硝基化合物的N-O伸缩振动在1545~1530 cm-1 和1360~1340 cm-1.
[2H] Ar NH NH Ar
.
氢化偶氮苯衍生物 14
2. 氢化偶氮苯类化合物的重排反应
N H N H
H + N H 2
联苯胺
N H 2
环上有取代基时的重排
R N HN H R
H +
H 2N R
R N H 2
注意取代基在重排前后的位置
.
15
➢ 氢化偶氮苯类化合物的重排机理(分子内重排)
2H+ NH NH
X
X OH
OH 加成
X OH
X OH
NO2
慢
N
OO
实验证据:
i. 动力学证据:双分子反应 ii. NO2在间位时反应难发生 iii. X 为 Cl, Br, I 时反应的速率接近 iv. X = F 时反应速率较快 v. 邻对位硝基增加,反应更加容易
.
N OO
消除 -X 快
N OO
Meisenheimer络合物
• 硝基化合物存在硝基式和酸式互变异构:
主要
.
10
• 具有-H的伯或仲硝基化合物存在互变异构现象,所 以呈酸性:
• 叔硝基化合物没有这种氢原子,因此不能异构成酸式,也就
不能与碱作用.
.
11
2. 硝基的还原
NO2
Fe / HCl or Zn / HCl or Sn (SnCl2) /HCl
酸性还原
NaOBr
.
13
➢ 硝基的酸性还原过程(经过多个中间产物)
[ 2 H ]
[ 2 H ]
[ 2 H ]
A rN O 2 A rN O A rN H O H A rN H 2
亚硝化合物
羟基芳胺
芳胺
一般难得到
➢ 硝基的碱性还原过程
Ar N O H2N Ar
-H2O Ar N OH
HN Ar
Ar N N Ar 偶氮苯衍生物
OH NaOH
ONa
NO2
NO2
21
硝基芳香卤代烃的亲核取代举例
OCH3 NO2
NO2
NaOCH3
Cl NO2
NaSH
NHNH2 NO2
NO2
NO2 NH2NH2
NH2CH3
.
SH NO2
NO2
NHCH3 NO2
NO2
22
C l + C H 3 O N a
NH2 R
(单分子还原)
R
Zn / NaOH
R
碱性还原
NH NH
氢化偶氮苯
R
(双分子还原)
➢ 合成上的应用 —— 制备芳香族胺类化合物
(向芳环上引入氨基)
.
12
• 在中性(Zn/NH4Cl)条件下还原,很容易停留在 N-羟基苯胺 Na3AsO3
Fe + NaOH
Fe
H2O2
Zn + NaOH
Zn + NaOH
NH2 NH2
H2N
NH2
NH
NH2
NH
H
2H+
NH2
H2N
H
NH2
.
16
•芳香族多硝基化合物 用碱金属的硫化物或多硫化物,硫氢化铵、硫化铵或多硫化铵 为还原剂,可以选择性还原其中的一个硝基成为氨基:
选择性还原其中 的一个硝基成为 氨基.
(2) 脂肪族硝基化合物的还原
R -N O 2 H 2 /P to rN i . R -N H 2
C H 3 ( C H 2 ) 5 C H C H 3 + N a N O 2
I
C H 3 ( C H 2 ) 5 C H C H 3 + C H 3 ( C H 2 ) 5 C H C H 3
N O 2
O N O
58%
30%
.
5
如何制备: C H 3 N O 2 C H 3 C H 2 N O 2
.
19
含硝基芳香卤代物的亲核取代
X NaOH 135~160oC
NO2
X NO2 Na2CO3
100oC NO2
X
O 2N
NO2
H 2O
OH H+
NO2
➢邻或对位
OH
硝基可促进
H+
N O 2 取代进行
NO2
➢硝基数目
OH
多,取代更
H+
O 2N
N O 2 加容易
NO2
NO2
.
20
取代反应的机理 —— 加成-消除机理
C H 3 C H C O O N a + N a N O 2
C l
C H 3 C H C O O N a- C O 2 C H 3 C H 2 N O 2
N O 2
(2) 芳香族硝基化合物的制备
. 淡黄色液体
6
三. 硝基化合物的物理性质
• 脂肪族硝基化合物是无色而具有香味的液体,难溶于水,而易
溶于醇和醚; • 大部分芳香族硝基化合物都是淡黄色固体,有些一硝基化合
17
3. 苯环上的亲电取代反应 • 硝基是间位定位基,它使苯环钝化:
• 由于硝基的钝化影响,硝基苯不能发生傅-克反应。
.
18
4. 芳环上的亲核取代反应I 加成-消除机理
➢一般条件下芳环上的亲核取代较难发生
例:
Cl
NaOH
H+
高温,高压
OH
为什么?
SN2过程
Cl
OH
无法翻转
SN1过程
Cl
+ Cl
C(sp2)-Cl不易断裂
•芳香族硝基化合物的N-O伸缩振动在1550~1510 cm-1 和 1365~1335 cm-1.
.
7
硝基乙烷的红外光谱
.
8
硝基苯的红外光谱
.
9
四. 硝基化合物的化学性质
1. α氢的酸性及与碱作用
• 脂肪族硝基化合物中,含有-H的伯或仲硝基化合物能逐渐溶解于氢氧化
钠(生成稳定的负离子):
• 共振结构式:
