聚合反应工程基础课后习题答案
聚合反应工程习题
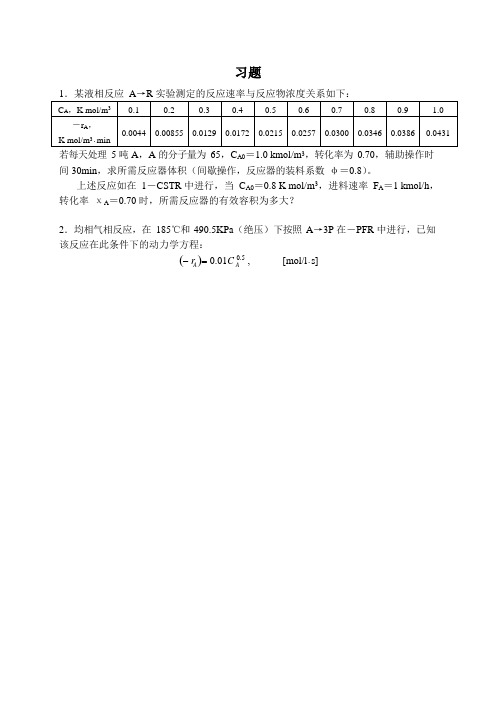
习题若每天处理5 吨A,A 的分子量为65,C A0=1.0 kmol/m3,转化率为0.70,辅助操作时间30min,求所需反应器体积(间歇操作,反应器的装料系数φ=0.8)。
上述反应如在1-CSTR 中进行,当C A0=0.8 K mol/m3,进料速率F A=1 kmol/h,转化率χA=0.70 时,所需反应器的有效容积为多大?2.均相气相反应,在185℃和490.5KPa(绝压)下按照A→3P 在-PFR 中进行,已知该反应在此条件下的动力学方程:(-r )= 0.01C 0.5 , [mol/l·s]A A当向进料中充入50%惰性气体时,求A 的转化率为80%时所需要得时间。
3.在管式反应器中进行某一均相液相反应,反应是在等温下按A+B→R 的二级反应进行,根据BR 的实验可知,在此温度下的反应速率常数K=120 m3/k mol·h,在管子的入口处,将A、B 二液分别以0.075m3/h 和0.025m3/h 的流量同时供料,A 液中含A组分为2.5 K mol/m3,B 液中含B 组分为7.5 K mol/m3,求A 组分的转化率达90%时所需的管长。
(管子内径为3cm)4.在有效容积为4 m3 的1-CSTR 内进行某均相一级反应,在某流量下,转化率达70%,如果流量不变,采用有效容积为1m3 的4-CSTR 串联操作,其转化率是多少?如采用有效容积为1m3 的8-CSTR,转化率又是多少?5.某液相均相反应A+B→P,在BR 中等温下进行,反应速率-r A=KC A C B,式中K=5×10-3l/mol·s,反应物的初始浓度C A0=C B0=2mol/l,要求A 的转化率X A=0.90,A 物料的平均处理量F A0=240mol/min,若将此反应移到一个管内径为125mm 的理想管式反应器中进行,假定反应温度不变,且处理量与所要求达到的转化率均与BR 相同,求所需管式反应器长度。
反应工程课后习题参考答案

1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)反应的选择性;(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol 时,则反应器的进料组成为2由甲醇的转化率达72%2y x +=72%; 4.27x=69.2% 解得x=18.96; y=0.77 所以,反应器出口气体组成为: CH 3OH:%100221004.27⨯++--y x yx =6.983%空气:%1002210023279.54⨯++--y x y x =40.19% 水: %10022100281.17⨯++++y x y x =34.87%HCHO: %10022100⨯++y x x=17.26%CO 2: %10022100⨯++y x y=0.6983%1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔23222CO 4H (CH )O H O +⇔+242CO 3H CH H O +⇔+24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图放空气体 Akmol/h原料气和冷凝分离后的气体组成如下:组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 21.460.82CH40.55 3.62N22.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
聚合反应工程作业及答案

1. 请考虑化学反应, A + B --- C ,该反应在全混流反应器中进行,反应温度为20℃,液料的体积流量为0.5m 3/h, CA 0=96.5mol/m 3, CB 0=184mol/m 3,催化剂的浓度C D =6.63mol/m 3。
实验测得该反应的速度方程为: r A =kC A C D 式中k=1.15*10-3m3/(mol.s)。
若要求A 的转化率为40%,试求反应器的体积。
解:设A 的转化率为x ,则有: 对于全混流反应器,应有:2. 某二级液相反应A+B →C ,已知CA o =CB O ,在间歇反应器中达到x=0.99,需反应的时间为10min,问:(1) 在全混流反应器中进行时,应为多少? (2) 在两个串联全混流反应器(反应体积相等)中进行时,又是多少? 解:在间歇反应器中,对二级反应(1)(1)在单个CSTR 中(2)(1)=(2) 则(2) 两个CSTR 串联CSTR-1:min10000==V V Rm τDA AC x kC r )1(0-=DD A A A A C x k xC x kC x C r x x C )1()1()(0000-=-=-=τh ks 28.244.87)63.6)(4.01)(1015.1(40.03==-⨯=-τ3014.1228.245.0m V V R =⨯==τm τm τ0009.9)99.01(1099.0)1(A A A C C x C x k =-=-=τ20)1(x kC xA -=ττττ020209900)99.01(99.0)1(A A A C C x C x k =-=-=12120100)1(R A A A A V x kC x C V -=(3)CSTR-1:(4);代入(3) ;3 .试证明在间歇操作时,一级反应转化率达到 99.9%所需的时间约为转化率为50%时的10倍. 而在单釜连续操作时(设为理想操作),约为 999倍. .(1)间歇dx/dt=k(1-x), t=1/k(ln(1/(1-x)) , 将 x1,x2 代入可得: t 2/t 1=10 (2)理想:v 0*c 0=v 0*c 1+ r a V , t= x/k(1-x) , 代入 x 1,x 2 可得: t 2/t1=9994.有一液相不可逆反应,反应速率方程为: -R A =KC A 2,已知20℃下:K=10M 3/kmol,C A0=0.2 kmol/ M 3, 加料速度为 2 M 3/小时,比较下列方案,何种转化率最大. (1) V R = 4 M3时理想管式流动反应器.(2) 理想管式流动反应器后串联一理想连续釜式反应器,体积各为2 M 3(3) 理想连续釜式反应器后串联一理想管式流动反应器, 体积各为2 M 3(4) 两段理想连续釜式反应器, 体积各为2 M 3解:1. 4M 3 , PFR42()2RV h τν=== , 由表2-13 得211011)1(A Ao A R x kC x V V -==τ222201200)1()(R A A A A A Vx kC x x C V -=-2212022)1(A Ao A A R x kC x x V V --==τR R R V V V ==21220021)1(A A RA A x kC V V x x --=6.390=V V Rmin 2.796.3922=⨯==V V Rτ二级反应, PFR:()1210*0.2AAx x -= , x A = 4/5=0.8 , C A = 0.042.PFR----X Af ------CSTR--------X第一步: 在PFR 中, 反应时间, 021()2R V h τν=== , ()1110*0.2A A x x -= , 得到: X A =0.667 , C A =0.2*(1-0.667)=0.0667 第二步: CSTR : 20(1)A A A x kC x τ=- ; 2110*0.2*(10.667)(1)AA x x =-- X A = 0.318 , C A =0.066*(1-0.318)=0.045 , 总转化率: X=(0.2-0.045)/0.2=0.7753. CSTR…… X A………………PFR………….X (1) CSTR 20(1)A A A x kC x τ=- ; 2110*0.2*(1)AA x x =- ; X A =0.5 ; (2)PFR : ()1110*0.1A Ax x -= X 2= 0.5 由此 : C A = 0.1*0.5 = 0.05总转化率: X=(0.2-0.05)/0.2= 0.754. CSTR1……..C A1………..CSTR2……..C A2 (1 ) CSTR1: 20(1)A A A x kC x τ=- ; 2110*0.2*(1)AA x x =- ; X A1=0.5(2) CSTR2: 20(1)A A A x kC x τ=- ; 2110*0.1*(1)AA x x =- ; X A2=0.381 C A2= 0.1*(1-0.381)= 0.0618; 总转化率: X=(0.2-0.0618)/0.2= 0.6910.8 (PFR, PFR) 0.775, (PFR, CSTR) 0.7(CSTR, PFR) , 0.691(CSTR,CSTR)证明:00()()()11()*()xx xn nn n w w n n nn jF j Pf j j f j j F j dx dx f j dxx x x P P p p ====⎰⎰⎰。
聚合反应工程基础课后习题答案

聚合反应工程基础课后习题答案聚合反应工程基础课后习题是学生在学习课程过程中用来巩固所学知识的重要环节。
通过完成习题,学生可以检验自己对知识点的掌握程度,及时发现和纠正错误,提高学习效果。
下面是聚合反应工程基础课后习题的答案。
1. 考虑以下聚合反应的机理:A +B -> ABAB + C -> ABCABC + D -> ABCD请回答以下问题:a) 这个反应的总反应方程是什么?b) 这个反应的反应级数是什么?c) 这个反应的速率方程是什么?d) 如果初始浓度为[A]₀、[B]₀、[C]₀和[D]₀,那么在任意时刻t,聚合物的浓度是多少?答案:a) 总反应方程是A + B + C + D -> ABCDb) 反应级数是4c) 速率方程是v = k[A][B][C][D]d) 在任意时刻t,聚合物的浓度是[A]₀ - [A]t,[B]₀ - [B]t,[C]₀ - [C]t 和[D]₀ - [D]t。
2. 一个聚合反应的速率方程是v = k[A][B]^2,其中k为速率常数。
如果初始浓度为[A]₀和[B]₀,那么在任意时刻t,[B]的浓度是多少?答案:根据速率方程可知v = k[A][B]^2,将其变形为d[B]/dt = -2k[B]^2,然后分离变量并积分,得到∫[B]₀^t d[B]/[B]^2 = -2k∫0^t dt。
将其求解,得到[ B]t = 1/([B]₀ - 2kt)。
3. 考虑以下聚合反应的机理:A +B -> AB (快速平衡)AB + C -> ABC (慢速平衡)ABC + D -> ABCD (快速平衡)请回答以下问题:a) 这个反应的总反应方程是什么?b) 这个反应的反应级数是什么?c) 这个反应的速率方程是什么?d) 如果初始浓度为[A]₀、[B]₀、[C]₀和[D]₀,那么在任意时刻t,聚合物的浓度是多少?答案:a) 总反应方程是A + B + C + D -> ABCDb) 反应级数是4c) 速率方程是v = k[A][B][C][D]/([AB][ABC])d) 在任意时刻t,聚合物的浓度是[A]₀ - [A]t,[B]₀ - [B]t,[C]₀ - [C]t 和[D]₀ - [D]t。
第2章逐步聚合习题参考答案

第二章 缩聚与逐步聚合反应-习题参考答案1.名词解释:逐步聚合;缩合聚合;官能团等活性;线型缩聚;体型缩聚;凝胶点;转化率;反应程度。
答:逐步聚合——单体转变成高分子是逐步进行的,即单体官能团间相互反应而逐步增长。
缩合聚合——由带有两个或两个以上官能团的单体之间连续、重复进行的缩合反应。
官能团等活性——在一定聚合度范围内,官能团活性与聚合物分子量大小无关。
线型缩聚——参加反应的单体都含有两个官能团,反应中形成的大分子向两个方向增长,得到线型缩聚物的一类反应。
体型缩聚——参加反应的单体中至少有一种单体含有两个以上的官能团,且体系平均官能度大于2,反应中大分子向三个方向增长,得到体型结构的聚合物的这类反应。
凝胶点——开始出现凝胶瞬间的临界反应程度。
转化率——参加反应的单体量占起始单体量的分数反应程度——参与反应的基团数占起始基团的分数。
3.由己二元酸和己二胺等摩尔合成尼龙—6,6。
已知聚合反应的平衡常数K=432,如果要合成聚合度在200的缩聚物,计算反应体系中的水含量应控制为多少?解:n X =n X =200,K=432代入此式可得: 224320.0108200w n K n X === 答:反应体系中的水含量应控制为0.0108 mol/L.4.计算等摩尔的对苯二甲酸与乙二醇反应体系,在下列反应程度时的平均聚合度和分子量。
0.500,0.800,0.900,0.950,0.995。
解: 等物质量条件下,有PX -=11,聚苯二甲酸乙二醇酯结构单元的分子量:M 0=192。
11n X p=-,n o n X M M ⨯=,因此各反应程度时的平均聚合度和分子量见下表:7.氨基己酸进行缩聚反应时,如在体系中加入0.2mol%的醋酸,求当反应程度P 分别达到0.950,0.980,0.990时的平均聚合度和平均分子量。
解: 方法1:2212 1.998'110.002a a ab b f N f N N N ⨯⨯===++++ 当p=0.950时,22202 1.9980.9502n X pf ==≈-⨯- 214010720=⨯=⨯=n o n X M M当p=0.980时,22482 1.9980.9802n X pf ==≈-⨯- 513610748=⨯=⨯=n o n X M M当p=0.990时,22912 1.9980.9902n X pf ==≈-⨯- 937910791=⨯=⨯=n o n X M M方法2:rp r r Xn 211-++=, NcNa Na r 2+==0.996 P=0.95, 20=XnP=0.98, 46=XnP=0.99, 83=Xn8.用Carothers 法计算下列聚合反应的凝胶点:(1)邻苯二甲酸酐+甘油,摩尔比3:2。
反应工程课后习题

第二章1.在一管式反应器中等温下进行甲烷化反应:催化剂体积为10ml,原料气中CO含量为3%,其余为N2、H2,气体,改变进口原料气流量Q0 进行实验,测得出口CO 的转化率为:83.367.650.038.529.422.2X/%203040506070试求当进口原料气体流量为50ml/min 时的转化速率。
解:是一个流动反应器,由(2.7)式可知其反应速率为rA=-dFA/dVrFA= FA,0(1-XA)=Q0CA0(1-XA)dFA=-Q0CA0dXA故反应速率可表示为:rA= Q0CA0dXA/dVr=CA0dXA/d(Vr/ Q0)用XA-Vr/ Q0作图,过Vr/ Q0=0.20min的点作切线,即得该条件下的dXA/d(Vr/ Q0)值aVr/ Q0 min 0.12 0.148 0.2 0.26 0.34 0.45XA % 20 30 40 50 60 70由(2.6)式可知rA=-dCA/dt=-d{CA0(1-xa)/ dt= CA0 dXA/ dt代入速率方程式CA0 dXA/ dt=0.8 C2A0(1-XA)2化简整理得dXA/(1-XA)2=0.8CA0dt积分得0.8 CA0t= XA/(1-XA)=9.6解得XA=90.59%2.在进行一氧化碳变换反应动力学研究中,采用B106催化剂进行试验,测得正反应活化能为9.629×104J/mol,如果不考虑逆反应,在反应物料组成相同的情况下,试问反应温度为550℃时的速率比反应温度为400℃时的反应速率大多少倍?解:从题中可知,反应条件除了温度不同外,其他条件都相同,而温度的影响表现在反应速率常数k上,故可用反应速率常数之比来描述反应速率之比。
r550/r400=k550/k400=Aexp(-E/RT550)/ Aexp(-E/RT400)=eE/R(1/T400-1/T550)=23(倍)3.在一恒容反应器中进行下列液相反应式中分别表示产物R及D的生成速率。
反应工程课后习题参考答案

1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:3222CH OH O 2HCHO 2H O +→+ 32222CH OH 3O 2CO 4H O +→+进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)反应的选择性;(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:0.629Y S 0.961196.11%X 0.720====(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol 时,则反应器的进料组成为2由甲醇的转化率达72%2y x +=72%; 4.27x=69.2% 解得x=18.96; y=0.77 所以,反应器出口气体组成为: CH 3OH:%100221004.27⨯++--y x yx =6.983%空气:%1002210023279.54⨯++--y x y x =40.19% 水: %10022100281.17⨯++++y x y x =34.87%HCHO: %10022100⨯++y x x=17.26%CO 2: %10022100⨯++y x y=0.6983%1.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:23CO 2H CH OH +⇔ 23222CO 4H (CH )O H O +⇔+ 242CO 3H CH H O +⇔+ 24924CO 8H C H OH 3H O +⇔+222CO H O CO H +⇔+由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图放空气体 Akmol/h原料气和冷凝分离后的气体组成如下:组分 原料气 冷凝分离后的气体 CO 26.82 15.49 H 2 68.25 69.78 CO 21.460.82CH40.55 3.62N22.92 10.29粗甲醇的组成为CH3OH 89.15%,(CH3)2O 3.55%,C3H9OH 1.10%,H2O 6.20%,均为重量百分率。
反应工程课后答案解析

第二章 均相反应动力学1、有一反应在间歇反应器中进行,经过8min 后,反应物转化掉80%,经过18min 后,转化掉90%,求表达此反应的动力学方程式。
3、 在间歇反应器中有一级液相可逆反应P A ⇔,初始反应时C A0=0.5mol/L ,C P0=0反应8min 后,A 的转化率为1/3,而平衡转化率是2/3,求此反应的动力学方程式。
解:p A AC k C k dtdC 21-=-根据一级可逆反应积分式5、恒温恒容的气相反应A →3P ,其动力学方程为Vn k dt dn V r A AA =-=-1)(,在反应过程中系统总压p t 与组分A 的分压均为变量,试推导)(A tp f dtdp =的表达式。
解:AtAA AtA A A A AAA A t A A t A A A t kp dtdp RT pk kc V n k dt dp RT dt dp RT dt dp RT dt dc r V n k dt dn v r dtdpdt dp p p p p p p p 221211(1)(22)(3)00======-=-=-=-=--=--=-+=得即8、纯气相组分A 在一等温等容间歇反应器中按计量式P A 5.2⇔进行反应,实验测得如下数据,时间/min 0 2 4 6 8 10 12 14 ∝ 分压p A /MPa 0.1 0.08 0.0625 0.0510.0420.0360.0320.028 0.020用积分法求此反应的动力学方程式。
解:由于当∞→t 时,02.0=A p 常数,因此假设为一级可逆反应。
第三章 均相反应过程1、液相一级等温反应在间歇釜中达到70%转化率需要12min ,若此反应移到同温度下平推流反应器和全混流反应器中进行时,所需要的空时和空速各为多少? 解:10011min 0429.07031min3.23370)7.01(1.07.0)1()(min 083.01211min 12min 1.07.01ln 12111ln 111ln---===∴==-⨯=-==-========-=∴-=cv A AA A A f A A A c v BR A Ax k x kc x c r x c CSTR t PFR x t k x kt τδττδ中在空速中所需的空时在3、液相反应在一间歇反应器中进行,反应速率如下表所示: C A /mol/L0.10.2 0.3 0.4 0.5 0.60.70.81.01.32.0(-r A )/mol/(L.min) 0.10.30.50.60.50.25 0.10 0.06 0.05 0.045 0.042(1) 若C A0=1.3mol/L ,,则反应时间为多少?(2)若反应移至平推流反应器中进行,C 0A =.5mol/L ,F A0=1000mol/h ,求x A0=0.30时所需反应器的大小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章化学反应工程基础1.说明聚合反应工程的研究内容及其重要性。
研究内容:①以工业规模的聚合过程为对象,以聚合反应动力学和聚合体系传递规律为基础;②将一般定性规律上升为数学模型,从而解决一般技术问题到复杂反应器设计,放大等提供定量分析方法和手段;③为聚合过程的开发,优化工艺条件等提供数学分析手段。
简而言之:聚合反应工程研究内容为:进行聚合反应器最佳设计;进行聚合反应操作的最佳设计和控制。
2.动力学方程建立时,数据收集方式和处理方式有哪些?收集方式:化学分析方法,物理化学分析方法处理方式:积分法,微分法。
3.反应器基本要求有哪些①提供反应物料进行反应所需容积,保证设备一定生产能力;②具有足够传热面积;③保证参加反应的物料均匀混合4.基本物料衡算式,热量衡算式①物料衡算:反应物A流入速度-反应物A流出速度-反应物A反应消失速度-反应物A积累速度=0(简作:流入量-流出量-消失量-积累量=0)②热量衡算:随物料流入热量-随物料流出热量-反应系统与外界交换热量+反应过程的热效应-积累热量=05.何谓容积效率?影响容积效率的因素有哪些工业上,衡量单位反应器体积所能达到的生产能力称之为容积效率,它等于在同一反应,相同速度、产量、转化率条件下,平推流反应器与理论混合反应器所需总体积比:η=Vp/Vm=τp/τm。
影响因素:反应器类型,反应级数,生产过程中转化率有关6.何为平推流和理想混合流?①反应物料在长径比很大的反应器中流动时,反应器内每一微元体积中流体均以同样速度向前移动,此种流动形态称平推流;②由于反应器强烈搅拌作用,使刚进入反应器物料微元与器内原有物料元瞬时达到充分混合,使各点浓度相等且不随时间变化,出口流体组成与器内相等此流动形态称理想混合流。
7.实现反应器的热稳定操作需满足哪些条件?① Qr=Qc,Qr体系放出热量;②②dQc/dT>dQr/dT,Qc 除热量;③③△T=T-Tw<RT2/E,E 反应活化能,T 反应器温度,Tw 冷却液温度8.何为返混?形成返混的主要原因有哪些?返混:指反应器中不同年龄的流体微元间的混合;原因:①由于物料与流向相反运动所造成,②②由于不均匀的速度分布所引起的,③由于反应器结构所引起死角、短路、沟流、旁路等。
9.停留时间的测定方法有哪些,各适用于什么具体情况?阶跃示踪法→试验装置脉冲示踪法→工业反应器10.停留时间分布和返混之间有什么关系?研究流动模型有何意义?返混造成停留时间分布,二者有密切关系,可用停留时间分布定量描述;同类反应器中返混程度,而同一停留时间分布可由不同情况返混与之相适应。
意义:流动模型是为了研究反应器内流体的实际流动形态,在不改变其性质的前提下,对其加以适当的理想化,这种适当理想化的流动形态称为流动模型,所以流动模型是反应器中液体流动形态的近似概括,是设计和放大反应器的基础。
第四章化工流变学基础1.简述流变学及其研究内容?流变学就是研究物质的变形和流动科学,其任务是使物质所具有多杂变形或流动现象更明确化、系统化、定量化、进一步把产生现象的机理上升到分子水平。
2.流体分类按流体力学观点:分为理想流体和实际流体两大类。
理想流体又称为无黏性流体,实际流体又称黏性流体,又可分为牛顿流体与非牛顿流体。
3.何为牛顿流体,非牛顿流体?非牛顿流体又有哪些类型?流动曲线通过坐标原点的一直线的流体称为牛顿流体;凡流动曲线不是直线或虽为直线但不通过坐标原点的流体称为非牛顿流体。
非牛顿流体分为三大类:非依时性(假塑性、胀塑性、宾汉流体);依时性(触变性、震凝性);粘弹性流体(入口效应、弹性回缩、爬杆效应、***)4.高分子流体为什么多属于假塑性流体大分子链的取向原因,大分子链为无规线团,彼此缠结,对流动阻力大,表现出较大的黏度。
当流动而受较大剪切作用时卷曲缠结的大分子结构被拉直取向,伸直后大分子在液体层间传递动量作用较原来小,因而随γ增加,表现出η减小,因此多属于假塑性流体。
5.为什么触变性流体和震凝性流体有特殊的流变行为?由于在一定剪切条件下,流体的结构随时间而受到逐步破坏,受破坏结构在剪切作用停止作用后又可以恢复,体现出独特流动行为。
6.一般对于涂料类流体希望其具有何种流动特性,为什么?一般希望具有触变性。
因为触变性可使涂料在受外力作用下变成易流动的液体,而当外力消失后又很快恢复到高黏性不流动状态,这样易于涂刷而又能保持涂刷后不流动,尤其适用于垂直面上的涂刷。
7.影响高分子流体流变行为的主要因素有哪些?如何对这些影响进行理论分析影响主要因素有高聚物平均分子量、分子量分布、压力、温度、以及溶液浓度。
①存在一临界分子量Mc,M>Mc,黏度急剧增加:M<Mc为牛顿流体;M>Mc为非牛顿流体②对分子量相近,分子量分布较宽的流体,比分子量分布较窄流体较早出现非牛顿流体转变,且分子量分布越宽,偏离牛顿流动也越远。
③温度:温度增加,黏度η下降。
对于柔性,温度对其影响不大,链段运动易,活化能小。
增加。
临界浓度Cc,当C<Cc为牛顿性流体 C>Cc,④浓度:聚合物溶液浓度增加,溶液黏度η为非牛顿流体,假塑性。
⑤压力影响:压力影响流体自由体积,压力P增加,自由体积下降,引起黏度增加。
7.何为表观粘度?剪切应力与剪切速率的比值称为表观黏度,Ma=Z/r8.非牛顿流体在圆管中的表观粘度是如何定义的(Ua)p=管壁处剪切应力τ/流动特性=+++9.非牛顿流体的流动行为指数对流体在圆管中的流动行为和聚合反应结果有何影响N下降,假塑性流体在管中流速分布比牛顿均匀;反应器中C、T、及径向分布也越均匀,分子量分布也越窄。
10.对非牛顿流体在圆管中层流流动规律进行研究有何重要意义?非牛顿流体与牛顿流体不同流动特性,二者动量质量传递特性也有所差别,进而影响到热量传递、质量传递、及反应结果。
因此对流速分布及压力降等问题研究,不仅能决定管中流体输送量与功率消耗,同时能了解影响官式反应、塔式反应器中物料浓度、温度分布,进而影响反应速度和分子来那个分子分布情况。
第五章搅拌聚合釜内流体的流动与混合1.搅拌器一般具有哪些功能?混合、搅动、悬浮、分散等2.搅拌釜内的流体的流动分为哪两个层次宏观:循环流动;微观:剪切流动。
3.循环流动的三个典型流动分别是什么?哪些流动对混合有利?哪些需克服?径向流动、轴向流动、切线流动;径向和轴向对混合有利,起混合搅动及悬浮作用;切线流动对混合不利。
4.何为打旋现象?如何消除打旋现象当η不大,搅拌转速较高时,桨叶放在釜中心线时,液体将随桨叶旋转的方向沿着釜壁滑动,釜内液体在离心力的作用下,涌向釜壁,使液面沿壁上升,中心部分液面下降,形成一个旋窝,通常称打旋现象。
消除打旋现象:偏心安装可减弱漩涡,安装挡板、加导流筒可有效消除。
5.试说出几种搅拌器的构型,特点和应用?①桨式搅拌器:桨叶构型为平桨、斜桨、锚形或框形桨者。
特点:结构简单,转速低、桨叶面积大、平桨、斜桨适用于η为0.1-102Pa·s液体搅拌;锚式、框式对高η液体。
②推进式搅拌器:三瓣叶片;适合湍流程度不高,循环量大。
优点:结构简单,制造方便,适用于液体η低,液量大液体搅拌。
剪切作用不大,循环性能好。
③涡轮式搅拌器:桨叶形式很多,有开式和闭式两类。
应用较广并处理程度范围广液体。
适用于低粘到中等程度液体混合,液液分散,液固悬浮及促进良好传热,传质,或化学反应。
④螺杆及螺带式搅拌器:适用于高粘度液体。
6.搅拌器应满足哪些基本要求?选择搅拌器的基本方法是什么?保证物料混合,消耗最小功率,所需费用最低,操作方便,易于维修。
选择基本方法:A.生产上对搅拌无特殊要求,可参照生产时所用类似搅拌经验地选择。
B.对搅拌有严格要求,且又无类似过程搅拌型式,应对设备工艺过程的操作类别,搅拌要求及经济性全面分析评价,找到主要控制因素进行选择适应型式C.对于过程开发或生产规模很大工程,在一定试验基础上,研究出最佳搅拌器桨叶形式,尺寸及操作条件,再相似模拟放大进行设计计算。
选择搅拌器原则:(1)均相液体混合:主要控制因素容积循环速率。
(2)非均相液体混合:使互不相溶液体能良好分散。
(3)固体悬浮:容积循环速率和湍流强度。
(4)气体吸收及液相反应:保证气体进入液体后被打散,被气泡均匀的分散。
控制因素:局部剪切作用、容积循环速率及高转速。
(5)高粘度体系控制因素:容积循环速率及低转速7.搅拌器的功率消耗主要用于那些方面?计算搅拌器功率有何重要意义搅拌器所消耗的能量;搅拌轴封所消耗;机械传动所消耗意义:(1)搅拌功率是衡量搅拌强度的主要物理量;(2)是搅拌机械设计的基本数据;(3)根据搅拌功率的选用搅拌电机8.从搅拌器的功率曲线可以得到哪些重要信息?功率函数;功率准数;雷诺数1.Nre=1-10:曲线斜率为-1,搅拌层流区;2.Nre=10-1000:搅拌过滤区;3.Nre》1000:搅拌湍流区,为一水平直线9.气液体系的搅拌功率与均相体系相比有哪些特点?液体中通入气体,降低了被搅拌液体的有效密度,因此也就降低了搅拌功率,搅拌功率可采用均相液体搅拌功率分析计算方法并加以修正。
而大量通入气体时,开始出现大气泡,功率消耗不再明显变化,称“液泛”。
10.何为泵送指数?其对搅拌器计算有何重要作用qd=Nqd*ND3,Nqd为泵送准数。
包含了流体的流速和搅拌的泵送能力,反映了搅拌的剧烈程度11.搅拌级别一般范围几个等级10个等级12.常用的搅拌桨叶直径的大致范围如何选定桨叶直径与釜径比值 D/T=0.2~~0.8平桨 0.5~~0.83涡轮 0.33~~0.4推进式 0.1~~0.3313.何为颗粒雷诺数?骑在不同的范围时,密度差如何计算NRe(p)=(dp·ut·ρ)/μ NRe(p)<0.3层流 >103 湍流密度差:(ρp-ρ)/μ(层流) (ρp-ρ)/ρ(湍流)14.聚合反应的搅拌级别一般选择几级一般分为十个等级15.悬浮程度与那些因素密切相关?桨叶转速越高,直径越大,颗粒沉粒沉降速度愈小,所得悬浮程度越高。
16.层流和湍流是=时的搅拌功率如何计算?为什么?因次分析:P=f(N、D、ρ、μ、g)搅拌功率准数:Np=P/(ρN3p5 ),Np=NFrqf(NRe) NRe=DN2/g:搅拌弗鲁德准数层流区:P=KMN2D3 重力影响可忽略,即不考虑NFr 影响 Np=K NRe-1湍流区:P=KρN3D5 湍流区功率曲线呈一水平直线与Re无关,Np为常数。
第六章搅拌聚合釜的传热与性质1,聚合速率在聚合过程中一般有三种类型,其中那些对反应控制比较有利?可采用那些措施实现这种过程?减速型、加速型、匀速型匀速型对反应控制有利,引发剂半衰期使用得当,也可逐渐或分批加入单体或催化剂使Rp保持均衡。
