【化学】 化学科普阅读题测试题及答案(word)
【化学】 化学科普阅读题练习题(含答案)经典
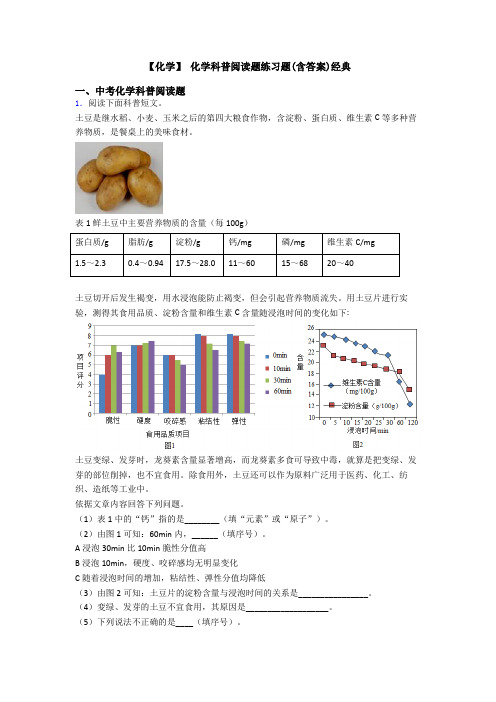
【化学】化学科普阅读题练习题(含答案)经典一、中考化学科普阅读题1.阅读下面科普短文。
土豆是继水稻、小麦、玉米之后的第四大粮食作物,含淀粉、蛋白质、维生素C等多种营养物质,是餐桌上的美味食材。
表1鲜土豆中主要营养物质的含量(每100g)蛋白质/g脂肪/g淀粉/g钙/mg磷/mg维生素C/mg1.5~2.30.4~0.9417.5~28.011~6015~6820~40土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。
用土豆片进行实验,测得其食用品质、淀粉含量和维生素C含量随浸泡时间的变化如下:土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒,就算是把变绿、发芽的部位削掉,也不宜食用。
除食用外,土豆还可以作为原料广泛用于医药、化工、纺织、造纸等工业中。
依据文章内容回答下列问题。
(1)表1中的“钙”指的是________(填“元素”或“原子”)。
(2)由图1可知:60min内,______(填序号)。
A浸泡30min比10min脆性分值高B浸泡10min,硬度、咬碎感均无明显变化C随着浸泡时间的增加,粘结性、弹性分值均降低(3)由图2可知:土豆片的淀粉含量与浸泡时间的关系是________________。
(4)変绿、发芽的土豆不宜食用,其原因是___________________。
(5)下列说法不正确的是____(填序号)。
A土豆是四大粮食作物之一 B土豆中维生素C含量最高C用水泡可防止土豆片褐変 D土豆开发应用的前景广阔【答案】元素 ABC 在其他条件相同时,在研究范围内,土豆片的淀粉含量随浸泡时间的延长而降低土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒 B 【解析】【分析】【详解】(1)物质都是由元素组成的,所以表1中的“钙”指的是元素;(2)A、由图1中的信息可知,浸泡30min比10min脆性分值高,故A正确;B、由图1中的信息可知,浸泡10min,硬度、咬碎感均无明显变化,故B正确;C、由图1中的信息可知,随着浸泡时间的增加,粘结性、弹性分值均降低,故C正确;(3)由图2提供的信息可知,在其他条件相同时,在研究范围内,土豆片的淀粉含量随着浸泡时间的延长而降低;(4)由题干提供的信息可知:土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒;(5)A、由题干“土豆是继水稻、小麦、玉米之后的第四大粮食作物”可知,A正确;B、由表1提供的信息可知,淀粉的含量最高,故B错误;C、由题干“土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。
【化学】 初中化学化学科普阅读题试题(有答案和解析)及解析

【化学】初中化学化学科普阅读题试题(有答案和解析)及解析一、中考化学科普阅读题1.(5分)阅读下列科普材料,回答相关问题。
(材料1)1915年4月22日下午5时,在第一次世界大战两军对峙的比利时伊珀尔战场,趁着顺风,德军一声令下开启了大约6000只压缩氯气(Cl2)钢瓶。
霎时间,在长约60公里的战线上,黄绿色的云团飘向法军阵地。
所经之地绿色植被枯黄褪色;英法士兵先是咳嗽继而喘息,甚至死亡,部分逃到高高的山上的士兵活了下来;战场上的武器锈迹斑斑。
这就是战争史上第一次化学战。
(1)推测氯气可能具有的物理性质是______。
(2)推测氯气可能具有的化学性质是______。
(3)元素周期表中氯元素的信息如图所示,其原子的核外电子数为______。
(材料2)氯气可用于制备多种消毒剂。
①二氧化氯是一种高效、安全环保型杀菌消毒保鲜剂。
②漂白粉是一种广泛普及的杀菌消毒漂白剂,有效成分是次氯酸钙[Ca(ClO)2],其水溶液遇空气中的二氧化碳生成碳酸钙和次氯酸[HClO],HClO起到杀菌、消毒、漂白的作用。
(1)①中二氧化氯的化学式为ClO2,其中氯元素的化合价为______。
(2)②中发生反应的化学方程式为______。
【答案】【材料1】(1)黄绿色气体(密度比空气大、刺激性气味)(2)毒性、与金属反应(氧化性、漂白性、腐蚀性)(3)17【材料2】(1)+4(2)Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO【解析】试题分析:根据材料的叙述可知,【材料1】(1)氯气可能具有的物理性质是黄绿色气体(密度比空气大、刺激性气味);(2)氯气可能具有的化学性质是毒性、与金属反应(氧化性、漂白性、腐蚀性);(3)元素周期表中氯元素的原子中,具有质子数=核电荷数=核外电子数,故其原子的核外电子数为17;【材料2】(1)①中二氧化氯的化学式为ClO2,其中氯元素的化合价,可根据化学式中元素的化合价的代数和为0,故为+4价;(2)②中发生反应的化学方程式为Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO。
【化学】化学化学科普阅读题练习题及解析

【化学】化学化学科普阅读题练习题及解析一、中考化学科普阅读题1.阅读下面科普短文(本文由网络文章改写)。
松花蛋又称皮蛋、变蛋、灰包蛋等,因剥开蛋壳后胶冻状的蛋清中常有松针状的结晶或花纹而得名,是一种我国传统风味食品,口感鲜滑爽口,色香味均有独到之处。
中医认为,松花蛋性凉,对牙痛、眼痛等疾病有一定疗效。
由于松花蛋会有一股碱涩味,在吃松花蛋的时候可以加入少量的姜醋汁。
松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。
料泥是由生石灰、纯碱、食盐、红茶、草木灰(主要成分K2CO3)等原料与水按比例混合均匀制得。
料泥制作过程中,通过一系列反应,产生的强碱(NaOH、KOH)经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,致使蛋白质分解、凝固并放出少量硫化氢气体和氨气。
同时渗入的碱还会与蛋白质分解出的氨基酸进一步发生中和反应,生成的盐的晶体沉积在凝胶态的蛋清中,便出现了朵朵“松花”。
而硫化氢气体则与蛋清和蛋黄中的矿物质作用生成各种硫化物,使蛋清和蛋黄的颜色发生改变,蛋清呈特殊的茶褐色、蛋黄则呈墨绿色。
下图表示松花蛋腌制时间与其中蛋清和蛋黄的pH的变化关系。
很多人在平时生活中都非常喜欢吃皮蛋瘦肉粥、凉拌松花蛋,专家提醒这种食物少吃无妨,却不能过多食用。
其一,松花蛋腌制过程中蛋白质分解、变质,导致营养价值遭到了一定的破坏。
其二,市售松花蛋还可能含铅(国家规定松花蛋中铅含量需小于0.5mg/kg)。
微量铅很容易被儿童吸收,导致铅中毒。
其三,剥开皮的松花蛋1至2小时内一定要吃完,若长时间暴露在空气中,非常容易感染沙门氏杆菌,沙门氏杆菌会快速繁殖,此时食用松花蛋很容易引起中毒现象。
依据文章内容,回答下列问题。
(1)食用松花蛋时加入少量姜醋汁可以除去松花蛋中______________味。
(2)料泥制作过程中会生成强碱NaOH和KOH,钾元素来自于原料中的_________。
生成NaOH的过程中,属于复分解反应的化学方程式为_________________。
(化学)初三化学化学科普阅读题题20套(带答案)

(化学)初三化学化学科普阅读题题20套(带答案)一、中考化学科普阅读题1.阅读下面科普短文(本文由网络文章改写)。
松花蛋又称皮蛋、变蛋、灰包蛋等,因剥开蛋壳后胶冻状的蛋清中常有松针状的结晶或花纹而得名,是一种我国传统风味食品,口感鲜滑爽口,色香味均有独到之处。
中医认为,松花蛋性凉,对牙痛、眼痛等疾病有一定疗效。
由于松花蛋会有一股碱涩味,在吃松花蛋的时候可以加入少量的姜醋汁。
松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。
料泥是由生石灰、纯碱、食盐、红茶、草木灰(主要成分K2CO3)等原料与水按比例混合均匀制得。
料泥制作过程中,通过一系列反应,产生的强碱(NaOH、KOH)经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,致使蛋白质分解、凝固并放出少量硫化氢气体和氨气。
同时渗入的碱还会与蛋白质分解出的氨基酸进一步发生中和反应,生成的盐的晶体沉积在凝胶态的蛋清中,便出现了朵朵“松花”。
而硫化氢气体则与蛋清和蛋黄中的矿物质作用生成各种硫化物,使蛋清和蛋黄的颜色发生改变,蛋清呈特殊的茶褐色、蛋黄则呈墨绿色。
下图表示松花蛋腌制时间与其中蛋清和蛋黄的pH的变化关系。
很多人在平时生活中都非常喜欢吃皮蛋瘦肉粥、凉拌松花蛋,专家提醒这种食物少吃无妨,却不能过多食用。
其一,松花蛋腌制过程中蛋白质分解、变质,导致营养价值遭到了一定的破坏。
其二,市售松花蛋还可能含铅(国家规定松花蛋中铅含量需小于0.5mg/kg)。
微量铅很容易被儿童吸收,导致铅中毒。
其三,剥开皮的松花蛋1至2小时内一定要吃完,若长时间暴露在空气中,非常容易感染沙门氏杆菌,沙门氏杆菌会快速繁殖,此时食用松花蛋很容易引起中毒现象。
依据文章内容,回答下列问题。
(1)食用松花蛋时加入少量姜醋汁可以除去松花蛋中______________味。
(2)料泥制作过程中会生成强碱NaOH和KOH,钾元素来自于原料中的_________。
生成NaOH的过程中,属于复分解反应的化学方程式为_________________。
【化学】 化学科普阅读题单元测试题(含答案)(word)

【化学】化学科普阅读题单元测试题(含答案)(word)一、中考化学科普阅读题1.碳酸钠是一种重要的化工原料。
吕布兰、索尔维和侯德榜为碳酸钠的工业化生产做出了巨大贡献。
I、吕布兰法1789年,法国医生吕布兰(N.Leblanc,1742-1806)以食盐、浓硫酸、木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如图:(1)碳酸钠俗称__________。
(2)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处__________________________________。
Ⅱ、索尔维法1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。
原理如下:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl 2NaHCO3ΔNa2CO3+CO2↑+H2O。
某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠,实验完毕后,将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量,实验记录如下:加热时间/min t0t1t2t3t4t5剩余固体质量/g未记录15.313.711.910.610.6请回答下列问题:(3)装置图中,饱和NaHCO 3溶液的作用是________(用化学方程式表达) (4)有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______(5)根据实验记录,计算t 2时NaHCO 3固体的分解率是________(已分解的NaHCO 3质量与加热前原NaHCO 3质量的比值)(精确到0.1%)。
若加热前NaHCO 3固体中还存在少量NaCl ,上述计算结果将________(填“偏大”、“偏小或“无影响”)。
(6)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布与众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的侯氏制碱法。
(化学)化学化学科普阅读题练习题含答案含解析

(化学)化学化学科普阅读题练习题含答案含解析一、中考化学科普阅读题1.⑴我国是一个海洋大国,海域面积十分辽阔。
习主席在三亚考察时指出,一定要向海洋进军,加快建设海洋强国。
加强创新协作,加快打造深海研发基地,加快发展深海科技事业,推动我国海洋科技全面发展。
海水中蕴含着丰富的化学资源,我们应予以合理开发及综合利用。
①海水淡化的常见方法有_____(至少答一条)。
②海水制镁工艺中,电解熔融氯化镁制取金属镁的化学方程式为_____。
③海水晒盐的基本原理为_____(选填“蒸发结晶”或“降温结晶”)。
④我国著名化学家_____创立了联合制碱法,极大优化了纯碱Na2CO3的生产工艺。
⑵我国有9900多万公顷盐碱地,根据土壤类型和气候条件,分为滨海盐渍区、黄淮海平原盐渍区、荒漠及荒漠草原盐渍区、草原盐渍区四大类型。
盐碱地影响农作物正常生长,农作物产量极低,甚至寸草不生。
盐碱土形成的根本原因在于水分状况不良,各种易溶性盐类在集盐地区的土壤表层逐渐积聚起来。
有些地区春季地表水分蒸发强烈,地下水中的盐分随毛管水上升而聚集在土壤表层,此即"返盐"季节;有些地区到了秋季,土壤中会析出芒硝(主要成分是Na2SO4•10H2O),人们将上述现象俗称为“春泛盐,秋泛硝”。
根据上述信息,试回答下列问题:①由图2可知,50℃时,两者中溶解度较大的物质是_____。
②将40℃等质量的NaCl和Na2SO4的饱和溶液同时降温到10℃,析出晶体较多的是_____。
③40℃时,将25gNa2SO4固体放入50g水中,充分溶解后,可得到Na2SO4的_____溶液。
(选填“饱和”或“不饱和”)④结合图2中的溶解度曲线,试解释“秋泛硝”的原理_____。
⑤盐碱地也是一种珍贵的土地资源,许多科技工作者正以满腔热情投入到治理盐碱地的工作中,目前已有许多可喜的实质性进展。
下列方法措施中,不能改良盐碱地的是_____(选填序号之一)。
(化学)九年级化学化学科普阅读题试题(有答案和解析)

(化学)九年级化学化学科普阅读题试题(有答案和解析)一、中考化学科普阅读题1.阅读下面科普短文。
一段时间以来,网传隔夜菜、肉类腌制品不能吃,是因为含亚硝酸盐。
对于亚硝酸盐大家有众多疑问。
疑问一:亚硝酸盐是什么东西?亚硝酸盐是一类无机化合物的总称,主要指亚硝酸钠(NaNO2),它是白色或淡黄色粉末,有咸味,易溶于水。
它是一种常见的食品添加剂,广泛用于各种火腿、酱卤肉等熟肉类食品加工,作为防腐剂和护色剂。
国家对食品中含有的亚硝酸盐的最大含量限定为:蔬菜4mg/kg,肉类 3mg/kg。
疑问二:亚硝酸盐的“毒”从何来?亚硝酸盐本身并无致癌效应,它被吸入血液 1~5 分钟后,就已经分解。
亚硝酸盐在胃中酸性环境下,易与氨基酸的分解产物发生反应,产生致癌物。
当摄入维生素 C 时可以阻止致癌物产生。
疑问三:隔夜菜中的亚硝酸盐含量会超标吗?实验人员准备了清炒菠菜、清炒芹菜和小白菜炒肉,三种菜各自被分成 6 份,常温和冷藏条件下各保存一半。
实验人员分别取 1 小时后、6 小时后、20 小时后的剩菜,经过捣碎、提取、离心、过滤,取出汤汁。
通过比色法逐一测得样品中亚硝酸盐含量,如下图所示。
实验结果表明,三种菜在放置 20 小时后,无论常温还是冷藏,亚硝酸盐含量虽均有增加,但都远未超过国家标准。
疑问四:摄入多少亚硝酸盐会对人体产生危害?人体对亚硝酸盐的一次性安全摄入量为每千克体重 0.2 mg。
我们日常吃的大米、蔬菜、肉品里面几乎都含有亚硝酸盐。
有数据显示,人体摄入的亚硝酸盐 80%来自蔬菜。
如果你体重 50 kg,即使一次性吃 2.5 kg 蔬菜也是安全的。
因此,将亚硝酸盐摄入量控制在安全范围内不会对人体造成危害。
依据文章内容,回答下列问题。
(1)亚硝酸钠中氮元素的化合价为_____。
(2)人体对亚硝酸盐的一次性安全摄入量为____________。
(3)下列有关说法正确的是_____。
A.“吃隔夜菜会致癌”是没有科学依据的B.常温储存及冷藏储存条件下,亚硝酸盐含量均呈增加趋势C.适量吃富含维生素的新鲜蔬菜水果,有利于抑制致癌物的产生D.从实验数据中发现蔬菜类的隔夜菜亚硝酸盐含量要高于含肉类的隔夜菜(4)亚硝酸钠是实验室常用的试剂,实验室一般用亚硝酸钠溶液与氯化铵溶液反应来制取 N2。
(化学)九年级化学化学科普阅读题题20套(带答案)及解析

(化学)九年级化学化学科普阅读题题20套(带答案)及解析一、中考化学科普阅读题1.阅读下面的科普短文在离地面约25km高空处有一层厚度极薄的气体层,主要成分是臭氧(O3),它是地球上一切生命的保护层。
与O2不同,通常状况下O3是淡蓝色气体,有难闻的鱼腥味。
O3不太稳定,一旦受热极易转化成O2,并放出大量的热。
O3比O2活泼的多,它能跟许多物质(SO2、CO、NO、氟利昂等)发生反应。
如除去工业废气中的二氧化硫,一种方法是在微热条件下,O3与二氧化硫化合成三氧化硫,三氧化硫再跟H2O化合就得到了硫酸。
臭氧发生器可以制得O3,其原理是在放电条件下,O2能转化为O3。
从臭氧发生器出来的气体中含O3约3%。
臭氧层能吸收太阳辐射中的大量紫外线,使地球上的生物免遭紫外线的伤害。
飞机排出的废气(含CO、NO等)以及常用的制冷剂“氟利昂”会使臭氧层形成空洞,从而使更多的紫外线照到地球表面,导致皮肤癌的发病率大大增加。
如不采取措施,后果不堪设想。
依据文章内容,回答下列问题:(1)从微观角度解释O3与O2化学性质不同的原因是_________________。
(2)O3与二氧化硫反应的文字表达式为_________________。
(3)你认为保护臭氧层的有效方法是___________________。
−−→三氧化硫减少废气(含CO、NO等)以【答案】分子结构不同臭氧+二氧化硫∆及制冷剂“氟利昂”的排放【解析】【详解】(1)从微观角度解释O3与O2化学性质不同的原因是:分子结构不同;(2)在微热条件下,O3与二氧化硫化合成三氧化硫,O3与二氧化硫反应的文字表达式−−→三氧化硫为:】臭氧+二氧化硫∆(3)根据“飞机排出的废气(含CO、NO等)以及常用的制冷剂“氟利昂”会使臭氧层形成空洞”可知,保护臭氧层的有效方法是:减少废气(含CO、NO等)以及制冷剂“氟利昂”的排放。
2.波尔多液的制备及组成测定波尔多液是常见的杀菌剂,为天蓝色碱性悬浊液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【化学】化学科普阅读题测试题及答案(word)一、中考化学科普阅读题1.阅读下面科普短文:亚硝酸盐广泛存在于自然环境和我们的生活中。
在粮食、豆类,蔬菜、肉类、蛋类等食物中,都可以检测出一定量的亚硝酸盐,蔬菜中一般都含有硝酸盐,含量高的是茎叶类蔬菜、其次是根茎类蔬、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐。
大剂量的亚硝酸盐能够将人体内血红素中的铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧,即产生亚硝酸盐中毒。
当体内+3价铁血红蛋白达到20%-40%就会出现缺氧症状,达到70%以上可导致死亡。
亚硝酸盐控制在安全范围内使用,是不会对身体造成危害的,而且它对预防致命的肉毒梭菌中毒具有不可替代的作用。
我国和许多国家都批准把亚硝酸盐作为食品添加剂以防止食品腐败,改进肉类颜色。
亚硝酸盐与肌肉中的乳酸作用会产生亚硝胺,亚硝胺不稳定易分解产生一氧化氮,一氧化氮与肌红蛋白结合产生红色的亚硝基肌红蛋白,使肉制品产生稳定的红色。
为了测定煮熟后的蔬菜中亚硝酸盐含量,研究人员选用白菜进行了测定,实验1温度为20℃,实验2温度为13℃,实验中分别取放置2、4、6、8、10、12、24小时的熟白菜汁3滴,滴入1滴稀硫酸,再滴入2滴0.03%高锰酸钾溶液,若溶液的紫红色褪去,表示含有亚硝酸盐,实验记录见表:依据文章内容,回答下列问题:(1)高锰酸钾溶液中的溶质是______。
(填化学式)(2)亚硝酸盐使人体中毒的原因______。
(3)下列有关亚硝酸盐的说法正确的是______。
(填字母序号)A煮熟蔬菜中的硝酸盐会被逐渐分解为亚硝酸盐B温度越低,熟蔬菜中亚硝酸盐产生的速率越快C亚硝酸盐与肌肉中的乳酸作用产生亚硝胺发生的是化学变化D我国规定食品中禁止添加亚硝酸盐(4)根据实验现象,你对一次吃不完的熟蔬菜的建议是______。
【答案】KMnO4它能将人体内血红素中铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧 AC ①低温下贮存;②尽早食用【解析】【详解】(1)在高锰酸钾溶液中,溶质是高锰酸钾,溶剂是水;故填:KMnO4;(2)大剂量的亚硝酸盐能够将人体内血红素中的铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧,即产生亚硝酸盐中毒;故填:它能将人体内血红素中铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧;(3)A.煮熟蔬菜中的硝酸盐会被逐渐分解为亚硝酸盐,故A正确;B.冰箱内蔬菜亚硝酸盐含量低于常温下亚硝酸盐含量,则说明低温保存剩菜能降低亚硝酸盐含量,温度越低,熟蔬菜中亚硝酸盐产生的速率越慢,故B错误C.亚硝酸盐与肌肉中的乳酸作用产生亚硝胺发生的是化学变化,故C正确;D.我国规定食品中可以按照国家标准添加适量的亚硝酸盐做防腐剂,故D错误。
故填:AC;(4)低温保存剩菜能降低亚硝酸盐含量,随着时间的延长,饭菜中亚硝酸盐含量逐渐增加;故填:①低温下贮存;②尽早食用。
2.阅读下面科普短文。
说起二氧化硫(SO2),你可能首先想到它是空气质量播报中堤及的大气污染物。
其实你真的了解SO2吗?难道它只是有害物质吗?SO2与食品工业SO2作为防腐剂、漂白剂和抗氧化剂广泛用于食品行业,葡萄酒酿制中适量添加SO2,可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动,食糖加工过程中可使用SO2进行脱色,按照我国食品添加剂使用标准(GB2760-2014),SO2合理使用不会对人体健康造成危害。
标准中部分食品SO2的最大残留量食品蜜饯葡萄酒食糖水果干巧克力果蔬汁最大残留量SO2与化石燃料化石燃料中的煤通常含有硫元素,直接燃烧会产生SO2为了减少煤燃烧产生的SO2污染空气,可以采取“提高燃煤质量,改进燃烧技术”的措施,例如,对燃煤避行脱硫固硫处理;还可以采取“优化能源结构、减少燃煤使用”等措施,例如、北京大力推广的“煤改气、煤改电”工程,有效改善了空气质量。
现在,你对SO2一定有了新的认识,在今后的化学学习中你对SO2:还会有更全面的认试回答下列问题:(1)按照国家标准,葡萄酒中的SO2最大残留量为______g/L。
(2)葡萄酒酸制过程中SO2的作用是______。
(3)你所知道的SO2排放过多,通常可以造成的环境问题是______写一种即可。
(4)下列措施能减少SO2排放的是______(填序号)。
A.将煤块粉碎对燃煤进行脱硫C.推广煤改气、煤改电循环利用工业尾气中的SO2【答案】0.25 防止葡萄酒在陈酿和贮藏的过程中被氧化,抑制葡萄汁中微生物的活动形成酸雨 BCD【解析】【详解】(1)由图中数据可知:食糖中SO2的最大残留量为0.25g/L。
(2)由题目所给信息可知:葡萄酒酿制过程中SO2的作用是:防止葡萄酒在陈酿和贮藏的过程中被氧化,抑制葡萄汁中微生物的活动(3)二氧化硫是形成酸雨的主要成分。
(4)A选项煤块粉碎并不能改变煤的含硫量,最终生成的二氧化硫质量不变,A不对;B选项对燃煤进行脱硫显然可以降低生成二氧化硫的质量;C选项文章最后一段有原话,煤改气或改电可以改善空气质量;D选项合理的循环使用尾气中的二氧化硫,可以减少的排放。
3.阅读下列科普短文。
即使艳阳高照、天气晴好,有时人们也会出现眼睛刺痛、咳嗽等不良症状。
专家认为,这很可能与臭氧(O3)有关。
臭氧原本是大气中自然产生的一种具有特殊臭味的微量气体,在常温常压下即可缓慢反应生成氧气,当温度达到165℃时迅速反应。
绝大部分臭氧存在于离地面25公里左右处的大气平流层中,这就是人们通常所说的臭氧层。
臭氧量往往随纬度、季节和天气等因素的变化而不同。
研究人员发现,天空中的臭氧层能吸收99%以上的太阳紫外线,为地球上的生物提供了天然的保护屏障。
为何它又成了危害健康的污染物?地表臭氧并非自然产生的,而是由石油产品(如汽油)等矿物燃料燃烧产生的氮氧化物(如二氧化氮)与空气中的氧气结合而形成的。
强烈的阳光照射会加速这一化学反应。
地表空气中的臭氧对人体极为有害,一些易于过敏的人长时间暴露在臭氧含量超过每立方米180微克的环境中,会产生上述不良症状。
研究表明,空气中每立方米臭氧含量增加100微克,人的呼吸功能就会减弱3%。
对于运动员来说,空气中的臭氧含量可以直接影响到他们的耐力和比赛成绩。
自2013年中国执行新《环境空气质量标准》,监测6种污染物以来,臭氧便成为一些城市夏季空气质量“超标日”的首要污染物。
下图为某地夏季某日昼时(7:00-18:00)臭氧、二氧化氮(NO2)浓度随时间的变化图。
依据文章内容回答下列问题。
(1)写出臭氧的一条物理性质________。
(2)写出臭氧迅速生成氧气反应的文字表达式________。
(3)如上图,某地夏季某日昼时,臭氧污染最严重的时间段是_____(填序号)。
A.8:00~10:00 B.10:00~12:00 C.12:00~14:00 D.14:00~16:00 (4)下列说法正确的是_____(填序号)。
A.臭氧层具有吸收紫外线的作用 B.地表空气中臭氧的含量与天气阴晴无关C.臭氧和氧气可以在不同的条件下相互转化D.空气中臭氧浓度不同会对人体造成不同程度的影响(5)为了减少臭氧污染,请你向市民提出一条生活中可行的倡议________。
【答案】特殊气味、气体臭氧氧气 D ACD 少开车【解析】(1)由资料可知,臭氧是一种具有特殊臭味的微量气体;(2)臭氧在165℃时迅速产生氧气,反应的文字表达式是臭氧氧气;(3)由图可知,臭氧在14点—16点时污染最为严重,故选D;(4)A、臭氧层可以吸收紫外线,防止对生物的破坏,正确;B、由资料控制,臭氧在地表空气中臭氧的含量与天气的阴晴有关,错误;C、臭氧在温度达到165℃时迅速产生氧气,故正确;D、空气中臭氧的浓度的多少对人体有直接的影响,正确。
故选ACD。
(5)地表臭氧并非自然产生的,而是由石油产品(如汽油)等矿物燃料燃烧产生的氮氧化物(如二氧化氮)与空气中的氧气结合而形成的,故我们应该减少化石燃料的燃烧,少开私家车。
4.阅读下面的科普短文。
水是地球上最常见的物质之一,生命的孕育和维系都需要水,关于它的传闻有很多。
传闻1:自来水中有余氯,不能饮用。
自来水从自来水厂到用户家可能需要经过几十公里的管道,为了保证水质,必须在水里加入一些消毒剂以防止细菌滋生。
最常用的消毒剂就是氯气,此外还有氯胺和二氧化氯等。
根据世界卫生组织的余氯标准推算,如果氯全部来自于饮用水,则自来水中氯的允许含量为5 mg/L。
而根据我国《生活饮用水卫生标准》,水厂出厂水中余氯不得高于4 mg/L。
由于传输损失,管网末端用户处的自来水中余氯含量远低于允许上限。
为维持消毒效果,国家规定管网末端自来水中余氯下限为0.05 mg/L。
传闻2:煮过很多次的“千滚水”有毒。
有研究对多次煮沸水中亚硝酸盐情况进行实验分析,实验的数据如表1所示。
表1 不同煮沸次数的水中亚硝酸盐含量(mg/L)水样类型亚硝酸盐含量一次沸水0.0008二次沸水0.0020三次沸水0.0028人体长时间摄入超标的亚硝酸盐,会增加患癌症的可能性。
但是在这个实验中可以看到,即使三次煮沸的水中,亚硝酸盐含量比我国天然矿泉水中亚硝酸盐标准(0.1 mg/L)还低不少。
从饮用水健康的角度来看,相比对开水中亚硝酸盐的忧虑,我们更应该注意如果不将水煮开,或者密封、储存方法不当,饮用水中可能存在细菌污染的隐患。
传闻3:常喝“富氧水”能够抗衰老。
富氧水原是医学界为了研究生物细胞厌氧性和好氧性的研究用水,是通过人为地往纯净水里充入更多的氧气制成的。
对于富氧水对健康的影响,学术界存在争议。
有研究认为若水中氧含量过高或常喝富氧水会加速氧化,使人体衰老。
无论是吸氧还是喝氧, 对健康人都是弊多利少。
人们在“喝氧”的问题上应采取慎重态度, 勿作非明智的选择。
依据文章内容回答下列问题。
(1)为保证水质,可用的自来水消毒剂包括__________。
(2)判断传闻1真假,并说明理由:__________。
(3)依据文中数据,煮沸的水中亚硝酸盐含量的变化规律是__________。
(4)传闻3的资料中,反映出的氧气性质有__________。
(5)下列关于水的说法不正确...的是___________(填字母序号)。
A.如果自来水中含氯量过低,水中细菌就可能超标B.因为“千滚水”含有亚硝酸盐,所以有毒而不能饮用C.“富氧水”中富含氧气,适合多喝【答案】氯气、氯胺和二氧化氯假,用户处的自来水中余氯含量远低于允许上限煮沸次数越多,亚硝酸盐含量越高可溶解在水中(或氧化性) BC【解析】(1)由材料可知自来水消毒剂包括氯气、氯胺和二氧化氯;(2)假的,因为用户处的自来水中余氯含量远低于允许上限;(3)由题中的表格可知,煮沸次数越多,亚硝酸盐含量越高;(4)阅读材料得,氧气性质有可溶解在水中(或氧化性);(5)A、水中的消毒剂含量过少,细菌可能超标,正确;B、“千滚水”含有亚硝酸盐,但亚硝酸盐含量比我国天然矿泉水中亚硝酸盐标准(0.1 mg/L)还低不少,可以饮用,错误;C、“富氧水”对健康人都是弊多利少,错误。
