溶液的浓度知识点与练习
06浓度问题

浓度问题【知识点】1、溶液=溶质+溶剂;浓度=溶质÷溶液;溶质=溶液×浓度;溶液=溶质÷浓度【多次混合核心公式】1、假设杯中溶液质量为M ,每次操作先倒出N 克溶液,再倒入N 克清水,n 为操作次数,则:n n )MN 1(r r -⨯=(r 为原溶液浓度,n r 为操作后的新浓度) 2、、假设杯中溶液质量为M ,每次操作先倒入N 克清水,再倒出N 克溶液,n 为操作次数,则:n n )N M M (r r +⨯=(r 为原溶液浓度,n r 为操作后的新浓度) 浓度=溶液溶质,先加入N 克清水,相等于溶液变为原来的M N M +倍,整体变为原来的NM M +倍。
核心公式演绎: 如果把MN 看成一个整体的话,则有: 3、溶液倒出比例为a 的溶液,再加入相同的溶剂,则浓度变为原来的1-a ;4、溶液加入比例为a 的溶剂,在倒出相同的溶液,则浓度变为原来的a11+。
【例 1】当含盐 30%的 60 千克盐水蒸发为含盐 40%的盐水时,盐水重量为多少千克?( ) (安徽 2009-11)A . 45B . 50C . 55D . 60【解】A溶质不变时本体关键:60×30%=40%X【例 2】将 10 克盐和 200 克浓度为 5%的盐水一起加入一杯水中,可得浓度为2.5%的盐水,则原来杯中水的克数是( )。
(江苏 2010C -31,山西 2009-97)A . 570B . 580C . 590D . 600【解】D总共的溶质为:10+200×5%=20克,根据条件可得%5.220010x 20=++,x=590 【例 3】一满杯纯牛奶,喝去 20%后用水加满,再喝去 60%。
此时杯中的纯牛奶占杯子容积的百分数为( )。
(安徽 2011-10)A . 52%B . 48%C . 42%D . 32%【解】D假设牛奶100可,第一次喝完剩80克,第二次喝去60%,剩余80×(1-60%)=32.【例 2】瓶子里装有 20%的酒精 1 千克,现分别倒入 100 克和 500 克的甲、乙两种酒精,此时瓶子里的酒精浓度变为 13%。
六年级寒假第二讲:(溶液浓度问题)附答案

解:设 20%的盐水需 x 克,则 5%的盐水为 600- x 克,那么 20%x+ ( 600-x)× 5%= 600× 15%
X = 400 600- 400=200(克)
练习 4
答:需要 20%的盐水 400 克, 5%的盐水 200 克。
1、 两种钢分别含镍 5%和 40%,要得到 140 吨含镍 30%的钢,需要含镍 5%的钢和含镍 40%的钢各多 少吨?
1、 从装满 100 克 80%的盐水中倒出 40 克盐水后,再用清水将杯加满,搅拌后再倒出 再用清水将杯加满。如此反复三次后,杯中盐水的浓度是多少?
40 克盐水,然后
2、 甲容器中又 8%的盐水 300 克, 乙容器中有 12.5%的盐水 120 克。 往甲、 乙两个容器分别倒入等量的 水,使两个容器中盐水的浓度一样。每个容器应倒入多少克水?
丙管中盐的质量: ( 30+10)× 0.5%= 02(克) 倒入乙管后,乙管中盐的质量: 0.2×【( 20+10 )÷ 10】= 0.6(克)
练习 5
倒入甲管,甲管中盐的质量: 0.6×【(10+10 )÷ 10】= 1.2(克) 1.2÷ 10= 12% 答:最早倒入甲管中的盐水质量分数是 12%。
例题 1。
2
爱迪教育
六年级数学寒假
有含糖量为 7%的糖水 600 克,要使其含糖量加大到 10%,需要再加入多少克糖?
【思路导航】根据题意,在 7%的糖水中加糖就改变了原来糖水的浓度,糖的质量增加了,糖水的质量也
增加了,但水的质量并没有改变。因此,可以先根据原来糖水中的浓度求出水的质量,再根
据后来糖水中的浓度求出现在糖水的质量,用现在糖水的质量减去原来糖水的质量就是增加
小学奥数6-2-6 溶液浓度问题(一).专项练习及答案解析(精品)

1、明确溶液的质量,溶质的质量,溶剂的质量之间的关系2、浓度三角的应用3、会将复杂分数应用题及其他类型题目转化成浓度三角形式来解4、利用方程解复杂浓度问题浓度问题的内容与我们实际的生活联系很紧密,就知识点而言它包括小学所学2个重点知识:百分数,比例。
一、浓度问题中的基本量溶质:通常为盐水中的“盐”,糖水中的“糖”,酒精溶液中的“酒精”等溶剂:一般为水,部分题目中也会出现煤油等溶液:溶质和溶液的混合液体。
浓度:溶质质量与溶液质量的比值。
二、几个基本量之间的运算关系1、溶液=溶质+溶剂2、=100%=100%+⨯⨯溶质溶质浓度溶液溶质溶液三、解浓度问题的一般方法1、寻找溶液配比前后的不变量,依靠不变量建立等量关系列方程2、十字交叉法:(甲溶液浓度大于乙溶液浓度)形象表达:A B =甲溶液质量乙溶液质量B A =甲溶液与混合溶液的浓度差混合溶液与乙溶液的浓度差注:十字交叉法在浓度问题中的运用也称之为浓度三角,浓度三角与十字交叉法实质上是相同的.浓度三角的表示方法如下:::乙溶液质量甲溶液质量z-y x-zy %浓度x 混合浓度z%3、列方程解应用题也是解决浓度问题的重要方法.知识精讲 教学目标溶液浓度问题(一)利用十字交叉即浓度三角进行解题(一)简单的溶液浓度问题【例1】某种溶液由40克食盐浓度15%的溶液和60克食盐浓度10%的溶液混合后再蒸发50克水得到,那么这种溶液的食盐浓度为多少?【考点】溶液浓度问题【难度】2星【题型】解答【解析】两种配置溶液共含食盐40×15%+60×10%=12克,而溶液质量为40+60-50=50克,所以这种溶液的浓度为12÷50=24%.【答案】24%【巩固】一容器内有浓度为25%的糖水,若再加入20千克水,则糖水的浓度变为15%,问这个容器内原来含有糖多少千克?【考点】溶液浓度问题【难度】2星【题型】解答【解析】100100207.51525⎛⎫÷-=⎪⎝⎭。
化学溶液的浓度计算方法知识点总结

化学溶液的浓度计算方法知识点总结在化学实验和工业生产中,计算溶液的浓度是非常常见且重要的。
了解浓度计算方法是学习化学的基础,本文将对化学溶液的浓度计算方法进行知识点总结。
一、摩尔浓度计算方法1. 摩尔浓度(M)是指单位体积溶液中所含溶质的物质的量,计算公式为:摩尔浓度(M)= 溶质的物质的量 (mol) / 溶液的体积 (L)例如:如果有2 mol的氯化钠(NaCl)溶解在500 mL的水中,则摩尔浓度为:M = 2 mol / 0.5 L = 4 M2. 摩尔浓度还可以根据溶液的质量计算,计算公式为:摩尔浓度(M)= 溶质的物质的量 (mol) / 溶液的质量 (g) / 溶液的物质的摩尔质量 (g/mol)例如:如果有0.5 g的氯化钠溶解在500 mL的水中,氯化钠的摩尔质量为58.5 g/mol,则摩尔浓度为:M = 0.5 g / 58.5 g/mol / 0.5 L = 0.017 M二、质量分数计算方法质量分数是指溶质在溶液中所占的质量比例,计算公式为:质量分数 = (溶质的质量 / 溶液的质量) × 100%例如:如果溶液中含有10 g的氯化钠和90 g的水,则氯化钠的质量分数为:质量分数 = (10 g / (10 g + 90 g)) × 100% = 10%三、体积分数计算方法体积分数是指溶质在溶液中所占的体积比例,计算公式为:体积分数 = (溶质的体积 / 溶液的体积) × 100%需要注意的是,体积分数只适用于液体混合物。
例如:如果将20 mL的酒精溶解在80 mL的水中,则酒精的体积分数为:体积分数 = (20 mL / (20 mL + 80 mL)) × 100% = 20%四、密度计算方法密度是指物质的质量与体积的比值,计算公式为:密度 = 物质的质量 (g) / 物质的体积 (mL)对于溶液,可以通过测量溶液的质量和体积来计算密度。
溶液的浓度知识点附答案

溶液的浓度知识点附答案一、初中化学溶液的浓度选择题1.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。
下列说法正确的是( )A.所得溶液可能都是饱和溶液B.20℃时,乙溶液的溶质质量最小C.溶液溶质的质量分数:甲>丙>乙D.升高温度,溶液溶质的质量分数一定变大【来源】浙江省金华市、丽水市2018年中考化学试题2.甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是A.20 ℃时,甲溶液中溶质的质量分数一定比乙溶液的大B.将40 ℃时甲的一定量饱和溶液降温至20 ℃,溶液质量不变C.甲的溶解度大于乙的溶解度D.40 ℃时,分别在100 g水中各加入30 g甲、乙,同时降温至20 ℃,甲、乙溶液均为饱和溶液【来源】2017年初中毕业升学考试(山东临沂卷)化学(带解析)3.右图是a、b、c 三种物质的溶解度曲线,下列分析不正确的是A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>cB.t2℃时,将50ga物质放入100g水中充分溶解恰好得到a的饱和溶液(a物质不含结晶水) C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系b >c=aD.将c的饱和溶液变为不饱和溶液,可采用降温的方法【来源】[首发]山东省枣庄市薛城区2017届九年级中考模拟(5月)化学试题4.a、b、c 三种物质的溶解度曲线如下图所示。
取等质量℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至℃。
下列说法不正确的是A.原饱和溶液中,溶质的质量分数 a>b="c"B.恢复至 t2℃时,析出溶质的质量 a>b=cC.恢复至t2℃时,三种溶液一定都是饱和溶液D.若继续降温至 t1℃,三种溶液一定都是饱和溶液【来源】2013年初中毕业升学考试(北京卷)化学(带解析)5.下列叙述正确的是()A.温度升高时,物质的溶解度增大B.凡是均一、透明的液体就是溶液C.浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液D.20℃时36g氯化钠溶于100g水中,恰好达到饱和,此溶液中溶质的质量分数是36%【来源】2019年内蒙古呼伦贝尔市三岔河中学中考化学模拟试卷(4月份)6.有w 克溶质质量分数为10%的硝酸钾溶液,若要将其溶质质量分数变为20%,可以采用的方法是A.蒸发掉溶剂的1/2 B.加入3w/20克的硝酸钾C.蒸发掉w/2克溶剂D.加入3w/14克的硝酸钾【来源】宁夏银川九中英才学校2019届九年级下学期第一次模拟考试化学试题7.以下关于溶液的叙述,正确的是( )A.均一、稳定的液体一定是溶液B.溶液一定是无色的C.配置一定溶质质量分数的溶液,一般步骤为计算、称量、溶解、装瓶存放D.若100g水中溶解了10g氯化钠固体,则此时所得氯化钠溶液中溶质的质量分数为10%【来源】【区级联考】山东省济南市天桥区2019届中考化学一模试卷8.甲、乙的溶解度曲线如图所示。
人教版九下化学第九单元课题3溶液的浓度知识点梳理
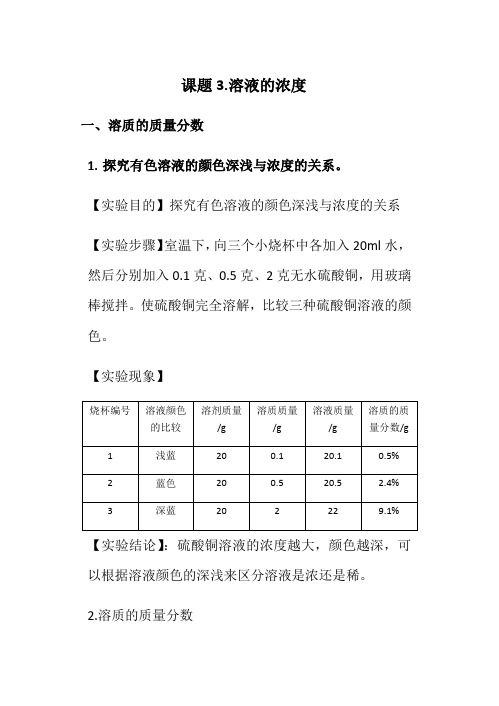
课题3.溶液的浓度一、溶质的质量分数1.探究有色溶液的颜色深浅与浓度的关系。
【实验目的】探究有色溶液的颜色深浅与浓度的关系【实验步骤】室温下,向三个小烧杯中各加入20ml水,然后分别加入0.1克、0.5克、2克无水硫酸铜,用玻璃棒搅拌。
使硫酸铜完全溶解,比较三种硫酸铜溶液的颜色。
【实验现象】【实验结论】:硫酸铜溶液的浓度越大,颜色越深,可以根据溶液颜色的深浅来区分溶液是浓还是稀。
2.溶质的质量分数(1)定义:溶质的质量分数就是溶质的质量与溶液质量之比(2)公式:=溶质质量溶质质量%100%100⨯+=⨯=溶剂质量溶质质量溶质质量溶液质量溶质质量溶质的质量分数可变形为:溶质的质量=溶液的质量×溶质的质量分数溶液的质量%100g 100⨯+=s s 分数饱和溶液中溶质的质量注意:①这里的溶质质量指的是溶解在溶液里的溶质质量不包括未溶解或者结晶析出的溶质的质量。
②代入公式计算的一定是质量,必要时用密度公式换算成质量③一定温度下饱和溶液的溶质的质量分数最大。
④除质量分数以外,人们有时也用体积分数来表示溶液的浓度。
例如:用做消毒剂的医用酒精中乙醇的溶质质量体积分数为75%,就是指100ml的医用酒精中含75ml 的乙醇。
3.溶解度与溶质质量分数的关系二、有关溶液的计算1.溶液的稀释(1)计算依据:稀释前后溶液中溶质的质量不变(2)稀释方法:加溶剂稀释或加稀溶液稀释(3)关系式:加水稀释:m浓×a%=(m 浓+m水)×b%稀加稀溶液稀释:m浓×a%浓+m稀×b%稀=(m浓+m稀)×c%(表示稀释后溶液中溶质的质量分数)2.溶液的增浓(1)增加溶质(注意:温度不变,向饱和溶液中增加溶质,溶质的质量分数不变)原溶液中的溶质与后加入的溶质质量之和等于混合后溶液中溶质的质量,即:原溶液中溶质的质量+增加的溶=混合后溶液中溶质的质量溶液的质量=原溶液的质量+增加的溶质的质量即若:设原溶液的质量为Ag,溶液质量分数为a%,加溶质为Bg后,变成溶质质量分数为b%的溶液,即:Ag×a%+Bg=(Ag+Bg)×b%(2)蒸发溶剂(无晶体析出)根据溶液蒸发溶剂后,溶质的质量不变。
(完整)六年级百分数应用题之简单浓度问题讲义及练习

(完整)六年级百分数应用题之简单浓度问题讲义及练习知识点概述:糖水的浓度是糖与糖水重量的比值;盐水的浓度是盐与盐水的重量的比值。
溶质是被溶解的物质,如糖、盐等;溶剂是溶解这些物质的液体,如水、汽油等;混合后的液体叫做溶液。
浓度问题涉及到以下关系式:①浓度=溶质质量÷溶液质量②溶质质量=溶液质量×浓度③溶液质量=溶质质量÷浓度④溶液质量=溶质质量+溶剂质量一、求溶液的浓度例题一:将20千克食盐溶解在180千克水中,求盐水的浓度。
例题二:将5克碘溶解在195克酒精中,制成碘酒,求碘酒的浓度。
练题:①将4克碘溶解在酒精中,制成2千克碘酒,求碘酒的浓度。
二、溶液的浓度发生变化:1、溶液的浓度降低:溶剂增加,关键是溶质的质量不变。
例题三:120千克浓度为25%的盐水,加多少水能够稀释成浓度为10%的盐水?练题:在重量为200克、浓度为15%的糖水中,加入多少克水可以得到浓度为10%的糖水?2、溶液的浓度增加:溶剂减少,关键是溶质的质量不变。
例题四:从含盐12.5%的40千克盐水中蒸发多少水分,才能制出含盐20%的盐水?例题五:在含盐0.5%的盐水中蒸发236千克水,得到含盐30%的盐水,问原来的盐水有多少千克?练题:1、有700克浓度为2.5%的盐水,为了制成浓度为3.5%的盐水,需要蒸发多少克水?3、溶液的浓度增加:溶质增加,关键是溶剂的质量不变。
例题六:将300克浓度为10%的糖水变成浓度为25%的糖水,需要加多少克糖?练题:现有300克浓度为20%的糖水,加多少糖可以使浓度变成40%?4、两种不同浓度的溶液混合:关键是混合前后溶质的质量以及溶液的质量不变。
例题七:500克浓度为70%的酒精溶液与300克浓度为50%的酒精溶液混合,得到的酒精溶液浓度是多少?例题八:要制成900克浓度为15%的食盐水,需要多少克20%和5%的食盐水?例题九:在100千克浓度为50%的硫酸溶液中加入多少千克浓度为5%的硫酸溶液,可以制成浓度为25%的硫酸溶液?。
小学奥数 溶液浓度问题(一) 精选练习例题 含答案解析(附知识点拨及考点)

1、明确溶液的质量,溶质的质量,溶剂的质量之间的关系2、浓度三角的应用3、会将复杂分数应用题及其他类型题目转化成浓度三角形式来解4、利用方程解复杂浓度问题浓度问题的内容与我们实际的生活联系很紧密,就知识点而言它包括小学所学2个重点知识:百分数,比例。
一、浓度问题中的基本量溶质:通常为盐水中的“盐”,糖水中的“糖”,酒精溶液中的“酒精”等溶剂:一般为水,部分题目中也会出现煤油等溶液:溶质和溶液的混合液体。
浓度:溶质质量与溶液质量的比值。
二、几个基本量之间的运算关系1、溶液=溶质+溶剂2、=100%=100%+⨯⨯溶质溶质浓度溶液溶质溶液三、解浓度问题的一般方法1、寻找溶液配比前后的不变量,依靠不变量建立等量关系列方程2、十字交叉法:(甲溶液浓度大于乙溶液浓度) 形象表达:A B =甲溶液质量乙溶液质量B A =甲溶液与混合溶液的浓度差混合溶液与乙溶液的浓度差注:十字交叉法在浓度问题中的运用也称之为浓度三角,浓度三角与十字交叉法实质上是相同的.浓度三角的表示方法如下:::乙溶液质量甲溶液质量z-y x-zy %浓度x 混合浓度z%3、列方程解应用题也是解决浓度问题的重要方法.知识精讲教学目标溶液浓度问题(一)利用十字交叉即浓度三角进行解题(一) 简单的溶液浓度问题 【例 1】 某种溶液由40克食盐浓度15%的溶液和60克食盐浓度10%的溶液混合后再蒸发50克水得到,那么这种溶液的食盐浓度为多少?【考点】溶液浓度问题 【难度】2星 【题型】解答【解析】 两种配置溶液共含食盐40×15%+60×10%=12克,而溶液质量为40+60-50=50克,所以这种溶液的浓度为12÷50=24%.【答案】24%【巩固】 一容器内有浓度为25%的糖水,若再加入20千克水,则糖水的浓度变为15%,问这个容器内原来含有糖多少千克?【考点】溶液浓度问题 【难度】2星 【题型】解答【解析】 100100207.51525⎛⎫÷-= ⎪⎝⎭。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节 溶质的质量分数● 牢记下面的公式:%100%100⨯+=⨯=溶剂质量溶质质量溶质质量溶液质量溶质质量溶质的质量分数 ● 使用该公式时的注意事项:⏹ 溶质的质量就是指形成溶液的那部分溶质,没有进入溶液的溶质不应考虑。
(计算溶质质量时要考虑溶解度)⏹ 溶液的质量包括溶液中所有溶质的质量。
⏹ 上下的单位要统一。
● %100g100⨯+=s s 分数饱和溶液中溶质的质量3、常见题型及基本思路:(1)溶液加水稀释的计算:根据稀释前后溶质的质量相等,可用以下计算式计算:m(浓)×a%(浓)=[m(浓)+m(水)] ×a%(稀)(2)溶质质量分数不同的同溶质溶液混合问题:一般可用下式计算:m(浓)×a%(浓)+m(稀)×a%(稀)=m(混)×a%(混)(3)求化学反应后所得溶液中溶质质量分数的问题:通过化学反应计算出溶质质量,再分析各量间关系求出溶液总质量,运用公式计算出反应后溶液中溶质的质量分数、求反应后所得溶液质量的一般方法:质量守恒法、溶液质量=m(反应物)-m↓-m↑、二、典型例题例1:现有100g溶质质量分数为15%的过氧乙酸溶液,欲配制成溶质质量分数为1、5%的溶液来使用,需加水多少克?解:设需加水质量为x,100g×15%=(100g+x)×1、5%x=900g、例2:配制2000g20%的稀硫酸用以除锈,需98%的浓硫酸与水各多少毫升?解:设需浓硫酸的质量为x2000g×20%=x×98%x=408、2g浓硫酸体积=408、2g÷1、84g/cm3=221、8mL水的体积=(2000g-408、2g)÷1g/cm3=1591、8mL例3:实验室用95%的浓硫酸与5%的稀硫酸来配制20%的硫酸180g,需要95%的硫酸与5%的硫酸各多少克?解:设需要95%,5%硫酸的质量分别为x,yx=30g y=150g例4:200g稀硫酸与足量锌反应,生成0、4g氢气、求:①原硫酸溶液中溶质的质量分数、②所得溶液中溶质质量分数、解:设参加反应的H2SO4质量为x,生成ZnSO4的质量为y、Zn+H2SO4=ZnSO4+H2↑98 161 2x y 0、4gx=19、6g y=32、2g(1)(2)例5:把16、9gNaCl与Na2CO3的混合物加入到100g7、3%的盐酸中,恰好完全反应、求反应后所得溶液中溶质的质量分数、解:盐酸中溶质质量为:100g×7、3%=7、3g设Na2CO3质量为x,生成NaCl质量为y,CO2质量为m,Na2CO3+2HCl=2NaCl+H2O+CO2↑106 73 117 44x 7、3g y mx=10、6g y=11、7gm=4、4g所得溶液溶质质量分数为:三、检测题(一)选择题:1、配制90g10%的NaNO3溶液后,向其中加入10gNaNO3搅拌至完全溶解,所得溶液中NaNO3质量分数就是( )A、19%B、10%C、9%D、无法计算2、把40g5%的CaCl2溶液溶质质量分数增大到10%,应采用的方法就是( )A、把溶剂蒸发掉一半B、加入2gCaCl2固体C、加入40g15%的CaCl2溶液D、把溶剂蒸发掉20g3、配制5000g20%的盐酸,需要38%的盐酸(密度为1、19g/cm3)的体积为( )A、2211mLB、1000mLC、2200mLD、2632mL4、某酒精溶液中乙醇所含的氢原子数与水所含的氢原子数相等,则该酒精溶液中溶质的质量分数为( )A、50%B、25%C、46%D、33、3%5、一份2%的NaCl溶液蒸发掉40g水后,溶质质量分数变为10%,则原溶液中溶质质量为( )A、1gB、2gC、5gD、8g6、20℃时,NaCl的溶解度为36g,该温度下,NaCl溶液中溶质质量分数不可能为( )A、20%B、26、5%C、25%D、30%(二)填空题:1、配制360、0g 10%的盐酸,需要36%的盐酸(密度为1、18g/cm3)____毫升,水____毫升、2、向90g10%的NaCl溶液中加入10gK2SO4搅拌至完全溶解,所得溶液中NaCl的质量分数为____、3、向40g5%的NaOH溶液中,加入60g10%的NaOH溶液,混合后溶液中NaOH质量分数为____、4、右图就是一瓶葡萄糖注射液标签,试根据给出的数据计算该溶液中含水____g,溶液的密度约为____g/cm3、(三)计算题:1、为了给水果消毒,某同学要把30g15%的KMnO4溶液稀释成0、3%的溶液,需加水多少克?2、将9gKNO3完全溶于21g水中,并将其均分为三份,计算:(1)取一份,其中溶质质量分数就是多少?(2)取一份,使其溶质质量分数增大一倍,需加入KNO3多少克?(3)取一份,欲使其溶质质量分数减小一半,需加水多少克?3、t℃时,4、8g镁与一定量的稀盐酸恰好完全反应,所得溶液溶质质量分数为25%、求所用盐酸中氯化氢的质量分数、4、取22、2g石灰石样品,放入盛有126g稀盐酸的烧杯中,石灰石中的CaCO3与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质质量变为139、4g、求反应后所得溶液中溶质的质量分数、5、常温下,将18、9gKCl 与K 2CO 3的混合物溶于149g 水中,向其中加入36、5g 稀盐酸,恰好完全反应,得到200g 不饱与溶液、求反应后所得溶液中溶质的质量分数、6、将10g 不纯的MgCl 2样品(杂质不溶于水),放入50g 水中,充分搅拌,待样品中MgCl 2全部溶解后过滤、将所得滤液与63、3gNaOH 溶液恰好完全反应,生成5、8g 白色沉淀、 求:(1)样品中MgCl 2的质量 (2)反应后所得溶液中溶质的质量分数7、甲、乙、丙三位同学分别取铁粉与铜粉的均匀混合物与某稀硫酸反应,所得数据如下: 甲 乙 丙 金属混合物质量(g)10 10 20 稀硫酸质量(g)100 120 100 反应后,过滤得干燥固体质量(g) 2 2 12 计算:(1)金属混合物中铁的质量分数;(2)甲制得硫酸亚铁质量;(3)该稀硫酸中溶质的质量分数、二、溶解度与质量分数的应用典型例题1: 1、20℃时,NaCl 的溶解度为36克,含义就是_________________________________、则该温度下溶质的质量分数就是_______。
2、在20℃时,食盐溶解度就是36g 。
在此温度时,将25g 食盐放入50g 水中,则所得溶液中溶质的质量分数就是_______。
规律小结:利用溶解度计算质量分数时注意:溶解度就是该温度下溶解溶质的_______值、 学以致用:1、一定温度时,某物质的溶解度为αg,形成的饱与溶液中溶质的质量分数为b%,则a 与b 的大小关系为 ( ) A 、a 大于b B 、 a 等于b C 、 a 小于b D 、无法判断 2、60℃时,50gH 2O 中最多溶解55gKNO 3。
若把60℃时的210gKNO 3饱与溶液蒸发掉50gH 2O 后,再降到60℃,则析出晶体后溶液中溶质质量分数就是 、 典型例题2:右下图就是甲、乙、丙三种固体物质的溶解度曲线,请根据图示填空: (1)随着温度的升高其溶解度反而减小的就是___________; 在______℃时,甲与丙的溶解度相等。
(2)t 3℃时,甲物质的饱与溶液中,溶质、溶剂、溶液的质量之比为__________。
(3)t 1℃时,甲、乙、丙三种物质的饱与溶液中,溶质质 量分数的大小关系就是________________(用“甲”、“乙”、 “丙”及“>”、“<”或“=”表示)。
⑷①t 3℃时甲的饱与溶液降温到t 1℃时,其溶质质量分数将____(填“变大、变小或不变”下同)② t 1℃时甲的饱与溶液升温到t 3℃时,其溶质质量分数将_____、⑸ ①t 3℃时丙的饱与溶液降温到t 1℃时,其溶质质量分数将_____、(同上)一、一定溶质质量分数溶液的配制学以致用3 配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序就是 ( )A 、③④①②⑤B 、①②③④⑤C 、④⑤①②③D 、②①④③⑤1、若配制150g 质量分数为10%的氢氧化钠溶液。
① 计算:需要氢氧化钠固体的质量为 g ;水的体积为 ml 、 ② 称量:调节托盘天平平衡后,将 放在托盘天平的左盘,称量其质量,然后在右盘添加 ,最后添加氢氧化钠固体,直至天平平衡。
③ 溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,用玻璃棒 ,使其溶解,并冷却至室温。
④ 存贮:把配好的溶液装入试剂瓶,塞好橡皮塞并 ,放到指定的地方。
2、误差分析:用量筒取液体时,视线应与量筒内液体 保持水平。
如果俯视读数,会引起量取水的体积 ,造成溶液质量 ,溶质的质量分数会 ;(填“偏低”“偏高”或“不变”)如果仰视读数,会引起量取水的体积 ,造成溶液质量 ,溶质的质量分数会 、 甲 乙 0 t 1t 2 t 3 t/℃ 丙 溶解度/g 50②t1℃时丙的饱与溶液升温到t3℃时,其溶质质量分数将_____、⑹将t3℃时等质量的甲、乙、丙的饱与溶液降温到t1℃时,_____析出的晶体多、所得溶液的溶质质量分数从大到小的顺序为___________、⑺判断下列说法就是否正确①t2℃时甲、丙两溶液的溶质质量分数相等。
( )②t2℃时甲、丙两物质的饱与溶液种分别含甲、乙两物质的质量相等( )(8)丙的不饱与溶液变为饱与溶液的方法就是________________________________________、【当堂作业】1、甲乙两种固体物质的溶解度曲线如图所示,下列说法正确的就是( )A、 t 1℃时,甲物质的溶解度小于乙物质的溶解度B、 t2℃时甲乙两物质的饱与溶液种分别含甲、乙两物质的质量相等C、将t3℃时的甲、乙两物质的饱与溶液降温至t1℃时,都会析出晶体D、甲、乙两物质的溶解度均随温度的升高而增大2、实验室需要配制15%的氯化钠溶液50g.(1)计算:需要氯化钠的质量为______、(2)某同学按下图所示步骤依次操作:其中操作错误的步骤就是_______(填字母序号);B中仪器的名称为__________ ;E中玻璃棒的作用就是___________、(3)若上图A中砝码的质量为5g,游码为2、5g,则小明称得的氯化钠质量实际为____、。
