黄曲霉毒素B1在食品检测中的研究新进展
黄曲霉毒素B1在食品检测中的研究新进展

黄曲霉毒素B1在食品检测中的研究新进展黄曲霉毒素B1是一种常见的真菌毒素,它存在于许多食品中,如谷物、坚果、蔬菜、食用油等。
长期摄入大量黄曲霉毒素B1会对人体健康造成极大危害,包括肝损害、癌症、免疫抑制等。
因此,黄曲霉毒素B1检测一直是食品安全领域的热门话题,近年来也有不少新的研究进展。
近年来,越来越多的研究者开始探索新的黄曲霉毒素B1检测方法,以提高检测的准确性和灵敏度。
(一)免疫检测法免疫检测法是目前最常用的黄曲霉毒素B1检测方法之一。
它基于抗体与毒素之间的特异性结合反应,通过测量样品中的反应物来确定黄曲霉毒素B1的存在和含量。
近年来,一些新的免疫检测法也得到了研究和应用,如磁珠免疫分离-荧光偏振光谱法、超微粒可视免疫层析法等。
这些方法具有检测快速、灵敏度高、操作简便等优点,可以应用于食品、饲料等领域的黄曲霉毒素B1检测。
(二)色谱法色谱法是一种基于化学分离技术的黄曲霉毒素B1检测方法。
近年来,液相色谱法和气相色谱法等新的色谱技术也得到了广泛应用。
例如,高效液相色谱法结合甲基化技术可以提高黄曲霉毒素B1分离和检测的灵敏度和准确性;气相色谱质谱联用技术可以实现对样品中多种毒素的同时检测,并提高检测的快速性和准确性。
除了新的黄曲霉毒素B1检测方法外,也有一些新的检测技术在研究和应用中。
(一)快速检测技术快速检测技术是指可以在短时间内对大量样品进行检测的技术。
例如,纳米钛氧化物电化学传感器可以在短时间内对含黄曲霉毒素B1的实际食品样品进行检测,快速、准确、灵敏。
另外,短时间内种植和发芽的植物可以用于检测含黄曲霉毒素B1的食品,快速、简便、低成本。
(二)大数据技术大数据技术在黄曲霉毒素B1检测中的应用主要是通过建立模型对大量数据进行处理和分析,以建立准确的检测模型。
例如,使用机器学习技术对各种食品中黄曲霉毒素B1的含量进行预测,以确定检测的阈值。
三、结语总的来说,黄曲霉毒素B1检测的研究不断取得新的进展,新的检测方法和技术促进了黄曲霉毒素B1的精准检测和控制,更好地保障着人们的饮食安全。
对食品中黄曲霉毒素B1的检测方法及分析

2010 NO.23S c i enc e a nd T ech n ol o gy I nno v at i on Her a l d研 究 报 告1 黄曲霉毒素B t测定原理与步骤方法在食品中黄曲霉毒素B1检测方法很多,有些样品如薯类及部分酱料、油类样品受样品杂质干扰的影响,因而使方法的灵敏度降低。
目前通常采用双向展开法,可以提高了检测方法的灵敏度,如测定了一份薯类样品,按灵敏度由原法的25ppb提高到5ppb,同时测定了含杂质较多的花生油、酱油及曲种等样品,情况亦是如此。
而原法灵敏度为5ppb的样品(如花生及部分花生油样品等)用双向展开法展开,其灵敏度亦可以进一步提高,有的可提高到1.25ppb。
今将双向展开法的原理及操作步骤介绍如下。
1.1原理因无水乙醚不能推动黄曲霉毒素B-(以下简称B。
)。
在用乙醚将薄层板横展时,可以把干扰的杂质推到样品点的旁边,而不像用乙醚纵展时,有时在样品的过道中留有部分杂质的底色。
在乙醚横展后再用丙酮:氯仿纵展,可以使样品在B1标准点相应处的杂质底色大量的减少.从而提高了原有方法的灵敏度。
1.2试剂(补充的)无水乙醚,分析纯,在无水乙醚中加入少许无水硫酸钠贮存。
1.3操作步骤主要补充双向展开法的操作步骤,其它参照B1测定法。
1.3.1滴加方法由于在具体测定条件下,用无水乙醚展开后Bt仍有很少的移动(因无水乙醚中含微量的水或醇以及空气中的湿度太大等均可以使B,移动),因此在滴加时必需同时滴加两块层析板。
在一块5×20cm的薄层板上距下端3cm的基线上滴加以下两个点:第1个点离左边边距0.8~1cm处滴加B。
标准液Ⅲ(0.04微克/毫升)10微升;第2个点离第一个点的间隔距离约1.8~2.0cm处滴加样液20微升。
在另一块上的滴加样式完全与第一块相同,祗在第二个样品点上再滴加B1标准液Ⅲ0.04(微克/毫升)10毫升。
1.3.2展开方法①横展:在展开槽内的长边放置玻璃支架一个,再加无水乙醚10毫升。
黄曲霉毒素B1在食品检测中的研究新进展

黄曲霉毒素B1在食品检测中的研究新进展黄曲霉毒素B1(AFB1)是一种常见的真菌毒素,存在于一些农产品中,如玉米、花生、大米等。
AFB1是一种强烈的致癌物质,被国际癌症研究机构(IARC)列为第一类致癌物质,因此对AFB1的检测非常重要。
本文将介绍近期对AFB1检测的新进展。
传统的AFB1分析方法主要基于色谱分析技术。
通过高效液相色谱(HPLC)或气相色谱(GC)对样品进行分离和检测。
虽然色谱分析技术被广泛应用于AFB1的检测,但也存在一些缺点,如要求昂贵专业的仪器和技术操作。
另外,此类方法也不适用于快速检测。
为了克服这些缺点,研究人员近年来开发了一些新的AFB1检测方法。
其中,基于免疫检测技术的方法逐渐成为主流。
免疫检测技术可以在不需要昂贵的仪器和技术操作条件下,快速准确地检测样品中的AFB1。
基于免疫检测技术开发的AFB1检测方法主要有以下几个方向:酶联免疫吸附测定法(ELISA)、荧光免疫分析法、光学谱学分析法、纳米材料检测法等。
ELISA是最常用的免疫检测技术之一。
该方法可以快速准确地定量检测样品中的AFB1含量。
ELISA方法利用特异性的抗AFB1抗体,将样品中的AFB1与抗体结合,然后采用酶标记检测,获得高灵敏度和高特异性的检测结果。
近年来,研究人员结合修饰的纳米材料,如金磁纳米颗粒、碳纳米管等,将其用于ELISA检测,既增强了ELISA的灵敏性,又提高了检测速度。
荧光免疫分析法是另一种免疫检测技术,该方法利用与AFB1结合的荧光标记物,通过检测荧光信号来定量检测样品中的AFB1含量。
该方法具有高灵敏度、高准确性和高特异性等优点,因此被广泛应用于食品检测领域。
光学谱学分析法是一种基于样品产生衍射或吸收性改变的检测技术。
研究人员开发了基于表面等离子体共振(SPR)或色谱显微镜(SCM)的光学谱学分析法来检测AFB1。
这些方法具有低成本、便携、易操作等优点,可以用于食品加工厂、市场等场所的实时检测需求。
食品中黄曲霉毒素B1 检测方法研究
仪,主要包含了传感和自动化识别两大系统。由于综合应用 质也可能会产生影响,降低或增加待测信号,形成基质效
了数学、物理、材料、神经及生理等诸多理论,能迅速完成 应。原因主要是生物样品中内源性成分的存在或融入样品
复杂气味和气体的识别,通过气味数学模型的构建及应用, 前处理中的外源性成分的影响。所以在样品本身、基质及
关键词:食品;黄曲霉毒素 B1;检测方法
当前,人们高度重视食品安全问题,在探索和研究各类 障人们的身体健康。
食品安全检测方法方面已取得了瞩目成果。黄曲霉毒素 B1 的毒性和致癌性极强,通过污染粮食作物及其制品从而对人
畜健康构成威胁,需高度重视其检测工作的开展。基于此,
本文介绍了几种用于检测食品中黄曲霉毒素 B1 的方法。 1 食品中黄曲霉毒素 B1 检测重要性
优势
劣势
电子鼻法
响应时间短、检测速度快,测定评估范围广,能避免人为误差, 无法识别分子水平上单个可挥发物标志物
重复性好
高效液相色谱 - 质谱联用法
重现性好、灵敏度高
程序烦琐、检测周期长、成本较高
时间分辨荧光免疫分析法
操作流程短、有效期长、灵敏度高、检测便捷、 试剂盒昂贵
食品科技
食品中黄曲霉毒素 B1 检测方法研究
王 媛
(连云港市赣榆区综合检验检测中心,江苏连云港 222100)
黄曲霉毒素B1在食品检测中的研究新进展

黄曲霉毒素B1在食品检测中的研究新进展黄曲霉毒素B1(Aflatoxin B1,AFB1)是一种由黄曲霉(Aspergillus flavus)和曲霉(Aspergillus parasiticus)产生的毒素,属于类黄酮类毒素,具有强烈的致癌性和致突变性。
AFB1对人类、动物和禽畜都有很高的毒性,长期摄入会引起肝癌、肝损伤等严重疾病,对食品安全构成了严重威胁。
对食品中的AFB1进行快速、准确的检测至关重要。
近年来,国内外科研人员在食品中AFB1检测方面开展了大量的研究工作,取得了许多新的成果与进展。
一、检测方法的研究进展目前,常见的AFB1检测方法主要包括高效液相色谱法、气相色谱法、免疫学方法以及生物传感技术等。
免疫学方法是目前应用最为广泛的一种快速检测方法,主要包括酶联免疫吸附检测法(ELISA)和免疫层析技术(TLC)。
近年来,在检测方法的研究方面,研究人员主要集中在提高检测的灵敏度、准确性和快速性上。
他们通过引入新型的亲和层析剂、磁性分离技术等手段,使得ELISA法在AFB1的检测中具有更高的灵敏度和准确性;一些研究者还利用纳米材料和纳米生物传感技术,开发出了更为快速、便捷的检测方法,大大缩短了检测时间,提高了检测效率。
二、食品中AFB1的快速筛查技术针对大批量食品样品的快速筛查需求,研究人员也积极探索了一些新的快速筛查技术。
利用近红外光谱技术对谷物中的AFB1进行非破坏性检测;利用电化学传感技术对液态食品中的AFB1进行快速筛查等。
这些新技术的引入,使得食品生产企业可以更为方便快捷地进行AFB1的快速筛查,为食品安全监管提供了有力的技术支持。
三、新型材料在AFB1检测中的应用除了新的检测方法和筛查技术外,新型材料的引入也为AFB1检测带来了新的思路。
一些研究者利用金纳米颗粒等材料,构建了高灵敏度、高特异性的传感器,用于AFB1的检测。
这些传感器具有操作简单、使用成本低等优点,可以有效地解决传统检测方法的部分缺陷。
食品中黄曲霉毒素的检测方法研究

食品中黄曲霉毒素的检测方法研究黄曲霉毒素是一种由黄曲霉属真菌产生的毒素,常见于谷物、豆类、坚果、干果等食品中。
长期摄入含有黄曲霉毒素的食品会对人体健康造成危害,因此对食品中黄曲霉毒素进行有效检测具有重要意义。
本文将探讨食品中黄曲霉毒素的检测方法研究现状及发展趋势。
一、黄曲霉毒素的危害黄曲霉毒素主要包括黄曲霉毒素B1、B2、G1、G2等多种类型,其中黄曲霉毒素B1是最为常见和具有毒性的一种。
食用含有黄曲霉毒素的食品会对人体肝脏、免疫系统等造成损害,严重时甚至导致癌症等疾病的发生。
二、传统检测方法1. 高效液相色谱法(HPLC)高效液相色谱法是目前较为常用的食品中黄曲霉毒素检测方法之一,其原理是通过色谱柱将样品中的黄曲霉毒素分离并进行定量分析。
虽然HPLC方法准确可靠,但存在操作复杂、耗时长、设备昂贵等缺点。
2. 气相色谱法(GC)气相色谱法是另一种常见的检测方法,通过气相色谱仪将样品中的黄曲霉毒素进行分离和检测。
GC方法具有分析速度快、灵敏度高等优点,但需要样品预处理步骤较多,且对操作人员技术要求较高。
三、近年新兴检测技术1. 免疫学检测法免疫学检测法是近年来发展较快的一种检测技术,包括酶联免疫吸附法(ELISA)、免疫层析法等。
这些方法基于抗体与抗原特异性结合的原理,具有操作简便、快速灵敏等优点,逐渐成为食品中黄曲霉毒素检测的主流技术之一。
2. 分子生物学检测法PCR(聚合酶链式反应)技术在食品中黄曲霉毒素检测中也得到了广泛应用。
通过PCR扩增样品中的DNA片段,再结合荧光探针或凝胶电泳等技术进行定量分析,具有高度灵敏度和特异性。
四、未来发展趋势随着科学技术的不断进步,食品中黄曲霉毒素的检测方法也在不断创新和完善。
未来食品安全领域可能会出现更加快速、准确、便捷的检测技术,如基于纳米材料的传感器技术、光谱分析技术等。
这些新技术的应用将进一步提升食品安全监管水平,保障公众健康。
综上所述,食品中黄曲霉毒素的检测方法研究是一个不断发展和完善的领域,各种新技术的涌现为提高食品安全水平提供了有力支持。
细菌降解黄曲霉毒素B1的研究进展

细菌降解黄曲霉毒素B i的研究进展严家俊S庄艺协S吴风霞2,金佳佳S张娟1(1.广东产品质量监督检验研究院,广东佛山528300;2.中国水产科学研究院南海水产研究所,广东省渔业生态环境重点实验室,广东广州510300)摘要:黄曲霉毒素Bi是目前己发现的黄曲霉毒素中毒性最强的一种,其具有强肝毒性、高致突变性和高致畸性。
广泛存在于农产品 及饲料食品中,对人类健康存在严重威胁,同时对粮食和畜牧业造成严重的经济损失。
细菌降解黄曲霉毒素Bi是一种有效、安全和环 保的解毒方法,该文通过对黄曲霉毒素Bi降解的影响因素、细菌胞外酶和胞内酶等对黄曲霉毒素Bi的降解机理以及黄曲霉毒素Bi降 解菌活性产物的应用研究等方面对细菌降解黄曲霉毒素Bi进行了论述,并对细菌降解黄曲霉毒素Bi应用前景进行展望,为以后更进 一步研究提供较为全面的资料。
关键词:黄曲霉毒素Bi;细菌;生物降解中图分类号:R155.5 文章编号:0254-5071 (2018)03-0010-04 doi:10.11882/j.issn.0254-5071.2018.03.003Advances in the study of b acterial degradation of a flatoxin BiYAN Jiaiun', ZHUANG Yixie', WU Fengxia2, JIN Jiaiia', ZHANG Juan'(i.Guangdong Testing Institute o f P roduct Quality Supervision,Foshan 528300, China;2.Guangdong Provincial K ey L aboratory o f F ishery E cology and Environment,South China Sea Fisheries Research Institute,Chinese Academ y o f F isheries Sciences,Guangzhou 5i0300, China)Abstract:Aflatoxin Bi is one of t he most toxic aflatoxin, which is characterized by strong hepatotoxicity, high mutagenicity and high teratogenicity. It is widespread in agricultural products and feed food, which poses a serious threat to human health, and at the same time it causes serious economic losses to grain and animal husbandry. Bacterial degradation of aflatoxin Bi is an effective, safe and environment-friendly method of detoxification. The biodegradation of aflatoxin Bi by bacteria was discussed in this paper from three aspects: factors affecting the degradation of aflatoxin Bi , the degradation mechanism of bacterial extracellular and intracellular enzyme for aflatoxin Bi .The application study of the active product of aflatoxin Bi-degrading bacteria, and the prospect of b acterial degradation of aflatoxin Bi was prospected as well, so as to provide more comprehensive information for further research.Key words:aflatoxin Bi ; bacteria; biodegradation黄曲霉毒素(aflatoxins,AFT)是一组由二呋喃环和香 豆素的组成的结构类似物[i],易溶于甲醇、丙酮和氯仿等有 机溶剂,难溶于水。
黄曲霉毒素B1_检测与脱毒方法最新研究进展

江苏农业学报(JiangsuJ.ofAgr.Sci.)ꎬ2021ꎬ37(3):789 ̄799http://jsnyxb.jaas.ac.cn孙统政ꎬ王㊀娜ꎬ田㊀俊ꎬ等.黄曲霉毒素B1检测与脱毒方法最新研究进展[J].江苏农业学报ꎬ2021ꎬ37(3):789 ̄799.doi:10.3969/j.issn.1000 ̄4440.2021.03.031黄曲霉毒素B1检测与脱毒方法最新研究进展孙统政ꎬ㊀王㊀娜ꎬ㊀田㊀俊ꎬ㊀杨坤龙(江苏师范大学生命科学学院ꎬ江苏徐州221116)收稿日期:2020 ̄08 ̄28基金项目:国家自然科学基金项目(31900036)ꎻ江苏省自然科学基金项目(BK20190994)ꎻ江苏省高等学校自然科学研究面上项目(19KJB180016)ꎻ江苏师范大学自然科学研究基金项目(18XLRX029)作者简介:孙统政(1999-)ꎬ男ꎬ江苏徐州人ꎬ本科生ꎬ主要从事病原真菌黄曲霉菌的形态发生㊁次级代谢产物合成和致病调控分子机制研究ꎮ(E ̄mail)1756648259@qq.comꎮ王娜为共同第一作者ꎮ通讯作者:杨坤龙ꎬ(E ̄mail)ykl_long@yeah.net㊀㊀摘要:㊀食品和谷物中的黄曲霉毒素污染在全球范围内造成了严重的经济和健康问题ꎮ黄曲霉毒素B1(AFB1)具有极强的致突变性和毒性ꎬ并且对人类和牲畜均具有强致癌性ꎮ有关毒素的脱毒技术一直是国内外的一个研究热点ꎬ其中物理法㊁化学法和生物法脱毒是主要的脱毒方法ꎮ本文结合最新的研究成果ꎬ详细介绍了黄曲霉毒素B1的毒性及主要的检测方法ꎬ对黄曲霉毒素物理㊁化学㊁生物脱毒方法进行了概述ꎮ关键词:㊀黄曲霉毒素B1ꎻ检测方法ꎻ脱毒方法中图分类号:㊀TS201.3㊀㊀㊀文献标识码:㊀A㊀㊀㊀文章编号:㊀1000 ̄4440(2021)03 ̄0789 ̄11ResearchprogressofaflatoxinB1detectionanddetoxificationmethodsSUNTong ̄zhengꎬ㊀WANGNaꎬ㊀TIANJunꎬ㊀YANGKun ̄long(SchoolofLifeSciencesꎬJiangsuNormalUniversityꎬXuzhou221116ꎬChina)㊀㊀Abstract:㊀Aflatoxincontaminationinfoodsandgrainsposesseriouseconomicandhealthproblemsworldwide.Afla ̄toxinB1(AFB1)isextremelymutagenicandtoxicꎬandishighlycarcinogenictohumansandlivestock.Thedetoxificationtechnologyfortoxinshasalwaysbeenaresearchhotspotathomeandabroad.Amongthemꎬphysicalꎬchemicalandbiologi ̄caldetoxificationaremaindetoxificationmethods.BasedonthelatestresearchresultsꎬthisarticleintroducedthetoxicityandmaindetectionmethodsofaflatoxinB1indetailandsummarizedphysicalꎬchemicalandbiologicaldetoxificationmeth ̄odsforaflatoxin.Keywords:㊀aflatoxinB1ꎻdetectionmethodꎻdetoxificationmethod㊀㊀黄曲霉菌(Aspergillusflauvs)是一种世界范围常见的许多重要农作物以及动物的共同致病菌ꎮ黄曲霉菌产生的次级代谢产物黄曲霉毒素B1(AFB1)是目前发现毒性和致癌性最强的天然化合物之一[1]ꎮ黄曲霉菌能够感染许多重要的农作物ꎬ例如ꎬ花生㊁玉米㊁棉花等ꎬ均可对收获前后的农作物进行污染ꎬ给世界各地的农业生产造成巨大的经济损失ꎮ根据联合国粮农组织统计ꎬ每年约有25%的谷物被真菌毒素污染ꎬ其中最主要的就是黄曲霉毒素ꎬ给农业造成了巨大经济损失[2]ꎮ中国同样是黄曲霉毒素污染的重灾区ꎬ多个省份储存的玉米和花生中都检测到了黄曲霉毒素的污染[3 ̄4]ꎬ此外ꎬ在多个抽样的酱油以及水产饲料等加工产品中都检出AFB1[5 ̄6]ꎮ由于黄曲霉毒素B1具有较稳定的理化性质ꎬ很难被降解ꎬ一旦污染的饲料被禽畜食用ꎬAFB1将在动物体内经羟基化代谢形成和AFB1毒性和致癌性基本相似的衍生物AFM1ꎬ一部分的AFB1的衍生物会随尿液和乳汁排出ꎬ而很大一部分会出现在奶制品和肉制品中ꎮ黄曲霉毒素具有较强的毒性㊁诱变性及致癌987性[7]ꎮAFB1是二氢呋喃氧杂萘邻酮的衍生物ꎬ含有一个双呋喃环和一个氧杂萘邻酮[8]ꎬ见图1ꎮAFB1结构中存在3个毒性位点:①呋喃环上的8㊁9位双键ꎬ是毒素与蛋白质和核酸形成复合物的作用位点ꎬ为基因突变以及致癌致畸的主要功能基团ꎻ②内酯环部分的10㊁11㊁15号位点ꎬ易受到水解作用ꎬ因此是较活跃的毒素降解位点ꎻ③环戊烯酮环上的1㊁2㊁3㊁14号位ꎬ该位点易被取代基团取代ꎬ从而也决定了黄曲霉毒素的毒性ꎮ黄曲霉毒素的污染给农牧业生产带来重大的经济损失ꎬ并严重危害人类健康和食品安全ꎬ目前世界卫生组织已将其认定为1A类致癌物ꎬ2017年中国农业农村部也将农产品中黄曲霉毒素的控制技术作为农业主推技术之一ꎮ因此ꎬ研究AFB1的脱毒技术变得尤为重要ꎮ图1㊀黄曲霉毒素B1的化学结构Fig.1㊀ChemicalstructureofaflatoxinB11㊀黄曲霉毒素B1毒性概述1.1㊀AFB1对人类和动物的毒性作用AFB1对人类和几种动物有剧毒ꎬ并具有3个主要特征:亲有机性㊁遗传毒性和致癌性ꎮ它主要对有机体的肝脏亲和并产生损害ꎬ例如肝出血和肝细胞坏死[9]ꎮ遗传毒性主要是诱导AFB1 ̄DNA加合物的形成和代谢形成ABF1环氧化物(ABFO)引起p53基因的热点突变ꎮ虽然部分AFBO会在谷氨酰胺转移酶作用下生成AFB1谷胱氨肽结合物或生成AFB1二氢二醇进一步在醛还原酶作用下生成AFB1二羟醇经肾脏排泄出机体ꎬ但是剩下的大部分AFB1仍然会损害机体ꎬ例如诱导DNA损伤进而引起肝细胞癌变[7]ꎮ临床调查发现ꎬAFB1是乙型肝炎病毒感染患者患肝癌的主要原因ꎮ它是一种遗传毒性肝癌ꎬAFB1通过诱导形成DNA加合物引起癌症ꎬ从而导致靶细胞发生遗传变化ꎬ诱导DNA链断裂和DNA碱基损伤ꎮ氧化损伤最终会导致癌症ꎮAFB1主要通过肝脏代谢ꎬ从食物中摄取的AFB1主要通过细胞色素P450酶代谢为最终致癌物AFB1 ̄8 ̄9 ̄环氧化合物(AFBO)ꎮ当AFBO与DNA反应时ꎬ它通过与鸟嘌呤碱基相互作用而抑制p53(外显子249的热点编码区)中的基因突变ꎬ这可能会导致肝细胞癌变ꎮAFB1通过P450系统代谢为许多羟基化产物ꎬ包括AFM1㊁AFQ1㊁AFP1㊁AFB2a[7]ꎮ黄曲霉毒素被摄入人体后ꎬ主要的中毒表现为急性中毒和慢性中毒ꎬ急性中毒发作通常由于高浓度的黄曲霉毒素摄入ꎮAFB1在人体中的转化途径如图2所示ꎮ1.2㊀AFB1对儿童生长发育的影响生长障碍或发育迟缓是一个重大的公共卫生问题ꎬ影响到全世界数以百万计的儿童ꎬ特别是在发展中国家ꎮ一项对125名肯尼亚孕妇的调查结果表明ꎬ有53%的孕妇血液中黄曲霉毒素生物标志物为阳性ꎬ而脐带血中标志物阳性率为37%ꎬ研究还发现黄曲霉毒素阳性的孕妇生产的新生儿体质量明显降低ꎬ另外ꎬ研究期间发生的2个死胎仅来自AFB1阳性孕妇[10]ꎮGong等[11]发现研究地区的479名儿童中有99%的儿童为AFB1 ̄白蛋白阳性ꎬ断奶后儿童阳性水平更高ꎬ此外ꎬ发育不良的儿童的AFB1 ̄白蛋白水平与身高和体质量之间呈显著负相关ꎬ断奶的儿童中AFB1 ̄白蛋白水平高于仍在接受母乳的孩子(断奶后饮食主要以玉米为主)ꎬAFB1 ̄白蛋白水平较高的儿童身高平均下降了1 7cmꎮ这些研究结果表明ꎬ胎儿和新生儿暴露于AFB1会对身体生长有显著影响ꎬ尤其在断奶后阶段ꎮ1.3㊀免疫抑制动物中的研究结果显示AFB1具有诱导免疫抑制的作用ꎮ例如ꎬ在暴露于AFB1的动物模型中发现ꎬB细胞和T细胞的活性降低了ꎬT细胞对AFB1毒性更敏感[12]ꎮ在黄曲霉菌引起的曲霉病中ꎬ鸡的吞噬细胞受到严重破坏ꎬ从循环中清除异物的能力下降ꎬ这可能会降低加工抗原成分的能力[13]ꎮ同样在暴露于AFB1的猪体内ꎬAFB1会降低淋巴细胞对有丝分裂原的反应ꎬ抑制大噬菌体迁移并延迟皮肤过敏反应[13]ꎮ尽管从动物研究中获得了许多有关AFB1影响免疫作用的数据ꎬ但是关于长期食用被097江苏农业学报㊀2021年第37卷第3期图2㊀黄曲霉毒素B1的生物转移途径Fig.2㊀BiotransformationpathwaysofaflatoxinB1AFB1污染的食物对人体免疫系统影响的数据很少ꎮ冈比亚儿童唾液中sIgA水平降低ꎬ可能是由于饮食中黄曲霉毒素的暴露水平较高[14]ꎮ在对64位加纳人的研究中ꎬ发现AFB1暴露可能导致淋巴细胞亚群的主要成分T细胞和B细胞减少ꎬ与低水平的AFB1白蛋白加合物相比ꎬ高水平的AFB1白蛋白加合物能显著降低CD8+细胞毒性T细胞中穿孔素和颗粒酶a水平[15]ꎮ在AFB1水平高的受试者中ꎬ这些免疫参数的改变可能导致细胞免疫功能受损ꎬ从而降低宿主对感染的抵抗力ꎮ2㊀黄曲霉毒素B1检测方法高效液相色谱法㊁薄层色谱法和液相色谱质谱法是过去几十年测定AFB1含量的常规分析方法[16]ꎬ这些分析方法具有很高的灵敏度和良好的重复性ꎬ但样品处理繁琐ꎬ需要昂贵的仪器和专业人员ꎬ很大程度上限制了其在AFB1快速检测和现场筛选中的应用[17]ꎮ近年来以适配体和新型纳米材料为基础的检测传感器因具备灵敏度高㊁检出限低㊁成本低和操作简单等优势ꎬ在AFB1等毒素检测中得到了广泛应用ꎮ此外ꎬ目前也开发出通过引入基于适配子的不同技术ꎬ例如电化学[18]㊁表面等离子体共振[19]和比色法[20]来检测AFB1ꎮ2.1㊀双真菌毒素比色生物传感器比色生物传感器基于浓度信息转换为颜色变化的比色ꎬ可用肉眼进行分辨而达到检测目的ꎬ具有低成本㊁便携性㊁易操作性等优点ꎬ已广泛应用于霉菌毒素检测ꎮ目前比色测定多集中应用在单一霉菌毒素的检测[21]ꎬ关于同时检测多种霉菌毒素的报道较少ꎮZhu等[22]开发了一种同时检测双霉菌毒素的生物传感器ꎬ首次实现了针对AFB1和赭曲霉毒素(OTA)2种霉菌毒素的双重目标检测ꎮ该双霉菌毒素检测的工作原理为:将Fe3O4/GO和TP ̄GO(TP为百里酚酞ꎬGO为氧化石墨烯)分别与不同的AFB1的半互补链结合ꎬ然后加入AFB1适体并组装形成AFB1检测复合体(图3A)ꎻ同样ꎬFe3O4@Au和AuNPs(金纳米颗粒)也与OTA的半互补链和适体结合形成OTA检测复合体(图3B)ꎻ当AFB1和OTA存在时ꎬ因适体和靶标之间的亲和力强于半互补链ꎬ两个检测复合体都将解离ꎬ磁超螺旋离心分离后ꎬ提取上清液进行反应ꎬ并根据相应溶液在不同pH值下的颜色变化确定AFB1和OTA的量(图3C)ꎮ由于反应条件的不同ꎬ两种传感方法互不干扰ꎬ甚至可以提供更高的检测效率ꎮ双真菌毒素比色生物传感器具有良好的检测性能ꎬ线性范围为AFB15~250ng/ml和OTA0.5~80 0ng/mlꎬ具有良好的重现性和选择性ꎬ在微生物和环境领域具有广阔的应用前景ꎮ2.2㊀刺激响应型水凝胶生物传感器由于适配体具有稳定性好㊁便携性㊁易于存储和高特异性等特点ꎬDNA/适体交联的DNA聚合物杂197孙统政等:黄曲霉毒素B1检测与脱毒方法最新研究进展A:TP ̄DNA1 ̄GO ̄AFB1适体 ̄DNA2 ̄Fe3O4/GO的组装ꎻB:AuNPs ̄OTA适体 ̄Fe3O4@Au ̄COTA适体纳米颗粒组装ꎮ图片参考自文献[22]ꎮ图3㊀基于比色生物传感器的黄曲霉素B1(AFB1)和赭曲霉毒素(OTA)检测的工作原理Fig.3㊀WorkingprincipleforaflatoxinB1(AFB1)andochratoxin(OTA)detectionbasedoncolorimetricbiosensor化刺激响应水凝胶引起了广泛的关注[23]ꎮTang等[24]在一项研究中ꎬ设计了一种简单的AFB1检测方法ꎬ结合了基于适体的靶标刺激反应水凝胶系统的多功能性以及使用电子天平作为读数的便利性ꎬ以线性透明质酸接枝的单链DNA复合物作为主链ꎬAFB1适体和聚乙烯亚胺作为交联剂ꎬ构建了AFB1靶标响应性双交联水凝胶ꎮ铂纳米颗粒(PtNPs)首先被嵌入水凝胶中ꎬAFB1的存在可以提高亲和力与适体结合ꎬ并导致适体从水凝胶中释放ꎮ通过添加DNA外切酶I(ExoI)可特异性识别并切割AFB1中的适体 ̄适体复合物ꎬ导致AFB1释放ꎻAFB1再次与水凝胶反应ꎬ导致水凝胶适体再次释放ꎬ从而实现目标循环ꎮ通过这种方式ꎬ水凝胶将崩溃ꎬ并使大量的PtNP释放ꎮ释放的PtNP与排水装置中的H2O2反应ꎬ在内部和外部之间产生压力差ꎬ从而排出水ꎬ并且水的质量可以通过简单的电子天平准确称量ꎮ该方法已用于花生样品中AFB1的检测[24]ꎬ在新鲜花生样品中未检测到AFB1ꎬ但在发霉的花生样品中检测到约33 16μg/kgAFB1ꎬAFB1的回收率在91 5%至98 1%之间ꎬ结果与AFB1酶联免疫分297江苏农业学报㊀2021年第37卷第3期析试剂盒的检测结果[92 8%至97 7%(LOD:1μg/kg)]基本一致ꎬ证明了使用该传感器检测食品样品中AFB1的可行性ꎮ2.3㊀新型荧光适配体传感器近年来ꎬ金纳米星(AuNSs)因具有特殊的多支化纳米结构ꎬ且有一个易于修饰和固定材料的中心核ꎬ应用范围广泛ꎮZheng等[18]成功地开发了一种新型的适体传感器ꎬ用于基于量子点和AuNSs的荧光定量猝灭剂纳米和智能手机光谱读取器的多农药实时定量ꎮWei等[25]以AuNSs作为荧光猝灭材料ꎬ制造了用于AFB1检测的简单新颖的FRET系统ꎮ由于适体的荧光标记会影响适体与其靶标的结合亲和力[25 ̄26]ꎬ因此ꎬ将合成羧基荧光素(FAM)标记的具有发夹结构的互补DNA设计为信号探针ꎮAuN ̄Ss不仅固定了大量的信号探针ꎬ而且由于其特殊的结构和出色的光学性能ꎬ还可以用作淬灭材料ꎮFAM标记的发夹结构(HP)与AFB1杂交适体形成双链DNAꎬ发夹结构被打开ꎮ当通过Bio ̄SA特异性结合在AuNSs的表面修饰双链DNA时ꎬFAM离AuNSs很远ꎬ导致淬灭效率低和荧光强度强ꎮ当AFB1存在时ꎬAFB1优先结合适体ꎬ导致双链DNA的崩解ꎮFAM标记的HP恢复发夹结构ꎬ使FAM接近AuNSsꎬ并降低荧光强度(图4)ꎮ新型荧光适配体传感器对玉米样品中AFB1的最低检出限为21 3pg/mlꎬ证明新型荧光适配体传感器的AFB1检测试验获得满意结果ꎬ并且在存在其他高浓度毒素的情况下也表现出良好的选择性ꎮ图片参考自文献[25]ꎮ图4㊀基于金纳米星/羧荧光素标记发夹/适体的AFB1荧光检测示意图Fig.4㊀SchematicdiagramforfluorescentdetectionofAFB1basedonAuNSs/carboxyfluorescein ̄labeledhairpin/aptamer3㊀黄曲霉毒素B1脱毒方法由于食品中黄曲霉毒素的污染对人类健康构成威胁ꎬ并造成严重的经济损失ꎬ因此开发高效㊁安全的AFB1脱毒方法具有重要意义ꎮ目前对真菌毒素的脱毒主要有2种策略:(1)防止霉菌污染和生长ꎻ(2)污染产品脱毒ꎮ常用的脱毒方法包括物理方法㊁化学方法和生物方法ꎮ3.1㊀物理方法3.1.1㊀加热脱毒㊀从食品中去除AFB1的物理方法最常见的是加热ꎮ众所周知ꎬ黄曲霉毒素在高温下稳定ꎬ因此需要苛刻的加热才能有效地去除黄曲霉毒素ꎮ最近的研究结果表明ꎬ在150~200ħ的温度下可以去除大量的AFB1(平均降低79%)ꎬ同时在高湿度下最为有效[27 ̄28]ꎮ该方法的问题是在加热和烘烤完成之后难以确保产品的完整性ꎬ从而会限制可以使用的最高温度ꎬ可能仅导致部分的AFB1分解ꎮ然而ꎬ该技术可以容易地以低成本实施ꎬ并且可以在2h或更短时间内实施ꎬ从而具有物流优势ꎮ3.1.2㊀γ射线脱毒㊀另一种最常用的物理净化方法是γ射线脱毒ꎬ可用于花生㊁谷物和动物饲料等多种食品基质ꎮ该技术为用γ射线源(例如60Co)辐照食品ꎬ直到获得一定量的电离辐射为止ꎬ电离辐射的范围为6~60kGyꎮAFB1含量平均降低65%[29]ꎮ使用强辐射存397孙统政等:黄曲霉毒素B1检测与脱毒方法最新研究进展在安全问题ꎬ可能使实施这项技术变得困难ꎮ3.1.3㊀吸附剂脱毒㊀在食品中添加吸附剂也可有效去除AFB1污染ꎮ此方法与降解方法不同ꎬ它不破坏㊁不减少食品中AFB1的量ꎮ吸附剂与AFB1结合可防止摄入后AFB1被肠道吸收ꎬ从而防止AFB1的肝毒性作用ꎮ(1)叶绿素对AFB1的吸附ꎮSimonich等[30]报道了在向受AFB1污染的饲料中添加叶绿素后ꎬ大鼠的AFB1 ̄DNA加合物减少了42%ꎬAFB1 ̄白蛋白减少了65%ꎬ肿瘤发生率降低了77%ꎮ一项使用人类志愿者的研究中也发现ꎬ叶绿素可将尿中AFM1水平降低28%ꎬ尿中AFB1水平降低41%[31]ꎮ这些数据表明ꎬ在高风险地区的饮食中添加吸附剂可能有助于减轻AFB1的毒性作用ꎮ(2)氧化磁性石墨烯(MGO)和磁性石墨烯(Mr ̄GO)的纳米材料对AFB1的吸附ꎮ磁性复合材料的孔径分布均匀ꎬ孔连通性好ꎬ表面积大ꎬ是吸附有机污染物的优秀吸附剂ꎮJi等[32]研究结果显示ꎬMGO和MrGO都能够在40min内移除AFB1ꎬ对于受污染的油样ꎬMGO将AFB1从16 1μg/L降低至2 2μg/Lꎬ去除率为86 33%ꎬ当吸附剂量为20mg/ml时最大去除率达到96 4%ꎮ磁性复合吸附剂在AFB1脱毒中的应用ꎬ可能为食用油工业开发新型复合吸附剂开辟一条新道路ꎮ(3)黏土对AFB1的吸附ꎮ与叶绿素相似ꎬ黏土可在消化道中结合AFB1并防止肠道吸收AFB1ꎮ钙蒙脱土(NovaSil)是目前被证明有效的吸附剂黏土ꎬ它可以显著减少AFB1生物标志物的毒性作用[33]ꎮAfriyie ̄Gyawu等进行了一项长期研究ꎬ发现在28周内给大鼠喂食NovaSil含量高达2 0%的饮食后ꎬ未观察到NovaSil具有明显的毒性[34]ꎮ此外ꎬ临床试验也证实ꎬNovaSil不仅能够明显降低参与者的尿AFM1和血清AFB1含量ꎬ而且具有较小的副作用[35]ꎮ这些结果表明ꎬ在饮食中添加NovaSil是降低AFB1毒性的安全有效方法ꎮ3.2 化学方法3.2.1㊀山梨酸钾㊁水合铝硅酸钠钙㊁L ̄蛋氨酸组合法㊀山梨酸钾(Sor)是一种有效的食品防腐剂ꎬ用于控制各种加工食品中霉菌的生长[36]ꎮ蛋氨酸(LM)是一种必需氨基酸ꎬ作为谷胱甘肽前体ꎬ可消除活性氧和DNA甲基化反应[37]ꎮ目前研究发现蛋氨酸有助于抗体的产生并改善血清中IgG水平[38]ꎮ因此ꎬ在AFB1污染的饮食中添加蛋氨酸可降低AFB1对动物的危害[39]ꎮ水合硅铝酸钠钙(Hsc)是一种化学吸附性物质ꎬ可以与AFB1形成稳定而牢固的复合物ꎬ以减少动物在消化和利用饲料过程中AFB1造成的不良影响ꎬ并且复合物还可以减弱AFB1对身体器官的毒性[40]ꎮReda等[41]发现在饲料中添加山梨酸钾(Sor)㊁水合铝硅酸钠钙(Hsc)和L ̄蛋氨酸(LM)的混合物能够有效提高兔抗AFB1毒性的能力ꎮ3.2.2㊀ClO2熏蒸法㊀二氧化氯(ClO2)是一种具有广泛且稳定的杀生物活性的强氧化剂和消毒剂ꎬ被用作水㊁水果和蔬菜的消毒剂ꎬ已经被联合国粮食及农业组织(FAO)分类为的食品添加剂ꎮClO2能够作用于AFB1毒性和致癌活性的关键活性位点 AFB1呋喃环的C8 ̄C9双键ꎮClO2将AFB1分解为4种物质:C17H13O8㊁C16H15O10㊁C17H15O10和C16H11O7ꎮ如图5所示ꎬ这4个降解产物的C8 ̄C9双键已被ClO2破坏ꎬ从而使经过修饰的AFB1降解产物的毒性大大降低甚至消失[42]ꎮYu等研究发现ꎬClO2气体可以抑制黄曲霉菌菌丝生长㊁孢子萌发和产生AFB1ꎮ随着ClO2浓度的增加ꎬAFB1的降解率也随之提高ꎬ而且AFB1的降解明显加快[42]ꎮ之前的研究者发现氯和次氯酸钠的氯化消毒剂能有效降解食品中的AFB1[43]ꎬ但是氯处理产生的化学残留物限制了其应用ꎬ并且作为液体消毒剂ꎬ次氯酸钠不适用于干物质(如谷物)脱毒ꎮ3.2.3㊀壳聚糖包被α ̄松油醇法㊀壳聚糖广泛用于包被生物材料ꎬ将某些化合物封装在壳聚糖纳米基质中可以增强其在保护食品中免受微生物污染的功效和稳定性ꎬ从而延长其货架寿命[44]ꎮα ̄松油醇是一种单萜醇ꎬ已在食品工业中广泛用作调味剂和熏蒸剂ꎬ用来保护食品免受微生物和昆虫的污染ꎮ此外它还具有广泛的药理特性ꎬ例如抗癌㊁抗炎和抗氧化[45]ꎮ将α ̄松油醇包被在壳聚糖中制成一种壳聚糖纳米乳液(α ̄TCsNe)ꎬ可用作新型抗真菌防腐剂增强α ̄松油醇的杀菌作用从而抑制AFB1的形成ꎮα ̄TCsNe的活性增强可能是由于α ̄松油醇的抗微生物活性与壳聚糖之间的协同作用所致ꎮ此外ꎬ纳米封装后的小粒径大表面积很容易穿透处理过的细胞ꎬ并干扰真菌细胞利用必需化合物ꎬ从而致其死亡[46]ꎮ该方法经济㊁方便㊁无毒㊁可控㊁无溶剂ꎬ这种方法对操作条件要求低ꎬ适用于亲水性和亲脂性化合物ꎬ用于配制稳定的纳米乳液[47]ꎮ497江苏农业学报㊀2021年第37卷第3期图片参考自文献[42]ꎮ图5㊀AFB1的4种降解产物结构Fig.5㊀StructureoffourdegradationproductsofAFB13.3㊀生物方法3.3.1㊀植物提取物降解㊀植物精油(EOs)具有显著的抗菌功效ꎬ因此作为健康危害性合成防腐剂的替代品具有巨大潜力ꎬ但其尚未被食品工业广泛使用ꎮ研究发现鸭嘴花和柠檬桉的提取物均有超过95%的AFB1降解率[48]ꎮYadav等[49 ̄50]发现0 3μl/ml壳聚糖包被的黑孜然精油可完全抑制黄曲霉菌生长和AFB1产生ꎬ壳聚糖包被的肉豆蔻精油在1 25μl/ml时便可以完全抑制AFB1产生ꎬ都具有很强的自由基清除活性ꎮPrakash等对马郁兰㊁芫荽㊁草果药㊁没药和香水树5种植物提取精油的抑菌㊁杀菌和对粮食的菌染防护率进行了研究ꎬ结果见表1[51]ꎮ表1㊀植物精油对黄曲霉产毒菌株的最低抑菌浓度㊁最低杀真菌浓度和对粮食的菌染防护率Table1㊀Minimuminhibitoryconcentrationꎬminimumfungicidalconcentrationofplantessentialoilagainsttoxin ̄produ ̄cingstrainsofAspergillusflavusandtheprotectionrateofgrainsagainstbacterialcontamination精油样品最小抑菌体积分数(μl/ml)最小杀菌体积分数(μl/ml)菌染防护率(%)香水树2.05.077.38芫荽3.0未知65.48草果药2.56.072.02马郁兰2.5-67.86没药3.07.055.363.3.2㊀益生菌抑制㊀利用微生物ꎬ特别是具有益生菌性质的微生物用于AFB1脱毒ꎬ是一种绿色高效㊁环保㊁廉价和安全的策略ꎮ不同类型的益生菌脱毒方式不同ꎬ有的将AFB1改造成其他无毒或低毒的次级产物或异构体ꎬ以达到消除食品和饲料中AFB1的目的ꎮ最新的益生菌脱毒研究成果如表2所示ꎮYang等[52]近期研究发现ꎬ利用米曲霉菌或者不产黄曲霉毒素的黄曲霉菌突变体可以抑制黄曲霉菌的生长和毒素的合成ꎮXing等早期也运用黑曲霉菌来拮抗黄曲霉菌ꎬ从花生中分离到20株黑曲霉菌ꎬ20个黄曲霉毒素生物合成基因中有19个被黑曲霉菌下调[53]ꎮ因此ꎬ利用不产毒的黄曲霉菌或者安全的曲霉工业用菌可以有效地对产毒黄曲霉菌进行生物防治ꎬ可减少产毒黄曲霉菌对许多农产品的侵染及合成毒素ꎬ达到提前防控并减少经济损失的作用[54]ꎮ3.3.3㊀基因水平调控㊀基因水平调控是指在基因转录或翻译水平上ꎬ利用一些综合性方法处理黄曲霉菌ꎬ使黄曲霉菌的某些产毒基因被抑制甚至阻断或下调黄曲霉菌生命活动的必须基因ꎬ从而限制AFB1合成所必需的蛋白质㊁酶和化学物质的形成ꎬ甚至杀死黄曲霉菌ꎮ黄曲霉毒素合成基因簇如图6所示ꎮDhanamjayulu等[55]使用苯并咪唑及其衍生物下调黄曲霉菌的AFB1合成基因中的调控基因aflR597孙统政等:黄曲霉毒素B1检测与脱毒方法最新研究进展和结构基因aflB表达ꎬ有效抑制AFB1的生物合成ꎬ仅10μg/ml的质量浓度抑制效率便达到了98%ꎬ但是并不影响黄曲霉菌的正常生长ꎮCasquete等[56]利用pH㊁水分活度和温度对2个调节基因(aflR和aflS)和1个结构基因(aflP)表达的进行了研究ꎬ结果表明在pH5 5㊁水分活度0 95和20~25ħ时基因具有最高表达水平和AFB1积累量ꎮXing等[53]利用黑曲霉菌拮抗黄曲霉菌ꎬ发现aflS的表达显著下调ꎬ导致aflS/AflR比值降低ꎬ表明黑曲霉菌可通过降低aflS的丰度而直接抑制AFB1的生物合成ꎮ近期ꎬChen等[57]从Bacillusmegaterium中分离出的短肽L ̄Asp ̄L ̄Asn(DN)可以有效抑制黄曲霉菌的生长ꎮ表2㊀益生菌对黄曲霉毒素的生物脱毒Table2㊀Biologicaldetoxificationofprobioticstoaflatoxin益生菌㊀㊀㊀㊀㊀排毒机理最小杀菌体积分数(μl/ml)生物脱毒率(%)参考文献枯草芽孢杆菌UTBSP1降解未知90.2ʃ5.2[58]嗜酸链球菌CW117降解591.2[59]植物乳杆菌MON03结合5054.3ʃ7.3㊁82.3ʃ8.3㊁39.8ʃ0.4[60]植物乳杆菌C88结合257.6ꎻ59.4[61]克氏乳杆菌KFLM382%吸附182.0[62]啤酒酵母KFGY718%生物转化74.0糖醋杆菌KFGM165.0嗜酸乳杆菌结合50.0[63]短乳杆菌28.0鼠李糖乳杆菌2012结合183.5[64]植物唇形LOCK0862结合10065.0[65]短杆菌LOCK109360.0鼠李糖鼠李LOCK108759.0罗伊氏杆菌LOCK109659.0干酪杆菌LOCK091149.0链霉菌亚种AsoensisK234降解188.3[66]黄褐链霉菌K144rimosus95.6金丝链霉菌K14579.9地衣芽孢杆菌CFR1降解94.7ʃ1.1[67]图6㊀黄曲霉毒素合成基因簇Fig.6㊀Biosynthesisgeneclusterofaflatoxin4㊀结语黄曲霉毒素B1是目前发现毒性和致癌性最强的天然污染物之一ꎬ对人类和动物健康安全存在潜在威胁ꎮ因此对黄曲霉菌和黄曲霉毒素的研究也成为近几十年来国内外同行研究的热点ꎮ本文主要综697江苏农业学报㊀2021年第37卷第3期述了AFB1的毒性ꎬ以及近年来AFB1检测和脱毒方法ꎮ由于AFB1的低剂量㊁高毒特性ꎬ开发出更灵敏㊁更快速㊁更经济的检测手段是新的趋势和挑战ꎮ尽管目前已有多种AFB1脱毒方法ꎬ但是每种方法都有各自的优点和缺陷ꎬ很难做到既能保障脱毒食品的风味品质ꎬ又能确保食品安全ꎮ对于黄曲霉毒素的防范应早发现ꎬAFB1一旦进入后期的食品加工链ꎬ即使脱毒技术再成熟也会带来健康威胁ꎮ因此对黄曲霉毒素的早期检测以及消除其在农作物收获前后的污染对黄曲霉毒素的预防具有重要意义ꎮ参考文献:[1]㊀刘㊀畅ꎬ刘㊀阳ꎬ邢福国.黄曲霉毒素生物学脱毒方法研究进展[J].食品科技ꎬ2010ꎬ35(5):290 ̄293.[2]㊀AMAIKESꎬKELLERNP.Aspergillusflavus[J].AnnuRevPhy ̄topatholꎬ2011ꎬ49:107 ̄133.[3]㊀DINGNꎬXINGFꎬLIUXꎬetal.Variationinfungalmicrobiome(mycobiome)andaflatoxininstoredin ̄shellpeanutsatfourdif ̄ferentareasofChina[J].FrontMicrobiolꎬ2015ꎬ6:1055. [4]㊀ZHANGSꎬWANGHꎬYANGMꎬetal.VersicolorinAisapoten ̄tialindicatorofaflatoxincontaminationinthegranary ̄storedcorn[J].FoodAdditives&Contaminants:PartAꎬ2018ꎬ35(5):972 ̄984.[5]㊀张自强ꎬ柏㊀凡ꎬ张克英ꎬ等.我国饲料中黄曲霉毒素B1污染的分布规律研究[J].中国畜牧杂志ꎬ2009ꎬ45(12):27 ̄30. [6]㊀李㊀江ꎬ李晓明ꎬ綦㊀艳ꎬ等.酶联免疫法检测酱油中的黄曲霉毒素B1[J].食品安全质量检测学报ꎬ2016ꎬ7(12):4735 ̄4739.[7]㊀ABRARMꎬANJUMFMꎬBUTTMSꎬetal.Aflatoxins:biosyn ̄thesisꎬoccurrenceꎬtoxicityꎬandremedies[J].CritRevFoodSciNutrꎬ2013ꎬ53(8):862 ̄874.[8]㊀宋承钢ꎬ王彦多ꎬ杨㊀健ꎬ等.黄曲霉毒素脱毒研究进展[J].食品安全质量检测报ꎬ2020ꎬ11(12):3945 ̄3957. [9]㊀MAGNUSSENAꎬPARSIMA.Aflatoxinsꎬhepatocellularcarcino ̄maandpublichealth[J].WorldJGastroenterol.2013ꎬ19(10):1508 ̄1512.[10]WALKERAꎬHALLINGERP.Schoolleadershipforlearningandchange:Progressofanasianagenda[M]//JOHNSONGꎬDEMP ̄STERN.LeadershipinDiverseLearningContexts.Cham:Spring ̄erInternationalPublishingꎬ2016:145 ̄171.[11]GONGYꎬHOUNSAAꎬEGALSꎬetal.Postweaningexposuretoaflatoxinresultsinimpairedchildgrowth:alongitudinalstudyinBeninꎬWestAfrica[J].EnvironHealthPerspectꎬ2004ꎬ112(13):1334 ̄1338.[12]WANGFꎬZUOZꎬCHENKꎬetal.SeleniumrescuesaflatoxinB1 ̄inhibitedTcellsubsetsandcytokinelevelsincecaltonsilofchickens[J].BiolTraceElemResꎬ2019ꎬ188(2):461 ̄467. [13]PENGXꎬZHANGKꎬBAISꎬetal.Histologicallesionsꎬcellcy ̄clearrestꎬapoptosisandTcellsubsetschangesofspleeninchick ̄enfedaflatoxin ̄contaminatedcorn[J].IntJEnvironResPublicHealthꎬ2014ꎬ11(8):8567 ̄8580.[14]TURNERPCꎬMOORESEꎬHALLAJꎬetal.ModificationofimmunefunctionthroughexposuretodietaryaflatoxininGambianchildren[J].EnvironHealthPerspectꎬ2003ꎬ111(2):217 ̄220. [15]SUQY.ThetoxificationanddetoxificationmechanismsofaflatoxinB1inhuman:Anupdate[M]//XIDL.AflatoxinB1occur ̄renceꎬdetectionandtoxicologicaleffects.Rijeka:IntechOpenꎬ2020:89221.[16]LIZBꎬXUENꎬMAHYꎬetal.Anultrasensitiveandswitch ̄onplatformforaflatoxinB1detectioninpeanutbasedonthefluores ̄cencequenchingofgrapheneoxide ̄goldnanocomposites[J].Ta ̄lantaꎬ2018ꎬ181:346 ̄351.[17]ABNOUSAKꎬDANESHNMꎬALIBOLANDIMꎬetal.Anewamplifiedπ ̄shapeelectrochemicalaptasensorforultrasensitivede ̄tectionofaflatoxinB1[J].BiosensBioelectronꎬ2017ꎬ94:374 ̄379.[18]ZHENGWLꎬTENGJꎬCHENGLꎬetal.Hetero ̄enzyme ̄basedtwo ̄roundsignalamplificationstrategyfortracedetectionofafla ̄toxinB1usinganelectrochemicalaptasensor[J].BiosensBioelec ̄tronꎬ2016ꎬ80:574 ̄581.[19]YANGMXꎬLIUGKꎬCHENHMꎬetal.AuniversalSERSaptasensorbasedonDTNBlabeledGNTs/Agcore ̄shellnanotrian ̄gleandCS ̄Fe3O4magnetic ̄beadtracedetectionofAflatoxinB1[J].AnalChimActaꎬ2017ꎬ986:122 ̄130.[20]CHENJꎬWENJꎬZHUANGL.Anenzyme ̄freecatalyticDNAcir ̄cuitforamplifieddetectionofaflatoxinB1usinggoldnanoparticlesascolorimetricindicators[J].Nanoscaleꎬ2016ꎬ8(18):9791 ̄9797.[21]WANGCꎬQIANJꎬWANGKꎬetal.ColorimetricaptasensingofochratoxinAusingAu@Fe3O4nanoparticlesassignalindicatorandmagneticseparator[J].BiosensorsandBioelectronicsꎬ2016ꎬ77:1183 ̄1191.[22]ZHUWꎬLILBꎬZHOUZꎬetal.Acolorimetricbiosensorforsim ̄ultaneousochratoxinAandaflatoxinsB1detectioninagriculturalproducts[J].FoodChemistryꎬ2020ꎬ319:126544.[23]VERMONDENTꎬCENSIRꎬHENNINKWE.Hydrogelsforpro ̄teindelivery[J].ChemRevꎬ2012ꎬ112(5):2853 ̄2888. [24]TANGLꎬHUANGYꎬLINCꎬetal.HighlysensitiveandselectiveaflatoxinB1biosensorbasedonExonucleaseI ̄catalyzedtargetre ̄cyclingamplificationandtargetedresponseaptamer ̄crosslinkedhy ̄drogelusingelectronicbalancesasareadout[J].Talantaꎬ2020ꎬ214:120862.[25]WEIMꎬZHAOFꎬXIEY.Anovelgoldnanostars ̄basedfluores ̄centaptasensorforaflatoxinB1detection[J].Talantaꎬ2020ꎬ209:120599.[26]LVLꎬLIDꎬLIURꎬetal.Label ̄freeaptasensorforochratoxinAdetectionusingSYBRGoldasaprobe[J].SensActuatorsBChemꎬ2017ꎬ246:647 ̄652.797孙统政等:黄曲霉毒素B1检测与脱毒方法最新研究进展[27]ARZANDEHSꎬJINAPS.Effectofinitialaflatoxinconcentrationꎬheatingtimeandroastingtemperatureonaflatoxinreductionincon ̄taminatedpeanutsandprocessoptimisationusingresponsesurfacemodelling[J].IntJFoodSciTechnolꎬ2011ꎬ46:485 ̄491. [28]ZHENGHꎬWEISꎬXUYꎬetal.ReductionofaflatoxinB1inpeanutmealbyextrusioncooking[J].LWT ̄FoodScienceandTechnologyꎬ2015ꎬ64(2):515 ̄519.[29]MOHAMEDNFꎬEL ̄DINERSSꎬKOTBMAMꎬetal.Assess ̄ingthepossibleeffectofgammairradiationonthereductionofafla ̄toxinB1ꎬandonthemoisturecontentinsomecerealgrains[J].AmericanJournalofBiomedicalSciencesꎬ2015(7):33 ̄39. [30]SIMONICHMTꎬEGNERPAꎬROEBUCKBDꎬetal.NaturalchlorophyllinhibitsaflatoxinB1 ̄inducedmulti ̄organcarcinogen ̄esisintherat[J].Carcinogenesisꎬ2007ꎬ28(6):1294 ̄1302. [31]RUSHINGBRꎬSELIMMI.AflatoxinB1:Areviewonmetabo ̄lismꎬtoxicityꎬoccurrenceinfoodꎬoccupationalexposureꎬandde ̄toxificationmethods[J].FoodandChemicalToxicologyꎬ2019ꎬ124:81 ̄100.[32]JIJꎬXIEW.DetoxificationofaflatoxinB1bymagneticgraphenecompositeadsorbentsfromcontaminatedoils[J].JournalofHaz ̄ardousMaterialsꎬ2020ꎬ381:120915.[33]PHILLIPSTDꎬAFRIYIE ̄GYAWUEꎬWILLIAMSJꎬetal.Re ̄ducinghumanexposuretoaflatoxinthroughtheuseofclay:Are ̄view[J].FoodAdditives&Contaminants:PartAꎬ2008ꎬ25(2):134 ̄145.[34]AFRIYIE ̄GYAWUEꎬMACKIEJꎬDASHBꎬetal.Chronictoxi ̄cologicalevaluationofdietaryNovaSilClayinSprague ̄Dawleyrats[J].FoodAdditives&Contaminantsꎬ2005ꎬ22(3):259 ̄269. [35]WANGPꎬAFRIYIE ̄GYAWUEꎬTANGYꎬetal.NovaSilclayinterventioninGhanaiansathighriskforaflatoxicosis:II.Reduc ̄tioninbiomarkersofaflatoxinexposureinbloodandurine[J].FoodAdditives&Contaminants:PartAꎬ2008ꎬ25(5):622 ̄634. [36]FERRANDCꎬMARCFꎬFRITSCHPꎬetal.Genotoxicitystudyofreactionproductsofsorbicacid[J].JournalofAgricultureandFoodChemistryꎬ2000ꎬ48(8):3605 ̄3610.[37]ALAGAWANYMꎬABDEMꎬARIFMꎬetal.Individualandcombinedeffectsofcrudeproteinꎬmethionineꎬandprobioticlevelsonlayinghenproductiveperformanceandnitrogenpollutioninthemanure[J].EnvironmentalScienceandPollutionResearchꎬ2016ꎬ23(22):22906 ̄22913.[38]SWAINBKꎬJOHRITS.Effectofsupplementalmethionineꎬcho ̄lineandtheircombinationsontheperformanceandimmunere ̄sponseofbroilers[J].BritishPoultryScienceꎬ2000ꎬ41(1):83 ̄88.[39]ELNESRSSꎬELWANHAMꎬXUQQꎬetal.Effectsofinovoinjectionofsulfur‐containingaminoacidsonheatshockprotein70ꎬcorticosteronehormoneꎬantioxidantindicesꎬandlipidprofileofnewlyhatchedbroilerchicksexposedtoheatstressduringincu ̄bation[J].PoultryScienceꎬ2019ꎬ98(5):2290 ̄2298. [40]SCHEIDELERSE.EffectsofvarioustypesofaluminosilicatesandaflatoxinB1onaflatoxintoxicityꎬchickperformanceꎬandmineralstatus[J].PoultryScienceꎬ1993ꎬ72(2):282 ̄288.[41]REDAFMꎬISMAILIEꎬELMEKKAWYMMꎬetal.Dietarysupplementationofpotassiumsorbateꎬhydratedsodiumcalciumal ̄muniosilicateandmethionineenhancesgrowthꎬantioxidantstatusandimmunityingrowingrabbitsexposedtoaflatoxinB1inthediet[J].JournalofAnimalPhysiologyandAnimalNutritionꎬ2019ꎬ104(1):196 ̄203.[42]YUYꎬSHIJꎬXIEBꎬetal.DetoxificationofaflatoxinB1incornbychlorinedioxidegas[J].FoodChemistryꎬ2020ꎬ328:127121. [43]SHIHUꎬSTROSHINERLꎬILELEJIK.Determinationoftherel ̄ativeeffectivenessoffourfoodadditivesindegradingaflatoxinindistillerswetgrainsandcondenseddistillerssolubles[J].JournalofFoodProtectionꎬ2017ꎬ80(1):90 ̄95.[44]KUMARCAꎬSINGHAꎬKUMARSVꎬetal.Assessmentofchi ̄tosanbiopolymerencapsulatedα ̄Terpineolagainstfungalꎬaflatox ̄inB1(AFB1)andfreeradicalsmediateddeteriorationofstoredmaizeandpossiblemodeofaction[J].FoodChemistryꎬ2020ꎬ311:126010.[45]KHALEELCꎬTABANCANꎬBUCHBAUERG.α ̄Terpineolꎬanaturalmonoterpene:Areviewofitsbiologicalproperties[J].OpenChemistryꎬ2018ꎬ16(1):349 ̄361.[46]MARTÍNEZ ̄ABADAꎬSÁNCHEZGꎬOCIOMJꎬetal.CHAP ̄TER11polymericmaterialscontainingnaturalcompoundswithan ̄tibacterialandvirucideproperties[M]//ALEXANDRAMBꎬMARíACꎬMARTAFG.Polymericmaterialswithantimicrobialactivity:Fromsynthesistoapplications.Cambridge:TheRoyalSo ̄cietyofChemistryꎬ2014:310 ̄326.[47]HASHEMINEJADNꎬKHODAIYANFꎬSAFARIM.Improvingtheantifungalactivityofcloveessentialoilencapsulatedbychitosannanoparticles[J].FoodChemistryꎬ2019ꎬ275:113 ̄122. [48]VIJAYANANDRAJSꎬBRINDARꎬKANNANKꎬetal.Detoxifi ̄cationofaflatoxinB1byanaqueousextractfromleavesofAdhato ̄davasicaNees[J].MicrobiologicalResearchꎬ2014ꎬ169(4):294 ̄300.[49]YADAVAꎬKUJURAꎬKUMARAꎬetal.EncapsulationofBuni ̄umpersicumessentialoilusingchitosannanopolymer:Preparationꎬcharacterizationꎬantifungalassessmentꎬandthermalstability[J].InternationalJournalofBiologicalMacromoleculesꎬ2020ꎬ142:172 ̄180.[50]YADAVAꎬKUJURAꎬKUMARAꎬetal.Assessingthepreserva ̄tiveefficacyofnanoencapsulatedmaceessentialoilagainstfoodbornemoldsꎬaflatoxinB1contaminationꎬandfreeradicalgenera ̄tion[J].LWT ̄FoodScienceandTechnologyꎬ2019ꎬ108:429 ̄436.[51]PRAKASHBꎬSINGHPꎬKEDIAAꎬetal.Assessmentofsomeessentialoilsasfoodpreservativesbasedonantifungalꎬantiaflatox ̄inꎬantioxidantactivitiesandinvivoefficacyinfoodsystem[J].FoodResearchInternationalꎬ2012ꎬ49(1):201 ̄208.[52]YANGKLꎬGENGQRꎬSONGFQꎬetal.Transcriptomese ̄897江苏农业学报㊀2021年第37卷第3期。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T logy科技分析与检测
黄曲霉毒素给人体造成十分严重的伤害。
所以,要更多地去关注黄曲霉毒素的检查方法和各种食品中黄曲霉毒素含量。
因此,本文主要对黄曲霉毒素B1在食品检测中的研究新技术进行了有效的分析,希望可以为相关人员提供一定的参考。
1 黄曲霉毒素B1在食品中检
测的重要性
曲霉是到处都有的,可以分布在空气还有土壤中,有着固定的温度还有湿度的空气,就容易发生食品的霉变。
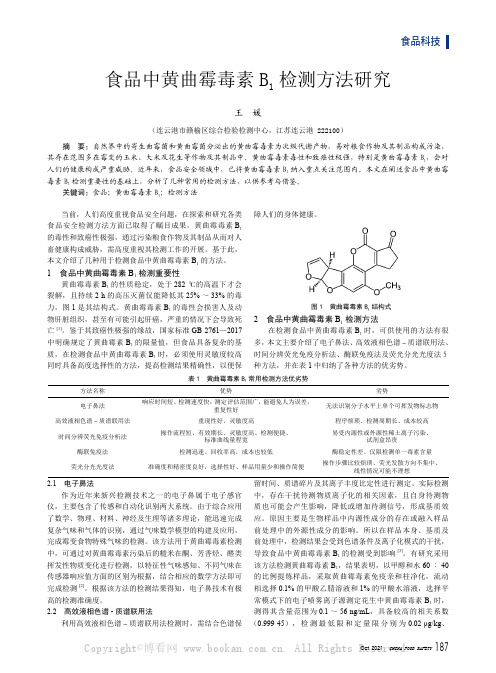
曲霉毒素就是在真菌毒霉素中最先开始发生的,本文中谈到的黄曲霉毒素就是在曲毒霉素当中比较严重的。
在1960年的时候,英国伦敦郊区就发生了一种火鸡X病,让黄曲霉毒素第一次被发现了,最容易见的地方就是谷物还有粮油制品这些物质的污染[1]。
因为黄曲霉毒素是有非常严重的致癌性,所以国家标准GB2761对食品中黄曲霉毒素B1的限量值很低,再加上食品的基质复杂,这意味着食品中黄曲霉毒素B1的检测方法既要有足够的灵敏度还要对黄曲霉毒素B1有高度的选择性。
2 黄曲霉毒素B1在食品检测
中的研究新进展
随着科学进步,黄曲霉素B1在食品中的检测方法也得到了很大的关注。
2.1 高效液相色谱—质谱联用法HPLC-MS主要依据NY/T2071-2011《饲料中黄曲霉毒素、玉米赤霉烯酮和T-2毒素的测定液相色谱--串联质谱法》完成相关检测,利用色谱保留时间以及质谱碎片及其离子丰度比定性,外标法定量。
在质谱检测过程中,具有对待测物质离子化产生干扰的相关因素,同时其自身待测物质可能会对其产生影响,导致待测信号
降低抑或增加的状况,并出现基质效
应[2]。
究其原因,主要包含生物样品
当中的内源性成分以及样品前处理时
所融入的外源性成分,因此,样品本身、
样品基质、样品前处理时,色谱条件
以及不同离子化模式均会对检测结果
产生干扰,不利于黄曲霉毒素B1在食
品当中的检测结构。
同时,此过程已
极为繁琐。
研究的最终结果说明,使
用甲醇-水60∶40的比例来对样品
去进行提炼,用黄曲毒霉素免疫亲和
柱净化,让1%的甲酸水溶液跟0.1%
的甲酸乙腈溶液作为超高效液相的流
动相,所以在电子喷雾离子源的平常
模式下所使用的多反应检测并且对花
生中的黄曲毒霉素B1进行测量[3]。
研
究说明,黄曲毒霉素B1在0.1~56 ng/
mL的范围,相关系数比较高,系数
到达了0.999 42,所得出来的检验最
低限是0.02 μg/kg,定量限是0.1 μg/
kg。
这个检测方法具有确认度高和净
化的效果比较好等优点,适合用于花
生这些复杂的样品的黄曲毒霉素的鉴
定。
因此,此技术在黄曲霉毒B1食品
检测当中获得了广泛的应用,并具有
较好的应用价值。
2.2 酶联免疫吸附筛查法
此检测方法主要将B1抗原抑或抗
体通过吸附剂吸附,并利用洗涤获取
清液,并加入被辣根过氧化物酶标记
的B1,二者则会产生特异性抗体,并
导致洗涤后发生显色反应,依据颜色
深浅对B1含量完成判定。
若将其与高
效液相色谱检测方法机芯对比,酶联
免疫吸附所受到的干扰较小,样品预
处理环节快速简便,同时极易回收,
并提前便利。
除此之外,此方法具有
检验流程简单,对检验环境无严格要
求的特点,主要适用于大批量的食品
检测。
但此方法亦具有一定的缺点,
因酶活性易受反应条件的干扰,导致
检测结果出现误差,因此, 利用此方
法时需通过其他方法给予复查从而进
一步保证检测结果的精准度。
2.3 薄层色谱法
此方法主要对样品进行提取、浓
缩、薄层分离后,黄曲霉毒素B1在紫
外光(波长365 nm)下产生蓝紫色荧
光,并依据其在薄层上显示荧光最低
检出量对其具体含量给予判定。
此方
法操作过程中对试剂、设备要求相对
不高,成本较低,主要适用于大批量
样品分离、筛选当中。
但同时其具有
灵敏度差、重现低、实验操作繁琐等
缺陷,因此,随着现代科技的进步此
方法已经不能满足当前检测的需求。
3 结语
因为每一种检测方法都拥有自己
不可替代的优点,也存在无法掩盖的
缺点。
所以检测机构应该在符合规定
的前提下根据自身条件选择高准确度
和高效率的检测方法。
但目前,我国
对黄曲毒霉素B1越来越关注。
相信在
以后的研究上能寻找出更高效更高灵
敏度和准确度的检测方法。
参考文献
[1]彭丽芳.黄曲霉毒素B1降解菌
的分离与鉴定[D].呼和浩特:内蒙古农
业大学,2018.
[2]罗建光.大豆油中黄曲霉毒素
B_1快速检测方法的研究[J].粮食与油
脂,2018,31(5):75-78.
[3]金慧慧,王晓红,姜娴.市售食
品黄曲霉毒素污染的监测结果[J].食品
安全导刊,2018(12):71-72.
黄曲霉毒素B1在食品检测中的研究新进展
□ 叶如婷 杜浩波 杨 乐 东莞市食品药品检验所
摘 要:黄曲霉毒 B1作为黄曲霉毒素产物当中对人体最具威胁的物质,直接危害到人体肝脏器官,并导致其出现突变、畸形等状况。
因此,为了避免黄曲霉毒素B1对人体所带来的毒害需加强其含量检测。
基于此,本文从黄曲霉毒素B1在食品检测当中重要性入手,对当前检测新技术进行了有效的分析,以供参考。
关键词:黄曲霉毒素B1;食品检测;新进展
DOI:10.16043/ki.cfs.2019.12.087
108食品安全导刊 2019年4月。
