化学计量
专题一 化学计量

专题一 化学计量一、物质的量与阿伏伽德罗常数1.基本概念(1)物质的量:是表示含有一定数目微粒集体的物理量。
符号n ,单位是摩尔(mol )。
表示对象:微观粒子(如原子、分子、离子、质子、中子等)。
(2)摩尔质量:单位物质的量的物质所具有的质量。
符号M ,SI 单位kg·mol -1。
以g·mol -1为单位时,摩尔质量的数值与粒子的相对原子质量或相对分子质量数值相等。
m n M =⨯(3)阿伏加德罗常数:0.012kg 12C 所含有的碳原子数。
符号N A ,单位mol -1。
1 mol 任何物质的指定微粒所含的指定微粒数目都是阿佛加德罗常数个,也就是0.012kg 12C 含有的碳原子数。
阿伏加德罗常数的近似值一般取2316.0210mol -⨯。
A N n N =⨯例1.设N A 表示阿佛加德罗常数,下列叙述中正确的是( )A .1.8gNH 4+中含有的电子数为N A ;B .常温常压下4.6g NO 2气体中含有的分子数为0.1N A ;C .100mL0.1mol·L -1Na 2CO 3溶液中含有的CO 32-数目为0.01N A ;D .18g D 2O 中含有的电子数为10N A 。
二、气体摩尔体积1.气体摩尔体积:单位物质的量的气体所占的体积。
符号:m V ,单位1-⋅mol L 。
公式:)()()(1mol n mol L V L V m ⨯⋅=-在标准状况(273K ,101KPa )下,气体摩尔体积约为22.41-⋅mol L 。
2.阿伏加德罗定律及其推论阿伏伽德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子。
RT M m nRT PV ==,RTPM V m ==ρ 推论1:同温同压下,气体的体积与物质的量成 比;推论2:同温同体积下,气体的压强与物质的量成 比;推论3:同温同压下,同体积的任何气体的质量与摩尔质量成比;推论4:同温同压下,同质量的气体的体积与摩尔质量成比;推论5:同温同压下,任何气体的密度与摩尔质量成比;推论6:同温同压下,对于摩尔质量相同的气体,其质量与分子个数成比;推论7:同温同体积下,等质量的任何气体,它们的压强与摩尔质量成比;推论8:同温同压下,混和气体中任一成分的物质的量分数(等于、大于、小于)其体积分数;3.气体摩尔体积的常见应用(1)由标准状况下气体密度求相对分子质量:(2)由相对密度求气体的相对分子质量:若为对H2的相对密度则为:,若为对空气的相对密度则为:.(3)求混合气体的平均相对分子质量():即混合气体1mol时的质量数值。
常用化学计量

常用化学计量化学计量是化学中一种非常重要的概念,用于描述化学反应中物质的量之间的关系。
在化学实验和工业生产中,化学计量被广泛应用于计算反应物和生成物的量,以及确定反应的理论产率和实际产率。
本文将介绍常用的化学计量方法和相关概念。
一、摩尔和摩尔质量摩尔(mol)是国际计量单位制中物质的量的单位,表示物质中粒子(如原子、分子、离子)的数量。
1摩尔物质中的粒子数被称为阿伏伽德罗常数,约为6.022×10^23。
摩尔质量指的是1摩尔物质的质量,单位是克/mol。
摩尔质量可以通过化学元素的相对原子质量来计算。
二、化学方程式和化学计量关系化学方程式用化学符号和化学式表示化学反应的过程,包括反应物和生成物之间的摩尔比例关系。
在化学方程式中,反应物前的系数表示了物质的摩尔比例,称为化学计量系数。
根据化学计量系数,可以推导出反应物消耗和生成物产生的摩尔比例关系。
三、摩尔比和摩尔比例摩尔比是指化学反应中不同物质的摩尔数量之比。
在化学方程式中,反应物和生成物之间的摩尔比可以通过化学计量系数得到。
摩尔比例是指不同物质的摩尔比与其化学计量系数之间的关系。
摩尔比例可以用来确定反应物的限量和过量,以及预测反应的理论产率。
四、反应物的限量和过量反应物的限量是指在化学反应中,限制了反应进行的物质。
反应物的限量取决于摩尔比例和反应物的初始量。
反应物的过量是指在化学反应中,存在超过摩尔比例所需量的反应物。
反应物的过量可能会导致浪费和产物纯度的降低。
五、理论产率和实际产率理论产率是指在理想条件下,根据化学计量关系计算得到的产物的量。
理论产率取决于反应物的摩尔比和反应物的初始量。
实际产率是指在实际实验条件下,实际得到的产物的量。
实际产率受到实验操作和反应条件等因素的影响,往往低于理论产率。
六、反应的收率和纯度反应的收率是指实际产率与理论产率之间的比值,用来评估反应的效率。
收率可以用来判断反应条件的优化和反应过程的控制。
反应的纯度是指产物中所含目标物质的纯度,通常用质量百分比表示。
基本概念-化学中常用计量
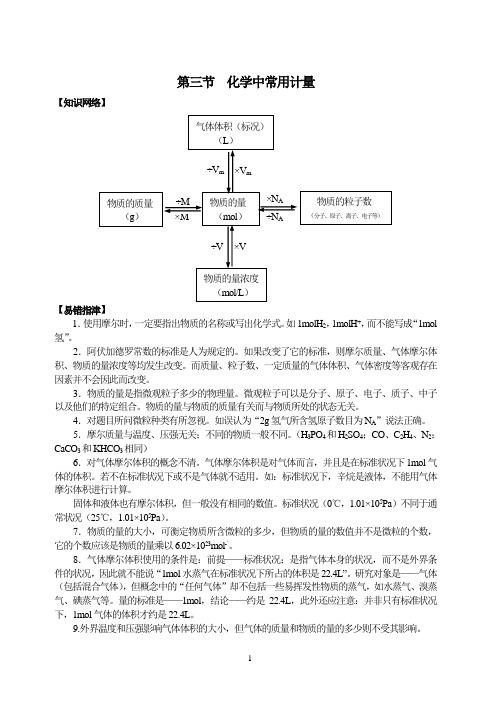
第三节化学中常用计量【知识网络】【易错指津】1.使用摩尔时,一定要指出物质的名称或写出化学式。
如1molH2,1molH+,而不能写成“1mol 氢”。
2.阿伏加德罗常数的标准是人为规定的。
如果改变了它的标准,则摩尔质量、气体摩尔体积、物质的量浓度等均发生改变。
而质量、粒子数、一定质量的气体体积、气体密度等客观存在因素并不会因此而改变。
3.物质的量是指微观粒子多少的物理量。
微观粒子可以是分子、原子、电子、质子、中子以及他们的特定组合。
物质的量与物质的质量有关而与物质所处的状态无关。
4.对题目所问微粒种类有所忽视。
如误认为“2g氢气所含氢原子数目为N A”说法正确。
5.摩尔质量与温度、压强无关;不同的物质一般不同。
(H3PO4和H2SO4;CO、C2H4、N2;CaCO3和KHCO3相同)6.对气体摩尔体积的概念不清。
气体摩尔体积是对气体而言,并且是在标准状况下1mol气体的体积。
若不在标准状况下或不是气体就不适用。
如:标准状况下,辛烷是液体,不能用气体摩尔体积进行计算。
固体和液体也有摩尔体积,但一般没有相同的数值。
标准状况(0℃,1.01×105Pa)不同于通常状况(25℃,1.01×105Pa)。
7.物质的量的大小,可衡定物质所含微粒的多少,但物质的量的数值并不是微粒的个数,它的个数应该是物质的量乘以6.02×1023mol-`。
8.气体摩尔体积使用的条件是:前提——标准状况;是指气体本身的状况,而不是外界条件的状况,因此就不能说“1mol水蒸气在标准状况下所占的体积是22.4L”。
研究对象是——气体(包括混合气体),但概念中的“任何气体”却不包括一些易挥发性物质的蒸气,如水蒸气、溴蒸气、碘蒸气等。
量的标准是——1mol,结论——约是22.4L,此外还应注意:并非只有标准状况下,1mol气体的体积才约是22.4L。
9.外界温度和压强影响气体体积的大小,但气体的质量和物质的量的多少则不受其影响。
化学计量

• 例3:成人每天从食物中摄取的几种元素的质量 分别为:0.8g Ca 、0.3g Mg、0.2g Cu 和0.01g Fe, 试求这4种元素的物质的量之比。
= = mol n(Mg)= = = mFe)= = = mol n(Ca): n(Mg): n(Cu): n(Fe) =224 : 140 : 35 : 2
物质的量、粒子数与阿伏伽德罗常数之间的关系:
n = N / NA
作为物质的量的单位,mol可以计量所有微 观粒子(包括原子、分子、离子、原子团、质 子、中子等),如1mol Fe、1mol O2 、1molNa+ 、 1mol SO42- 等。 1mol不同物质中所含的粒子数是相同的,由 于不同粒子的质量不同,1mol不同物质的质量 也不同。例如1mol H2O和1mol Al 所含的粒子数 都是6.02x1023 个,但他们的质量不同。
第二节:化学计量在实验中的应 用
一、物质的量单位——摩尔
物质的量是一个物理量,它表示含有一定 数目的粒子的集合体,符号n。物质的量的单位 为摩尔,简称摩,符号为mol。国际上规定, 1mol粒子集体所含的粒子数与0.012kg12C中所含 的碳原子数相同,约为6.02x1023。把1mol任何 粒子的粒子数叫做阿伏伽德罗常数,符号NA, 通常用6.02x1023 /mol表示。
1mol H2O的质量是18g,约含有 6.02x1023 个水分子。 0.5mol H2O的质量是9g,约含有3.01x1023 个水分子。 1mol Al的质量是27g,约含有6.02x1023 个铝原子。 2mol Al的质量是54g,约含有1.204x1024 个铝原子。
1mol 任何粒子集合体都含有6.02x1023 个 粒子;而1mol任何粒子或物质的质量以克为 单位时,其数值都与该粒子的相对原子质量 或相对分子质量相等。单位物质的量的物质 所具有的质量叫做摩尔质量。摩尔质量的符 号为M,所常用的单位为g/mol(或g∙mol-1)。 例如: Mg 的摩尔质量是24g/mol; KCl 的摩尔质量是74.5g/mol; SO2 的摩尔质量是64g/mol; CO32- 的摩尔质量是60g/mol;
知识点9.化学计量

知识点10.化学计量在实验中的应用1.任何粒子或物质的质量以克为单位,在数值上与该粒子的相对原子质量或相对分子质量相等时,所含粒子的数目都是×1023。
我们把含有×1023个粒子的集体计量为1摩尔。
简称摩,符号为mol 。
×1023mol -1叫做阿佛加得罗常数,N A 。
它的符号是n 。
粒子集合体可以是分子、离子、原子、离子团,甚至是组成它们的质子、电子、中子等微观粒子。
1摩尔铁原子可表示为1molFe 、3摩尔氧分子可表示为3molO 2、10摩尔钠离子可表示为1molNa +。
2.单位物质的量的物质所含有的质量叫做摩尔质量。
符号为M ,常用单位为g/mol 。
摩尔质量在数值上都与该粒子的相对分子质量或相对原子质量或式量相等,单位不同。
H 2O 的相对分子质量为18,摩尔质量为18g/mol ,1 mol H 2O 的质量是18g ,含有×1023个水分子;0.5 mol H 2O 的质量是9g ,含有×1023个水分子。
3.物质体积的大小取决于构成这种物质的粒子数目、粒子大小、粒子之间的距离。
单位物质的量的气体所占的体积称为气体摩尔体积,符号Vm ,单位L/mol 。
气体物质的量(n)与气体体积(V)、气体摩尔体积(V m )的关系为V=n ·Vm 。
气体摩尔体积的数值决定于气体所处的温度和压强。
例如,标准状况(常用S.T.P.表示,其温度0℃×105)时V m = /mol ;标准状况下,44g 二氧化碳的物质的量是1mol ,微粒数是×1023个,所占体积为。
标准状况下11.2 L 的Cl 2和质量为49g 硫酸所含的分子数相等。
4.相同温度和压强下,相同体积的任何气体都含有相同的分子数,这个规律叫做阿伏加德罗定律。
标准状况下11.2 L 的Cl 2和CO 2、H 2、N 2的质量分别为、22g 、1g 、14g ,但他们所含的分子数都是×1023个。
化学常用计量

17
有关NA的专题
阿伏加德罗常数是近几年高考的“热点”问题。多年来 高考试题重现率几乎为100% 试题主要考查考生对物质的量、阿伏加德罗常数,摩尔 质量、气体摩尔体积、物质的量浓度、阿伏加德罗定律这些 概念的辩析是否清楚,各种守恒关系、平衡的有关原理掌握 得是否牢固。特别是在“摩尔”使用时,微观粒子可以是原 子、分子、离子、电子或其它粒子或这些粒子的特定组合, 气体摩尔体积的适用范围,阿伏加德罗定律的使用范围。对 这些重点和难点反复进行考查。这对考生思维能力的严密性 是一个很好的检验。 相关原理:电子守恒、电荷守恒、电离平衡、水解平衡、物 质结构、晶体结构方面的知识等。
9
阿伏加德罗常数
实验测定12g12C中碳原子的个数。 符号:NA。单位:个/mol • NA的基准是12g碳-12中的原子个数。 • 12C不仅是摩尔的基准对象,而且还是相对原子质量的基准。 • NA是一个实验值,现阶段常取6.02×1023作计算。要注意NA 与6.02×1023的区别
10
气体摩尔体积
16
电荷守恒
一定体积的溶液中,阴阳离子所带电荷数 (或电荷物质 的量)相等 例: MgSO4 和 Al2(S04)3 混合液中, C(Al3+)=0.1mol/L, C(SO42-)=0.3mol/L, 则C(Mg2+)=( A ) A 0.15mol/L B 0.3mol/L C 0.45mol/L D 0.2mol/L
22
关于NA的注意事项
• 状况条件
条件为非标准状况,如常温常压下(25℃、1atm),已 知气体体积,不能直接应用22.4L· -1进行体积计算(注意: mol 可进行任何气体的质量、物质的量等计算)。 例:判断下列说法的正误 常温常压下,11.2LБайду номын сангаас气所含的原子数为NA 常温常压下,16g氧气所含的原子数为NA 在常温常压下,1molO含有的原子数为2NA 电解饱和CuSO4溶液,若阳极产生气体11.2L,则转移电子2NA 在同温同压下,相同体积的任何气体单质所含的原子数相同
知识点什么是化学计量

知识点什么是化学计量化学计量是化学中的一个重要概念,涉及到化学反应中物质的量的关系。
化学计量涉及到摩尔、物质的摩尔质量、化学方程式的平衡等概念。
了解化学计量的基本知识对于理解化学反应过程、计算反应中所需的物质量等都非常重要。
一、摩尔及其应用在化学中,摩尔是一个重要的计量单位,表示1摩尔物质的质量等于该物质的摩尔质量。
摩尔质量可以通过元素的原子量或化合物的分子式来计算。
例如,摩尔质量可以用来计算物质的质量,例如1摩尔的氧气(O₂)的质量就等于32克(O的原子量16乘以2)。
同时,通过摩尔概念,可以判断化学方程式中物质的量的关系,如2H₂ + O₂ → 2H₂O 表示在化学反应中,2摩尔的氢气和1摩尔的氧气反应生成2摩尔的水。
二、化学方程式的平衡在化学方程式中,摩尔比可以用来描述反应物和生成物的比例关系。
化学方程式的平衡意味着反应物和生成物在化学反应中的物质的量是平衡的。
化学方程式的平衡是使用摩尔比来实现的。
在平衡的化学方程式中,反应物和生成物的系数表示反应物和生成物的摩尔比。
根据质量守恒定律,反应物的总摩尔数需要等于生成物的总摩尔数,这样才能保持物质的质量不变。
三、摩尔比的计算摩尔比可以通过化学方程式中的系数来计算。
系数表示了物质在反应中参与的摩尔数。
根据化学方程式中的系数,可以计算出反应物之间的摩尔比以及生成物之间的摩尔比。
例如,在化学反应2H₂ + O₂ → 2H₂O中,可以确定氢气和氧气的摩尔比为2:1,表示2摩尔的氢气会与1摩尔的氧气反应生成2摩尔的水。
四、摩尔比的应用摩尔比在化学中有广泛的应用。
它可以用于计算反应物所需的物质量,也可以用于确定反应生成物的产量。
通过摩尔比,可以在已知一个物质的物质量的情况下,计算其他物质的物质量。
例如,在反应2H₂ + O₂ → 2H₂O中,如果已知氢气的物质量,可以通过摩尔比计算出所需的氧气的物质量。
此外,通过摩尔比还可以计算反应的理论产量。
理论产量是在理想情况下反应生成物的产量,根据摩尔比和已知反应物的物质量,可以计算出理论产量。
常用化学计量

常用化学计量一、化学计量的概念化学计量是研究化学反应中化学物质的量关系的学科,主要包括比化学计量和物理化学计量两个方面。
比化学计量主要研究物质在化学反应中的量关系,包括化学反应的计量关系、化学计量法则等;物理化学计量则主要研究化学反应的能量变化、反应速率等内容。
化学计量是化学学科的基础,在化学研究和应用中都起着重要的作用。
在实验室中,如果无法准确掌握和计算化学反应中物质的量关系,就无法进行精确的实验和制备;在工业生产中,化学计量的应用也非常广泛,特别是在化学反应的工业过程中,研究物质的量关系有助于提高产品的质量和生产效率。
二、化学计量有哪些基本概念?化学计量有许多基本概念,其中比较重要的包括原子量、分子量、摩尔质量和化学计量分析等。
1. 原子量原子量是指元素中每个原子的质量。
根据国际单位制规定,实验中测定出的氢原子的质量是标准的,其原子量被定义为1,其它元素的原子量相对于氢原子的原子量来确定。
2. 分子量分子量是指物质中每个分子的质量。
分子量与相对分子质量的概念相同,也是用相对于氢原子的原子质量来计算。
但由于最小的分子量是2(即H2),因此分子量的最小基本单位是2u。
3. 摩尔质量摩尔质量是指物质中每摩尔分子的质量。
摩尔质量通常用克/摩尔(g/mol)作单位。
4. 化学计量分析化学计量分析是一种通过分析化学计量反应中物质的量关系,来确定实验样品中某种化合物的定性或定量成分的方法。
化学计量分析的主要方法包括氧化还原滴定法、酸碱滴定法、沉淀滴定法等。
三、常用化学计量公式在化学计量中,有许多公式可以帮助我们计算物质的量关系,以下是几个常用的化学计量公式。
1. 摩尔质量计算公式摩尔质量(M)是指物质的分子量用克表示的值,可以用以下公式来计算:M = m/n其中m为物质的质量(单位为g),n为物质的摩尔数。
2. 化学计量关系公式在化学反应中,物质的量关系可以用一个“化学计量关系”公式来表示,该公式是指两个化学物质的量比在反应方程式中的系数关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学计量内容丰富,围绕化学计量的核心,即保证化学测量结果的准确、可靠和可比,归纳起来至少应包括以下几个方面:
一、SI基本单位摩尔的复现和基本物理量的测量
摩尔是SI单位制中表示物质的量的基本单位,也是唯一一个直接关于化学计量的SI单位,是化学计量的基础。
物质的量(即化学成分量)测量是化学测量的最主要内容。
将化学成分量溯源至SI单位,是化学计量追求的终极目标。
摩尔的复现和基本物理常数的测量是国际化学计量界共同努力的方向。
二、化学计量基(标)准的建立、复现、保存和使用
化学测量从内容上说,可分为化学成分量、物理化学量、化学工程量和生物量测量几大类。
目前,在我国已经建立的化学计量基准只有6项,远不能满足化学测量溯源的需求。
由于化学测量的复杂性,要研究和建立更多的化学计量基准,其难度是巨大的。
即使是已经建立的计量基准,随着科学技术的发展,也需要不断地更新,才能持续满足社会发展的需要。
此外,种类数以百计的化学测量标准,作为全国、部门或区域的量值传递的测量标准,在量值溯源链中发挥了非常重要的作用。
它们的建立、复现、保存、更新和使用在一定程度上,保证了化学测量结果的准确可靠。
三、标准物质及其相关技术的研究和应用
标准物质是测量标准的一个种类。
其与传统定义的物理测量标准相比,具有其特殊性,因此国际上有专门针对标准物质的定义。
化学测量绝大多数是相对测量,而且影响测量不确定度的因素复杂。
可以说,没有标准物质,化学测量无法实现,更谈不上准确可靠和可比。
标准物质可分为纯物质和基体标准物质两大类。
其中纯物质及其相应的纯溶液,主要用于校准分析仪器,或用作测量标准给待测量赋值;另一类是基体标准物质,主要用于考察确认测量方法、测量人员以及测量过程的质量控制,有时也用于校准仪器(X-射线荧光光谱法、近红外光谱法)。
由于化学测量涉及的物质种类繁多,成分复杂,不同基体、不同物质、甚至是同一种物质和成分的不同含量水平,对测量结果的影响也不尽相同,某一化学特定量的标准物质基本上仅适用于基体和含量与其相同或相似的特定量的测量。
目前,虽然已经有上千种标准物质在各个领域使用,但是仍然有许多重要的领域需要更多适用的标准物质。
尤其是制造工业、贸易、健康和环境等领域,标准物质的需求量巨大。
需要不断地研究标准物质的有关理论、测量技术、不确定度表述方法等,研制不同种类的标准物质满足量值传递和溯源的要求。
这些工作需要化学计量工作者和相关测量领域分析专家长期共同的努力。
四、化学测量方法的研究、确认和应用
化学测量方法从基本原理、可能达到的不确定度水平或其在化学测量溯源链中的作用,可分为基准方法、高准确度方法、标准方法和参考方法等,国际计量局物质量咨询委员会(BIPM/CCQM)目前认定有5个潜在的基准方法:重量法、库仑法、凝固点下降法、称量滴定法和同位素稀释质谱法。
认为其通过全面系统的研究,有可能发展为具有最高计量学特性(即最高测量不确定度水平)的基准方法,它们是化学测量量值溯源到SI的根本。
另外一些测量方法,虽然目前尚不能统一地作为潜在的基准方法看待,但经过系统的研究,可望达到较高准确度水平,如中子活化分析法、腔衰荡光谱法、核磁共振法等一些应用新技术的测量方法。
此外,由于对有些物质,其待测量无法准确定义,国际上常约定采用某些参考方法实现溯源,即溯源到参考方法,这在临床医学领域应用比较普遍。
此外,在国际标准和国家标准方法的制定中,首先需要研究测量方法,包括其应用范围、测量重复性、线性范围、基体影响、灵敏度或检出限、稳定性等,涉及很多化学计量问题。
在大量使用国际标准方法和国家标准方法时,也需要对方法进行验证,确保得到正确的应用。
五、化学测量结果及测量不确定度的评定方法的研究和应用
正是由于化学测量的过程复杂,影响测量不确定度的因素众多,使得化学测量结果以及相应的不确定度评定,相比物理测量要复杂得多,对于这一点,广大分析工作者和化学计量工作者深有体会。
如何运用国际上关于测量不确定度的评定指南,评价化学测量结果的质量,建立适合化学测量不确定度评定的数学模型,寻求测量不确定度的主要来源、量化各个分量以及评定合成不确定度和扩展不确定度均需要进行研究,并不断完善。
相应地,如何将已获得测量不确定度的信息,用于化学测量过程的质量控制,设计和改进化学测量程序,获得符合预期用途的测量结果,则是测量不确定度应用的更深层次的内容。
六、研究化学测量仪器及其检定或校准的方法
化学测量多数是通过分析测量仪器完成的,随着科学技术的飞速发展,新的分析技术层出不穷,新型的、快速的、多参数的、在线的分析仪器不断涌现,在产品检测、环境监测、食品安全、医疗保健等行业广泛应用。
如何评价这些分析仪器的计量性能,如何实现监督管理,是确保其提供的测量结果准确可靠的前提。
这也是对化学计量工作的一大挑战。
需要针对不同的分析仪器研究其特性,制定相应的检定或校准方法,以及判定合格与否的技术指标等。
现实中,分析仪器检定和校准方法的研究,往往落后于分析新技术自身的发展,因此,化学计量工作者需要不断努力,紧紧跟随新技术的发展步伐。
七、研究化学计量单位和单位制,实现单位制的统一
实现单位制的统一是公平贸易的最基本的要求。
化学计量在国际、国内贸易方面发挥着
重大作用,实现国际米制公约框架下的单位制统一,促进采用国家法定计量单位,是化学计量的必需工作之一。
随着生物技术的发展和应用,生物测量工作也日渐重要,相应地也对生物计量提出了更高的要求。
生物量,尤其是生物活性的国际单位是什么?如何定义?这是20世纪后半叶困扰国际计量界的问题。
随着国际纯粹与应用化学联合会与国际临床化学联合会(IUPAC/IFUB)推荐以“katal”表示酶的催化活性(符号z)的单位(符号kat),并于1999年l0月被国际最高计量权威机构——国际计量大会(CGPM)批准,“kat”成为新增的具有专门名称、符号的国际单位制(SI)的导出单位,这个问题才得以解决。
但如何应用该单位实现量值溯源,还有很多工作要做。
八、探究量值传递与量值溯源途径和方法
量值传递和量值溯源是实现测量结果可比性的手段,这不仅涉及技术问题,还与计量管理有关,包括法制计量管理工作。
化学计量的特点决定了其不能像物理计量那样,采取使用长期不变的、反复使用的计量基(标)准,逐级检定或校准标准计量器具的方法进行量值传递,大多数化学测量量值传递需要通过标准物质来实现。
如何建立量值传递和溯源体系,将国际或国家最高计量标准,采用何种技术手段进行传递和溯源,采用什么最有效的传递或溯源途径等需要在新形势下不断地完善。
九、核心测量能力和关键国际比对
核心测量能力是近几年CCQM提出的一个有关化学计量的新概念,旨在以最少的国际比对覆盖最多的测量能力。
但即使在CCQM内部,也没有形成一个一致的定义,不同的工作组之间的理解也不相同,因此还需要进一步地研究、发展和完善。
校准和测量能力(CMC)是指各个国家计量院或指定机构所具有的、通常情况下能有效地提供给客户的校准和测量能力,是各国签署国际互认协议的技术基础。
关键国际比对则为各国申报的校准和测量能力提供证明。
因此,关键比对项目的遴选和组织、参考值的确定、测量能力接受原则等是国际化学计量组织工作的重要内容。
而对于各国的化学计量工作,如何通过参加必要的关键比对获得相关领域的测量能力,如何申报测量能力以及确定其相应的不确定度,使本国的测量能力得到国际承认,是各国计量院的一项重要工作。
十、化学计量技术和知识的传播和培训
化学计量学是一门实用性很强的科学。
从其自然科学的属性上,原则上可认为是分析化学的一个分支,主要研究量值准确可靠的理论与实践的各个方面。
因此,应加强化学计量学与分析化学的融合,国外有些大学开设有专门的课程,或组织短期培训,从事化学计量知识的传播和培训,而在我国这方面的工作还很薄弱,没有得到重视,可以说教育与实际应用是
脱节的。
很多走出校门从事化学分析的人员,不具备基本的化学计量知识,也不具备分析测量结果可溯源的概念,没有如何获得准确可靠的测量结果的完整思路和方法,以至于出现很多不应有的因检测结果不准确造成的事件。
因此,应加强如何获得准确可靠和可比的化学测量结果方面的培训和教育,如测量结果的溯源性、可靠性和可比性技术,化学测量质量控制技术,化学测量不确定度评定及其应用、测量方法的确认,标准物质或校准溶液的使用和生产以及良好操作规范等。
十一、化学计量的法制工作
化学计量的法制工作包括:
(1)制定化学计量仪器的检定规程,并开展仪器计量检定。
(2)制定标准物质的技术规范,进行技术鉴定与统一管理。
(3)化学计量器具新产品定型鉴定和进口计量器具的计量性能评价。
(4)对出具公正数据的分析检验机构进行实验室认可。
(5)对量值争议的化学测量进行仲裁。
以上各个方面不是孤立的,而是密切相关的,只有协调发展才能实现化学测量结果的准确性、等效性、可比性和溯源性,化学计量才能逐步向人们预期的方向发展。
