(化学)中考化学化学科普阅读题题20套(带答案)及解析
【化学】 化学科普阅读题练习题(含答案)经典
【化学】化学科普阅读题练习题(含答案)经典一、中考化学科普阅读题1.阅读下面科普短文。
土豆是继水稻、小麦、玉米之后的第四大粮食作物,含淀粉、蛋白质、维生素C等多种营养物质,是餐桌上的美味食材。
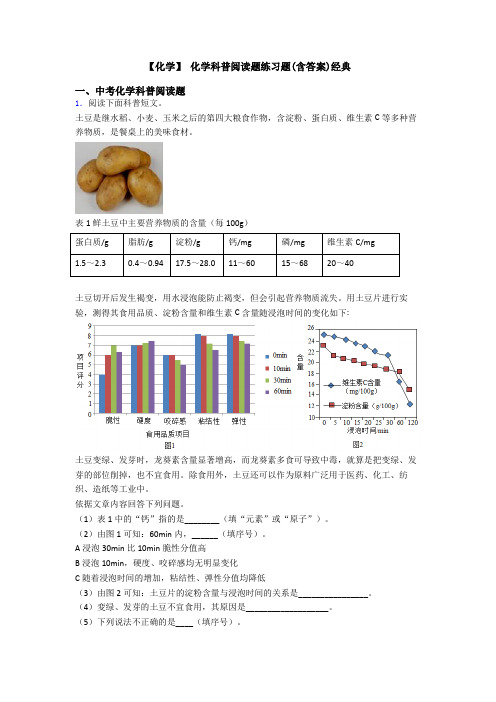
表1鲜土豆中主要营养物质的含量(每100g)蛋白质/g脂肪/g淀粉/g钙/mg磷/mg维生素C/mg1.5~2.30.4~0.9417.5~28.011~6015~6820~40土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。
用土豆片进行实验,测得其食用品质、淀粉含量和维生素C含量随浸泡时间的变化如下:土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒,就算是把变绿、发芽的部位削掉,也不宜食用。
除食用外,土豆还可以作为原料广泛用于医药、化工、纺织、造纸等工业中。
依据文章内容回答下列问题。
(1)表1中的“钙”指的是________(填“元素”或“原子”)。
(2)由图1可知:60min内,______(填序号)。
A浸泡30min比10min脆性分值高B浸泡10min,硬度、咬碎感均无明显变化C随着浸泡时间的增加,粘结性、弹性分值均降低(3)由图2可知:土豆片的淀粉含量与浸泡时间的关系是________________。
(4)変绿、发芽的土豆不宜食用,其原因是___________________。
(5)下列说法不正确的是____(填序号)。
A土豆是四大粮食作物之一 B土豆中维生素C含量最高C用水泡可防止土豆片褐変 D土豆开发应用的前景广阔【答案】元素 ABC 在其他条件相同时,在研究范围内,土豆片的淀粉含量随浸泡时间的延长而降低土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒 B 【解析】【分析】【详解】(1)物质都是由元素组成的,所以表1中的“钙”指的是元素;(2)A、由图1中的信息可知,浸泡30min比10min脆性分值高,故A正确;B、由图1中的信息可知,浸泡10min,硬度、咬碎感均无明显变化,故B正确;C、由图1中的信息可知,随着浸泡时间的增加,粘结性、弹性分值均降低,故C正确;(3)由图2提供的信息可知,在其他条件相同时,在研究范围内,土豆片的淀粉含量随着浸泡时间的延长而降低;(4)由题干提供的信息可知:土豆变绿、发芽时,龙葵素含量显著增高,而龙葵素多食可导致中毒;(5)A、由题干“土豆是继水稻、小麦、玉米之后的第四大粮食作物”可知,A正确;B、由表1提供的信息可知,淀粉的含量最高,故B错误;C、由题干“土豆切开后发生褐变,用水浸泡能防止褐变,但会引起营养物质流失。
九年级化学化学科普阅读题试题(有答案和解析)
九年级化学化学科普阅读题试题(有答案和解析)一、中考化学科普阅读题1.果果关注本地首例违规添加亚硝酸钠食品安全公诉案件,为了维护消费者权益,查询整理氯化钠和亚硝酸钠的有关信息,回答下列问题:(1)阅读上表写出亚硝酸钠的两条物理性质为___。
(2)食盐是日常调味品,亚硝酸钠有毒,氯化钠和亚硝酸钠是两种不同的物质,从宏观的角度看,是由于这两种物质的_____不同。
(3)亚硝酸钠跟盐酸反应会生成氯化钠、两种氮的氧化物和水,请你写出亚硝酸钠跟盐酸反应的化学方程式为_____。
(4)亚硝酸钠外观酷似食盐,有咸味,常被误作食盐食用而导致中毒事件发生。
有一包外观酷似食盐的固体,结合表中信息,如何鉴别它是亚硝酸钠还是氯化钠______(包括选取的试剂、方法、实验现象和结论,只写出一种方法即可)。
【答案】易溶于水,熔点为271℃,沸点为320℃,熔点低等元素组成2NaNO2+2HCl=NO↑+NO2↑+2NaCl+H2O 取少量放在金属片上加热,若先熔化则为亚硝酸钠;或取少量溶于水,分别加入硝酸银溶液,若有白色沉淀则为氯化钠,若有浅黄色沉淀则为亚硝酸钠;取少量溶于水,滴加酚酞试液,若变红则为亚硝酸钠,否则为氯化钠;或取少量溶于水,用pH试纸测定,若pH>7为亚硝酸钠,若pH=7,则为氯化钠【解析】【分析】【详解】(1)出亚硝酸钠的两条物理性质为:易溶于水,熔点为271℃,沸点为320℃,熔点低等;(2)食盐是日常调味品,亚硝酸钠有毒,氯化钠和亚硝酸钠是两种不同的物质,从宏观的角度看,是由于这两种物质的元素组成不同,氯化钠由氯元素和钠元素组成,亚硝酸钠有钠元素、氮元素和氧元素组成。
(3)亚硝酸钠跟盐酸反应会生成氯化钠、一氧化碳、二氧化碳和水的化学方程式为:2NaNO2+2HCl=NO↑+NO2↑+2NaCl+H2O;(4)亚硝酸钠外观酷似食盐,有咸味,常被误作食盐食用而导致中毒事件发生。
有一包外观酷似食盐的固体,结合表中信息,鉴别它是亚硝酸钠还是氯化钠方法是:取少量放在金属片上加热,若先熔化则为亚硝酸钠;或取少量溶于水,分别加入硝酸银溶液,若有白色沉淀则为氯化钠,若有浅黄色沉淀则为亚硝酸钠;取少量溶于水,滴加酚酞试液,若变红则为亚硝酸钠,否则为氯化钠;或取少量溶于水,用pH试纸测定,若pH>7为亚硝酸钠,若pH=7,则为氯化钠。
(化学)初三化学化学科普阅读题题20套(带答案)

(化学)初三化学化学科普阅读题题20套(带答案)一、中考化学科普阅读题1.阅读下面科普短文(本文由网络文章改写)。
松花蛋又称皮蛋、变蛋、灰包蛋等,因剥开蛋壳后胶冻状的蛋清中常有松针状的结晶或花纹而得名,是一种我国传统风味食品,口感鲜滑爽口,色香味均有独到之处。
中医认为,松花蛋性凉,对牙痛、眼痛等疾病有一定疗效。
由于松花蛋会有一股碱涩味,在吃松花蛋的时候可以加入少量的姜醋汁。
松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。
料泥是由生石灰、纯碱、食盐、红茶、草木灰(主要成分K2CO3)等原料与水按比例混合均匀制得。
料泥制作过程中,通过一系列反应,产生的强碱(NaOH、KOH)经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,致使蛋白质分解、凝固并放出少量硫化氢气体和氨气。
同时渗入的碱还会与蛋白质分解出的氨基酸进一步发生中和反应,生成的盐的晶体沉积在凝胶态的蛋清中,便出现了朵朵“松花”。
而硫化氢气体则与蛋清和蛋黄中的矿物质作用生成各种硫化物,使蛋清和蛋黄的颜色发生改变,蛋清呈特殊的茶褐色、蛋黄则呈墨绿色。
下图表示松花蛋腌制时间与其中蛋清和蛋黄的pH的变化关系。
很多人在平时生活中都非常喜欢吃皮蛋瘦肉粥、凉拌松花蛋,专家提醒这种食物少吃无妨,却不能过多食用。
其一,松花蛋腌制过程中蛋白质分解、变质,导致营养价值遭到了一定的破坏。
其二,市售松花蛋还可能含铅(国家规定松花蛋中铅含量需小于0.5mg/kg)。
微量铅很容易被儿童吸收,导致铅中毒。
其三,剥开皮的松花蛋1至2小时内一定要吃完,若长时间暴露在空气中,非常容易感染沙门氏杆菌,沙门氏杆菌会快速繁殖,此时食用松花蛋很容易引起中毒现象。
依据文章内容,回答下列问题。
(1)食用松花蛋时加入少量姜醋汁可以除去松花蛋中______________味。
(2)料泥制作过程中会生成强碱NaOH和KOH,钾元素来自于原料中的_________。
生成NaOH的过程中,属于复分解反应的化学方程式为_________________。
化学科普阅读题专题(含答案)

化学科普阅读题专题(含答案)一、中考化学科普阅读题1.阅读下面科普短文。
2017年,我国在南海北部神狐海域进行的可燃冰试采获得成功。
你对可燃冰有多少了解呢?什么是可燃冰?可燃冰外观像冰,主要含甲烷水合物(由甲烷分子和水分子组成),还含少量二氧化碳等气体。
甲烷水合物的分子结构就像一个一个由若干水分子组成的笼子,每个笼子里“关”一个甲烷分子。
可燃冰是怎样形成的?可燃冰的形成要满足三个条件:(1)温度不能太高。
(2)压力要足够大。
(3)要有甲烷气源。
在上述三个条件都具备的情况下,天然气可与水生成甲烷水合物,分散在海底岩层的空隙中。
甲烷水合物能稳定存在的压强和温度范围如图所示:为什么开采困难?可燃冰开采的最大难点是保证甲烷气体不泄露、不引发温室效应,甲烷引发的温室效应比二氧化碳厉害10至20倍,可燃冰一离开海床便迅速分解,容易发生喷井意外,还可能会破坏地壳稳定平衡,引发海底塌方,导致大规模海啸。
可燃冰有哪些用途?一体积可燃冰可储载约164倍体积的甲烷气体,具有能量高、燃烧值大等优点,而且储量丰富,因而被各国视为未来石油天然气的替代能源。
甲烷还是重要的化工原料,可制造碳黑、乙炔、氰化氢等。
依据文章内容,回答下列问题:(1)可燃冰形成的适宜条件是_________。
A 高温高压B 低温高压C 低温低压(2)可燃冰作为能源的优点是_________________。
(3)甲烷燃烧的化学方程式为_________________。
(4)有关可燃冰的说法正确的是___________。
A 可燃冰不是冰B 可燃冰开采时若出现差错,可能引发严重的环境灾害C 在1atm和25℃时,可燃冰能稳定存在【答案】B 能量高,燃烧值大 CH4+2O2点燃CO2+2H2O AB【解析】【分析】【详解】(1)由题干信息可知,可燃冰形成的适宜条件是低温高压;故填:B;(2)可燃冰具有能量高、燃烧值大等优点,而且储量丰富;故填:能量高,燃烧值大;(3)甲烷与氧气在点燃的条件下反应生成水和二氧化碳;故填:CH4+2O2点燃CO2+2H2O;(4)A.可燃主要含甲烷水合物,冰的成分是水,可燃冰不是冰,说法正确;B.甲烷引发的温室效应比二氧化碳厉害10至20倍,可燃冰一离开海床便迅速分解,容易发生井喷意外,还可能会破坏地壳稳定平衡,引发海底塌方,导致大规模海啸,因此可燃冰开采时若出现差错,可能引发严重的环境灾害,说法正确;B.由图象可知,在1atm和25℃时,可燃冰不能稳定存在,说法错误。
(化学)九年级化学化学科普阅读题题20套(带答案)及解析

(化学)九年级化学化学科普阅读题题20套(带答案)及解析一、中考化学科普阅读题1.阅读下面的科普短文在离地面约25km高空处有一层厚度极薄的气体层,主要成分是臭氧(O3),它是地球上一切生命的保护层。
与O2不同,通常状况下O3是淡蓝色气体,有难闻的鱼腥味。
O3不太稳定,一旦受热极易转化成O2,并放出大量的热。
O3比O2活泼的多,它能跟许多物质(SO2、CO、NO、氟利昂等)发生反应。
如除去工业废气中的二氧化硫,一种方法是在微热条件下,O3与二氧化硫化合成三氧化硫,三氧化硫再跟H2O化合就得到了硫酸。
臭氧发生器可以制得O3,其原理是在放电条件下,O2能转化为O3。
从臭氧发生器出来的气体中含O3约3%。
臭氧层能吸收太阳辐射中的大量紫外线,使地球上的生物免遭紫外线的伤害。
飞机排出的废气(含CO、NO等)以及常用的制冷剂“氟利昂”会使臭氧层形成空洞,从而使更多的紫外线照到地球表面,导致皮肤癌的发病率大大增加。
如不采取措施,后果不堪设想。
依据文章内容,回答下列问题:(1)从微观角度解释O3与O2化学性质不同的原因是_________________。
(2)O3与二氧化硫反应的文字表达式为_________________。
(3)你认为保护臭氧层的有效方法是___________________。
−−→三氧化硫减少废气(含CO、NO等)以【答案】分子结构不同臭氧+二氧化硫∆及制冷剂“氟利昂”的排放【解析】【详解】(1)从微观角度解释O3与O2化学性质不同的原因是:分子结构不同;(2)在微热条件下,O3与二氧化硫化合成三氧化硫,O3与二氧化硫反应的文字表达式−−→三氧化硫为:】臭氧+二氧化硫∆(3)根据“飞机排出的废气(含CO、NO等)以及常用的制冷剂“氟利昂”会使臭氧层形成空洞”可知,保护臭氧层的有效方法是:减少废气(含CO、NO等)以及制冷剂“氟利昂”的排放。
2.波尔多液的制备及组成测定波尔多液是常见的杀菌剂,为天蓝色碱性悬浊液。
九年级化学化学科普阅读题试题(有答案和解析)
九年级化学化学科普阅读题试题(有答案和解析)一、中考化学科普阅读题1.阅读下面科普短文(原文作者:袁越)。
二氧化碳是著名的温室气体,它能让太阳光顺利通过,却会阻止地表热量的散失。
在地球形成的初期,太阳的辐射强度只有现在的四分之一,为什么那时的地球没有被冻成冰球呢?最新的理论认为,液态的水(比如降雨)能够溶解空气中的二氧化碳,再把它变为碳酸盐,沉积到岩石层中。
同时,地球的内部很热,沉积在地壳中的碳经常会随着火山喷发而重新变为二氧化碳释放到大气中,这就形成了一个碳循环。
经过几亿年的时间,这个碳循环逐渐达到了某种平衡,使大气中的二氧化碳保持一定的含量。
正是由于这些二氧化碳产生的温室效应,使得地球的温度不至于太冷。
生命的诞生促成了另一个碳循环。
众所周知,生命的基础是光合作用,就是利用太阳提供的能量,把二氧化碳中的碳元素提取出来,连接成一条长短不一的碳链。
这样的碳链被称为“有机碳”,因为它既能作为生命的“建筑材料”,搭建成生命所需的各种有机分子(碳水化合物、蛋白质和氨基酸等),又能“燃烧自己”,产生能量供生命使用。
有机碳的燃烧过程又可以称之为“氧化反应”,其产物就是二氧化碳和水。
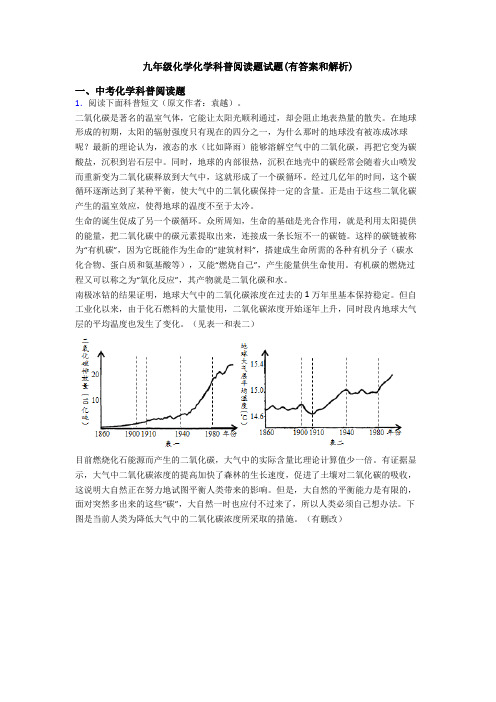
南极冰钻的结果证明,地球大气中的二氧化碳浓度在过去的1万年里基本保持稳定。
但自工业化以来,由于化石燃料的大量使用,二氧化碳浓度开始逐年上升,同时段内地球大气层的平均温度也发生了变化。
(见表一和表二)目前燃烧化石能源而产生的二氧化碳,大气中的实际含量比理论计算值少一倍。
有证据显示,大气中二氧化碳浓度的提高加快了森林的生长速度,促进了土壤对二氧化碳的吸收,这说明大自然正在努力地试图平衡人类带来的影响。
但是,大自然的平衡能力是有限的,面对突然多出来的这些“碳”,大自然一时也应付不过来了,所以人类必须自己想办法。
下图是当前人类为降低大气中的二氧化碳浓度所采取的措施。
(有删改)依据文章内容,回答下列问题。
(1)在地球形成的初期,地球没有被冻成冰球的原因是。
最新九年级化学化学科普阅读题题20套(带答案)

最新九年级化学化学科普阅读题题20套(带答案)一、中考化学科普阅读题1.查阅资料知:甲酸(HCOOH)是一种无色、有刺激性气味的液体,与浓硫酸混合加热的反应为:HCOOH CO↑+H2O。
实验室可利用下图装置制取CO并还原CuO。
请回答下列问题:(1)甲酸发生了________反应。
(填反应类型)(2)实验中应先通入一段时间CO,后加热CuO,目的是________。
(3)能证明甲酸生成CO的现象是①________;②________。
(4)点燃D处酒精灯的目的是________。
(5)写出B中CO与CuO发生的反应,用化学方程式表示________。
【答案】(1)分解反应(2)防止CO与空气混合,受热后爆炸(3)①B中黑色粉末逐渐变红②C中澄清石灰水变浑浊(顺序可颠倒)(4)除去未反应的CO,防止空气污染(5)CO+CuO△Cu+CO2【解析】试题分析∶根据所学知识和题中信息知,(1)甲酸发生了分解反应。
(2)实验中应先通入一段时间CO,后加热CuO,目的是防止CO与空气混合,受热后爆炸。
(3)能证明甲酸生成CO的现象是①B中黑色粉末逐渐变红②C中澄清石灰水变浑浊。
(4)点燃D处酒精灯的目的是除去未反应的CO,防止空气污染。
(5)写出B中CO与CuO发生的反应,用化学方程式表示CO+CuO△Cu+CO2考点∶考查制取CO并还原CuO。
2.阅读下面科普短文:亚硝酸盐广泛存在于自然环境和我们的生活中。
在粮食、豆类,蔬菜、肉类、蛋类等食物中,都可以检测出一定量的亚硝酸盐,蔬菜中一般都含有硝酸盐,含量高的是茎叶类蔬菜、其次是根茎类蔬、然后是瓜类蔬菜,它们在煮熟后如果久置,硝酸盐就会被分解为亚硝酸盐。
大剂量的亚硝酸盐能够将人体内血红素中的铁元素由+2价氧化为+3价,从而使其失去携氧能力,引起全身组织缺氧,即产生亚硝酸盐中毒。
当体内+3价铁血红蛋白达到20%-40%就会出现缺氧症状,达到70%以上可导致死亡。
(化学)化学科普阅读题练习题含答案及解析

(化学)化学科普阅读题练习题含答案及解析一、中考化学科普阅读题1.宁厂古镇位于重庆巫溪县附近,是中国早期制盐地之一,距今约5000年之久。
其主要的工艺流程如下:先将盐卤(亦称卤水或卤汁)引入深达数米的贮卤池沉淀杂质,再经笕管导入纵向排列的数口铁锅中开始熬。
卤水先经大火煎煮,迅速蒸发水分,然后利用豆汁或蛋清、猪血等吸附硫酸钙等杂质,再用竹编的筛子舀起,称为“提浆”。
提浆之后的锅内盐卤“清澈见底”,之后用小火慢慢熬煮,适时下母子渣盐(盐种),促使卤水结晶成盐粒。
已经结晶的盐粒还需要经过淋花水的工序。
花水是一种卤汁,将卤汁一遍遍淋在刚刚结晶的盐粒上,洗去盐粒表面残留的杂质,增加盐粒的亮泽度。
之后滤去残留的水分,再转至烘干炕摊开烘干,最后打包、计重、入库房。
(1)“提浆”和实验室“过滤”一样,都是为了除去溶液中不溶性杂质,在实验室的过滤操作中必需要用到的玻璃仪器有烧杯、玻璃棒和____。
(2)熬盐和实验室的____原理相同。
(3)竹编的筛子相当于实验室的过滤操作中所用到的____。
(4)花水是氯化钠的____(填“饱和”或“不饱和”)溶液。
(5)氯化钠是重要的化工原料。
工业上通过电解饱和食盐水来大量制取烧碱, 同时得到二种副产物氢气和氯气,反应的化学方程式为____。
【答案】漏斗 蒸发 滤纸 饱和 2222NaCl 2H O2NaOH Cl H ++↑+↑通电 【解析】【分析】【详解】(1)过滤过程中用到玻璃仪器有烧杯玻璃棒漏斗,故填:漏斗;(2)熬盐和实验室蒸发的原理相同,故填:蒸发;(3)竹编的筛子起到过滤作用,相当于滤纸,故填:滤纸;(4)花水是一种卤汁,洗去盐粒表面残留的杂质,只去除杂质不溶解氯化钠,是氯化钠的饱和溶液,故填:饱和;(5)电解饱和食盐水制取烧碱, 同时得到副产物氢气和氯气,化学方程式为: 2222NaCl 2H O2NaOH Cl H ++↑+↑通电【点睛】 该题考察过滤操作的原理,及注意事项2.阅读下列科普短文。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(化学)中考化学化学科普阅读题题20套(带答案)及解析一、中考化学科普阅读题1.阅读下列科普短文并回答问题:纯碱的用途非常广泛。
纯碱工业始创于18 世纪,西方国家对这一技术采取了严格的保密措施。
一些专家想探索此项技术的秘密,均以失败告终。
1943年,我国化学工程专家侯德榜针对西方纯碱生产时食盐利用率低,制碱成本高,废液、废渣污染环境和难以处理等不足,发明了侯氏制碱法又称联合制碱法。
发明原理第一步:氨气与水和二氧化碳反应生成一分子的碳酸氢铵。
先添加NH3而不是CO2:CO2在NaCl中的溶解度很小,先通入NH3使食盐水显碱性(用无色酚酞溶液检验),能够吸收大量CO2气体。
第二步:碳酸氢铵与氯化钠反应生成氯化铵和碳酸氢钠沉淀。
第三步:在5℃~ 10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥。
向时液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是:①增大NH4+的浓度,使NH4Cl更多地析出②使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。
联合法综合利用了合成氨的原料,提高了氯化钠的利用率,减少了环境污染。
NH3、CO2都来自于合成氨工艺:这样NH4Cl就成为另一产品化肥。
综合利用原料、降低成本、减少环境污染,NaCl利用率达96%。
第四步:加热碳酸氢钠制取纯碱。
温度溶解度物质0102030405060 NaCl35.735.836.036.336.637.037.3 NH4HCO311.916.121.728.436.644.159.2 NaHCO3 6.98.159.611.112.714.416.4 NH4Cl29.433.337.241.445.850.455.2阅读短文,回答下列问题:(1)写出侯氏制碱法第二步的化学反应方程式_____。
(2)饱和食盐水中持续通入氨气和二氧化碳气体后,溶液中大量存在的离子有_____。
(3)第二步的复分解反应发生时,常温下向溶液中持续通入氨气和二氧化碳气体,碳酸氢钠以沉淀的形式先析出的原因是_____。
(4)写出侯氏制碱法的一个优点_____。
(5)循环利用的物质是_____。
(6)侯氏制碱法中没有涉及的化学反应类型是_____。
(7)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,_____。
【答案】4334NaCl NH HCO NaHCO NH Cl +=↓+ Na +、NH 4+、HCO 3-、Cl - NaHCO 3溶解度最小,最易形成饱和溶液而析出晶体 绿色、环保、无污染、原材料利用率高(填一个即可) 二氧化碳、饱和食盐水 置换反应 先滴加过量的稀硝酸,再滴加硝酸银溶液,生成白色沉淀则说明有氯化钠,否则没有 【解析】 【详解】(1)侯氏制碱法第二步是碳酸氢铵与氯化钠反应生成氯化铵和碳酸氢钠沉淀,反应的化学反应方程式是4334NaCl NH HCO NaHCO NH Cl +=↓+。
故填:4334NaCl NH HCO NaHCO NH Cl +=↓+。
(2)饱和食盐水中持续通入氨气和二氧化碳气体后,氨气与水和二氧化碳反应生成一分子的碳酸氢铵,溶液中有氯化钠、碳酸氢铵,含有的离子是:Na +、NH 4+、HCO 3-、Cl -; 故填:Na +、NH 4+、HCO 3-、Cl -。
(3)第二步发生复分解反应时,常温下向溶液中持续通入氨气和二氧化碳气体,从表中所给的数据可以得到碳酸氢钠的溶解度最小,所以碳酸氢钠以沉淀的形式先析出; 故填:NaHCO 3溶解度最小,最易形成饱和溶液而析出晶体。
(4)侯氏制碱法的优点有绿色、环保、无污染、原材料利用率高; 故填:绿色、环保、无污染、原材料利用率高(合理即可)。
(5)从流程图可以得到,二氧化碳、饱和食盐水在反应物和生成物中都有,所以循环利用的物质是二氧化碳、饱和食盐水; 故填:二氧化碳、饱和食盐水。
(6)侯氏制碱法中,二氧化碳与水反应生成碳酸,是化合反应;氯化钠与碳酸氢铵反应生成碳酸氢钠和氯化钠是复分解反应;碳酸氢钠分解生成碳酸钠、水和二氧化碳是分解反应,没有涉及的化学反应类型是置换反应;故填:置换反应。
(7)为检验产品碳酸钠中是否含有氯化钠,也就是检验溶液中是否含有氯离子,可取少量试样溶于水后,先滴加过量的稀硝酸,再滴加硝酸银溶液,生成白色沉淀则说明有氯化钠,否则没有;故填:先滴加过量的稀硝酸,再滴加硝酸银溶液,生成白色沉淀则说明有氯化钠,否则没有。
2.活性氧化锌(ZnO )粒径介于1~100nm ,是一种面向21世纪的新型高功能精细无机产品。
某科研小组利用某废弃的氧化铜锌矿(主要成分为CuO 和ZnO ,其余成分既不与酸反应,也不溶解于水)回收铜,并制备活性氧化锌。
(查阅资料)()()4324422Z ZnSO +n +2NH H OOH NH SO ⋅↓;()4323424ZnSO +4NH H OZn NH SO +4H O ⎡⎣⎦⋅⎤;()22Zn OH ZnO+H O △常温下氢氧化物沉淀时溶液的pH 见下表: 氢氧化物 ()3Fe OH()2Fe OH()2Zn OH()2Cu OH开始沉淀时的pH1.97.06.04.7沉淀完全时的pH3.2 9.0 8.0 6.7(实验设计)设计的部分实验流程如图所示:请根据上述资料和实验流程回答下列问题: (1)操作1的名称是____________。
(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为_______________。
(3)加过量铁粉后,发生反应的基本反应类型是__________,得到滤渣1的成分为__________。
(4)加入双氧水的作用是___________;不选用高锰酸钾,而选用双氧水的优点是_______。
(5)完成操作2的实验步骤①___________;②_______;③灼烧。
(交流反思)(6)从绿色化学的角度分析上述实验流程,除了能回收金属单质和活性氧化锌外,还可以获取的有用副产品是(写出化学式,并指明其用途)________。
【答案】过滤 2442CuO+H SO CuSO +H O ;2442ZnO+H SO ZnSO +H O 置换反应 Cu 、Fe 将4FeSO (2Fe +)氧化成()243Fe SO (3Fe +),以便在后续操作中将溶液中的铁元素除去 不引入较难除去的杂质 加入适量稀硫酸,调节溶液的pH 至8.0 过滤、洗涤、干燥 23Fe O 作颜料、()442NH SO 作化肥 【解析】 【分析】 【详解】 实验设计:(1)操作1是使不溶性物质氢氧化铁和其他可溶性物质分离的过程,为过滤; (2)在氧化铜锌矿中加入过量稀硫酸,目的是使氧化铜和氧化锌完全反应进入溶液,主要成分发生反应的化学方程式为:2442=CuO+H SO CuSO +H O 、2442=ZnO+H SO ZnSO +H O ;(3)由于加入铁粉前是硫酸铜、硫酸锌以及剩余的硫酸的混合溶液,加入铁粉,反应的反应分别为:44Fe+CuSO =Cu+FeSO 和2442=F Fe+H SO SO +H e ↑,都是单质和化合物反应生成新的单质和新的化合物,为置换反应。
反应后,由于加入的铁过量,所以滤渣含有剩余的Fe ,同时还有生成的Cu 。
(4)加入双氧水的作用是 4FeSO (2Fe +)氧化成()243Fe SO (3Fe +),以便在后续操作中将溶液中的铁元素除去;不选用高锰酸钾,而选用双氧水的优点是:不引入较难除去的杂质。
(5)()2Zn OH 沉淀完全时的pH 为8.0,故操作2的实验步骤为:①加入适量稀硫酸,调节溶液的pH 至8.0;②过滤、洗涤、干燥;③灼烧。
交流反思:(6)从绿色化学的角度分析上述实验流程,除了能回收金属单质和活性氧化锌外,()3Fe OH 受热可得到23Fe O ,可作颜料,以及()442NH SO 可作化肥,故还可以获取的有用副产品是:23Fe O 作颜料、()442NH SO 作化肥。
3.阅读下面科普短文然后回答问题。
氢能源汽车氢能汽车是以氢气为主要能量的汽车。
一般的内燃机,通常注入柴油或汽油。
氢能汽年有许多优点,首先是干净卫生,氮气燃烧府的产物是水,不会污染环境;其次是氮气在燃烧时比汽油的发热量高。
近年来,国际上以氨为燃料的“燃科电池受动机”技术取得重大突破,而“燃料电池汽车”已成为推动“氮经济”的发动机,氢气可以通过电解水、水煤气转化等方法大量制取,而且不需要对汽车发动机进行大的改装,因此氢能汽车具有广阔的应用前示,推广氢能汽车需要解决三个技术问题:大量制取廉价氯气的方法;解决氢气的安全储运问题:解决汽车所常的高性能、廉价的氧供给系统。
随着储氢材料的研究进展,科学家们研制的高效率氮燃料电池,减小了氢气损失和热量散失。
我国在氢能汽车研发领域取得重大突破。
据国内媒体报道,现代FE 氢燃料电池车亮相2017广州车展,该车采用了第四代氢燃料电池技术,内部有三个同尺寸的储氢罐组成,实现了世界最高的氢气存储密度,最大续航能力可达800公里。
(1)汽油、柴油是_________炼制的产品。
(填一种化石燃料) (2)氢气燃烧的化学方程式是________。
(3)氢燃料电池车的优点是_______________。
(答出一点即可)(4)2017年广州车展的现代FE 氢燃料电池车还具有以下特殊的性能____________。
(5)你认为氢能汽车具有广阔的应用前景的依据是____________。
(6)下列说法正确的是_______。
A .目前,通过电解水获取的氢气价格昂贵B .氢能汽车行驶时可将机械能转变为化学能C .我国在氢能源汽车的研究领域已取得重大突破D .以汽油为燃料的汽车行驶时可向空气中排放有毒气体和烟尘 【答案】石油 2222H O 2H O 点燃干净卫生,氢气燃烧后的产物是水,不会污染环境;氢气在燃烧时比汽油的发热量高;(答出一点即可) 世界最高的氢气存储密度,最大续航能力可达800公里 氢气可以通过电解水、水煤气转化等方法大量制取,而且不需要对汽车发动机进行大的改装 ACD 【解析】 【分析】 【详解】(1)汽油、柴油是石油炼制的产品; (2)氢气与氧气在点燃的条件下反应生成水;(3)氢燃料电池车的优点是:干净卫生,氢气燃烧产物是水,不污染环境,氢气在燃烧时比汽油的发热量高;(4)2007年广州车展的现代FE 氢燃料电池车还具有以下特殊的性能:最高的氢气储存密度,最大续航能力可达800公里;(5)氢气可以通过电解水、水煤气转化等方面大量制取,而且不需要对汽车发动机进行大的改装,所以氢能汽车具有广阔的应用前景;(6)A 、目前通过电解水获得氢能,成本高、效率低,应寻找合适的催化剂,故正确。
