(完整word版)高中化学选修三习题附答案
化学选修三试题及答案

化学选修三试题及答案一、选择题(每题3分,共30分)1. 下列物质中属于纯净物的是()。
A. 空气B. 矿泉水C. 蒸馏水D. 盐水2. 根据元素周期表,下列元素中属于金属元素的是()。
A. 碳B. 氧C. 钠D. 硫3. 下列化合物中,属于共价化合物的是()。
A. NaClB. CaOC. HClD. MgO4. 化学反应速率与反应物浓度的关系是()。
A. 无关B. 成正比C. 成反比D. 无关5. 根据化学平衡原理,下列说法正确的是()。
A. 化学平衡是动态平衡B. 化学平衡是静态平衡C. 化学平衡是完全反应D. 化学平衡是不可逆反应6. 根据酸碱中和反应的原理,下列说法正确的是()。
A. 酸和碱反应一定生成盐和水B. 酸和碱反应一定生成盐和二氧化碳C. 酸和碱反应一定生成盐和氧气D. 酸和碱反应不一定生成盐和水7. 根据氧化还原反应的原理,下列说法错误的是()。
A. 氧化还原反应中一定有元素化合价的变化B. 氧化还原反应中一定有电子的转移C. 氧化还原反应中一定有元素的氧化态变化D. 氧化还原反应中一定有元素的还原态变化8. 根据原子结构,下列说法正确的是()。
A. 原子核由质子和中子组成B. 原子核由质子和电子组成C. 原子核由质子和原子组成D. 原子核由中子和电子组成9. 根据化学键的类型,下列说法正确的是()。
A. 离子键只存在于金属和非金属之间B. 共价键只存在于非金属和非金属之间C. 金属键只存在于金属元素之间D. 离子键和共价键都存在于金属和非金属之间10. 根据物质的溶解性,下列说法正确的是()。
A. 所有盐类都能溶于水B. 所有盐类都不能溶于水C. 盐类的溶解性与离子的极性有关D. 盐类的溶解性与离子的大小有关二、填空题(每空2分,共20分)1. 元素周期表中,第IA族的元素是______。
2. 根据化学键的类型,氯化钠中的化学键是______。
3. 化学反应中,能量变化的两种形式是______和______。
化学选修三练习题及答案及解析

化学选修三练习题及答案及解析2、以下各能层中不包含p能级的是A. N B. M C. L D.K3、以下能级中轨道数为3的是A. s能级B. p能级C. d能级D. f能级4、下列各原子或离子的电子排布式错误的是 A. K+ 1s22s22p63s23p B. F 1s22s22p C. S2- 1s22s22p63s23pD.Ar1s22s22p63s23p61、从原子结构的观点看,元素周期表中同一横行的短周期元素,其相同,不同;同一纵行的主族元素,其最外层电子数相同,能层数不同。
2、除第一和第七周期外,每一周期的元素都是从元素开始,以结束。
4、甲元素原子核电荷数为17,乙元素的正二价离子跟氩原子的电子层结构相同:甲元素在周期表中位于第周期,第主族,电子排布式是,元素符号是,它的最高价氧化物对应的水化物的化学式是乙元素在周期表中位于第周期,第主族,电子排布式是,元素符号是,它的最高价氧化物对应的水化物的化学式是三ⅦA1s22s22p63s23p5ClHClO4四ⅡA 1s22s22p63s23p64sCa Ca21、下列说确的是A. 处于最低能量的原子叫做基态原子B.p2表示3p能级有两个轨道C. 同一原子中,1s、2s、3s电子的能量逐渐减小D. 同一原子中,2p、3p、4p能级的轨道数依次增多2、X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是A. XYZB. X2YZC. X2YZD. XYZ33、下列说法中,不符合ⅦA族元素性质特征的是A. 从上到下原子半径逐渐减小B. 易形成-1价离子C. 从上到下单质的氧化性逐渐减弱D. 从上到下氰化物的稳定性依次减弱、下列说法中,正确的是A. 在周期表里,主族元素所在的族序数等于原子核外电子数B. 在周期表里,元素所在的周期数等于原子核外电子层数C. 最外层电子书为8的都是稀有气体元素的原子D. 元素的原子序数越大,其原子半径也越大6、A、B、C、D都是短周期元素。
高中化学选修三教材答案
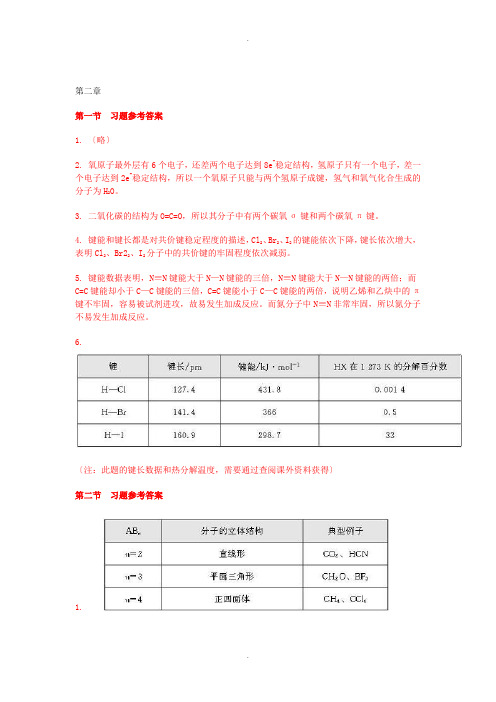
第二章第一节习题参考答案1. 〔略〕2. 氧原子最外层有6个电子,还差两个电子达到8e-稳定结构,氢原子只有一个电子,差一个电子达到2e-稳定结构,所以一个氧原子只能与两个氢原子成键,氢气和氧气化合生成的分子为H2O。
3. 二氧化碳的结构为O=C=O,所以其分子中有两个碳氧σ键和两个碳氧π键。
4. 键能和键长都是对共价键稳定程度的描述,Cl2、Br2、I2的键能依次下降,键长依次增大,表明Cl2、Br22、I2分子中的共价键的牢固程度依次减弱。
5. 键能数据表明,N≡N键能大于N—N键能的三倍,N≡N键能大于N—N键能的两倍;而C=C键能却小于C—C键能的三倍,C=C键能小于C—C键能的两倍,说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应。
而氮分子中N≡N非常牢固,所以氮分子不易发生加成反应。
6.〔注:此题的键长数据和热分解温度,需要通过查阅课外资料获得〕第二节习题参考答案1.2. 在乙炔分子中,2个碳原子各以1个sp杂化轨道与氢原子形成1个碳氢σ键,同时又各以其另1个sp杂化轨道形成1个碳碳σ键,除此之外,每个碳原子通过2个未参加杂化的p轨道〔相互垂直〕形成了2个π键,因此,乙炔的三键中有1个σ键和2个π键。
3. 甲醛分子的立体结构:碳原子采取sp2杂化,甲醛分子中有2个C—H σ键,而C—O之间有1个σ键和1个π键。
4. 氢离子接受水分子中氧原子上的孤对电子以配位键形成H3O+,电子对给予体是H2O,接受体是H+。
5. 银离子与氯离子形成难溶的氯化银沉淀。
加入氨水后,银离子接受氨分子中氮原子给出的孤对电子以配位键形成[Ag〔NH3〕2]+,由于生成了可溶性的[Ag〔NH3〕2]+,继续加入氨水时氯化银就溶解了。
第三节习题参考答案1. 水是角形分子,氢氧键为极性键,所以水分子中正电荷的中心和负电荷的中心不重合,为极性分子。
而二氧化碳为直线形分子,虽然碳氧键为极性键,但分子的正电荷的中心和负电荷的中心重合,所以为非极性分子。
(word完整版)高中化学选修3物质结构与性质习题附答案

(word完整版)⾼中化学选修3物质结构与性质习题附答案《物质结构与性质》同步复习第1讲原⼦结构1题⾯(1)34.969是表⽰__________;(2)35.453是表⽰__________;(3)35是表⽰_______________;(4)35.485是表⽰__________;(5)24.23%是表⽰__________;答案:(1)34.969是表⽰同位素35Cl 的相对原⼦质量;(2)35.453是表⽰氯元素的相对原⼦质量;(3)35是表⽰35Cl 原⼦的质量数;(4)35.485是表⽰氯元素的近似相对原⼦质量;(5)24.23%是表⽰同位素37Cl 在⾃然界存在的氯元素中所占的原⼦个数百分⽐。
5题⾯已知A 、B 、C 、D 和E 5种分⼦所含原⼦数⽬依次为1、2、3、4和6,且都含有18个电⼦。
⼜知B 、C 和D 是由两种元素的原⼦组成。
请回答:(1)组成A 分⼦的原⼦的核外电⼦排布式是;(2)B 和C 的分⼦式分别是和;C 分⼦的⽴体结构呈型,该分⼦属于分⼦(填“极性”或“⾮极性”);(3)若向D 的稀溶液中加⼊少量⼆氧化锰,有⽆⾊⽓体⽣成。
则D 的分⼦式是,该反应的化学⽅程式为;(4)若将1mol E 在氧⽓中完全燃烧,只⽣成1mol CO 2和2molH 2O ,则E 的分⼦式是。
答案:(1)1s 22s 22p 63s 23p 6 (2)HCl H 2S V 极性(3)H 2O 2 2H 2O22H 2O+O 2↑(4)CH 4O1题⾯答案:①1s 22s 22p 63s 23p 5 ②3s 23p 5 ③3 ④ⅦA ⑤10 ⑥2s 22p 6 ⑦2 ⑧0 ⑨24 ⑩1s 22s 22p 63s 23p 63d 54s 1 ⑾4 2题⾯(1)砷原⼦的最外层电⼦排布式是4s 24p 3,在元素周期表中,砷元素位于_______周期族;最⾼价氧化物的化学式为,砷酸钠的化学式是。
化学-选修3课后习题

化学(选修3)课后习题第一章原子结构与性质1、原子结构1.以下能级符号正确的是()A.6s B.2d C.3f D.7p2.以下各能层中不包含p能级的是()A.N B.M C.L D.K3、以下能级中轨道数为3的是()A.s能级B.p能级C.d能级D.f能级4.下列各原子或离子的电子排布式错误的是()A.K+1s22s22p63s23p6B.F 1s22s22p5C.S2-1s22s22p63s23p4D.Ar 1s22s22p63s23p65.下列各图中哪一个是氧原子最外层的电子排布图?()6.以下电子排布式是不是基态原子的电子排布?A.1s12s1()B.1s22s12p1()C.1s22s22p63s2()D. 1s22s22p63p1()7.按构造原理写出第9、17、35号元素原子的电子排布式。
它们核外电子分别有几层?最外层电子数分别为多少?8.在元素周期表中找出钠和硫,按构造原理写出它们的电子排布式和电子排布图,并预言它们的最高价化合价和最低化合价。
2、原子结构与元素的性质1.从原子结构的观点看,元素周期表中同一横行的短周期元素,其相同,不同;同一纵行的主族元素,其相同,不同。
2.除第一和第七周期外,每一周期的元素都是从元素开始,以结束。
3原子序数电子排布式在周期表中的位置是金属还是非金属最高价氧化物的水化物化学式与酸碱性气态氢化物的化学式151s22s22p63s23p4第二周期V A族4.甲元素原子核电荷数为17,乙元素的正二价离子跟氩原子的电子层结构相同:(1)甲元素在周期表中位于第周期,第主族,电子排布式是,元素符号是,它的最高价氧化物对应的水化物的化学式是(2)乙元素在周期表中位于第周期,第主族,电子排布式是,元素符号是,它的最高价氧化物对应的水化物的化学式是5.主族元素和副族元素的电子排布有什么不同的特征?主族元素的价电子层和副族元素的价电子层有何不同?6.有人把氢在周期表中的位置从ⅠA移至ⅦA,怎样从电子排布和化合价理解这种做法?7.元素的金属性与非金属性随核电荷数递增呈现周期性变化,给出具体例子对这种变化进行陈述。
人教版高中化学选修3全册同步课时练习及答案汇编

人教版高中化学选修3同步练习及解析目录1.1 原子结构.doc1.1.1 能层、能级、构造原理1.1.2 能量最低原理、泡利原理、洪特规则1.2 原子结构与元素的性质1.2.1 原子结构与元素周期表1.2.2 元素周期律第1章单元质量检测试题及解析2.1.1 共价键2.1.2 键参数等电子体2.2 分子的立体构型2.2.1 价层电子对互斥理论2.2.2 杂化轨道理论2.2.3 配合物理论简介2.3 分子的性质第1课时键的极性和分子的极性2.3 分子的性质第2课时范德华力和氢键2.3.4 溶解性、手性、无机含氧酸分子的酸性第2章单元质量检测试题及解析3.1.1 晶体与非晶体3.1.2 晶胞3.2 分子晶体与原子晶体3.2.1 分子晶体3.2.2 原子晶体3.3 金属晶体3.3.1金属键、金属晶体的原子堆积模型.doc3.4 离子晶体3.4.1 离子晶体、晶格能第3章单元质量检测试题及解析1.1 原子结构基础落实知识点1 能层、能级、构造原理1.下列叙述正确的是( )A.能级就是电子层B.每个能层最多可容纳的电子数是2n2C.同一能层中的不同能级的能量高低相同D.不同能层中的s能级的能量高低相同2.下列有关认识正确的是( )A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n-1D.各能层含有的电子数为2n23.下列各项中,前面的能级先填入电子的是( )①3d和4s ②4p和5s ③5s和4d ④5p和4dA.①② B.②③C.②④ D.③④知识点2 核外电子的排布规律4.下列电子排布图能表示氮原子的最低能量状态的是( )A.B.C.D.5.具有如下电子层结构的原子,其相应元素一定属于同一主族的是( ) A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子B.3p亚层上只有1个空轨道的原子和4p亚层上只有1个空轨道的原子C.最外层电子排布为n s2的原子和最外层电子排布为n s2n p6的原子D.最外层电子排布为3s2的原子和最外层电子排布为4s2的原子6.下列各组表述中,两个微粒一定不属于同种元素原子的是( )A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子B .M 层全充满而N 层为4s 2的原子和核外电子排布为1s 22s 22p 63s 23p 63d 64s 2的原子C .最外层电子数是核外电子总数的15的原子和最外层电子排布为4s 24p 5的原子 D .2p 能级有一个未成对电子的基态原子和原子的价电子排布为2s 22p 5的原子知识点3 原子光谱、电子云与原子轨道7.对充有氖气的霓虹灯管通电,灯管发出红色光。
人教版高中化学选修3全册同步课时练习及答案汇编

人教版高中化学选修3同步练习及解析目录1.1 原子结构.doc1.1.1 能层、能级、构造原理1.1.2 能量最低原理、泡利原理、洪特规则1.2 原子结构与元素的性质1.2.1 原子结构与元素周期表1.2.2 元素周期律第1章单元质量检测试题及解析2.1.1 共价键2.1.2 键参数等电子体2.2 分子的立体构型2.2.1 价层电子对互斥理论2.2.2 杂化轨道理论2.2.3 配合物理论简介2.3 分子的性质第1课时键的极性和分子的极性2.3 分子的性质第2课时范德华力和氢键2.3.4 溶解性、手性、无机含氧酸分子的酸性第2章单元质量检测试题及解析3.1.1 晶体与非晶体3.1.2 晶胞3.2 分子晶体与原子晶体3.2.1 分子晶体3.2.2 原子晶体3.3 金属晶体3.3.1金属键、金属晶体的原子堆积模型.doc3.4 离子晶体3.4.1 离子晶体、晶格能第3章单元质量检测试题及解析1.1 原子结构基础落实知识点1 能层、能级、构造原理1.下列叙述正确的是( )A.能级就是电子层B.每个能层最多可容纳的电子数是2n2C.同一能层中的不同能级的能量高低相同D.不同能层中的s能级的能量高低相同2.下列有关认识正确的是( )A.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n-1D.各能层含有的电子数为2n23.下列各项中,前面的能级先填入电子的是( )①3d和4s ②4p和5s ③5s和4d ④5p和4dA.①② B.②③C.②④ D.③④知识点2 核外电子的排布规律4.下列电子排布图能表示氮原子的最低能量状态的是( )A.B.C.D.5.具有如下电子层结构的原子,其相应元素一定属于同一主族的是( ) A.3p亚层上有2个未成对电子的原子和4p亚层上有2个未成对电子的原子B.3p亚层上只有1个空轨道的原子和4p亚层上只有1个空轨道的原子C.最外层电子排布为n s2的原子和最外层电子排布为n s2n p6的原子D.最外层电子排布为3s2的原子和最外层电子排布为4s2的原子6.下列各组表述中,两个微粒一定不属于同种元素原子的是( )A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子B .M 层全充满而N 层为4s 2的原子和核外电子排布为1s 22s 22p 63s 23p 63d 64s 2的原子C .最外层电子数是核外电子总数的15的原子和最外层电子排布为4s 24p 5的原子 D .2p 能级有一个未成对电子的基态原子和原子的价电子排布为2s 22p 5的原子知识点3 原子光谱、电子云与原子轨道7.对充有氖气的霓虹灯管通电,灯管发出红色光。
2021-2022高中化学人教版选修3作业第二章第2节价层电子对互斥理论(系列二)Word版含解析

课时作业8价层电子对互斥理论时间:45分钟满分:100分一、选择题(共48分)1.(双选题)能说明CH4分子的5个原子不在同一平面而为正四面体结构的是()A.两个键之间的夹角为109°28′B.C—H键为极性共价键C.4个C—H键的键能、键长相同D.二氯甲烷没有同分异构体解析:CH4分子的空间结构由两个键之间的夹角决定,只有正四面体结构中,键角才为109°28′。
分子的空间构型与共价键的极性无关。
同样二氯甲烷没有同分异构体也说明了CH4分子为正四面体结构,如果为平面结构,则二氯甲烷就存在两种构型。
C项中因为同为C—H 键,不论分子构型如何,它们的键能、键长都相等。
答案:AD2.用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是()A.NH+4为正四面体形B.CS2为直线形C.HCN为V形D.PCl3为三角锥形解析:NH+4、CS2、HCN中心原子上的价电子都用于形成共价键,没有孤电子对,所以其构型分别为正四面体形、直线形、直线形;PCl3中心P原子上有一对孤电子对,未用于形成共价键,其空间构型为三角锥形。
答案:C3.用价层电子对互斥理论判断SO3的分子构型为()A.正四面体形B.V形C.三角锥形D.平面三角形解析:本题考查用价层电子对互斥模型判断分子的构型,SO3中S原子的价电子全部用于形成共价键,S原子周围有3个氧原子,应属于平面三角形。
答案:D4.据报道,大气中存在一种潜在的温室气体SF5—CF3,虽然其数量有限,但它是已知气体中吸热最高的气体。
关于SF5—CF3的说法正确的是()A.分子中有σ键也有π键B.所有原子在同一平面内C.CF4与CH4都是正四面体结构D.0.1 mol SF5—CF3分子中电子数为8 mol解析:A项,分子中都是σ键,无π键,错误;B项,碳原子与其相连的四个原子形成四面体结构,不可能所有原子共平面;C项,正确;D项,一个分子中有94个电子,错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
…装…………○○…………__姓名:___________班 …装…………○○…………第II 卷(非选择题) 一、综合题:共4题 每题15分 共60分 1.金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度。
其单质和化合物具有广泛的应用价值。
氮化钛(Ti 3N 4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。
以TiCl 4为原料,经过一系列反应可以制得Ti 3N 4和纳米TiO 2(如图1)。
如图中的M 是短周期金属元素,M 的部分电离能如下表: 请回答下列问题: (1)Ti 的基态原子外围电子排布式为________________。
(2)M 是______(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为________。
(3)纳米TiO 2是一种应用广泛的催化剂,纳米TiO 2催化的一个实例如图2所示。
化合物甲的分子中采取sp 2方式杂化的碳原子有__________个,化合物乙中采取sp 3方式杂化的原子对应的元素的电负性由大到小的顺序为________________。
(4)有一种氮化钛晶体的晶胞与NaCl 晶胞相似,如图3所示,该晶胞中N 、Ti 之间的最近距离为a pm ,则该氮化钛的密度为______________ g·cm -3(N A 为阿伏加德罗常数的值,只列计算式)。
该晶体中与N 原子距离相等且最近的N 原子有________个。
(5)科学家通过X -射线探明KCl 、MgO 、CaO 、TiN 的晶体与NaCl 的晶体结构相似。
且知三种离子晶体的晶格能数据如下: KCl 、CaO 、TiN 三种离子晶体熔点由高到低的顺序为________________。
【答案】(1)3d 24s 2 (2)Mg 12 (3)7 O>N>C (4) 12 (5)TiN>CaO>KCl 【解析】本题主要考查的是物质的结构和性质。
(1)Ti 位于第四周期,第IVB 族,外围电子排布为3d 24s 2,故答案为3d 24s 2;(2)金属M 的第三电离能远远大于第二电离能,所以M 应为短周期第IIA 族元素,又因M 可把Ti 置换出来,所以M 应为Mg ,其晶体堆积模型为六方最密堆积,配位数为12,故答案为:Mg ,12;(3)化合物甲的分子中采取Sp 2杂化的碳原子由苯环上的6个碳原子和羧基中的一个,共7个,根据化合物乙的结构可知Sp3杂化的原子有羟基中的氧,氨基中的氮,碳链上的三个碳,C、N、O都位于第二周期,原子序数递增,电负性逐渐增大,所以它们的电负性关系为:O>N>C,故答案为:7,O>N>C;(4)由晶胞结构可知,N原子位于立方体晶胞的8个顶点,6个面心,而Ti原子位于立方体晶胞的12个棱中点和1个体心,根据均摊法可算出该晶胞中N原子个数为8×+6×=4,该晶胞中Ti原子数为:12×+1=4,晶胞质量为m=×4+×4=,晶胞中N、Ti之间的最近距离为立方体边长的一半,所以立方体边长为2a pm,则晶胞的体积V=(2a×10-10)3 cm3,所以晶体的密度ρ==;以顶点的N原子为例,顶点的N原子离面心上的N原子距离最近,则与顶点N原子同层上的有4个晶胞中的4个面心上的N原子,同样上层4个,下层4个,共12个,故答案为,12;(5)由表中数据可知,离子晶体所带电荷越大,晶格能也越大,KCl中,离子都带1个单位的电荷,CaO中离子都带2个单位的电荷,TiN中离子都带3个单位的电荷,所以晶格能TiN>CaO>KCl,而晶格能越大,离子晶体熔点越高,所以三种离子晶体熔点由高到低的顺序为:TiN>CaO>KCl,故答案为:TiN>CaO>KCl。
【备注】无2.X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。
X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。
请回答下列问题:(1)R核外电子排布式为__________________。
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为__________,离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_________________(填化学式),原因是_________________________________________________________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为_________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________(填化学式)。
Na+的配位数为________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。
已知该晶胞的密度为ρ g ·cm3,阿伏加德罗常数为N A,则两个最近的W离子间距离为 nm。
(用含ρ、N A的计算式表示)【答案】(1) 1s22s22p63s23p2 (2) sp2、sp3;平面三角形; (3) SiO2;SiO2为原子晶体,CO2为分子晶体;(4) 2Cu+8NH 3+O2+2H2O2[Cu(NH3)4]2++4OH−; (5) Na2O; 4;立方体; ×107【解析】本题考查物质结构综合推断题,涉及原子核外电子排布,化合物中心原子的杂化,分子空间构型,晶胞的有关计算等。
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。
X是所有元素中原子半径最小的,是H元素;Y有三个能级,且每个能级上的电子数相等,电子排布式为1s22s22p2,是C元素;Z原子单电子数在同周期元素中最多,是N元素;W与Z同周期,第一电离能比Z的低,原子序数比N大,是O元素;R与Y同一主族,是Si元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,是Cu元素。
(1)R(Si)………装……………○……线…………○…__________姓名:_______________………装……………○……线…………○…核外电子排布式为1s 22s 22p 63s 23p 2(2) X 、Y 、Z 、W 形成的有机物CO(NH 2)2中C 、N 的杂化轨道类型分别为 sp 2、sp 3;离子中心原子N 孤电子对数形成3个,立体构型是平面三角形;(3) Y 、R 的最高价氧化物分别是CO 2和SiO 2,沸点较高的是SiO 2;SiO 2为原子晶体,CO 2为分子晶体;(4) 将Q(Cu)单质的粉末加入到ZX 3(NH 3)的浓溶液中,并通入O 2,充分反应后溶液呈深蓝色,生成铜氨络离子,该反应的离子方程式为2Cu+8NH 3+O 2+2H 2O 2[Cu(NH 3)4]2++4OH −;(5)该晶胞中钠离子位于晶胞体心,有8个,氧离子位于顶点和面心,分摊4个,所以化学式为Na 2O ;Na +的配位数为4;距一个阴离子周围最近的所有阳离子为顶点构成的几何体为立方体;晶胞体积为,则两个最近的W 离子间距离为×107 nm 【备注】无3.[化学—选修3:物质结构与性质] 在元素周期表中,除稀有气体外几乎所有元素都能氢形成氢化物。
(1)氨气属于共价型氢化物,工业常用氨气和醋酸二氨合铜[Cu(NH 3)2]Ac 的混合液来吸收一氧化碳(醋酸根CH 3COO -简写为Ac -)。
反应方程式为:[Cu(NH 3)2]Ac+CO+NH 3 [Cu(NH 3)3CO]Ac ①请写出基态Cu +离子的价电子排布式_________________。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为_______________,理由是_________;其中NH 3应为_________(填“极性”或“非极性”)分子。
③醋酸分子(CH 3COOH)中的两个碳原子的杂化方式分别是_________________。
④生成物[Cu(NH 3)3CO]Ac 中所含化学键类型有_________(填序号)。
a.离子键 b.金属键 c.共价键 d.配位键 (2)某离子型氢化物化学式为XY 2,晶胞结构如图所示,其中6个Y 原子(○)用阿拉伯数字16标注。
①已知1、2、3、4号Y 原子在晶胞上、下面上。
则5、6号Y 原子均在晶胞_________(填“侧面”或“内部”)。
②根据以上信息可以推知,XY 2晶体的熔沸点______(填“>”“=”或“<”)固态氨的熔沸点。
③若该晶胞的边长为a nm ,密度为ρg/cm 3,XY 2的摩尔质量为M g/mol ,则阿伏加德罗常数为______。
【答案】(1)①3d 10 ②N >O >H 氮原子的2p 轨道为半充满结构,相对稳定,氧与氢比较,氧原子核电荷数大,非金属性强,难失电子,极性 ③sp 3 sp 2 ④acd (2)①内部 ②> ③ 【解析】本题考查了物质结构与性质。
(1)①Cu 元素为29号元素,原子核外由29个电子,故基态Cu +离子的价电子排布式为3d 10。
②氨水溶液中含有N 、O 、H 三种元素,N 原子的2p 轨道为半充满结构,相对稳定,O 与H 比较,O 原子核电荷数大,非金属性强,难失电子,故第一电离能由大到小的顺序为N >O >H 。
③甲基中C 原子形成4个单键,杂化轨道数目为4,采用sp 3杂化,羧基中C 原子形成3个σ 键,杂化轨道数为3,采用sp 2杂化。
④铜离子与氨气之间存在配位键,氨气中N与H形成共价键,[Cu(NH3)3CO]+与Ac-之间是离子键,故该题选abd。
(2)①X位于8个顶点和一个体心,晶胞中一共含有2个X,由化学式XY2可知,该晶胞中含有4个Y,又1、2、3、4号Y原子在晶胞的上下面上,则实际为2个Y原子,则5、6号Y原子均在晶胞内部。
②XY2晶体为离子晶体、固态氨为分子晶体,所以XY2晶体的熔沸点比固态氨高。
③一个晶胞中含有2个XY2,XY2的摩尔质量为M g/mol,则晶胞的质量为g,若该晶胞的边长为a nm,则晶胞的体积为=a3×10-21cm3,晶胞的密度为ρg/cm3,则= a3×10-21,解得N A=。
【备注】无4.如图分别是金刚石、石墨、足球烯和碳纳米管的结构示意图。
