第四章 胶体化学(合)
胶体化学(物化重难点)

电势的值小于热力学电势且受外加电解质的影响很大;决定胶粒电泳速度的物理量是
电势,而不是热力学电势;向溶胶中加入电解质,可改变 电势,但对热力学电势无影响;
电势等于零的状态称为等电态,在等电态,扩散层厚度为零,胶粒不带电,在电场作用
下,无电泳现象。 10.2.7 胶团结构 溶胶的胶团结构分为胶核、 胶粒及胶团三个层次。 以AgCl溶胶为例, 当用KCl与AgNO 3 制备AgCl溶胶时,胶粒和胶团的组成、结构与KCl和AgNO 3 相对用量有关,若AgNO 3 过量, 则胶粒与胶团结构如图 2,即 胶体粒子 滑动面
10.2.1 胶体定义:分散相粒子在某维上的线度为 1 nm~100nm 时的高分散系统称为胶 体。按分散相粒子线度分类:分子分散系统(真溶液,如乙醇水溶液) 、胶体分散系统(如 碘化银溶胶) 、粗分散系统(如牛奶) 。 10.2.2 按胶体系统稳定性分类 憎液溶胶: 分散相不能溶于分散介质中所形成的胶体系统。 对于由金属及难溶于水的卤 化物、硫化物或氢氧化物等在水中形成的胶体称憎液溶胶(简称为胶体) 。憎液溶胶的粒子 均是由数目众多的分子构成,存在着很大的相界面,因此憎液溶胶具有高分散性、多相性以 及热力学不稳定性的特点。如氢氧化铁溶胶、碘化银溶胶等。 形成憎液溶胶的必要条件是: (1)分散相的溶解度要小; (2)必须有稳定剂存在,否则 胶粒易聚结而聚沉。 憎液溶胶的制备:分散法包括研磨法、胶溶法(如 Fe(OH)3 溶胶的制备) 、超声分散法、电 弧法; 凝聚法包括化学凝聚法 (如水解反应制氢氧化铁溶胶) 和物理凝聚法 (如更换溶剂法、 蒸气骤冷法等) 。 憎液溶胶的净化:目的是除去对新制备的溶胶的稳定性不利的过多的电解质或其它杂 质。净化的方法主要有渗析法和超过滤法。 亲液溶胶: 半径落在胶体粒子范围内的大分子溶解在合适的溶剂中所形成的系统。 高分 子溶液为亲液溶胶。将溶剂蒸发,大分子化合物凝聚,再加入溶剂,又可形成溶胶。因此,
胶体化学核心知识点

1.胶体的定义及分类胶体(Colloid)又称胶状分散体(colloidal dispersion)是一种较均匀混合物,在胶体中含有两种不同状态的物质,一种分散相,另一种连续相。
分散质的一部分是由微小的粒子或液滴所组成,分散质粒子直径在1~100nm之间的分散系是胶体;胶体是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系,这是一种高度分散的多相不均匀体系。
按照分散剂状态不同分为:气溶胶——以气体作为分散剂的分散体系。
其分散质可以是液态或固态。
(如烟、雾等)液溶胶——以液体作为分散剂的分散体系。
其分散质可以是气态、液态或固态。
(如Fe(OH)3胶体)固溶胶——以固体作为分散剂的分散体系。
其分散质可以是气态、液态或固态。
(如有色玻璃、烟水晶)按分散质的不同可分为:粒子胶体、分子胶体。
如:烟,云,雾是气溶胶,烟水晶,有色玻璃、水晶是固溶胶,蛋白溶液,淀粉溶液是液溶胶;淀粉胶体,蛋白质胶体是分子胶体,土壤是粒子胶体。
2.胶体的不同表征方式胶体分散体系分为单分散体系和多分散体系。
单分散系表征可以用分散度、比表面积法(不规则形状包括单参数法,双参数法和多参数法)多分散体系可以用列表法、作图法,如粒子分布图,粒子累计分布图。
用激光粒度分析仪测定。
胶体的稳定性一般用zeta电位来表征。
zeta电位为正,则胶粒带正电荷,zeta电位为负,则胶粒带负电荷。
zeta电位绝对值越高,稳定性越好,分散度越好,一般绝对值>30mV说明分散程度很好。
胶体的流变性表征—黏度。
可用毛细管黏度计,转筒黏度计测定。
3.有两种利用光学性质测定胶体溶液浓度的仪器;比色计和浊度仪,分别说明它们的检测原理比色计它是一种测量材料彩色特征的仪器。
比色计主要用途是对所测材料的颜色、色调、色值进行测定及分析。
工作原理:仪器自身带有一套从淡色到深色,分为红黄蓝三个颜色系列的标准滤色片。
仪器的工作原理是基于颜色相减混合匹配原理。
罗维朋比色计目镜筒的光学系统将光线折射成90°并将观察视场分成可同时观察的左右两个部分,其中一部分是观察样品色的视场;另一部分是观察参比色(即罗维朋色度单位标准滤色片)的视场。
胶体化学第四章第五节

§4.5
3. 吡啶盐
阳离子表面活性剂
吡啶盐是属于特种形式叔胺,它与高级卤代烷反 应生成与季胺盐相似的烷基吡啶盐。
式中R=C12一C18,X=Cl,Br。 例如,氯化十二烷基吡啶、氯化十六烷基吡啶、 溴化十六烷基吡啶及氯化十七酰甲胶基吡啶等均 为这种类型的阳离子表面活性剂。 它们主要用作纤维的防水剂,染色助剂和杀菌剂。
§4.5 阳离子表面活性剂
2. 季铵盐及季胺化反应 季铵盐是常用的阳离子表面活性剂,具有如下化 学结构式
式中R,Rl,R2,R3是四个相同的或不同的烷基, X是卤素原于或酸根。
§4.5
阳离子表面活性剂
2. 季铵盐及季胺化反应
( 1 )季胺化反应: 由叔胺与烷化剂作用生成季铵盐的反 应,称为季胺化反应。常用的烷化剂如表所示:
§4.5
2. 季铵盐
阳离子表面活性剂
(2)季铵盐的性质及应用 季铵盐一般都有良好的水溶性,并随其碳链长度的增加, 水溶性下降,碳原于数低于C14的易溶于水,高于C14的难溶 于水。若季铵盐的烷基中含有不饱和的基团时,能增加它 们的溶解性。克拉夫特温度与碳链长度有如下线性关系。 kraff点=a+b n 式中n为碳链长,a,b为常数。 季铵盐阳离子表面活性剂带有正电荷,对于带有负表 面电荷的纺织品、金属、玻璃、塑料、矿物、动物或人体 组织等具有强的吸着能力,易在基质表面上形成亲油性膜 或产生阳电性,故广泛用作纺织品的防水剂、柔软剂、抗 静电剂、缓蚀剂和杀茵消毒剂等。
§4.5 阳离子表面活性剂
1. 铵盐型
(2) 铵盐的性能与应用
铵盐为弱碱盐,对pH较为敏感,处在酸性条件下,形成可 溶于水的铵盐,碱性条件则游离出胺。
铵盐的物性与胺不同,一般为不挥发性的无臭固体,易溶 于水而不溶于醚、烃等有机溶剂。例如,十二胺虽是体后,加入醋 酸,生成的十二胺醋酸盐,是能溶于水的良好的表面活性剂。 脂肪族高级铵盐主要用作表面活性剂的原料。低级铵盐阳 离子表面活性剂可作为纤维软整理剂,酸性溶液的缓蚀剂等。
教案高中化学胶体化合物

教案高中化学胶体化合物
教学目标:
1. 了解胶体的定义和性质;
2. 能够区分溶液、悬浮液和胶体;
3. 掌握胶体的制备方法和表征方法;
4. 能够解释胶体的稳定性及其应用。
教学重点:
1. 胶体的定义和性质;
2. 胶体的制备方法和表征方法;
3. 胶体的稳定性及应用。
教学难点:
1. 胶体和溶液、悬浮液的区分;
2. 胶体的表征方法的理解。
教学准备:
1. 教材:高中化学教科书;
2. 实验器材:玻璃棒、试管、试剂瓶等;
3. 实验药品:淀粉溶液、明胶溶液等。
教学过程:
1. 引入胶体的概念(10分钟)
通过实际生活中的例子和图示,引入胶体的概念,让学生了解什么是胶体,与溶液和悬浮液的区别。
2. 胶体的制备方法(20分钟)
介绍胶体的制备方法,包括物理法和化学法,并进行实验演示或实验操作,让学生亲自制备胶体。
3. 胶体的性质和表征方法(20分钟)
讲解胶体的性质,如颜色、透明度等,并介绍胶体的表征方法,如透射电镜、超速离心等。
4. 胶体的应用(15分钟)
探讨胶体的应用,如在食品工业、医药工业等领域的应用,并让学生展示或发表自己的看法。
5. 总结与评价(15分钟)
总结胶体的定义、性质、制备方法、表征方法和应用,并对学生的学习情况进行评价和反馈,帮助学生解决学习中的问题。
教学反思:
通过本节课的教学,学生应该能够掌握胶体的概念、性质、制备方法、表征方法和应用,
帮助学生建立起对胶体化合物的整体认识,提高化学知识的理解和应用能力。
天津大学胶体与表面化学课件第四章界面现象和吸附

所以: wr
dAs
- 表面张力, 表示液体增加单位表面 积时,环境所做的可逆功,单位 J. m-2。
2019/12/14
3
由于恒T、P下,可逆非体积功等于系统的Gibbs函数变
wr dGT .P dA
所以:
(
G As
)T
.P
所以也称为增加单位表面积时增加的Gibbs函数, 单位 J.m-2。
2019/12/14
4
注:表面张力:
F / 2l
单位面积表面功:
wr
dAs
单位面积表面Gibbs函数:
( G As
)T .P
三者虽为不同的物理量,但三者单位均可
化为 N.m-1 。
因为: N.m-1 = N.m/m2 = J/m2
根据Van’t Hoff 等压方程
吸附平 衡常数
吸附热
ln
Kp
H RT
ln
C
2019/12/14
33
设: A + S 平衡 CgA
A-S CsA
Kp
C As
C
g A
2019/12/14
34
因为 CsA与色谱的保留体积VR成正比(即CsA∞ VR )。
C
s A
C
g A
KVR
Kp
2019/12/14
5
二、热力学公式:(先考虑系统内只有一个相界面)
dG SdT Vdp dn B() B() dA B
du Tds PdV dn B() B() dA B
胶体化学第4章 表面张力 毛细作用和润湿作用
则x与y各增加dx和dy 。
Young-Laplace 公式
移动后曲面面积增量为: dAs (x dx)( y dy) xy
D'
x dx C'
o'
xdy ydx (dydx 0)
增加这额外表面所需功为
A'
D
dz
B'
C
y
o
Wf g xdy ydx
克服附加压力所作的功为 W ' psdV dV xydz
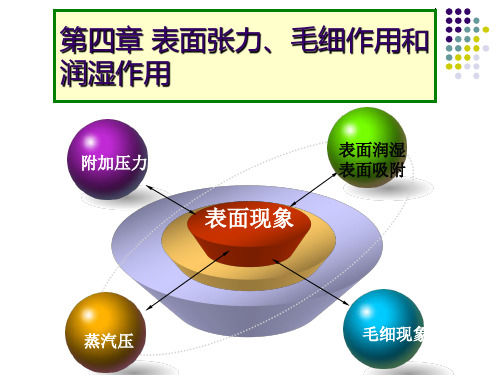
第四章 表面张力、毛细作用和 润湿作用
附加压力
表面现象
表面润湿 表面吸附
蒸汽压
毛细现象
表面张力和表面能
ps
界定:界面和表面
什么是界面?
不同相态之间,两相紧密接触、约有几个分子厚度的 过渡区,称为该两相的界面(interface)。
常见的界面有:
液体 界面 性质
气-液界面 液-液界面 液-固界面
气-固界面 固-固界面
液体界面性质的研究内容
研究对象: 液-气界面性质; 液-固界面性质; 液-液界面
基本内容: 1、物体表面会发生怎样的物理化学现象 2、物体表面分子和内部有何不同 3、界面现象对体系性质的影响
前沿热点、实际应用:
1、超临界干燥技术 2、仿生材料——超疏水、超亲水材料 3、分子子组装膜;LB膜。。。。。。
狭义的表面吉布斯自由能:
g
G ( A ) p,T ,nB
保持温度、压力和组成不变,每增加单位表面积时,
Gibbs自由能的增加值称为表面Gibbs自由能,或简称表
面自由能或表面能,用符号g 或 表示,单位为J·m-2。
等温、等压条件下,可逆的增加单位表面积时,环 境对体系所做的功转化为表面层分子的吉布斯自由能。
胶体化学考点

胶体化学考点一、σ的定义:恒温恒压下,可逆地增加单位表面积,环境对体系所做的功,单位J〃m-2定义表面张力(σ):单位长度液体表面的收缩力,单位N〃m-1(或mN〃m-1)表面过剩:表面浓度与体相浓度之差接触角:在固、l、g三相交界处,作l-g界面的切线,由此切线经液体内部与液固界面所成的夹角二、L ap l ace方程:三种特殊情况下的表达式1、曲面为球面,则R1=R2=R,ΔP=2σR2、曲面为柱面,则R1=R,R2=≦,ΔP=σ/R3、气泡存在两个g-l界面,且R1=R2=RΔP=4σ/R三、沾湿、浸湿、铺展,润湿过程的热力学判据,接触角判据。
•热力学判据沾湿 - Wa=σg-l(1+cosθ)≥0 θ≤180°浸湿 A=σg-l cosθ≥0 θ≤90°铺展 S=σg-l(cosθ-1)≥0 θ≤0°•接触角判据:通常真截将θ作为润湿与否的依据,θ>90°时,称为不润湿;θ<90°时,称为润湿;θ≤0°时(或不存在)铺展。
四、吸附等温线的类型类型Ⅰ:单分子层吸附,远低于P时,即吸满单分子层,P上升, 不再增加类型Ⅱ:S型吸附等温线(常见),低压下为单分子层,压力增加,产生多分子层吸附,图中B是低压下曲线的拐点,通常认为吸满了单分子层,B也即计算比表面的依据,如-195℃下氮在铁催化剂上的吸附。
类型Ⅲ:较少见,一开始即为多分子层吸附。
类型Ⅱ、Ⅲ在P→P0时,曲线趋于纵轴平行线的渐近线,表明产生了吸附质的凝聚,如低温下(-137.7~-58℃)溴在硅胶上的吸附。
类型Ⅳ:低压下产生单分层吸附,压力增加,吸附剂的孔隙结构中产生毛细凝聚,急剧上升,毛细孔中装满吸附质后, 不再上升。
如常温下,苯在硅胶上的吸附。
类型Ⅴ:低压下即产生多分子层吸附,压力增加,毛细凝聚五、单分子层吸附理论假设(1)被吸附分子间无作用力,因而分子脱附不受周围分子的影响。
胶体化学复习资料

胶体化学复习资料名词解释表面张力:液体表面层由于分子引力不均衡而产生的沿表面作用于任一界线上的张力。
表面能:物质的表面具有表面张力σ,在恒温恒压下可逆地增大表面积dA,则需功σdA,因为所需的功等于物系自由能的增加,且这一增加是由于物系的表面积增大所致,故称为表面自由能或表面能。
接触角:在固、液、气三相接触达到平衡时,三相接触周边的任一点上,液气界面切线与固体表面间形成的并包含液体的夹角。
高能表面/低能表面:按照不同物体表面的比表面能大小不同,把比表面能大于0.1J/m2的表面称为高能表面,把比表面能小于0.1J/m2的表面称为低能表面。
PS版上空白部分的氧化铝膜,比表面能约为0.7J/m2,属于高能表面。
PS版上图文部分的重氮感光树脂层,比表面能约为0.03~0.04J/m2,属于低能表面。
润湿作用:润湿作用通常是指液体在固体表面上附着的现象。
固体表面的一种流体被另一种流体所取代的过程。
铺展:液体在另外一种不互溶的液体表面自动展开成膜的过程。
吸附热:吸附过程产生的热效应。
在吸附过程中,气体分子移向固体表面,其分子运动速度会大大降低,因此释放出热量。
物理吸附的吸附热等于吸附质的凝缩热与湿润热之和。
表面活性剂:具有固定的亲水亲油基团,在溶液的表面能定向排列,并能使表面张力显著下降的物质。
浊点:油类、清漆等液体样品在标准状态下冷却至开始出现混浊的温度为其浊点。
非离子型表面活性剂,在水溶液中的浓度随温度上升而降低在升至一定温度值时出现浑浊,经放置或离心可得到两个液相,这个温度被称之为该表面活性剂的浊点。
kraft点:阴离子表面活性剂一般在低温下溶解困难,随着水溶液浓度上升,溶解度达到极限时,就会析出水合的活性剂。
但是,当水溶液温度上升到一定值时,由于胶束溶解,溶解度会急剧增大,这时的温度称为临界胶束溶解温度,即Kraft点。
HLB值:表面活性剂为具有亲水基团和亲油基团的两亲分子,表面活性剂分子中亲水基和亲油基之间的大小和力量平衡程度的量,定义为表面活性剂的亲水亲油平衡值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定势离子
反离子
电位测定
K
单位距离电位差下胶粒的移动速 度,电泳淌度,m2.V-1.s-1
U
分散介质粘度,Pa.s 常数,胶粒球形,取1.5;片型、 棒型为1.0
电学性质
电泳:颗粒运动 电动现象 电学性质 动电现象 流动电位:介质运动 沉降电位:颗粒运动
电渗:介质运动
五、溶胶的稳定与聚沉
AgI溶胶
丁达尔(Tyndall)现象解释
散射
光线绕过离子 前进,并从该粒 子向各个方向传 播。
散射 反射或折射
丁达尔(Tyndall)现象解释
散射
反射或折射
丁达尔(Tyndall)现象解释
可见光400~800nm(0.4~0.8m),
溶胶粒子, 0.001~0.1m 悬浮体,0.1~10m
2、凝聚法
使分子或离子聚结成胶体粒子并分散在分散介
质中.
(1) 物理凝聚法:
(2)化学凝聚法:
利用水解、复分解、 氧化反应,生成不溶或 难溶的物质。
更换溶剂法 在蒸馏水中滴入松 电 香乙醇溶液 弧 法
2、凝聚法
(2)化学凝聚法
水解反应
FeCl3 3H2O FeO H3 3HCl
称为溶剂化。
例如:氯化钠在溶液中,结构单元就是水化
的钠离子(Na+)和氯离子(Cl-)。即氯化
钠被水溶剂化。
一个极性溶剂分子有带部分正电荷的正端和带部 分负电荷的负端,如R-O-H。正离子与溶剂的负端, 负离子与溶剂的正端互相吸引,称为离子—偶极作用, 也称为离子偶极健。离子—偶极作用是溶剂化的本质, 一个离子可形成多个离子—偶极健,结果离子被溶剂 化,在溶剂包围中。 质子溶剂的溶剂化作用除了离子—偶极健外,往 往还有氢键的作用。
散介质之间亲和力较弱,有明显的相界面,属于热力学不稳定体系,
如粘土在水中形成的溶胶。
按分散相和分散介质之间的亲和力分类
(2)亲液胶体(lyophilic sol): 分散相与分散介质之间有很好的亲和力和很强的溶剂化作 用,如高分子化合物溶液,虽然是分子分散的真溶液,但其分 子大小已经达到胶体范围,因此具有胶体的一些特性(例如扩 散慢、不透过半透膜、有丁铎尔效应等)。 只有典型的憎液溶胶才能全面地表现出胶体的特性,因此, 本章以溶胶作重点来讨论胶体的共同性质。
3 2 2 2 2 2 2 1 2 1 2
散射光强 度I与入射 光波长λ成 反比
n1,n2——分散介质和分散相的折光率 C——单位体积中的胶体粒子数 V——单个粒子的体积
乳光现象的解释
(1)红光波长大,散射作用弱,光线主 要通过溶胶;
(2)蓝光波长小,散射作用强,光线通
过溶胶少。 (思考:蓝天碧水?)
体中,分散相粒子的直径在0.001 ~ 0.1 m(1 ~ 100nm)之间。
二、溶胶的制备
1、分散法 2、凝聚法
溶液 பைடு நூலகம் 高分散体系 粗分散体系
凝聚 分散
胶体
1、分散法
(1) 粉碎
用研钵、球磨机或胶体磨 (2)稳定剂
表面活性剂或电解质
如:研磨过的TiO2在稀的肥皂溶液
乳光现象利用—超显微镜设计
普通高倍显微镜: 大于300nm粒子 超显微镜: 10 ~300nm 看到的是散射光点。 看 到 的 物 象 为 散 射 光 点
2 溶胶的运动性质—布朗运动
2 溶胶的运动性质—布朗运动
微观解释:固体粒子处在液体分子包围之 中,由于液体分子一直处于不停的、无序 的热运动状态,因而不断地撞击着固体粒 子。如果固体粒子较小,在某一瞬间,固 体粒子各个方向所受力不能相互抵消,就 会向某一方向运动,在某一瞬间又向另一
溶胶的净化
溶胶的净化:通过化学凝聚法制备的溶胶,往往含有过量
的电解质,影响溶胶的稳定性,需要用透析方法除去过量
的电解质。
溶胶的透析装置
三、溶胶的性质
1 光学性质 2 运动性质 3 电学性质
溶胶的性质是溶胶的特征, 可以提供判断溶胶的方法。
1 光学性质—丁达尔现象
1、光学现象——乳光现象
一、分散体系
按分散相和分散介质聚集状态分类:
分散相 分散介质 液 名 称 实 例
气 液 固
气 液 固 气 液 固
液溶胶 (sol)
固溶胶 (solid sol) 气溶胶 (aerosol)
泡沫(如灭火泡沫、充气钻井液) 乳状液(牛奶、石油、O/W,W/O乳化钻井液) 悬浮体、溶胶(如油漆、水基钻井液)
胶核
吸附层离子 胶粒 胶团
扩散层离子
动电现象
1. 沉降电位 由于带电固体粒 子或液滴在分散介质 中沉降则在流体的表 面和底层间产生电位 差 (电泳现象的逆现象)
动电现象
1. 沉降电位(电泳现 象的逆现象) 2. 流动电位(电渗现 象的逆现象) 加压使液体流 过相对静止的固体 (如毛细管)所产 生电位差。
溶剂化 的本质
溶胶稳定原因
动力稳定性:溶胶粒子小
聚结稳定性:溶胶粒子带电以及扩散双 电层的溶剂化
溶胶动力稳定性与聚结稳定性的关系
3、溶胶的聚沉
定义:溶胶由于失去聚结稳定性,进而失去动力
稳定性的整个过程叫聚沉。
(1)电解质聚沉作用
聚沉过程:高价反离子的作用
与吸附层中定势离子与 反离子数目有关
第四章
第二章 岩心分析
胶体化学
第一节 岩心分析概述
第二节 岩心分析技术及应用
2013年5月30日 第三节 岩心分析技术应用展望
前言
一、分散体系
二、胶体化学的定义
三、胶体化学研究的体系
四、胶体化学解决的问题
一、分散体系
定义:一种或几种物质分散在另一 种物质中形成的体系。 举例:奶油,油漆 分散相、分散介质 分类:按聚集状态分类 按分散相质点大小分类
粒子越小、温度越高、 介质粘度越低,布朗 运动越剧烈。
η——介质的粘度; r——粒子的半径;
NA——阿伏加德罗(Avogadro)常数。
布朗运动的作用
克服由于重力而引起的定向运动,利于
动力稳定性
增加碰撞机会,不利于聚结稳定性
3、溶胶的电学性质—电泳
胶体粒子在电场的作用下向正极或负极
移动、作定向移动的现象。
2
u——粒子下沉速度; r——粒子半径; ρ,ρ0——分散相、分散介质密度; η——分散介质粘度; g——重力加速度。
影响动力稳定性的因素
X RT t N A 3r
2 r 0 g u 9
2
①粒子大小:r越小,下沉速度越小,布朗 运动越剧烈,动力稳定性越好; ②温度:温度越高,动力稳定性越好; ③密度差:分散相和分散介质密度差越大, 动力稳定性越不好。 粒子大小是主要的影响因素(在分子 上是平方项)。
二、胶体化学的定义
胶体:
指的是高度分散的分散体(质点大小在
1nm~100 nm)。
胶体化学:
是研究胶体体系的化学。
二、胶体化学的定义
举例:泥土分散在水中 (1)分子或离子分散体系 (2)胶体 (3)悬浮体(粗分散体系)
胶体是物质存在 的一种特殊状态,而不是一 种特殊的物质
二、胶体化学的定义
胶体是物质存在的一种特殊状态,
方向运动,因此,造成粒子的无规则运动。
当粒子直径大于5m时,就没有布朗运动 了,因为这时粒子周围受到的撞击力相互
抵消。
爱因斯坦 (Einstein)方程
影响布朗运动的因素
温度 粒子大小 介质粘度
X
RT t N A 3r
X——粒子的平均位移; t——观察平均位移时每次相隔的时间; T——热力学温度;
固
浮石、泡沫塑料 沸石、珍珠、某些宝石 某些合金、有色玻璃 混合气体 雾 烟、尘
气
分散体系按质点大小分类
分子或离子分散体系
<10-9m 10-7m~10-9m > 10-7m
胶体分散体系
粗分散体系
按分散相和分散介质之间的亲和力分类
(1)憎液胶体(lyophobic sol):简称溶胶 由难溶物质分散在分散介质中所形成的分散体系,分散相与分
3、溶胶的聚沉
等电态 临界电位:溶胶开始明显聚沉时的电位 (20~30mV) 聚沉值:一定时间内,能使溶胶发生聚沉的电解质 的最低浓度。用每升溶胶中所加电解质的毫摩尔数
1 、胶体分散体系的特征 (1) 多相; (2)大表面的体系; (3)高表面能; (4)热力学不稳定。
直径为10nm的球形质点, 质点总体积1cm3, 其面积为600m2。
三、胶体化学研究的分散体系
2 聚合物溶液
(1)真溶液
(2)均相体系
(3)热力学稳定
四、胶体化学的主要研究内容
1 胶体体系的稳定与破坏
1、溶胶的稳定性 动力稳定性与聚结稳定性 2、动力稳定性
用来衡量溶胶在重力场作用下分散相是否 容易下沉的性质。 在重力场下,如果分散相下沉速度小到可 以忽略,则这种溶胶具有动力稳定性。 是否具有动力稳定性取决与布郎运动与下沉 运动
下沉运动
Stokes公式
2 r 0 g u 9
3、溶胶的电学性质—电泳
碘化钾加到过量的硝酸银中制备的胶体,加电后 分散相移向负极; 碘化银带正电 硝酸银加到过量的碘化钾中制备的胶体,加电后 分散相移向正极。 碘化银带负电
3、溶胶的电学性质—电渗
分散介质在电场的作用下向正极或
负极移动作定向移动的现象。
(2) 电
